Professional Documents
Culture Documents
Descomposición Del Peróxido de Hidrógeno
Uploaded by
Andrés Felipe ArizaOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Descomposición Del Peróxido de Hidrógeno
Uploaded by
Andrés Felipe ArizaCopyright:
Available Formats
DESCOMPOSICIN DEL PERXIDO DE HIDRGENO
Alba Gisell Garzn Avella Andrs Felipe Ariza Gabriel Jimnez aggarzona@unal.edu.co afarizal@unal.edu.co gabrieljimenez44@gmail.com 02245473 02245380 Ingeniera Qumica Universidad Nacional de Colombia Sede Bogot medios (10% - 35%) se utilizan como decolorador de cabello en salones de belleza y como oxidante RESUMEN en prcticas de laboratorio y porcentajes altos (70% - 90%) son utilizados desde usos industriales hasta componente para combustible sta prctica cuyo objetivo fue la demostracin de de cohetes. Es frecuentemente utilizado en reas la descomposicin del perxido de hidrgeno de investigacin para medir la actividad de (Agua oxigenada), se dividi en dos partes: La enzimas, como la catalasa, presente en primera fue utilizando xidos de metales como el organismos vivos. PbO2, MnO2 y Fe2O3 (catalizadores inorgnicos) y un palito de madera al rojo vivo luego de ser Un catalizador es una sustancia que altera encendido con fuego; al ser introducido en cada (aumenta o disminuye) la velocidad de una recipiente con su respectiva reaccin entre el reaccin mediante la disminucin o el de la oxido correspondiente y perxido, se pudo energa que se requiere para iniciar una reaccin comprobar la presencia de oxigeno molecular qumica. Estos proporcionan un camino demostrada en el avivamiento de la llama. La alternativo para la reaccin qumica, alterando la segunda parte se realiz utilizando yoduro de velocidad de la misma, pero no se consumen, potasio y levadura como aceleradores de como en el caso de la catlisis con dixido de reaccin, logrando una instantnea manganeso, en la que el mismo permanece descomposicin evidenciada en la cantidad de inalterado luego de la descomposicin. espuma producida en la probeta, ms conocida como Pasta de dientes para elefantes. El Un eficiente y conocido reactivo usado en resultado fue una eficiente demostracin de la catlisis de descomposicin es el yoduro de descomposicin del H2O2, liberando vapor de potasio (KI). Este es un catalizador porque solo agua y oxgeno molecular en todos los casos, aumenta la velocidad de reaccin, no se gasta exceptuando el procedimiento realizado con el como reactivo. Sin embargo, una pequea parte xido de hierro, para el cual su resultado fue una s que reacciona, convirtindose en yodo. La emulsin. presencia del yodo se pone de manifiesto por el color marrn de algunas zonas del producto. La reaccin se realiza en una probeta graduada bastante alta, ya que el producto (espuma dada por la produccin instantnea de oxgeno) formado sale verticalmente hacia arriba y de forma rpida. Por eso y por su textura, se llama pasta de dientes. Como el agua oxigenada es un oxidante muy fuerte hay que protegerse las manos con guantes. Adems, como la reaccin es muy rpida, es conveniente llevar gafas protectoras. Tambin, se encuentra la catalasa, que es una enzima (catalizador de naturaleza biolgica) que hace que la descomposicin del perxido de hidrgeno sea cinticamente favorable, es decir, que transcurra a mayor velocidad, lo cual es vital en un organismo ya que, siendo es uno de los
INTRODUCCIN
Profundizando en los conceptos que se requieren para entender plenamente el proceso de descomposicin del perxido de hidrgeno, y el papel de los reactivos como catalizadores, es necesario conocer que el perxido de hidrgeno es un fuerte oxidante y es inestable a temperatura ambiente, por lo que se descompone lentamente en vapor de agua y oxgeno liberando calor (reaccin exotrmica). Se encuentra a distintas concentraciones de acuerdo con sus usos. Por ejemplo, porcentajes bajos (3% - 9%) se encuentran comnmente en el mercado para usos medicinales y domsticos, porcentajes
productos del metabolismo celular, es potencialmente txico, por lo que es transformado enseguida en oxgeno y agua. Adems, la catalasa cumple una funcin protectora contra determinados microorganismos patgenos, sobre todo anaerobios. Las bacterias anaerobias, mueren al estar en contacto con oxgeno, es por esta razn que el oxgeno producido por esta enzima tiene efecto bactericida sobre estos microorganismos. Esta catalasa est presente en la levadura activa, la cual cataliza la descomposicin del perxido ms lentamente que el yoduro de potasio y otras sales, lo que hace posible una medicin muy aproximada del tiempo requerido en la reaccin en funcin de la concentracin usada del reactivo, obteniendo as una serie de grficas que efectivamente deben demostrar la proporcionalidad directa entre la velocidad de reaccin y la concentracin.
Procedimiento: Primero que todo, abrir las bolsas de basura de manera que queden extendidas sobre el mesn en el cul se realizar la prctica. Esto se hace con el fin de recoger ms fcilmente los desechos y evitar los derrames sobre objetos delicados. En cada vaso desechable depositar 5 mL de jabn lquido. Luego para el primer vaso con ayuda de una esptula, tomar aproximadamente 10 gr de MnO2 y agregarlos al contenido del vaso. Realizar lo mismo con los otros dos slidos.
METODOLOGA
A. Descomposicin del perxido de hidrgeno utilizando varios slidos (xidos) como catalizadores. Para la primera parte del experimento necesitamos los siguientes materiales: Reactivos:
xido de Manganeso (MnO2) xido de Hierro (Fe2O3) xido de Plomo (PbO2) Agua oxigenada (H2O2) al 15% - 50 volmenes. Ahora con cada una de las 3 jeringas, medir 5 mL de agua oxigenada. Al mismo tiempo (con ayuda de otra persona), depositarlos en cada uno de los vasos y observar la reaccin. Enseguida, para comprobar que se libera O2, introducir un palito rojo vivo el cual con antelacin fuego con el fin de que su llama presencia de oxgeno. efectivamente de madera al se expuso al aumentara en
Materiales:
3 vasos desechables. Una esptula. Jabn lquido. 3 Jeringas de 5 mL. 3 palitos de madera. Encendedor. 2 bolsas de basura.
Repetir este proceso con las 3 muestras e identificar si los slidos son catalizadores o simplemente formaron una emulsin. B. Descomposicin del perxido de hidrgeno utilizando levadura activa
seca como catalizador. Reactivos:
constantes las cantidades de levadura-Shampoo y el perxido de hidrgeno. Se vuelven a tomar los tiempos segn los volmenes que alcanza la espuma como se mencion anteriormente. Se hace el procedimiento nuevamente utilizando 3%, 2,5% y 2% de perxido de hidrgeno. Cabe aclarar que para hacer una dilucin, por ejemplo, al 3% se realiza lo siguiente: 4%_______5 mL 3%_______ X X= 3% (5 mL) 4%
Un sobre mediano de Levadura en polvo 5 mL de Perxido de Hidrgeno al 2% 5 mL de Perxido de Hidrgeno al 2,5% 5 mL de Perxido de Hidrgeno al 3% 5 mL de Perxido de Hidrgeno al 3,5% 5 mL de Perxido de Hidrgeno al 4%
Nota: Para las diferentes concentraciones, se toma como base agua oxigenada al 4% y a partir de stas se preparan diferentes diluciones con las concentraciones deseadas.
Donde X= 3,25 mL de perxido Luego completar un volumen de 5 mL con un volumen de 1,25 mL de agua. As sucesivamente para las dems diluciones.
Materiales:
Probeta de 100 mL. Shampoo para alfombras. 28 g de Levadura seca en polvo. 2 Bolsas de basura o plstico protector. Un cronmetro. Una jeringa de 5 mL. Agua.
Para comenzar, como se hizo anteriormente, es necesario cubrir el lugar de trabajo (mesn u otro espacio) con bolsas de basura abiertas para poder recoger mejor los desechos. Iniciar con 3 mL de una mezcla de levadura activa y shampoo para alfombras, luego se agrega a la probeta de 100 mL. Con la jeringa se toman 5 mL de agua oxigenada al 4%, y se deposita en la probeta. A medida que la espuma va subiendo se toma el tiempo, por ejemplo: Volumen (mL) 20 mL 30 mL 40 mL Tiempo (s) 0,56 s 0,97 s 1,56 s
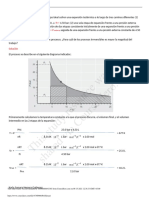
RESULTADOS Las relaciones obtenidas en el desarrollo de la practica muestran una tendencia de crecimiento de la velocidad de reaccin al aumentar la concentracin del perxido de Hidrogeno (Fig. 1), aun as en el proceso se observaron que concentraciones menores de perxido (2.5% H2O2) reaccionaron primeramente en tiempo (0,3 dcimas de segundo) ante reacciones de mayor concentracin (3.0, 3.5% H2O2) que lo hicieron posteriormente (0.17, 0.12 dcimas de segundo), utilizando un medio de reaccin que estuvo conformado por jabn de alfombras y levadura
Hasta completar 100 mL o el mximo volumen que se pueda registrar. Repetir el mismo procedimiento utilizando esta vez Agua oxigenada al 3,5 %, manteniendo
activa que se mezclaron hasta obtener un liquido de color grisceo de una apariencia viscosa, esta mezcla reaccion en contacto con el perxido generando espuma (Elephants Toothpaste) (lo que demuestra la generacin de oxgeno) consiguiendo observar que la espuma producida en la descomposicin del perxido de Hidrgeno mostraba una consistencia cremosa, esta descomposicin ocurri a gran velocidad (entendido como el aumento del volumen de la espuma presente) en general para todas las concentraciones ocurri un primer momento en el cual reduca su velocidad en relacin a el tiempo transcurrido llegando a un momento final donde la espuma producto de la reaccin terminaba su aumento de volumen, adicionalmente se observo un aumento en la temperatura de la probeta en las reacciones de mayor concentracin de perxido de Hidrogeno, hecho que confirma la naturaleza exotrmica de la reaccin.
Velocidad de reaccin del perxido
100 90 80 70 VOLUMEN (mL) 60 50 40 30 20 10 0 0 5 10 TIEMPO(S) Figura 2 15 20 Perxido al 4% Peroxido al 3% Peroxido al 2,5% Peroxido al 3,5% Perxido al 2%
Dependencia de la velocidad con la concentracin H2O2
4
3,5
y = 0,973x + 2,350
2,5
El volumen de la espuma generada en este proceso mostro adicionalmente tres puntos en los cuales el volumen y el tiempo caracterizaron cada uno de ellos el primero, en el cual el volumen no mostro ningn cambio en una escala de tiempo muy baja (centsimas de segundo) el segundo un aumento de volumen considerable en escalas de tiempo bajas (dcimas de segundo) y por ultimo un aumento de volumen lento y progresivo en escalas de tiempo superior a las anteriores (segundos), las concentraciones y el volumen final de cada proceso estuvieron relacionadas en cantidades proporcionales es decir a mayor concentracin mayor volumen final en la muestra (Fig. 2).
Ln Velocidad
2 0,4 0,6 0,8 1 1,2 1,4 1,6
Ln Concentracin
DISCUSIN En cuanto a la reaccin que ocurri a mayor velocidad en una muestra que contena una concentracin menor de perxido de Hidrogeno en comparacin con el tiempo y la concentracin mayor de otras muestras es probable que este hecho se presentara al realizar un mal procedimiento al disponer de una cantidad mayor de levadura a la reaccin que provoc un aumento del material enzimtico este a su vez propicio una reaccin ms acelerada de los componentes, por otro lado la situacin que pudo haberse presentado es la realizacin de un mal
Figura 1
El aumento de volumen de la espuma comprendida como producto de la reaccin que estuvo relacionada con la concentracin de H2O2 (Fig. 2) la cual tuvo un acenso vertiginoso en el recipiente que contena los reactivos ( probeta 100 mL) se estabiliz pasados algunos segundos sin llegar a llenar por completo el recipiente.
procedimiento en la dispersin de la levadura activa que se encontraba solida (grnulos) con el jabn de alfombras en estado liquido de alta viscosidad, que no proporciono suficiente material enzimtico (catalasa) disponible a la reaccin, este ultimo de menor posibilidad dado que el hecho que atae esta circunstancia donde muestras con concentraciones mayores de perxidos de Hidrogeno reaccionaron ms lentamente en comparacin con una muestra de menor concentracin, ocurri en dos muestras lo que le proporciona mayor posibilidad a el primer evento. En cuanto a el proceso cataltico realizado fue pertinente en el desarrollo de la prctica, la velocidad de reaccin ocurri en periodos de tiempos apreciables por los investigadores adems el desarrollo de esta actividad podra realizarse junto con otros procesos que podran haber contribuido con el conocimiento de la velocidad de reaccin y por ende de la descomposicin del perxido de Hidrogeno. Los resultados mostraron una fuerte relacin a las variables de concentracin y volumen, cabe rescatar que existen variables de esta reaccin que no se tuvieron en cuenta que podran generar una comprensin mayor del proceso, como la vida til de la levadura luego de ser expuesta y diluida, los inhibidores de pH y dems componentes presentes en el agua oxigenada comercial, entre otras.
CONCLUSIN A lo largo de la prctica, se logr una evidente demostracin de la catlisis de descomposicin del perxido de hidrgeno a partir de catalizadores de accin instantnea (qumicos y enzimticos), que, no consumindose, alteraron la velocidad de reaccin, siendo esta evidenciada en la espuma producida, indicio de produccin de oxgeno y vapor de H2O, los cuales son productos de la descomposicin. Tambin se apreci, mediante el uso de grficas y procedimientos matemticos que la velocidad de descomposicin en la prctica es directamente proporcional a la concentracin de perxido. Adems se pudo comprobar el papel de la catalasa presente en la levadura, teniendo como referencia previa su funcin enzimtica en los seres vivos.
You might also like
- Cuso4 (5h2o) Ficha de SeguridadDocument7 pagesCuso4 (5h2o) Ficha de SeguridadLUCILAVENAVIDES100% (1)
- Descomposición Catalítica de Peróxido de HidrógenoDocument31 pagesDescomposición Catalítica de Peróxido de HidrógenoRomy ArenazasNo ratings yet
- Lab OrgánicaDocument10 pagesLab OrgánicaLPNo ratings yet
- CÉLULAS GALVÁNICASDocument13 pagesCÉLULAS GALVÁNICASLuciaNo ratings yet
- Taller 1Document10 pagesTaller 1Juan Camilo DicueNo ratings yet
- Ejercicios Fisicoquimica ResueltosDocument14 pagesEjercicios Fisicoquimica ResueltosNilton CesarNo ratings yet
- Obtención de Acetato de IsoamiloDocument3 pagesObtención de Acetato de IsoamiloAbigail FloresNo ratings yet
- Práctica Nº3 - Solubilidad en Función de La TemperaturaDocument13 pagesPráctica Nº3 - Solubilidad en Función de La TemperaturaCamilo Rafael Osorio PintoNo ratings yet
- Repaso P1 - SolubilidadDocument1 pageRepaso P1 - SolubilidadEmily GonzalezNo ratings yet
- Ecuaciones de Estado CúbicasDocument3 pagesEcuaciones de Estado CúbicasFisicoquimica ULS100% (1)
- ProblemasDocument9 pagesProblemasLeticiaNo ratings yet
- RecristalizacionDocument8 pagesRecristalizacionTeresa FuerteNo ratings yet
- Clase 4 Magnitudes Molares ParcialesDocument66 pagesClase 4 Magnitudes Molares ParcialesEduardo Escobar AlvarezNo ratings yet
- Ejercicios Efecto Ión Común y AmortiguadoresDocument1 pageEjercicios Efecto Ión Común y AmortiguadoresJorge Alejandro Vargas Alvarez100% (1)
- Degradación Catalítica de Azul de MetilenoDocument3 pagesDegradación Catalítica de Azul de MetilenoMayerly AyalaNo ratings yet
- Tema 9 FenomenosDocument3 pagesTema 9 Fenomenosamigot3No ratings yet
- 06 Problemas Unidad 2Document11 pages06 Problemas Unidad 2Maya MendozaNo ratings yet
- Espectro de Infrarrojo de Los Ácidos CarboxílicosDocument18 pagesEspectro de Infrarrojo de Los Ácidos CarboxílicosViridianaGarcia50% (2)
- PRACTICA #3 Leyes de Los GasesDocument3 pagesPRACTICA #3 Leyes de Los GasesMarcia Nis67% (3)
- EJERCICIODocument1 pageEJERCICIOyessicaNo ratings yet
- Reporte Practica #1 Aromatica Esterificación de Un FenolDocument13 pagesReporte Practica #1 Aromatica Esterificación de Un Fenoljesusbernalort100% (1)
- Reacciones de aldehídos y cetonas con aminasDocument10 pagesReacciones de aldehídos y cetonas con aminasdugamianNo ratings yet
- Práctica No.9 CinéticaDocument3 pagesPráctica No.9 CinéticaMaria Camila SantiagoNo ratings yet
- Ejercicios MateDocument2 pagesEjercicios MateNiksa Jeannette Yañez AmpueroNo ratings yet
- Guia RedoxDocument3 pagesGuia RedoxMatii VegaNo ratings yet
- Examen Cinetica Unidad 2 - NeftaDocument2 pagesExamen Cinetica Unidad 2 - NeftaMartha L Pv RNo ratings yet
- Practica 1 Reacción de Catalasa y Lactato DeshidrogenasaDocument4 pagesPractica 1 Reacción de Catalasa y Lactato DeshidrogenasaGerardoMendozaDoradoNo ratings yet
- Efecto de Factores Ambientales en La Curva de CrecimientoDocument2 pagesEfecto de Factores Ambientales en La Curva de CrecimientoSilvana StarNo ratings yet
- ProblemasDocument2 pagesProblemasJoseph Sulca MartinezNo ratings yet
- PRÁCTICA III. Modelo de La Curva de PoderDocument2 pagesPRÁCTICA III. Modelo de La Curva de PoderJAVIER SOLISNo ratings yet
- Ejercicios Contaminacion AtmosfericaDocument109 pagesEjercicios Contaminacion AtmosfericaÁngel Olazo67% (3)
- Análisis de La Técnica Práctica 10.. 9Document4 pagesAnálisis de La Técnica Práctica 10.. 9Edith AlmanzaNo ratings yet
- Ejercicios 4. Volumetria RespuestasDocument4 pagesEjercicios 4. Volumetria RespuestasJuan Esteban Gonzalez OrdoñezNo ratings yet
- Equilibrio de Solubilidad y KPSDocument8 pagesEquilibrio de Solubilidad y KPSRosa Sotomayor100% (1)
- Estequiometria y RL.Document5 pagesEstequiometria y RL.Danilo OrtizNo ratings yet
- Viscosidad de Soluciones de Un PolímeroDocument11 pagesViscosidad de Soluciones de Un PolímeroDaniel Moreno CabreraNo ratings yet
- Ecuaciones de Diseño (CSTR) - Semana 4Document21 pagesEcuaciones de Diseño (CSTR) - Semana 4Stey SantiagoNo ratings yet
- Factores Que Influyen en La Formación de ComplejosDocument2 pagesFactores Que Influyen en La Formación de ComplejosLuis Angel Castillo OrtizNo ratings yet
- Problemas RFP 2018082111Document6 pagesProblemas RFP 2018082111Jorge Gutierrez AranibarNo ratings yet
- Ficha Tecnica Acido AceticoDocument7 pagesFicha Tecnica Acido AceticoFrAn MirandaNo ratings yet
- Obtención de NitrobencenoDocument4 pagesObtención de NitrobencenoNyFa RozenNo ratings yet
- Problema 3 AnalisisDocument3 pagesProblema 3 AnalisisRAMO ZENITRAMNo ratings yet
- Diagrama de Flujo (Sintesis de Cloruro de Ter-Butilo)Document1 pageDiagrama de Flujo (Sintesis de Cloruro de Ter-Butilo)AlexisBernal100% (1)
- SolubiidadDocument4 pagesSolubiidadyenifer0% (1)
- Problemas de Adsorcion y CinéticaDocument2 pagesProblemas de Adsorcion y CinéticaMoises Ramirez50% (2)
- Taller de CalorDocument4 pagesTaller de CalorHenry SanchezNo ratings yet
- Ejercicios de cálculos químicos y reaccionesDocument3 pagesEjercicios de cálculos químicos y reaccionesBenz Aio Calachua Araujo100% (1)
- Determinación de La Constante de EquilibrioDocument12 pagesDeterminación de La Constante de EquilibrioAndrea GonzálezNo ratings yet
- Desarrollo - TermodinamicaDocument3 pagesDesarrollo - TermodinamicaPedro Anguamea IbarraNo ratings yet
- EQUILIBRIO Solucionesacuosas3Document94 pagesEQUILIBRIO Solucionesacuosas3alessandro0% (1)
- Mayor Rendimiento Del Proceso Haber-BoshDocument7 pagesMayor Rendimiento Del Proceso Haber-Boshransetab100% (1)
- Balance de materia multietapas destilación oxígenoDocument4 pagesBalance de materia multietapas destilación oxígenoCarlos VillarrealNo ratings yet
- Practica de LaboratorioDocument6 pagesPractica de Laboratoriosofia ordazNo ratings yet
- 1 Ejercicios PropuestosDocument7 pages1 Ejercicios PropuestosArnaldo ArizaNo ratings yet
- Problemas de Destilacion FlashDocument4 pagesProblemas de Destilacion FlashDivita ArandaNo ratings yet
- Dioses CineticosREMIXDocument8 pagesDioses CineticosREMIXArturo LGNo ratings yet
- Actualización en Farmacoterapia CovidDocument3 pagesActualización en Farmacoterapia Covid0532121001 JAIDER MANUEL CASIANI SIMARRA ESTUDIANTE ACTIVONo ratings yet
- Actividad de La Catalasa A Diferentes TemperaturasDocument6 pagesActividad de La Catalasa A Diferentes TemperaturasIliana Donaji Santiago Cruz50% (4)
- Tema 1 ElectivaDocument25 pagesTema 1 ElectivaEsther LPNo ratings yet
- Sellador Elastico Poliuretano Sikaflex 1a PDFDocument3 pagesSellador Elastico Poliuretano Sikaflex 1a PDFVS JeanNo ratings yet
- Lamiado Plano Parcial # 1 Manofactura PDFDocument26 pagesLamiado Plano Parcial # 1 Manofactura PDFMadrid K AnyeliiNo ratings yet
- MA465 - S12 - S31 - RPPC3 - REPASO PC3 - Docentes PDFDocument8 pagesMA465 - S12 - S31 - RPPC3 - REPASO PC3 - Docentes PDFCamila SanchezNo ratings yet
- El CementoDocument4 pagesEl CementoJUAN ISAI CESPEDES MEJIANo ratings yet
- Monografia Contaminacion Ambiental Sin PortadaDocument28 pagesMonografia Contaminacion Ambiental Sin Portadasolmarro50% (2)
- Muestreo de CarnicosDocument10 pagesMuestreo de CarnicosAlbert Bernal Mamani100% (1)
- Presion CapilarDocument15 pagesPresion CapilarAlex Mamani CuizaNo ratings yet
- Kelcot Vademecum PetroleoDocument9 pagesKelcot Vademecum PetroleoNicolás Fernández CanepaNo ratings yet
- Calor Especifico de Un MetalDocument24 pagesCalor Especifico de Un MetalJimmy JohnsNo ratings yet
- Catalogo2020Marzo CapA Al CapGDocument175 pagesCatalogo2020Marzo CapA Al CapGJuan WilchesNo ratings yet
- Actividad en Las Células MicrobianasDocument7 pagesActividad en Las Células MicrobianasKaterin Díaz FuentesNo ratings yet
- CquintiniDocument38 pagesCquintiniJose Jacobo Alvarez Saint-HilaireNo ratings yet
- Clasificacion de TapasDocument4 pagesClasificacion de TapasEduardo RamírezNo ratings yet
- Tesis Proteccion Sup Protecion Catodica AdistanciaDocument154 pagesTesis Proteccion Sup Protecion Catodica Adistanciaaarroyof0% (1)
- Practica 5 Lechos Empacados 2023pdfDocument36 pagesPractica 5 Lechos Empacados 2023pdfJosue HernandezNo ratings yet
- Problemas Cap. V - ViDocument18 pagesProblemas Cap. V - ViAlexander TRNo ratings yet
- Seguridad Con ExplosivosDocument90 pagesSeguridad Con ExplosivosDayler Martín Ramírez Aguilar100% (1)
- Olimpiadas OnceDocument18 pagesOlimpiadas OncejoseNo ratings yet
- Aleaciones Metálicas Usadas en OdontologiaDocument42 pagesAleaciones Metálicas Usadas en OdontologiaNobul XNo ratings yet
- Formas Farmacéuticas EmulsionesDocument38 pagesFormas Farmacéuticas EmulsionesRasecCCarrascoNo ratings yet
- s01s1 Ejercicios ResueltosDocument13 pagess01s1 Ejercicios ResueltosCarlos Danilo Garcia Tello100% (1)
- Informe Visita Clima BusDocument9 pagesInforme Visita Clima BusCarlitos MartínezNo ratings yet
- Indices OjoDocument19 pagesIndices OjoBryan RodríguezNo ratings yet
- Formato Plantilla PowerPoint FINAL LineamientoDocument12 pagesFormato Plantilla PowerPoint FINAL Lineamientoluis carlos duarteNo ratings yet
- Taller 3 Química Orgánica 2019-2Document3 pagesTaller 3 Química Orgánica 2019-2GIOVANNY SEBASTIAN ALVARADO MENDEZNo ratings yet
- Clase 4 DiagenesisDocument54 pagesClase 4 DiagenesisManuel AzancotNo ratings yet
- Destilacion TBP de Los CrudosDocument4 pagesDestilacion TBP de Los CrudosWashington Omar Masaquiza100% (3)
- Normas y Codigos Vi Asme S 2 (202120)Document43 pagesNormas y Codigos Vi Asme S 2 (202120)jose.A ApazaNo ratings yet