Professional Documents
Culture Documents
Antigenele Si Anticorpii
Uploaded by
Ale RobaşCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Antigenele Si Anticorpii
Uploaded by
Ale RobaşCopyright:
Available Formats
IV.
Antigenele
Reprezint substane (vii sau particule inerte) ce sunt
recunoscute ca i non-self de ctre organism. Antigenele sunt
capabile s induc un rspuns imun umoral specific (definit ca i
umoral din cauza participrii moleculelor de anticorpi cu rol de
mediatori) i/sau un rspuns imun celular (prin participarea celulelor
reacionate de ctre antigene).
Non-self reprezint nu numai structur strin, dar i un
aranjament particular al aminoacizilor n cadrul structurii primare a
proteinelor, care poate fi epus la suprafa!a celular i recunoscut ca i
non-self.
"a modul general, antigenele capabile s induc un rspuns
imun, sunt definite ca i imunogene i pot fi macromolecule (cu o
greutate molecular mai mare 10000 !)# de obicei sunt proteine, mai
rar glucide i lipide.
$entru a fi imunogen (capacitatea de a induce sintez de
anticorpi specifici) un antigen trebuie s posede c%te&a caracteristici'
( s fie recunoscut ca i non-self,
( pe suprafa!a lui s eiste determinani antigenici (recunoscui ca
i epitopi) care &or induce antigenicitatea i imunogenicitatea.
Antigenele cu muli determinani antigenici (celule,
esuturi, fragmente de" bacterii, virusuri, parazii, animale) pot fi'
structurile proteice sau macromoleculele glucoproteice libere (care
sunt foarte uor fagocitate), sau legate de anumite celule specializate )
cum sunt #$% (%elulele $rezentatoare de #ntigen) celule cu rol
pregtirea i prezentarea antigenelor.
Antigenicitatea depinde de'
- persistena unei molecule antigenice n organism,
- structura c&imic (proteinele i glicoproteinele sunt foarte
imunogene),
- modul de prezentare a epitopului pe suprafa!a celular,
- calea de inoculare a antigenului.
Substanele chimice simple (cu greutate molecular mai mic
de 10 '!) se recunosc ca i haptene sau antigene incomplete (cum
sunt medicamentele, molecule lipidice, glucidice, toate recunoscute ca
i alergeni) i nu posed capacitatea de a fi imungene# aceste structuri
sunt capabile s de&in imunogene doar c%nd sunt legate de o
protein carrier cu a*utorul creia vor avea o greutate molecular
mai mare. +,iar dac &aptena nu induce sintez de anticorpi, este
capabil s reacioneze cu anticorpii specifici (atunci c(nd e)ist
anticorpi specifici sintetizai *n urma e)punerilor anterioare la aceeai
&apten)# cel mai adesea se sintetizeaz molecule de +g,.
$entru ca un anticorp s fie sintetizat mpotri&a unei ,aptene,
trebuie s eiste o cooperare ntre limfocitele - i . (cooperare
intercelular)# celulele - &or fia carrier(ul i &or epune ,aptena
limfocitelor ., care &or fi acti&ate i se &or transforma n plasmocite
(celule sintetizatoare de anticorpi specifici anti-&apten) (fig 11).
///////////////////////////////////
/ig 11 %ooperarea intercelulara
///////////////////////////////////
Determinanii antigenici, cunoscu!i i ca epitopi, &ariaz ca i
numr de la un antigen la altul, fiind ntr(un numr mai mare c%nd
molecula este mai mare, conform(ndu-se profilul antigenic.
Valena antigenic &ariaz n func!ie de greutatea molecular
a moleculei de antigen 0e eemplu, molecula de ,emoglobin (cu o
greutate molecular de apro)imativ 01 '!) are 1 situsuri combinati&e
(valene), molecula de mioglobin (cu o greutate de 12 '!) are 2
&alen!e.
3n cazul unui antigen proteic eist epitopi diferii (capabili s
induc sintez de anticorpi specifici diferii, practic pentru fiecare tip
de epitopi) iar n cazul unui antigen poliza&aridic eist epitopi
repetitivi (unii dintre ei cu funcii dominante).
$entru fiecare tip de epitop, n populaia limfoid eist un
corespondent, reprezent%nd o clon limfoid. +a i regul general, un
epitop selecteaz o clon limfoid propice (care va fi activat i va
e)pansiona) rezultatul fiind sinteza de anticorpi specifici# etapa final
este combinaia dintre antigen i anticorpul specific.
Configuraia spaial influen!eaz grupurile determinante )
acest lucru poate fi eplicat prin faptul c fiecare epitop (diferit) &a
induce sintez de anticorpi specifici ) care posed un situs potri&it,
denumit paratop, care prezint specificitate fa de epitop.
4ist situaii c%nd antigenul induce sintez de anticorpi, iar
acetia sunt capabili s reacioneze i cu structuri antigenice similare
celui care le(a indus produc!ia ) recunoscu!i ca i antigene cross-
reactive# aceste antigene posed n comun structuri similare sau c,iar
identice, rezultatul fiind cross-reacii (de e)emplu streptococul 3-
&emolitic grup # posed structuri similare cu cele miocardice umane).
3n ceea ce pri&ete recunoaterea structurilor antigenice de
ctre celulele mitogene active, antigenele se pot clasifica n'
antigene naturale, antigene strine, antigene self! i antigene
ale sistemului de histocompatibilitate'
( antigenele naturale' pot fi solubile (proteine, poliza&aride)
sau corpusculare (virusuri, bacterii, parazii etc)# pentru a fi
imunogenice, proteinele trebuie s aib o greutate molecular *ntre 4
'! i 10 '! (unele sunt *nalt imunogene de e)emplu albumina,
glicoproteinele serice, *n timp ce altele sunt slab imunogene).
( marea ma*oritate a antigenelor, sunt antigene strine! sunt
reprezentate de' proteine, nucleoproteine, lipoproteine, glicoproteine,
poliza&aride cu greutate molecular mare# dintre acestea'
( a. antigene microbiene ) cum sunt' capsula, peretele
celular, flagelii, pilii, to)inele, anvelopa viral i
( b. antigene non-microbiene ( care includ' polenul,
celulele sanguine, proteinele serice, rejetul de esut etc.
( antigenele self! ) sunt antigene autologe, fiind capabile s
de&in imunogene, *n anumite condiii"
( prin eliberarea *n circulaie a componentelor sec&estrate
(din creier, testicule, tiroid, cristalin) care nu circul libere n condi!ii
fiziologice, ne&enind n contact cu sistemul limfoid n cursul procesului
de maturare imunologic# dac accidental aceste structuri &in n
contact cu sistemul imun, &or induce un rspuns autoimun#
( c%nd eist tulburri funcionale ale limfocitelor -
( n caz de tumori ) se &or forma structuri antigenice
(antigene specifice tumorale *nuntrul sau pe suprafaa celulelor
tumorale) care se identific n 2 categorii'
( a antigene tumorale asociate virusului
- b antigene asociate rejetului de gref
-c antigenele oncofetale (embriofetale5 sau
antigenul carcinofetal# aceste antigene sunt prezente doar n
perioadele embrionare i fetale, dar pot reapare la indi&izii cu patologie
tumoral, din cauza unei depresii genetice (de e)emplu -fetoproteina
i antigenul carcino-embrionar)# -fetoproteina este o glicoprotein
seric, la adult concentra!ia este foarte sczut (1-6 ng7ml)# n condi!ii
oncogenice, concentra!ia crete, de&enind un mar'er al carcinomului
&epato-celular sau al tumorilor cu celule germinative# antigenul
carcino-embrionar ) este un antigen proteic i un mar'er al tumorilor
de tract gastro-intestinal sau respirator.
- antigene de histocompatibilitate (a se vedea *n continuare).
Specificitate antigenic
4ste determinat doar de determinanii antigenici, nu de
ntreaga molecul. Aceasta eplic de ce 5 antigene au aceeai
specificitate c%nd au epitopi identici (c&iar dac restul celulei este
diferit) sau 5 antigene sunt diferite c%nd posed epitopi diferi!i (c&iar
dac restul moleculelor este identic).
Specificitatea de specie (specificitatea izo-antigenic)
-o!i membrii unei anumite specii posed antigene specifice,
care nu se gsesc la membrii altor specii.
Specificitatea de organ
6n indi&id prezint antigene caracteristice de organ, esut (de
e)emplu" de cristalin, &epatic5 care nu sunt prezente pe alte structuri
ale indi&idului
Antigene heterofile
7unt antigene ce se gsesc *n esuturile membrilor aparin(nd
unor specii total diferite (de e)emplu antigenele "orssman care
e)ist la mamifere, reptile cu s(nge rece, peti, dar i bacterii"
8almonella, 8&igella, Neisseria, %lostridium9 un alt e)emplu este
streptococul #-hemolitic grup A care are antigene comune, ca i
structur, cu cele ale muc&iului cardiac uman i cu esutul conjunctiv
uman).
Antigenele specifice celulare
7unt denumite i mar$eri antigenici de suprafa# pe baza
lor este posibil identificarea populaiilor celulare.
6nul dintre antigenele prezente pe suprafa!a tuturor celulelor
unui indi&id (ca i parte a membranei celulare) este antigenul de
histocompatibilitate# acest antigen nu difer de la un organ la altul
sau de la un !esut la altul al aceluiai indi&id, dar difer ntre indi&izii
aceleiai specii.
#ntigenele de &istocompatibilitate sunt codate genetic, de ctre
5 loci diferi!i de ,istocompatibilitate, localiza!i pe gene diferite (locii
pentru sistemul ma%or de compatibilitate sunt localizai pe
cromozomul :)# pe l%ng acetia sunt recunoscu!i si loci pentru
sistemul minor de histocompatibilitate (antigene minore de
&istocompatibilitate) care prezint o imunogenicitate sczut.
Clasificarea antigenic
a. din punct de vedere al organismului care recunoate
structurile non-self!, antigenele pot fi clasificate ca i& antigene
autologe, allo-antigene sau 'eno-antigene.
Antigenele autologe ) se dez&olt n func!ie de structura
c&imic sau modificrile structurilor self, dar apar i n tulburrile
sistemului imun, c%nd dispare tolerana fa de structurile self, astfel
transform%ndu(se n structuri imunogenice# aceste condi!ii induc un
rspuns autoimun (patologie autoimun).
Allo-antigenele sau i(o-antigenele ) sunt prezente numai la
anumi!i indi&izi ai unei specii, fiind capabile s induc producie de
izoantigene la al!i indi&izi din aceeai specie (de e)emplu antigenele
sistemului ;#., antigenele de &istocompatibilitate, mar'erii celulelor
limfoide etc).
)eno-antigenele apar!in diferitelor specii# aceste structuri sunt
*ntotdeauna recunoscute ca i non-self.
b. din punct de vedere al claselor celulare care pot fi
acti&ate de ctre antigene, se disting' antigene timo-dependente i
antigene timo-independente.
Antigenele timo-dependente ) sunt recunoscute de
limfocitele -&# aceste antigene se gsesc larg rsp%ndite n natur, de
obicei fiind molecule ne-polimerizate.
Antigenele timo-independente ) nu implic participarea
limfocitelor -, fiind capabile s activeze direct limfocitele .# acest tip
este reprezentat de molecule polimerizate, ce prezint determinani
antigenici repetitivi (de e)emplu endoto)inele, poliza&aridele din
capsula pneumococului).
c. !in%nd cont de calea utili(at de celulele fagocitare *n
procesarea antigenelor, eist 2 tipuri'
( tipul I ) prima clas ) antigenele nu sufer nici un fel de
modificare molecular# antigenele sunt e)presate pe lanul a al <=% (a
se vedea reprezentarea sc&ematic fig 11) al #$% (celulelor
prezentatoare de antigen).
( tipul II ) clasa secund ) c%nd antigenele sunt
desfurate spaial, pentru a se evidenia epitopii
( tipul III ) clasa a treia ) antigenele necesit a fi divizate
*n fragmente, de ctre celulele fagocitare, pentru a fi re-e)puse pe
suprafaa celulelor ca i fragmente de epitopi
Superantigenele +SA,-
Reprezint o familie de molecule, ce apar!in fie'
a. to'inelor bacteriene, sau
b. produilor codai de genele retrovirale.
a. e'oto'inele (de e)emplu enteroto)ina, to)ina e)foliativ, a
sindromului de soc to)ic ale stafilococului aureus coagulazo (>5 pe
scurt stafilococului patogen, to)inele eliberate de unele tulpini ale
streptococului piogenes de grup #, to)ina eliberat de %lostridium
perfringens) toate sunt capabile s dezec&ilibreze &omeostazia
sistemului imun
7(a do&edit c, n general, pentru activarea e)tensiv a
limfocitelor - este ne&oie doar de cantiti mici de to)ine.
b. din aceast categorie, se pot men!iona' superantigenele
limfocitelor minore (<?8-<inor ?@mp&oc@tes 8uperantigens5 sau
proteina . ce aparine nucleocapsidei virusului rabiei
-oate aceste superantigene stimuleaz un numr mare de
limfocite -, induc%nd un lan! de procese complee n cadrul sistemului
imun, cauz%nd sindromul ocului septic p%n la reacii autoimune# dar
n acelai timp aceste propriet!i se pot folosi n beneficiul terapeutic la
diferite patologii, cum ar fi' artrite, 8+!#, patologia malign, prin
utilizarea caracterului imunomodulator al superantigenelor.
Aeplicarea celulelor - (sub influena superantigenelor) este
acompaniat de o sintez important de +?-1, +/N_ i alte cito8ine.
3n cazul to)icitii induse de superantigene, este implicat acelai
proces de proliferare limfocitar, acompaniat de secreie de cito'ine,
leucotriene i eliberare de ali factori pro-inflamatori.
-oate aceste fenomene, stimuleaz ntr(o manier pronun!at
diferite tipuri celulare, conduc%nd ntr(un final la imunosupresie i oc.
$roliferarea limfocitelor activate (indus de superantigene) are
ne&oie de prezen!a de celule accesorii' limfocite ., monocite,
macrofage, celule dendritice, celule timice. -oate acestea e)preseaz
pe suprafaa lor molecule apar!in%nd clasei a ++-a <=% (%omple)ului
<ajor de =istocompatibilitate5
%lasa a ++-a <=% constituie principalul receptor celular pentru
superantigenele bacteriene, pentru antigenele clasice sau peptidele
antigenice (procesate de #$%- celulele prezentatoare de antigen)#
peptidele antigenice sunt fiate *ntr-o cavitate format de B i 3 &eli)-
ul structural al <=% clasa a ++-a # n cazul antigenelor neprocesate,
acestea &or fi fiate de ctre <=% clasa a ++-a , *nafara situsului
men!ionat anterior.
/ecunoaterea superantigenelor de ctre limfocitele 0
"egtura dintre superantigene i moleculele clasei a ++-a <=%
este primul pas necesar pentru recunoaterea antigenic# n acest mod
ele se &or lega de limfocitele -# rezult 5 proprieti ale
superantigenelor'
( se pot lega de moleculele clasei a ++-a <=% i
( pot s activeze limfocitele - ) rezultatul este un comple'
trimolecular, format din' 0C/ (receptorul celulei -5 - SA,
(superantigenele5 - 1C2 II (clasa a ++-a a %omple)ului major de
=istocompatibilitate5
///////////////////////////////////
/ig 11 $rezentarea superantigenelor
///////////////////////////////////
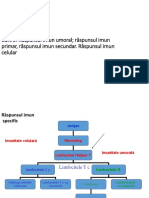
V. Anticorpii
Aecunoaterea structurilor Cnon-selfD este mar'erul rspunsului
imun adaptativ specific 4ist 5 tipuri distincte de molecule implicate'
imunoglobulinele i receptorii pentru antigeni ai celulelor 0
(-%A---%ell receptors).
Diversitatea i heterogenicitatea sunt trsturile
caracteristice ale acestor molecule# eist do&ezi c rearan%amentul
e'tins al genelor care genereaz imunoglobulinele i -%A ) st la
baza abilit!ii de a recunoate o mare diversitate de antigene
Imunoglobulinele
7unt un grup de glicoproteine, prezente n ser, esuturi i n
secreiile e)ocrine ale mamiferelor
3n organismul uman eist sub 9 forme diferite'
- molecule libere (*n fluidele organismului)
- comple'e Ag-Ac (antigen-anticorp)
- molecule citofilice fi'e (prin intermediul fragmentului "c, care
este un fragment C-terminal (carbon-terminal5 c(nd legarea are
loc *ntr-o manier nespecific9 *n cazul legrii specifice,
particip fragmentul "c care este .23-terminal)
- molecule fi'e situate pe suprafaa celulelor 4 ) ca i
receptori pentru antigene.
%ontactul dintre antigene i celulele . este necesar pentru
transformarea acestora n celule formatoare de anticorpi (plasmocite)
care &or secreta cantit!i mari de anticorpi. <oleculele de
imunoglobuline legate de membrana celular a celulelor . au aceleai
specificiti de legare ca i ale anticorpilor ce sunt produi de
plasmocite
4ste necesar s se men!ioneze trsturile moleculelor de
imunoglobuline ) care sunt diferite de ale altor proteine plasmatice,
astfel'
- capacitatea de a reaciona ntr(o manier specific cu antigenele
(prin intermediul paratopului)
- sensibilitatea fa de anumite enzime" papain, pepsin
- abilitatea de a fi)a componentele sistemului %omplement
- activarea proceselor de fagocitoz (prin intermediul opsonizrii
situaie *n care imunoglobulinele se identific ca i opsonine)
- sunt divizate *n clase i subclase.
7e recunosc 6 clase diferite de imunoglobuline ce eist la
mamiferele superioare, dup cum urmeaz' +gE, +g<, +g,, +g# i +g!.
Aceste clase se disting ntre ntre ele, lu%nd n considerare'
- mrimea moleculei,
- *ncrctura electric (din punct de vedere electroforetic,
migreaz de la fraciunea gamma spre fraciunea alfa a
proteinelor serice normale) (fig 10)
- secvena ##
- coninutul de carbo&idrai (%=)
- afinitate i aviditate (se refer la capacitatea de a recunoate
antigenele i puterea de legare a unui singur situs combinativ
sau a mai multor situsuri combinative)
/////////////////////////////////
/ig 10 <obilitatea electroforeticF a proteinelor plasmatice
/////////////////////////////////
Structura anticorpilor
%ristalografia *n radiaii G, demonstreaz forma de liter H a
moleculei de imunoglobulin.
:oleculele de imunoglobuline sunt compuse din dou tipuri
distincte de lanuri polipeptidice (lanul ? lig&t i lanul greu =
&eav@5 care sunt legate *ntre ele prin legturi covalente i necovalente.
5anul uor (5)
Are o greutate molecular de aproimati& 16000 ! i este
prezent la toate clasele de imunoglobuline# lan!urile uoare ale celor
mai multe &ertebrate eist sub 5 forme' denumite $appa ('5 i
lambda (5, acestea fiind practic izotipuri ale lanurilor uoare
-oate lan!urile uoare prezint o poriune constant
;poriunea %-terminal (carbon terminal5 ce prezint 102 reziduri de ##,
identificat ca i C5 (%onstant ?ig&t c&ain) i o regiune variabil (N-
terminal denumit V5 Iariable ?ig&t c&ain) deoarece prezint
variabilitate secvenial.
5anul greu
Are aproimati& 60000-22000 ! (apro)imativ de 1 ori mai lung
dec(t lanurile uoare) cu o structur distinct pentru fiecare clas i
subslas# eist < tipuri diferite' i . Aceste tipuri
determin clasa de imunoglobulin, respecti&' Ig,6 Ig16 IgA6 Ig7 i
IgD.
7e poate discuta i despre eisten!a subclaselor, doar la 5 tipuri
de imunoglobuline' Ig, i IgA.
3n cazul clasei Ig, eist 9 izotipuri (la baza lor stau 4 tipuri
diferite de lanuri grele" ________ i ____duc%nd la
identificarea a 9 subclase' Ig,86 Ig,3 Ig,9 i Ig,:.
Clasa IgA prezint 1 izotipuri' ;8 i ;3 ) iar subclasele se
identific ca i IgA8 i IgA3.
-oate aceste tipuri de lanuri grele, posed o regiune variabil
(I=) i un numr distinct de regiuni constante (%=).
Aegiunea I= prezint o &ariabilitate mult mai mare dec%t
regiunea I? (a lanului uor), ceea ce face s eiste o abilitate mare n
recunoaterea epitopilor (a determinanilor antigenici).
3n cadrul ambelor regiuni variabile ) ale lan!urilor grele i uoare
) anumite segmente scurte polipeptidice arat o &ariabilitate
ecep!ional ) segmente care se recunosc ca i regiuni
hipervariabile (*n concordan cu secvena ##), creindu(se astfel
%!As (%omplementar@ !eterming Aegions) practic regiuni
complementare. Regiunile &ariabile sunt pliate ntr(o aa manier ca
regiunile &ipervariabile sunt aduse aproape una de alta, pentru a se
forma structura de suprafa! care leag antigenul.
3n cazul claselor +gE, +g#, +g! i +g, eist 2 regiuni constante %=
(sau domenii) denumite %=1, %=1, %=0# deoarece molecula de +g<
este cea mai mare, eist 9 domenii' %=1, %=1, %=0 i %=4.
+a o regul care este strict respectat, n orice molecul de
imunoglobulin cele 1 lanuri uoare sunt identice (fie ' sau J), precum
i cele 1 lanuri grele (fie B, K, L, M sau N).
/iecare clas de imunoglobulin are funciile ei specifice, dar n
general sunt molecule bifuncionale'
( domeniile omologe ale lan!urilor grele i uoare sunt aezate *n
perec&e, n fragmente /ab (#ntigen .inding /ragment5, care particip
la legarea antigenului cu molecula de anticorp
( fragmentele %-terminal, sunt identificate ca i /c (%r@stallized
/ragment5 i au funcie efectoare, fiind implicate n '
( fi)area tisular,
( n activarea sistemului %omplement i
( acti&area celulelor implicate *n rspunsul imun # aceste celule
posed pe suprafaa lor receptori /c, cu rol *n legarea fragmentului /c
al moleculei de +g.
( este recunoscut o alt component foarte important a
moleculelor de imunoglobuline i anume regiunea CbalamaD (C&ingeD
region5 localizat ntre domeniile +=> i %=1# este o poriune fle)ibil,
de aceea permite procesul de adaptare la forma epitopului, particip%nd
la legarea de acesta.
+u a*utorul proteazelor, s(a putut do&edi structura clasic (fig 14) a
moleculei de +gE, astfel'
( papaina ) o fitoproteaz cli&eaz molecula de +gE la ni&elul
regiunii CbalamaD ntre domeniile %L1 i %L1 ) rezult%nd 1 fragmente
identice /ab i un fragment /c,
( pepsina ) o alt enzim, genereaz 5 fragmente mari ale
moleculei de ?g@ (practic 1 regiuni /ab care sunt legate una de alta,
prin regiunea CbalamaD) i un fragment parial de /c.
/////////////////////////////////
/ig 14 8tructura clasic a moleculei de +gE clivarea cu papain i pepsina"
I? ?ig&t Iariable Aegion (Aegiunea variabil a lanului uor59 %? ?ig&t
%onstant Aegion (regiunea constant a lanului uor59 I= =eav@ Iariable
Aegion (Aegiunea variabil a lanului greu59 %=1, 1, 0 =eav@ %onstant
!omains (Aegiunea constant a lanului greu59 /c %@stallized /ragment
(/ragmentul cristalizabil59 /ab #ntigen .inding /ragment (/ragmentul care
leaga antigenul59 =inge Aegion (regiunea C balamaD5
///////////////////////////////////
!iferenele secveniale (legate de succesiunea AA) ntre
moleculele de imunoglobuline pot fi' i(otipice, alotipice i idiotipice'
( variaia i(otipic ( genele pentru variantele izotipice sunt
prezente la to!i indi&izii sntoi apar!in%nd aceleiai specii# genele
pentru lan!urile' L1, L1, L0, L4, N, B1, B1, M, K, J, ' sunt toate prezente
n genomul uman, de aceea se definesc ca i izotipuri.
( variaia alotipic ) se refer la variaiile genetice care eist
ntre indi&izii apa!in%nd aceleiai specii, implic%nd e)istena a diferite
alele ale unui anume locus# de eemplu, &arianta pentru +gE0 ) nu se
gsete la to!i indi&izii, de aceea se definete ca i alotip apare ca i
variant a regiunii constante a lanului greu.
( variaia idiotipic ) este o variaie a domeniului variabil, n
mod particular la ni&elul regiunilor &ipervariabile# n general, sunt
specifice pentru clonele individuale ale limfocitelor .
( e'cluderea alelic ) pare s fie responsabil de sinteza unui
unic anticorp alotipic (care s fie specific fiecruia dintre miliardele de
antigene diferite cu care un individ vine *n contact de-a lungul vieii)#
plasmocitele sintetizatoare de anticorpi sufer aceast e)cludere
alelic.
Clasele de imunoglobuline
Clasa Ig,
<olecula de +gE are o structur tipic (prezentat mai sus)#
posed 1 legturi disulfidice intra-lan uor (o legtur *n regiunea
variabil i cealalt *n regiunea constant) i 4 legturi la nivelul
lanurilor grele N#
At%t n lanul uor c%t i n lanul greu, primele domenii
corespund regiunilor &ariabile (I=-lan greu, respecti& I?-lan uor).
!iferenele minime ntre subclasele de +gE (+gE1, +gE1, +gE0 i
+gE45 sunt reprezentate de sec&en!a de AA, care sunt concentrate n
regiunea CbalamaD
%lasa de +gE este clasa cea mai reprezentat n serul normal
uman, reprezent%nd 20-26O din ntreg rezer&orul de imunoglobuline.
%lasa +gE, care este distribuit *ntre spaiile intra i
e)travasculare, este reprezentanta ma*or a rspunsului imun
secundar (A+85 Anticorpii ?g@ maternali confer imunitatea temporar
a nou-nscutului# prin tra&ersarea placentei, moleculele de ?g@ confer
un ni&el crescut al imunit!ii pasi&e a nou(nscutului. +gE con!inute n
laptele matern, tra&erseaz selecti& tractul gastro(intestinal.
0intre rolurile clasei +gE, men!ionm'
- implicarea ei n #!%% (prin fagocitoza opsoninic)
- ia parte la reaciile de neutralizare (?g@ a&%nd funcia de
anticorpi neutralizani)
- acti&eaz sistemul %omplement (n cursul reaciei de fi)are a
%omplementului).
Clasa Ig1
+lasa ?g: are o structur pentamolecular# lan!ul greu A posed
secvena proprie de ## i au un domeniu constant *n plus. 7ubunit!ile
sunt legate prin legturi disulfidice ntre regiunile constante (la ni&elul
domeniului %0).
:olecula complet este format dintr(o regiune dens
compactat central, ce posed bra!e care radiaz (aspect obser&at n
microscopia electronic), a&%nd o configuraie tridimensional
Aceast clas reprezint >BC din rezer&orul de imunoglobuline
serice# din cauz ca dimensiunea este mare, ma*oritatea acestei clase
este situat intravascular i reprezint clasa de molecule acti&ate n
decursul rspunsului imun primar (A+$59
-ot din cauza dimensiunii, aceast clas nu poate tra&ersa
bariera placentar, neput%nd participa la imunitatea dob%ndit a nou(
nscutului.
+%nd moleculele de +g< se leag de flagelii bacterieni, capt o
configura!ie plat, de timbru do&edindu(se astfel fleibilitatea
regiunilor balama (la nivelul domeniilor %1 i %0) (fig 16).
D alt trstur a acestei clase este eisten!a unui lan peptidic
adiional Clanul PD, care st la baza reac!iei de polimerizare ntre cele <
molecule structurale.
%lasa +g< particip la amplificarea reaciilor de aglutinare,
precipitare i activare a sistemului %omplement
///////////////////////////////////
/ig 16 %onfiguraia CtimbruD a structurii pentamoleculare a clasei de +g<
(polimerizare datorat e)istenei lanului CPD5
///////////////////////////////////
Clasa IgA
?anul B posed 9 domenii' I=, %B1, %B1 i %B0# fragmenul %-
terminal este capabil s lege co&alent un lan adiional CPD rezult%nd o
structur dimeric# microscopia electronic arat n cazul clasei +g# o
imagine de dublu CHD9
Aceast clas reprezint ><(5BC din rezer&orul plasmatic al
imunoglobulinelor serice.
+g# se gsete n mod predominant *n secreiile suprafeelor
mucoase, cum sunt' saliva, colostru, secreiile tra&eo-bronice,
lacrimale, genito-urinare etc.
+g#s (+g# secretor5 este constituit din 1 uniti de +g#, un
component secretor i un lan CPD9 spre deosebire de lanul CPD,
componentul secretor nu este sintetizat de plasmocite (limfocite .
activate5, ci de ctre celulele epiteliale# structura dimeric este
sus!inut n aceast configura!ie de ctre lanul CPD secretat de ctre
plasmocitele submucosale (fig 1:).
8ubclasa +g#1 este cea mai reprezentat n ser, n timp ce +g#1
predomin n secre!ii# acest lucru se poate datora eisten!ei
microorganismelor de la ni&elul tractului respirator i digesti&e, care au
capacitatea de a cliva proteolitic subclasa +g#1.
:ecanismele de ac!iune la ni&el mucosal nu sunt pe deplin
n!elese, probabil func!ioneaz ca i obstacole n calea penetrrii
bacteriene la ni&elul celulelor epiteliale mucosale.
///////////////////////////////////
/ig 1: 8tructura dimeric a unei molecule de +g#s
///////////////////////////////////
Clasa IgD
Aceast clas reprezint mai pu!in de >C din totalul
imunoglobulinelor serice# acest lucru s(ar putea datora susceptibilit!ii
crescute la ac!iunea proteolitic, c,iar la proteoliz spontan# se
gsesc n cantit!i mai mari la ni&elul membranar al limfocitelor ., ca
i receptori membranari# se presupune c inter&in i n procesul de
dez&oltare a memoriei celulare.
Clasa Ig7
4ist n cantitti infime *n fraciunea plasmatic a
imunoglobulinelor. 7unt imunoglobuline citofilice, deoarece au
capacitatea de a se lega de receptorii celulari specifici (/cMA5 ce eist
pe suprafa!a anumitor celule' eozinofile, bazofile, celule mastocitare
de la nivelul mucoaselor" conjunctivale, nazale sau bronice.
+elulele men!ionate au toate n comun o trstur structural'
prezen!a intracitoplasmatic a granulelor ce con!in peptide biologic
acti&e (&istamin, serotonin, bradi'inin, &eparin etc).
Aceast clas este implicat n imunitatea anti-&elmintic i n
reaciile de tip alergic (astmul bronic, febra de f(n5 c%nd eist
eozinofilie.
Sinte(a de imunoglobuline
Aceste molecule sunt sintetizate sub un control genetic riguros#
odat sintetizate, moleculele &or *mbtr(ni, &or suferi un proces de
descompunere i &or fi nlocuite de alte molecule nou sintetizate.
Ambele procese ) catabolic i anabolic ) interfer dinamic,
rezultatul fiind meninerea homeosta(iei *n rspunsul imun de
tip umoral.
8inteza moleculelor de anticorpi, urmeaz anumite etape, astfel'
- procesul de CcomutareD &is(E(&is de clasa de imunoglobuline ce
urmeaz a fi sintetizat
- sintetiza lanurilor polipeptidice
- secundar aceste lan!uri se asambleaz
- se adaug componentele %= (domenii constante ale lanurilor
grele5 care &ariaz ntre 5(2 C la ?g@> p%n la >B(>5C la ?g:, ?g0
i ?g4
- polimerizarea i eliminarea moleculelor de imunoglobuline n
spaiile intra i e)travasculare
- catabolismul ) moleculele C*mbtr(niteD sunt n permanen!
nlocuite de molecule tinere, la un ni&el constant, determinat de'
tipul de clas, viteza de sintez a moleculelor, situsul de
degradare a moleculelor de imunoglobuline (probabil intestinul
gros i ficatul5
/eceptorii imunoglobulinelor
#ciunile intercelulare care implic participarea
imunoglobulinelor, se pot desfura condi!ionat de eisten!a
receptorilor pentru imunoglobuline pe suprafaa diferitelor celule9
c%!i&a dintre receptorii imunoglobulinici identifica!i, sunt'
- receptorii pentru Ig, ) care mediaz c%te&a funcii efectoare
(activiti biologice)'
o particip la fagocitoz (*n cursul #!%%)
o elibereaz mediatori i amplific procesul de prezentare a
antigenului
4ist 0 grupe de receptori tip +gE-A pe suprafa!a celulelor' "c<-
/I (%!:4) "c<-/II (%!01) i "c<-/III (%!1:)# to!i aceti receptori se
caracterizeaz prin eisten!a domeniilor e)tracelulare, iar distribu!ia
lor este urmtoarea'
- /cL-A+ ) pe suprafa!a celulelor mononucleare
- /cL-A++ ) distribuite larg pe suprafa!a celulelor mononucleate i
neutrofilelor
- /cL-A+++ ) pe macrofage, $<N, NQ i celulele -.
- receptorii pentru Ig7, eist n 5 variante'
o "c=-/I ) pe mastocite, eozinofile, bazofile ) reprezent%nd
receptorul clasic pentru ?g4
o "c=-/II ) pe leucocite i limfocite.
"unciile efectoare ale imunoglobulinelor
Func!ia principal a anticorpilor este de legare a antigenului#
#ctivarea sistemului %omplement este unul dintre cele mai
importante mecanisme efectoare ale moleculelor din clasa ?g@ i ?g:#
odat legate de antigen, se acti&eaz cascada enzimatic a sistemului
+omplement.
?g@9, ?gA, ?g0 i ?g4 nu au capacitatea de a acti&a acest sistem.
Aplicaii clinice ale imunoglobulinelor
7unt reprezentate de'
- transferul pasiv al unui ser imun sau &iperimun (cu inten!ia de a
lupta c%t mai eficient i rapid ) *n bolile infecioase acute"
scarlatin, tetanus, difterie etc)
- metode de diagnostic imunologic' n care trebuie utilizate
propriet!ile indi&iduale ale claselor de imunoglobuline'
precipitine, aglutinine, fi)atori de %omplement, sau *n metode ce
folosesc enzime i substrat ,?+8#, ,+#, +/ etc)
- identificarea anumitor subclase de imunoglobuline ) n s%nge,
urin, alte fluide biologice
- anticorpii monoclonali ) cu scopul identificrii anumitor antigeni
sau n ncercarea de a neutraliza celule de tip malign (*n
patologia neoplazic).
You might also like
- AntigeneleDocument3 pagesAntigeneleDora CenusaNo ratings yet
- Subiecte ImunologieDocument13 pagesSubiecte ImunologieDana AlexeNo ratings yet
- Curs 10 Antigene Si AnticorpiDocument27 pagesCurs 10 Antigene Si AnticorpiBogdan Bogatu100% (1)
- Imunologie CursDocument45 pagesImunologie CursDiana Ioana DumitrascuNo ratings yet
- Antigenele de HistocompatibilitateDocument29 pagesAntigenele de HistocompatibilitateMaria SasuNo ratings yet
- Nul EnterobacterDocument2 pagesNul EnterobacterApostu AncaNo ratings yet
- Subiecte ImunoDocument26 pagesSubiecte ImunoLarisa ButuNo ratings yet
- Celulele NKDocument14 pagesCelulele NKAndreea MrscNo ratings yet
- Reactii Ag AcDocument12 pagesReactii Ag Acunicorn_XNo ratings yet
- Raspunsul Imun CelularDocument7 pagesRaspunsul Imun CelularBetty ModoleaNo ratings yet
- Sub 5Document6 pagesSub 5Martesciuc VeraNo ratings yet
- Reactia Antigen-AnticorpDocument13 pagesReactia Antigen-AnticorpHer AngelaNo ratings yet
- Curs 10. Patogenitate Si Virulenta. Factorii Care Determina Patogenitatea BacteriilorDocument9 pagesCurs 10. Patogenitate Si Virulenta. Factorii Care Determina Patogenitatea BacteriilorAndrada OargăNo ratings yet
- Reactii Ag AcDocument23 pagesReactii Ag AcOvidiu TurcuNo ratings yet
- 07 Raspunsul Imun CelularDocument5 pages07 Raspunsul Imun CelularAna-MariaNo ratings yet
- Raspunsul Imun CelularDocument20 pagesRaspunsul Imun CelularNotInterested100% (1)
- Reacția IFCDocument17 pagesReacția IFCLuminita SajinNo ratings yet
- Curs 22. Genul Yersinia. Genul PseudomonasDocument9 pagesCurs 22. Genul Yersinia. Genul PseudomonasMedeea Mede0% (1)
- Subiecte Rezolvate LPDocument29 pagesSubiecte Rezolvate LPLoredana Elena UngureanuNo ratings yet
- Apararea NespecificaDocument5 pagesApararea NespecificaAndrada MariaNo ratings yet
- MD - Curs 3 - AnticorpiiDocument33 pagesMD - Curs 3 - Anticorpiimonicamonica06No ratings yet
- A. Reacţii de Aglutinare DirectăDocument2 pagesA. Reacţii de Aglutinare DirectăRaluca MaximNo ratings yet
- Factori de PatogenitateDocument6 pagesFactori de PatogenitateraluconfidentialNo ratings yet
- Bacili Gram Pozitivi NesporulatiDocument7 pagesBacili Gram Pozitivi NesporulatiLum16100% (1)
- Structura BacteriilorDocument11 pagesStructura BacteriilorAlexandra G. Cazan0% (1)
- Imunologie LP Ii 2010Document12 pagesImunologie LP Ii 2010violeta.enachescu-1No ratings yet
- Curs 3 - Raspuns Imun SpecificDocument7 pagesCurs 3 - Raspuns Imun SpecificIacob Denisia SeforaNo ratings yet
- Curs 5. Imunologie Răspunsul Imun Umoral - Celular PDFDocument43 pagesCurs 5. Imunologie Răspunsul Imun Umoral - Celular PDFMarian NeaguNo ratings yet
- Diagnosticul de Laborator EnterobacteriiDocument10 pagesDiagnosticul de Laborator EnterobacteriiSimona BratuNo ratings yet
- Material Consolidat Pregatire Examen Analize Imunologice 21-Iunie-2020 CompressedDocument33 pagesMaterial Consolidat Pregatire Examen Analize Imunologice 21-Iunie-2020 CompressedAna-Maria TanasăNo ratings yet
- Enzyme-Linked Immunosorbent Assay (ELISA) LiseviciElenaM1905Document16 pagesEnzyme-Linked Immunosorbent Assay (ELISA) LiseviciElenaM1905Elena L.No ratings yet
- Bacili Gram PozitiviDocument105 pagesBacili Gram PozitiviconoroNo ratings yet
- LP Bactemed III 9-14Document21 pagesLP Bactemed III 9-14Ramona MükNo ratings yet
- LimfociteDocument6 pagesLimfociteBianca AndreeaNo ratings yet
- Haemophilus InfluenzaDocument6 pagesHaemophilus InfluenzaIonela Marinela Badescu100% (1)
- Reactii Imunologice Utilizate in Laboratorul ClinicDocument6 pagesReactii Imunologice Utilizate in Laboratorul Clinicgabi podosuNo ratings yet
- IMUNOGLOBULINELE - ScurtDocument3 pagesIMUNOGLOBULINELE - ScurtMaria CloșcăNo ratings yet
- Anticorpi MonoclonaliDocument22 pagesAnticorpi Monoclonalibvl78No ratings yet
- LP 9 Microbiio Reactia Ag AcDocument35 pagesLP 9 Microbiio Reactia Ag AcAncaMariaNo ratings yet
- HipersensibilitateaDocument71 pagesHipersensibilitateaYoana PanteaNo ratings yet
- Curs 1 - Ciclul Replicativ + IntroducereDocument7 pagesCurs 1 - Ciclul Replicativ + IntroducereFaieryNo ratings yet
- Teste in Lab de ImunologieDocument119 pagesTeste in Lab de Imunologien1u1s1h1100% (1)
- Cursuri InflamatiiDocument131 pagesCursuri InflamatiiOana Andreea Ursică100% (1)
- Hiv SidaDocument3 pagesHiv Sidadoc buc100% (1)
- Proba de DigestieDocument4 pagesProba de DigestieroxanaNo ratings yet
- ImunoglobulineDocument10 pagesImunoglobulineClaudia JicmonNo ratings yet
- Mecanismele de Recunoaştere În RICDocument6 pagesMecanismele de Recunoaştere În RICOana AldeaNo ratings yet
- TolerantaDocument10 pagesTolerantaBianca AndreeaNo ratings yet
- Referat ComuniczareDocument3 pagesReferat ComuniczareJuly Si Mari RaducanuNo ratings yet
- c2 - Modalitati de Aparare A OrganismuluiDocument8 pagesc2 - Modalitati de Aparare A OrganismuluialiceinwinterNo ratings yet
- EnterococcusDocument26 pagesEnterococcusViorelia AdamescuNo ratings yet
- ANTIBIOGRAMADocument3 pagesANTIBIOGRAMAmiliindianuNo ratings yet
- Curs 5 Metode Imunochimice de AnalizaDocument5 pagesCurs 5 Metode Imunochimice de AnalizaGabriela PerdumNo ratings yet
- Curs 6 Mitache STAFILOCOCDocument29 pagesCurs 6 Mitache STAFILOCOCdaniela_piNo ratings yet
- Curs IIDocument5 pagesCurs IIcnajesrnasiferfNo ratings yet
- CURSUL 6 Si 7Document76 pagesCURSUL 6 Si 7AndreiNo ratings yet
- Antigene Si ImunogeneDocument12 pagesAntigene Si Imunogenegorexz gore100% (1)
- Curs 8 ImunoGlobuline CORECTATDocument9 pagesCurs 8 ImunoGlobuline CORECTATAuraNo ratings yet
- Prelegeri Totalizarea 3Document342 pagesPrelegeri Totalizarea 3Liudmila RusuNo ratings yet
- TOT CE TREBUIE SĂ ȘTII CA SĂ FII AS LA BIOLOGIE ÎNTR-UN DITAMAI CAIETULFrom EverandTOT CE TREBUIE SĂ ȘTII CA SĂ FII AS LA BIOLOGIE ÎNTR-UN DITAMAI CAIETULRating: 5 out of 5 stars5/5 (3)
- 7 Amprenta in Protetica FixaDocument223 pages7 Amprenta in Protetica FixaTeo PopNo ratings yet
- Alvin Toffler-Socul Viitorului 1-0-10Document290 pagesAlvin Toffler-Socul Viitorului 1-0-10Alina Mocanu100% (1)
- Imanuel Geiss - Istoria LumiiDocument606 pagesImanuel Geiss - Istoria Lumiigreezlee1319100% (1)
- Revolta Robotilor David IckeDocument47 pagesRevolta Robotilor David Ickecata.olteanu5984100% (2)
- Adresa 3196Document1 pageAdresa 3196Teo PopNo ratings yet
- ASsanoDocument6 pagesASsanoTeo PopNo ratings yet
- Nervul MandibularDocument11 pagesNervul MandibularTeo PopNo ratings yet
- Curs 5Document51 pagesCurs 5Teo PopNo ratings yet
- Stoma Nr-3 2013 Art-10Document4 pagesStoma Nr-3 2013 Art-10Teo PopNo ratings yet
- Serafim Rose - Cartea Facerii, Crearea Lumii Si Omul Inceputurilor - Ierom. Serafim RoseDocument465 pagesSerafim Rose - Cartea Facerii, Crearea Lumii Si Omul Inceputurilor - Ierom. Serafim RoseSamir Mihail Vancica100% (6)
- Nervul TrigemenDocument5 pagesNervul TrigemenDanbog BogdanNo ratings yet
- Tumori OdontogeneDocument24 pagesTumori OdontogeneCiprian Deac50% (4)
- Adresa 3196Document1 pageAdresa 3196Teo PopNo ratings yet
- Anestezia in StomatologieDocument15 pagesAnestezia in Stomatologiecameleon100% (4)
- Adresa 3196Document1 pageAdresa 3196Teo PopNo ratings yet
- Serafim Rose - Cartea Facerii, Crearea Lumii Si Omul Inceputurilor - Ierom. Serafim RoseDocument465 pagesSerafim Rose - Cartea Facerii, Crearea Lumii Si Omul Inceputurilor - Ierom. Serafim RoseSamir Mihail Vancica100% (6)
- Boala ParodontalaDocument19 pagesBoala ParodontalaTeo PopNo ratings yet
- Serafim Rose - Cartea Facerii, Crearea Lumii Si Omul Inceputurilor - Ierom. Serafim RoseDocument465 pagesSerafim Rose - Cartea Facerii, Crearea Lumii Si Omul Inceputurilor - Ierom. Serafim RoseSamir Mihail Vancica100% (6)
- Petre Tutea - Cugetari MemorabileDocument19 pagesPetre Tutea - Cugetari MemorabilenickalxNo ratings yet
- Samarandache, Florentin - India MagicaDocument89 pagesSamarandache, Florentin - India Magicaellalove100% (3)
- Proteze Mobile12Document22 pagesProteze Mobile12Teo Pop100% (1)
- Scurt Istoric Al ImplantologieiDocument27 pagesScurt Istoric Al ImplantologieiDiana IanaNo ratings yet
- Stoma Nr-3Document6 pagesStoma Nr-3Teo PopNo ratings yet
- Anatomie PatologicaDocument1 pageAnatomie PatologicaTeo PopNo ratings yet
- AtbDocument39 pagesAtbharveydominoNo ratings yet
- Anatomie PatologicaDocument1 pageAnatomie PatologicaTeo PopNo ratings yet
- Poti Muta Muntii Din Loc - 6 Metode Verificate de Crestere A Increderii in SineDocument37 pagesPoti Muta Muntii Din Loc - 6 Metode Verificate de Crestere A Increderii in Sineprojectconsult100% (16)
- Aryana Havah An Unnak Ki Versus An Unnak KiDocument81 pagesAryana Havah An Unnak Ki Versus An Unnak KiTeo PopNo ratings yet
- Trezirea in Traditiile Spirituale Ale Omenirii de MirahorianDocument164 pagesTrezirea in Traditiile Spirituale Ale Omenirii de MirahorianLao Tzu Lao Zi Lao Tseu100% (19)
- Bancuri 1 - Viata e Trista, Salariul e HazliuDocument713 pagesBancuri 1 - Viata e Trista, Salariul e HazliuangelofgloryNo ratings yet