Professional Documents
Culture Documents
Antioksidan Talas Ungu IVEN
Uploaded by
Ivhen AninOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Antioksidan Talas Ungu IVEN
Uploaded by
Ivhen AninCopyright:
Available Formats
URAIAN UMUM
1. Judul Uji Aktivitas Antioksidan Tepung Talas Ungu (Colocasia esculenta) Dengan Metode 1,1-Difenil-2-Pikrihidrazil (DPPH) Tahun 2013. 2. Tim Peneliti Yuniven Merina Anin Mahasiswa Jurusan Farmasi Poltekkes Kemenkes Kupang 3. Bidang Ilmu Bidang tekhnologi produksi, tekhnologi pangan dan gizi masyarakat
ABSTRAK Talas ungu (Colocasia esculenta) dapat diolah menjadi tepung yang kaya vitamin dan antosianin juga betakaroten yang mempunyai khasiat antioksidan. Tujuan dari penelitian ini adalah Membuat tepung dari talas ungu melalui proses pengeringan dengan sinar matahari dan mendapatkan data ilmiah tentang aktivitas antioksidan talas ungu. Aktivitas antioksidan ditentukan menggunakan metode DPPH dengan vitamin C sebagai baku pembanding. Daya aktivitas antioksidan peredaman radikal bebas DPPH (% peredaman) ekstrak serta vitamin C dianalisis dan masing-masing dihitung harga IC50 nya melalui analisis probit. Talas ungu (Colocasia esculenta) diolah menjadi tepung kemudian diuji aktivitas antioksidannya.
BAB I PENDAHULUAN
A. Latar Belakang
Kekayaan alam Indonesia merupakan sumber daya alam yang sangat berharga, iklim tropis yang dimiliki negara ini membuatnya menjadi negara yanag agraris yang banyak mengandalkan sektor agraria dalam menunjang pembangunan dan kebutuhan masyarakatnya. Pangan merupakan kebutuhan
dasar manusia untuk melanjutkan kehidupan. Kebutuhan pangan manusia berasal dari tumbuh-tumbuhan (pertanian primer) serta ternak dan ikan (pertanian sekunder), pangan yang dibutuhkan harus sehat dalam arti memiliki nilai gizi yang optimal seperti : vitamin, mineral, karbohidrat, lemak dan lainnya (). Bahan baku sebagian besar pangan olahan berasal dari tepung terigu (Triticum aestivum L. (Club wheat) dimana produksi tepung terigu di Indonesia masih bergantung pada gandum import. Selain itu, tepung terigu tidak mengandung vitamin A. Tepung tersebut difortifikasi untuk meningkatkan nilai gizi. Kedua faktor tersebut berdampak pada harga tepung terigu. Upaya-upaya dalam memanfaatkan bahan baku lokal sebagai subtitusi tepung terigu terus dilakukan. Talas ungu (Colocasia esculenta) sebagai salah satu sumber pangan lokal mempunyai potensi sebagai subtitusi tepung terigu. Kandungan vitamin dan mineral yang terkandung dalam talas ungu dapat mencukupi kebutuhan
3
gizi dalam makanan sehingga tidak perlu difortifikasi. Penelitian menunjukan banyaknya kandungan antioksidan yang berasal dari antosianin, vitamin C, vitamin E dan betakaroten yaitu pada ubi jalar ungu, dimana kandungan antosianin pada ubi jalar ungu yaitu 110-210 mg/100 g. Kandungan betakaroten sebesar 1.208 mg dan vitamin C sebesar 10,5 mg (Nintami, 2012). Antosianin dan betakaroten merupakan antioksidan alamiah yang dapat menghambat reaksi oksidasi oleh radikal bebas yang dapat memicu munculnya berbagai penyakit karena kerusakan sel. (Winarsi, 2007) Peningkatan nilai ekonomis dari talas ungu sebagai pangan lokal dapat dilakukan dengan mengolah menjadi bentuk setengah jadi, seperti tepung talas ungu yang selanjutnya dapat digunakan sebagai bahan subtitusi tepung terigu pada produk roti, kue dan mi basah, yang cukup potensial sebagai pengganti sumber karbohidrat. Penepungan dapat menjadi alternatif optimalisasi konsumsi pangan karena lebih fleksibel dan praktis dalam pengolahan produk makanan. Berdasarkan latar belakang tersebut maka dilakukan penelitian mengenai UJI AKTIVITAS ANTIOKSIDAN TEPUNG TALAS UNGU (Colocasia esculenta) DENGAN METODE 1,1-difenil-2-pikrihidrazil (DPPH) TAHUN 2013. B. Rumusan Masalah Apakah tepung talas ungu memiliki aktivitas antioksidan?
C. Tujuan Penelitian 1. Membuat tepung dari talas ungu melalui proses pengeringan dengan sinar matahari. 2. Mendapatkan data ilmiah tentang aktivitas antioksidan talas ungu. D. Manfaat Penelitian 1. Dapat memperkaya pengetahuan masyarakat tentang manfaat yang terkandung dalam talas ungu 2. Dapat memberikan informasi kepada masyarakat secara umum bagaimana mengolah talas ungu menjadi tepung
BAB II TINJAUAN PUSTAKA
A. Profil Tanaman Talas 1. Taksonomi tanaman talas Taksonomi tumbuhan talas secara lengkap adalah sebagai berikut: Kingdom Divisi Subdivisi Kelas Ordo Famili Genus Species : Plantae : Spermatophyta : Angiospermae : Monocotyledonae : Arales : Araceae : Colocasia : Colocasia esculenta
2. Kandungan gizi tanaman talas Umbi talas merupakan bahan pangan yang memiliki nilai gizi yang cukup baik. Komponen makronutrien dan mikronutrien yang terkandung di dalam umbi talas meliputi protein, karbohidrat, lemak, serat kasar, fosfor, kalsium, besi, tiamin, riboflavin, niasin, dan vitamin C (Catherwood et al., 2007; Huang et al., 2007; Sefa-Dedeh dan Agyr-Sackey, 2004; Perez et al., 2007). Komposisi kimia tersebut bervariasi tergantung pada beberapa faktor, seperti jenis varietas, usia, dan tingkat kematangan dari umbi. Muchtadi dan Sugiyono (1992)
6
menambahkan bahwa faktor iklim dan kesuburan tanah juga turut berperan terhadap perbedaan komposisi kimia dari umbi talas. Nilai lebih dari umbi talas adalah kemudahan patinya untuk dicerna. Hal ini disebabkan oleh ukuran granula patinya yang cukup kecil dan patinya mengandung amilosa dalam jumlah yang cukup banyak (20-25%). B. Oksidan radikal bebas Reaksi oksidasi terjadi setiap saat. Ketika kita bernapas pun terjadi reaksi oksidasi. Reaksi ini mencetukan terbetuknya radikal bebas yang sangat aktif, yang dapat merusak stuktur serta fungsi sel. Namun reaktivitas radikal bebas itu dapat dihambat oleh sistem antioksidan yang melengkapi sistem kekebalan tubuh. (Winarsi, 2007). Proses oksidasi yang terjadi nonstop di dalam tubuh menghasilkan molekul-molekul yang memiliki elektron berpasangan dan tidak
berpasangan. Molekul dengan elektron berpasangan akan membut kerja sesel tubuh tabil. Tetapi kerik tak berpasangan, elektronnya akan menjadi radikal bebas untuk mencari pasangannya. Ketika radikal bebs tersebut menempel pada molekul yan berpasangan yang dilakukannya hanyalah merusak DNA sel-sel molekul tersebut. Tetapi ketika dua radikal bebas yang mncari pasangan bertemu, mereka akan menciptakan hubungan yang stabil. Hal ini disebut rantai perusakan sudah dipatahkan oleh keterikatan antara dua radikal bebas. Namun tak semua radikal bebas beruntung menemukan pasangan elektronnya. Untuk itulah tubuh secara alamiah mengeluarkan enzim
antioksidan agar tetap melindungi sel-sel tubuh dari niat merusak radikal bebas (Siagian, 2011) Radikal bebas juga muncul di dalam proses fungsi normal dalam sel. Ini disebut metabolisme dan tentu saja sangatlah penting. Proses metabolisme memerlukan banyak reaksi kimiayang melibatkan aksi radikal bebas. Penggabungan rantai-rantai asam amino (polimerisasi) untuk membentuk protein, atau polimerisasi dari glukosa menjadi polisakarida, glikogen, misa, prosesnya dikendalikan selnya melibatkan aksi radikal bebas. Pada sebagian besar keadaan, prosesnya dikendalikan seara otomatis dan jumlah radikal bebas tidak menjadi terlalu tinggi sehingga berbahaya. (Youngson, 2005) C. Antioksidan 1. Pengertian Antioksidan Dalam pengertian kimia, senyawa antioksidan adalah senyawa pemberi elektron (Electro donors). Secara biologis, pengertian antioksidan adalah senyawa yang mampu menangkal atau meredam dampak negatif oksidan dalam tubuh. Antioksidan bekerja dengan cara mendonorkan satu elektronn kepada senyawa yang bersifat oksidan sehingga aktivitas senyawa oksidan tersebut bisa dihambat. (Winarsi, 2007) 2. Klasifikasi Antioksidan Secara umum, antioksidan dikelompokkan menjadi 2, yaitu antioksidan enzimatis dan non-enzimatis. Antioksidan enzimatis
misalnya enzim superoksida dismutase (SOD), katalase, dan glutation peroksida. Antioksidan non-enzimatis masih dibagi dalam 2 kelompok lagi, yaitu Antioksidan larut lemak, seperti tokoferol, karotenoid, flavonoid, quinon dan bilirubin. Sedangkan antioksidan larut air, seperti asam askorbat, asam urat, protein pengikat logam, dan protein pengikat heme. Berdasarkan mekanisme kerjanya, antioksidan digolongkan menjadi 3 kelompok, yaitu antioksidan primer, sekunder, dan tersier. a) Antioksidan primer Suatu senyawa dikatakan antioksidan primer apabila dapat memberikan atom hidogen secara cepat kepada senyawa radikal, kemudian senyawa radikal yang terbentu egera berubah menjadi senyawa yang lebih stabil (Winarsi, 2007). Bellville-Nabet (1996) menyebutkan bahwa antioksidan primer bekerja dengan cara mencegah pembentukan senyawa radikal bebas baru, atau mengubah radikal bebas yang telah terbentuk menjadi molekul yang kurang reaktif. Antioksidan primer meliputi enzim
Superoksida dismutase (SOD), katalase, dan glutation peroksidase. b) Antioksidan sekunder Antioksidan sekunder disebut juga antioksidan eksogenus atau non-enzimatis. Antioksidan dalam kelompok ini disebut sistem pertahanan preventif. Kerja sistem antioksidan non-enzimatis yaitu dengan cara memotong reaksi oksidasi berantai dari radikal bebas
tau denan cara menangkapnya. Akibatnya radikal bebas tidak akn bereaksi dengan komponen seluler (Lampe, 1999). Antioksidan sekunder meliputi vitamin E, vitamin C, -karoten, flavonoid, bilirubin, dan albumin (Winarsi, 2007) c) Antioksidan tersier Kelompok antioksidan tersier meliputi sistem enzim DNArepair dan metionin sulfoksida reduktase. Enzim-enzim ini berfungsi dalam perbaikan biomolekuler yang rusak akibat reaktivitas radikal bebas. (Winarsi, 2007) D. Metode pengujian aktivitas antioksidan 1. Metode DPPH Salah satu metode yang digunakan untuk pengujian aktivitas antioksidan adalah metode DPPH. Metode DPPH didasarkan pada kemampuan antioksidan untuk menghambat radikal bebas dengan mendonorkan atom hidrogen. Perubahan warna ungu DPPH menjadi ungu kemerahan dimanfaatkan untuk mengetahui aktivitas senyawa antioksidan. Metode ini menggunakan kontrol positif sebagai pembanding untuk mengetahui aktivitas antioksidan sampel. Kontrol positif ini berupa tokoferol, BTH, dan vitamin C. Uji aktivitas antioksidan dengan DPPH menggunakan 1,1-difenil-2-pikrihidrazil sebagai radikal bebas. Prinsipnya adalah reaksi penangkapan hidrogen oleh DPPH dari senyawa antioksidan misalnya troloks yang mengubahnya menjadi 1,1-difenil-2-pikrihidrazil.
10
H N-N(C6H5)2 O2N NO2 + AH antioksidan O2N N-N(C6H5)2
NO2 + A
NO2
NO2
Gambar 1. Reaksi antara DPPH dengan antioksidan Tabel 1. Tingkat kekuatan antioksidan dengan metode DPPH
Intensitas Sangat kuat Kuat Sedang Lemah
(Sumber: Edhisambada, 2011)
Nilai IC50 < 50 ppm 51 100 ppm 101 150 ppm > 150 ppm
2. Uraian spektrofotometri a) Pengertian Spektrofotometri Spektrofotometri UV-VIS merupakan metode yang
digunakan untuk analisa kualitatif dan kuantitatif bahan kimia. Metode spektroskopi ini didasarkan pada interaksi antara zat kimia dan energi, energi dan energi yang dimaksudkan adalah cahaya. Dua daerah pengukuran pada spektrofotometri UV-VIS yaitu daerah radiasi lembayung (ultraviolet) pada panjang gelombang 200-380 nm dan daerah radiasi sinar tampak (visibel) pada panjang gelombang 380-780 nm (Anonim, 1979). Spektrum
11
UV-VIS disebut juga spektrum elektronik karena terjadi sebagai hasil interaksi radiasi elektron. Interaksi itu terjadi karena adanya gugus berikatan rangkap atau terkonjugasi yang mengabsorbsi radiasi elektromagnetik di daerah UV-VIS. Apabila radiasi elektromagnetik dikenakan pada suatu molekul atom yang terjadi adalah sebagian dari radiasi
elektromagnetik tersebut diserap oleh molekul atau atom tersebut sesuai dengan strukturnya. Penyerapan radiasi oleh adanya senyawa pada daerah UV-VIS diakibatkan oleh adanya perubahan tingkat energi elektron dalam molekul. Apabila cahaya monokromatis dilewatkan pada suatu media yang homogen dengan intensitas cahaya datang (Io) maka sebagian besar cahaya tersebut dipantulkan (Ir), sebagian diabsorbsi (Ia) dan sebagian diteruskan (It). Dirumuskan : Io = Ir + Ia + It Hukum yang menggambarkan jumlah cahaya yang
diteruskan oleh suatu larutan dengan konsentrasi suatu konstituen yang mengabsorbsi cahaya tersebut dikenal dengan hukum lambert-beer yakni :
Log Io It
= a.b.c
Dimana : Io It a
= intensitas radiasi mula-mula = absorbtivitas = serapan
12
b c
= ketebalan = konsentrasi
Secara mendasar, metode-metode spektroskopi pada interaksi antara cahaya dan materi. Absorbansi larutan bertambah dengan pengurangan kekuatan sinar. Bila kekuatan benda atau konsentrasi materi yang dilewati cahaya bertambah maka cahaya akan lebih banyak diserap. Jadi absorbansi berbanding lurus dengan ketebalan dan konsentrasi. b) Instrumen spektrofotometri UV Vis Spektrofotmetri pada dasarnya terdiri atas sumber sinar monokromator, tempat untuk zat yang diperiksa, detektor, penguat arus, dan alat ukur atau pencatat.
13
BAB III METODE PENELITIAN
A. Jenis penelitian Jenis penelitian ini adalah Eksperimen Semu. B. Tempat dan waktu penelitian Penelitian ini dilakukan di laboratorium Farmakognosi dan Laboratorium Instrumen Jurusan Farmasi pada bulan Juni Juli 2013. C. Variabel 1) Variabel bebas Variabel bebas dalam penelitian ini adalah konsentrasi ekstrak talas ungu () yang digunakan untuk meredamkan radikal bebas 1,1diphenyl-2-picrilhidrazil (DPPH). 2) Variabel terikat Variabel terikat dalam penelitian ini adalah aktivitas antioksidan ekstrak talas ungu () terhadap 1,1-diphenyl-2-picrilhidrazil (DPPH).
14
D. Populasi Sampel Populasi dalam penelitian ini adalah talas ungu yang ada di Kabupaten Kupang. E. Sampel dan Teknik Sampling 1. Sampel Sampel yang digunakan dalam penelitian ini adalah ekstrak talas ungu () yang dibuat dalam konsentrasi beberapa konsentrasi. 2. Teknik sampling Teknik pengambilan sampel menggunakan teknik Purposive Sampling. F. Definisi Operasional 1) Talas ungu merupakan tanaman talas dengan warna daging ungu 2) Soxhletasi mengekstrak adalah metode ekstraksi yang digunakan talas untuk ungu,
senyawa
betakaroten
dari
tepung
menggunakan pelarut aseton. 3) Ekstrak aseton adalah ekstrak kental yang diperoleh dengan cara soxhletasi dan dibuat dalam konsentrasi 5.000, 10.000, 15.000 dan 20.000 ppm yang digunakan dalam uji aktivitas antioksidan dalam meredam radikal bebas 1,1-diphenyl-2-picrilhidrazil (DPPH). 4) Aktivitas antioksidan adalah kemampuan ekstrak aseton tepung talas ungu dalam meredam radikal bebas 1,1-diphenyl-2-picrilhidrazil (DPPH).
15
G. Alat dan Bahan 1. Alat a. b. c. d. e. f. g. h. i. Alat soxhlet (Eyela) Rotavapor (Eyela) Beaker gelas (pyrex) Erlenmeyer 250 mL (pyrex) Spektrofotometer UV-VIS (Shimadsu tipe W-1700) Neraca analitik Kern, type EW 220-3NM Labu ukur (pyrex) Pipet ukur Buret 25 mL (Dien)
2. Bahan a. b. c. d. e. f. Umbi talas ungu Aseton Etanol DPPH pro sintesis FeCl3 pro analis Vitamin C
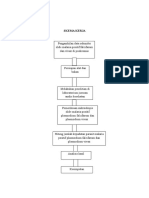
H. Prosedur Penelitian 1. Pengambilan sampel a. Pembuatan tepung 1) Umbi talas direndam dalam larutan garam 3% selama 5 menit 2) Umbi talas yang telah bersih dirajang tipis-tipis
16
3) Selanjutnya direndam dalam larutan kapur tohor 1,5% (b/v) selama 4 jam 4) Dicuci untuk proses penetralan 5) Hasil rajangan yang telah direndam dikeringkan menggunakan cahaya matahari 6) Setelah kering rajangan digiling dan diayak untuk mendapatkan tepung talas. b. Pembuatan ekstrak aseton umbi talas ungu Tepung talas ungu ditimbang sebanyak 100 gram dimasukkan dalam kantong dari kertas saring dan diikat dengan tali lalu dimasukkan dalam labu alas bulat ditambahkan pelarut aseton sebanyak 330 ml menggunakan metode soxhletasi diatur pada suhu 65 oC. Soxhletasi dihentikan sampai diperoleh larutan penyari yang jernih. Ekstrak yang diperoleh dipekatkan dengan evaporator dengan suhu 60 oC hingga pekat, selanjutnya disebut ekstrak aseton. Ekstrak aseton kemudian dibuat berbagai konsentrasi 5.000, 10.000, 15.000 dan 20.000 ppm. 2. Identifikasi kualitatif kandungan sampel Identifikasi senyawa polifenol dilakukan dengan menambahkan larutan besi (III) klorida 1% dalam air atau etanol kepada larutan cuplikan yang menimbulkan warna hijau, merah, ungu, biru, atau warna hitam yang kuat (Harborne, 1987).
17
3. Pengujian aktivitas antioksidan a) Penyiapan larutan DPPH 0,5 mM Larutan pereaksi adalah 0,5 mM dalam pelarut etanol. Larutan ini dibuat dengan cara menimbang 20 mg serbuk DPPH dan dimasukkan ke dalam labu ukur 100 ml ditambah etanol sebagian kemudian dikocok untuk melarutkan serbuk DPPH dan
ditambahkan etanol sampai tanda batas. b) Penentuan panjang gelombang maksimum Penentuan panjang gelombang maksimum larutan DPPH dilakukan sebagai berikut : 1 ml larutan DPPH 0,5 mM ditambah 4 ml etanol, dikocok homogen dan diukur serapannya yang diperoleh pada rentang 510-520 nm dengan blanko etanol. c) Penyiapan larutan uji Ekstrak etanol dilarutkan dalam etanol yang dibuat konsentrasi 20.000 ppm sehingga dalam 100 ml pelarut mengandung 2.000 mg ekstrak yang disebut larutan induk. d) Pengukuran absorbansi peredaman radikal bebas DPPH Larutan uji dengan berbagai konsentrasi 5.000, 10.000, 15.000, dan 20.000 ppm sebanyak 4 ml ditambahkan 1 ml larutan pereaksi DPPH dimasukkan dalam vial dikocok. Didiamkan selama 30 menit, kemudian dibaca serapan aktivitasnya pada panjang gelombang maksimum. Blanko yang digunakan adalah etanol dan vitamin C sebagai kontrol positif.
18
b. Analisis hasil Hasil pengukuran absorbansi dengan menggunakan
spektrofotometer UV-VIS digunakan untuk menghitung presentase peredaman radikal bebas DPPH. Aktifitas peredaman radikal bebas DPPH dihitung dengan menggunakan rumus :
Daya antioksidan = (Abs blangko Abs sampel Abs blangko x 100%
Daya aktifitas antioksidan peredaman radikal bebas DPPH (% peredaman) ekstrak etanol serta vitamin C dianalisis dan masing-masing dihitung harga IC50 nya melalui analisis probit.
19
JADWAL PELAKSANAAN Waktu pelaksanaan (Minggu ke-) 3 4 5 6
No
Kegiatan 1 2 Pengumpulan bahan baku, sortasi basah, sortasi kering Penepungan Pembuatan ekstrak aseton talas ungu Identifikasi kualitatif kandungan sampel Pengujian aktivitas antioksidan Analisis hasil
2 3 4 5 6
20
RINCIAN ANGGARAN A. Bahan Harga Satuan (Rp) 900/ml 1500/g 2700/mg 182/ml Total (Rp) 450.000 150 270.000 182.000 902.150
No 1 2 3 4
Nama Bahan Aseton Baku Vitamin C DPPH pro sintesis Etanol Pro Analisis
Jumlah 500 ml 100 mg 100 mg 1000 ml Jumlah
B. Reagen Jumlah No 1 Nama Bahan FeCl3 Pro Analisis 100 mg 1% Jumlah Harga Satuan (Rp) 5000/g Total (Rp) 500 500
C. Total Anggaran Bahan Reagen Total Rp902.150,Rp500,Rp902.650,-
21
DAFTAR PUSTAKA
Entjang, Indan, 2000. Ilmu Kesehatan Masyarakat. Bandung: Citra Aditya Bakti Harborne, J. 1987. Metode Fitokimia. Bandung : ITB Bandung. Hal 49 Siagian, Priska. 2011. Keajaiban Antioksidan. Jakarta: Gramedia Pustaka Utama Underwood, A.L, dan R.A. Day,Jr. 1999. Analisis Kimia Kuantitatif. Jakarta : Erlangga Winarsi, Hery. 2007. Antioksidan Alami & Radikal Bebas. Yogyakarta: Kasinus Youngson, Robert. 2005. Antioksidan Manfaat Vitamin C & E Bagi Kesehatan. Jakarta: Arcan
22
You might also like
- METABOLISME ENERGIDocument72 pagesMETABOLISME ENERGIEarlyna Sinthia AlexandraNo ratings yet
- Pati Hanya Tersusun Dari Dua Fraksi Yaitu Amilosa Dan AmilopektinDocument1 pagePati Hanya Tersusun Dari Dua Fraksi Yaitu Amilosa Dan AmilopektinDhimazz ApriaantoNo ratings yet
- Tepung TelurDocument17 pagesTepung TelurOchima Walichi Prameswari100% (1)
- EVALUASI PROTEINDocument15 pagesEVALUASI PROTEINKristianto PradiptaNo ratings yet
- Uas - Limbah Ternak - Ikuar JunandaDocument5 pagesUas - Limbah Ternak - Ikuar JunandaIkuar JunandaNo ratings yet
- ACARA II AmilosaDocument15 pagesACARA II AmilosanoorarifahNo ratings yet
- Makalah Pangan Fungsional Hewani-Senyawa Dari Ikan Dan AlgaDocument12 pagesMakalah Pangan Fungsional Hewani-Senyawa Dari Ikan Dan AlgaElysabeth agnesNo ratings yet
- MINERAL DALAM TUBUHDocument2 pagesMINERAL DALAM TUBUHMuhammad Raafi100% (1)
- Hurdle TeknologiDocument8 pagesHurdle TeknologiArindyaAndrianNo ratings yet
- Kandungan Karbohidrat Pada Tanaman HanjeliDocument8 pagesKandungan Karbohidrat Pada Tanaman HanjeliKiki Fatmawati100% (1)
- Skripsi MikoDocument51 pagesSkripsi MikoedyriodedeNo ratings yet
- Beras Analog Tepung MocafDocument7 pagesBeras Analog Tepung MocafAditya SetyaNo ratings yet
- Functional Food PDFDocument58 pagesFunctional Food PDFAprinia Dian NurhayatiNo ratings yet
- Aulia Rif'an Putra Nugraha, S.TPDocument96 pagesAulia Rif'an Putra Nugraha, S.TPBintang AdinaNo ratings yet
- PKM P 2012 IPB Hera T. Karakteristik Susu BubukDocument15 pagesPKM P 2012 IPB Hera T. Karakteristik Susu BubukriloaddNo ratings yet
- KRAKERSAPELDocument70 pagesKRAKERSAPELFebi RianiNo ratings yet
- Media Formulasi FermentasiDocument32 pagesMedia Formulasi FermentasiluqmanhharahapNo ratings yet
- KESUKAAN KONSUMENDocument8 pagesKESUKAAN KONSUMENvialutvianaNo ratings yet
- OPTIMALKAN NILAI GIZI NUGGET IKAN LELE DENGAN PENAMBAHAN WORTELDocument7 pagesOPTIMALKAN NILAI GIZI NUGGET IKAN LELE DENGAN PENAMBAHAN WORTELResy Rachma SyahtriNo ratings yet
- Pabrik Mikro Pasta Santan KelapaDocument6 pagesPabrik Mikro Pasta Santan KelapaHasbullah DahlanNo ratings yet
- ISOLASI ENZIMDocument48 pagesISOLASI ENZIMCitra AnggraeniNo ratings yet
- Skripsi Susanti PDFDocument45 pagesSkripsi Susanti PDFRima TWulan SariNo ratings yet
- PROPOSAL PKM Kelompok 5 Teknologi Pengolahan Sayur Dan BuahDocument26 pagesPROPOSAL PKM Kelompok 5 Teknologi Pengolahan Sayur Dan BuahresresfirNo ratings yet
- PORANGDocument5 pagesPORANGGunawanTri-Widagdo100% (1)
- Devy Syahputri (05031381823071) Laporan Praktikum HigieneeDocument11 pagesDevy Syahputri (05031381823071) Laporan Praktikum HigieneeDevy SyahputriNo ratings yet
- Proposal PenelitianDocument9 pagesProposal PenelitianElisa YunitaNo ratings yet
- Enzim AmilaseDocument5 pagesEnzim AmilaseIka N. PrasetyaningsihNo ratings yet
- EVALUASI PROTEIN DAN LEMAKDocument11 pagesEVALUASI PROTEIN DAN LEMAKzidni9No ratings yet
- YoghurtPembuatanDocument13 pagesYoghurtPembuatanWanda YunitaNo ratings yet
- Bab II Antinutrisi Dan ToksisDocument65 pagesBab II Antinutrisi Dan ToksisAdwin IsmailNo ratings yet
- Cookies Ubi JalarDocument35 pagesCookies Ubi JalarNadia PraditasariNo ratings yet
- Kajian Karakteristik Ketan Hitam (Aini, Et Al)Document12 pagesKajian Karakteristik Ketan Hitam (Aini, Et Al)Adi Kiplie100% (1)
- AflatoxinDocument11 pagesAflatoxinresha gustiNo ratings yet
- LKP EGP Daya Cerna Protein Fix 2Document9 pagesLKP EGP Daya Cerna Protein Fix 2AuliaNo ratings yet
- Laporan Praktikum SpermatologiDocument49 pagesLaporan Praktikum SpermatologiYunita ChoirunNo ratings yet
- (Terjemahan) Section 3. Chapt. 14Document45 pages(Terjemahan) Section 3. Chapt. 14174Debianto TikupadangC20UmumNo ratings yet
- Teknik Penyimpanan Dan PenggudanganDocument11 pagesTeknik Penyimpanan Dan PenggudanganUlfa TriovantaNo ratings yet
- Laporan PKLDocument76 pagesLaporan PKLDiniYuliantiNo ratings yet
- Sni 7474 2009 Rendang SapiDocument2 pagesSni 7474 2009 Rendang SapiYant RUma ButarNo ratings yet
- Dasar Teori Bakteri Asam LaktatDocument20 pagesDasar Teori Bakteri Asam Laktatrezkinugroho100% (1)
- Dodol SusuDocument16 pagesDodol Susuindah tiaraNo ratings yet
- TINJAUAN PUSTAKADocument8 pagesTINJAUAN PUSTAKAMunawirNo ratings yet
- Makalah Susu Kedelai FixDocument30 pagesMakalah Susu Kedelai FixPhy ElfNo ratings yet
- BiotoksikologiDocument6 pagesBiotoksikologiVidyatami Hanum PratiwiNo ratings yet
- Kadar AmilosaDocument53 pagesKadar AmilosaAldila Ratna OvrisadinitaNo ratings yet
- Jurnal Isolasi Dan Karakterisasi Bakteri Kotoran AyamDocument10 pagesJurnal Isolasi Dan Karakterisasi Bakteri Kotoran AyamTaufiq Ali100% (1)
- Telur Puyuh 3Document21 pagesTelur Puyuh 3Mubayinah100% (1)
- Non Thermal Food PerservationDocument58 pagesNon Thermal Food PerservationClaraNo ratings yet
- Teknologi Pangan Dan Gizi - Sayur SayuranDocument16 pagesTeknologi Pangan Dan Gizi - Sayur SayuranNisa Novita SariNo ratings yet
- Makalah BTPDocument16 pagesMakalah BTPViiindriNo ratings yet
- Isolasi Enzim Lipase Dari MikroorganismeDocument6 pagesIsolasi Enzim Lipase Dari Mikroorganismenorma fauziyahNo ratings yet
- Bab 1 2 Nata de WatermelonDocument3 pagesBab 1 2 Nata de WatermelonAnnisaNrNo ratings yet
- Pengolahan Termal (Blanching, Pasteurisasi, SterilisasiDocument38 pagesPengolahan Termal (Blanching, Pasteurisasi, SterilisasiSyntiya Inanda KhoidirNo ratings yet
- Makalah TahuDocument6 pagesMakalah TahuFiqar ArdhikaNo ratings yet
- Skripsi Susu JagungDocument68 pagesSkripsi Susu JagungHidayati Toluhula100% (1)
- Cheese StarterDocument13 pagesCheese StarterMeg CescNo ratings yet
- LAPORAN TELUR DAN SUSUDocument55 pagesLAPORAN TELUR DAN SUSUAna Althaufunnisa TwingirlNo ratings yet
- Bab Ii - 9Document8 pagesBab Ii - 9Syahira AddinaNo ratings yet
- ANTIOKSIDAN KATUKDocument15 pagesANTIOKSIDAN KATUKMuhamad IqbalNo ratings yet
- 14.I1.0078 ADINDA KHAIRUNISA (8.11) ..PDF BAB IDocument7 pages14.I1.0078 ADINDA KHAIRUNISA (8.11) ..PDF BAB IAkbar Galih UtomoNo ratings yet
- Tugas PengadaanDocument4 pagesTugas PengadaanIvhen AninNo ratings yet
- Laporan Pkpa Bab I-Ii (Fixxx)Document78 pagesLaporan Pkpa Bab I-Ii (Fixxx)Ivhen AninNo ratings yet
- PKPA Apoteker di RSD dr. SoebandiDocument154 pagesPKPA Apoteker di RSD dr. SoebandiernaNo ratings yet
- Drug Utilility Study: Cirroshis Hepatic + AscitesDocument16 pagesDrug Utilility Study: Cirroshis Hepatic + AscitesIvhen AninNo ratings yet
- Tugas PengadaanDocument4 pagesTugas PengadaanIvhen AninNo ratings yet
- Nyeri Otot 1Document4 pagesNyeri Otot 1Ivhen AninNo ratings yet
- Laporan Pkpa Bab III-lampiranDocument65 pagesLaporan Pkpa Bab III-lampiranIvhen AninNo ratings yet
- Bab IDocument8 pagesBab IIvhen AninNo ratings yet
- Wa0000Document4 pagesWa0000Ivhen AninNo ratings yet
- Tugas F.praktis Bu Utari AniDocument20 pagesTugas F.praktis Bu Utari AniIvhen AninNo ratings yet
- NoDocument1 pageNoIvhen AninNo ratings yet
- Tugas F.praktis Bu Utari AniDocument20 pagesTugas F.praktis Bu Utari AniIvhen AninNo ratings yet
- Suplementasi Besi Merupakan Cara Efektif Karena Kandungan Besinya Yang Dilengkapi Asam Folat Yang Sekaligus Dapat Mencegah Anemia Karena Kekurangan Asam FolatDocument6 pagesSuplementasi Besi Merupakan Cara Efektif Karena Kandungan Besinya Yang Dilengkapi Asam Folat Yang Sekaligus Dapat Mencegah Anemia Karena Kekurangan Asam FolatIvhen AninNo ratings yet
- Drug Utilility Study: Cirroshis Hepatic + AscitesDocument16 pagesDrug Utilility Study: Cirroshis Hepatic + AscitesIvhen AninNo ratings yet
- RawDocument9 pagesRawIvhen AninNo ratings yet
- WarfarinDocument1 pageWarfarinIvhen AninNo ratings yet
- Artikel SelesaiDocument7 pagesArtikel SelesaiIvhen AninNo ratings yet
- 51]BPOM tarik 51 produk jamu berbahayaDocument3 pages51]BPOM tarik 51 produk jamu berbahayaIvhen AninNo ratings yet
- Kanker Serviks NewDocument29 pagesKanker Serviks NewIvhen AninNo ratings yet
- Makalah Insulin SC Bu KisDocument13 pagesMakalah Insulin SC Bu KisIvhen AninNo ratings yet
- 51]BPOM tarik 51 produk jamu berbahayaDocument3 pages51]BPOM tarik 51 produk jamu berbahayaIvhen AninNo ratings yet
- 1.MAKALAH OsteoporosisDocument19 pages1.MAKALAH OsteoporosisIvhen AninNo ratings yet
- Alat Dan Perbekalan FarmasiDocument3 pagesAlat Dan Perbekalan FarmasiIvhen Anin0% (1)
- WarfarinDocument1 pageWarfarinIvhen AninNo ratings yet
- Makalah Insulin SC Bu KisDocument13 pagesMakalah Insulin SC Bu KisIvhen AninNo ratings yet
- Bab IDocument6 pagesBab IIvhen AninNo ratings yet
- TUGAS Dr. RatihDocument10 pagesTUGAS Dr. RatihIvhen AninNo ratings yet
- Lamp IranDocument1 pageLamp IranIvhen AninNo ratings yet
- Apakah Metadon ItuDocument1 pageApakah Metadon ItuIvhen AninNo ratings yet
- Apakah Metadon ItuDocument1 pageApakah Metadon ItuIvhen AninNo ratings yet










































































![51]BPOM tarik 51 produk jamu berbahaya](https://imgv2-2-f.scribdassets.com/img/document/331124887/149x198/7ba7a0f6c3/1479194896?v=1)