Professional Documents
Culture Documents
Asessmen 1
Uploaded by
winpraduani0 ratings0% found this document useful (0 votes)
27 views20 pagesPenilaian Sikap dan Keterampilan
Original Title
asessmen 1
Copyright
© © All Rights Reserved
Available Formats
PPTX, PDF, TXT or read online from Scribd
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentPenilaian Sikap dan Keterampilan
Copyright:
© All Rights Reserved
Available Formats
Download as PPTX, PDF, TXT or read online from Scribd
0 ratings0% found this document useful (0 votes)
27 views20 pagesAsessmen 1
Uploaded by
winpraduaniPenilaian Sikap dan Keterampilan
Copyright:
© All Rights Reserved
Available Formats
Download as PPTX, PDF, TXT or read online from Scribd
You are on page 1of 20
Nama Kelompok :
Dian Damayanti (13030194010)
Windi Praduani (13030194015)
Dinda Diana R (13030194017)
Imade Octaviani N (1330194055)
Laily Nur Faizah (13030194056)
PENILAIAN SIKAP DAN KETERAMPILAN
Materi Pokok :
Reaksi eksoterm dan reaksi endoterm
Perubahan entalpi reaksi
Kalorimeter
Hukum Hess
Energi ikatan
Kompetensi Inti
KI-1 : Menyadari adanya keteraturan dari sifat hidrokarbon,
termokimia, lajureaksi, kesetimbangan kimia, larutan dan
koloid sebagai wujud kebesaran Tuhan YME dan
pengetahuan tentang adanya keteraturan tersebut sebagai
hasil pemikiran kreatif manusia yang kebenarannya
bersifat tentatif.
KI-2 : Menunjukkan perilaku ilmiah (memiliki rasa ingin tahu,
disiplin, jujur, objektif, terbuka, mampu membedakan
fakta dan opini, ulet, teliti, bertanggung jawab, kritis,
kreatif, inovatif, demokratis, komunikatif) dalam
merancang dan melakukan percobaan serta berdiskusi
yang diwujudkan dalam sikap sehari-hari.
KI-3 : Membedakan reaksi eksoterm dan reaksi endoterm
berdasarkan hasil percobaan dan diagram tingkat energi.
KI-4 : Merancang, melakukan, menyimpulkan serta
menyajikan hasil percobaan reaksi eksoterm dan reaksi
endoterm.
Kompetensi Dasar
4.4 Merancang, melakukan, menyimpulkan serta
menyajikan hasil percobaan reaksi eksoterm dan
reaksi endoterm. (Kelas XI)
LEMBAR PRAKTIKUM SISWA
PERUBAHAN ENTALPI REAKSI
DALAM KALORIMETER SEDERHANA
A. Tujuan
Menentukan H reaksi antara HBr dan NaOH menggunakan
calorimeter sederhana.
B. Alat dan Bahan
1. Kalorimeter sederhana
2. Termometer
3. Gelas ukur 250 ml
4. 50 ml HBr 0,1 M
5. 50 ml NaOH 0,1 M
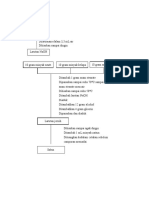
C. Cara Kerja
1. Masukkan 50 ml larutan NaOH 0,1 M ke dalam kalorimeter
sederhana, kemudian tutup rapat dan catat suhunya.
2. Masukkan 50 ml larutan HBr 0,1 M ke dalam gelas ukur dan
catat suhunya.
3. Tentukan suhu awal dengan menghitung suhu rata-rata
antara kedua larutan HBr dan NaOH.
4. Tuangkan HBr ke dalam kalorimeter sederhana yang berisi
larutan NaOH.
5. Aduk secara merata campuran kedua larutan dalam
kalorimeter tersebut. Pada kondisi ini, suhu akan naik,
kemudian menjadi tetap dan semakin menurun. Catat suhu
tetap sebagai suhu akhir
D. Hasil Pengamatan
Suhu larutan NaOH 0,1 M =
0
C
Suhu larutan HBr 0,1 M =
0
C
Suhu rata-rata (suhu awal) =
0
C
Suhu akhir =
0
C
Kenaikan suhu =
0
C
Pertanyaan :
1. Berapakah kenaikan suhu yang terjadi pada
campuran kedua larutan dalam kalorimeter
sederhana?
2. Jika kalor jenis larutan dianggap sama dengan kalor
jenis air (4,2 Jg
-1
0
C
-1
), hitunglah perubahan entalpi
reaksinya.
3. Tuliskan persamaan termokimia dari reaksi tersebut.
4. Termasuk jenis reaksi apakah persamaan
termokimia tersebut? Jelaskan.
5. Gambarkan diagram tingkat energinya.
6. Jelaskan kesimpulan dari praktikum ini.
PENILAIAN SIKAP
INDIKATOR :
*Jujur dalam melakukan kegiatan belajar maupun
praktikum
*Disiplin, tepat waktu dan menaati tata tertib yang
berlaku
*Tanggung jawab atas argumen maupu perilaku
selama kegiatan belajar maupun praktikum
*Peduli terhadap teman dan lingkungan sekitar
*Mampu kerjasama dengan baik dalam kelompok
*
NO Nama Siswa
Skor
K
e
j
u
j
u
r
a
n
D
i
s
i
p
l
i
n
T
a
n
g
g
u
n
g
J
a
w
a
b
P
e
d
u
l
i
K
e
r
j
a
s
a
m
a
J
u
m
l
a
h
1
2
3
4
5
6
7
8
9
10
Keterangan pengisian skor
*Sangat tinggi : 4
*Tinggi : 3
*Cukup tinggi : 2
*Kurang : 1
Nilai = skala yang diperoleh x 100
skala maksimal
Penilaian :
Skor 5 9 = Kurang (Nilai 25 - 40)
Skor 10 13 = Cukup (Nilai 50 - 65)
Skor 14 16 = Baik (Nilai 70 - 80)
Skor 17 20 = Sangat baik (85 100)
PENILAIAN KETERAMPILAN
INDIKATOR :
*Terampil merangkai alat
*Terampil menggunakan Kalorimeter
*Terampil menggunakan Termometer
*Mengamati suhu pada termometer
*Terampil mencampurkan kedua larutan dalam Kalorimeter
*Mengamati dan mencatat hasil pengamatan
*
No Nama
Aspek Penilaian
Jumlah
Skor
Nilai
(a) (b) (c) (d) (e) (f)
1
2
3
4
5
Aspek yang dinilai :
*Keterampilan merangkai alat
*Kerapihan menggunakan Kalorimeter
*Keterampilan menggunakan Termometer
*Keterampilan mengamati suhu pada termometer
*Keterampilan mencampurkan kedua larutan dalam
kalorimeter
*Mengamati dan mencatat hasil pengamatan dengan
benar
* Penilaian :
Skor 6 9 = Kurang (Nilai 33 - 50)
Skor 10 12 = Cukup (Nilai 55 - 67)
Skor 13 15 = Baik (Nilai 72 - 83)
Skor 16 -18 = Sangat baik (Nilai 89 - 100)
You might also like
- Pengaruh Konsentrasi Terhadap Pergeseran Kesetimbangan KimiaDocument18 pagesPengaruh Konsentrasi Terhadap Pergeseran Kesetimbangan KimiawinpraduaniNo ratings yet
- Analitik NMRDocument1 pageAnalitik NMRwinpraduaniNo ratings yet
- Kesetimbangan Kimia2Document35 pagesKesetimbangan Kimia2winpraduaniNo ratings yet
- Latian Soal UH StoikiometriDocument2 pagesLatian Soal UH StoikiometriwinpraduaniNo ratings yet
- Lampiran Grafik Reaksi AntaraDocument3 pagesLampiran Grafik Reaksi AntarawinpraduaniNo ratings yet
- KALSIUMDocument2 pagesKALSIUMwinpraduaniNo ratings yet
- Teori Belajar PiagetDocument10 pagesTeori Belajar PiagetUmi MahdiyahNo ratings yet
- Laporan Praktikum Matematika Kelas VDocument1 pageLaporan Praktikum Matematika Kelas VwinpraduaniNo ratings yet
- Soal Cerita Kecepatan Dan DebitDocument7 pagesSoal Cerita Kecepatan Dan DebitwinpraduaniNo ratings yet
- RPP Stoikiometri Part 2Document8 pagesRPP Stoikiometri Part 2Susu Pasteuirisasi UnimedNo ratings yet
- Taxonomi AndersonDocument3 pagesTaxonomi AndersonMuhammad YardoNo ratings yet
- Analitik NMRDocument1 pageAnalitik NMRwinpraduaniNo ratings yet
- Taksonomi AndersonDocument2 pagesTaksonomi AndersonLusiana LidwinaNo ratings yet
- SILABUS KIMIA SMADocument26 pagesSILABUS KIMIA SMASlamet RaNo ratings yet
- Daster AASDocument5 pagesDaster AASwinpraduaniNo ratings yet
- Hasil Pengamatan SabunDocument13 pagesHasil Pengamatan SabunwinpraduaniNo ratings yet
- ReaksiDocument3 pagesReaksiwinpraduaniNo ratings yet
- RPP Kimia KTSPDocument213 pagesRPP Kimia KTSPMuhammad AlamsyahNo ratings yet
- SengDocument1 pageSengwinpraduaniNo ratings yet
- TujuanDocument3 pagesTujuanwinpraduaniNo ratings yet
- Storyboard WindiDocument28 pagesStoryboard WindiwinpraduaniNo ratings yet
- Hasil Pengamatan SabunDocument13 pagesHasil Pengamatan SabunwinpraduaniNo ratings yet
- Ikatan kimia antar atom dan jenis ikatanDocument2 pagesIkatan kimia antar atom dan jenis ikatanwinpraduaniNo ratings yet
- Fungsi Biokim MineralDocument6 pagesFungsi Biokim MineralwinpraduaniNo ratings yet
- Windi Praduani - 13030194015 - PKA 2013 - Tugas 2 (Review RPP)Document2 pagesWindi Praduani - 13030194015 - PKA 2013 - Tugas 2 (Review RPP)winpraduaniNo ratings yet
- Asam-basa LarutanDocument5 pagesAsam-basa LarutanwinpraduaniNo ratings yet
- Bagian 11.5 Rumus Untuk HidratDocument11 pagesBagian 11.5 Rumus Untuk HidratwinpraduaniNo ratings yet
- Lap - Resmi FitoDocument25 pagesLap - Resmi FitowinpraduaniNo ratings yet
- RPP Ikatan KimiaDocument4 pagesRPP Ikatan KimiawinpraduaniNo ratings yet
- Reaksi Kimia Eksoterm dan EndotermDocument15 pagesReaksi Kimia Eksoterm dan EndotermwinpraduaniNo ratings yet