Professional Documents
Culture Documents
KARAKTERISASI Fusarium
Uploaded by
AdnanLasuardaOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
KARAKTERISASI Fusarium
Uploaded by
AdnanLasuardaCopyright:
Available Formats
21
KARAKTERISASI BIOLOGI ISOLAT-ISOLAT Fusarium sp
PADA TANAMAN CABAI MERAH (Capsicum annuum L.)
ASAL BOYOLALI
Skripsi
Program Studi/Jurusan Agronomi
Oleh :
ENDAH SULISTYO NUGRAHENI
H 0106008
FAKULTAS PERTANIAN
UNIVERSITAS SEBELAS MARET
SURAKARTA
2010
22
KARAKTERISASI BIOLOGI ISOLAT-ISOLAT Fusarium sp
PADA TANAMAN CABAI MERAH (Capsicum annuum L.)
ASAL BOYOLALI
SKRIPSI
Untuk memenuhi sebagian persyaratan
guna memperoleh derajat Sarjana Pertanian
di Fakultas Pertanian
Universitas Sebelas Maret
Jurusan/Program Studi Agronomi
Oleh :
ENDAH SULISTYO NUGRAHENI
H0106008
FAKULTAS PERTANIAN
UNIVERSITAS SEBELAS MARET
SURAKARTA
2010
23
HALAMAN PENGESAHAN
KARAKTERISASI BIOLOGI ISOLAT-ISOLAT Fusarium sp PADA
TANAMAN CABAI MERAH (Capsicum annuum L.) ASAL BOYOLALI
yang dipersiapkan dan disusun oleh
Endah Sulistyo Nugraheni
H 0106008
Telah dipertahankan di depan Dewan Penguji
pada tanggal : 28 Juli 2010
Dan dinyatakan telah memenuhi syarat
Susunan Tim Penguji
Ketua
Anggota I
Anggota II
Ir. Sri Widadi, MP
Dr. Ir. Supyani, MP
Prof. Dr. Ir. Supriyono, MS
NIP. 195208231976112001
NIP. 196610161993021001
NIP. 195907111984031002
Surakarta,
Juli 2010
Mengetahui,
Universitas Sebelas Maret
Fakultas Pertanian
Dekan
Prof. Dr. Ir. H. Suntoro, MS
NIP. 19551217 198203 1 003
24
KATA PENGANTAR
Puji syukur pada Allah SWT atas limpahan rahmat dan hidayah-Nya
sehingga penulis dapat menyelesaikan skripsi yang berjudul Karakterisasi
Biologi Isolat-Isolat Fusarium sp Pada Tanaman Cabai Merah (Capsicum
annuum L.) Asal Boyolali.
Penulis menyadari bahwa dalam penulisan dan penyusunan skripsi ini dapat
berjalan baik dan lancar karena adanya bimbingan, bantuan, dan pengarahan
berbagai pihak. Oleh karena itu, pada kesempatan ini penulis bermaksud
mengucapkan terimakasih kepada :
1. Prof. Dr. Ir. H. Suntoro, MS selaku Dekan Fakultas Pertanian Universitas
Sebelas Maret Surakarta.
2. Ir. Wartoyo SP, MS selaku Ketua Jurusan Agronomi Fakultas Pertanian
Universitas Sebelas Maret Surakarta.
3. Ir. Sri Widadi, MP selaku Dosen Pembimbing Utama yang telah memberikan
saran dan sumbangan pemikiran kepada penulis selama pelaksanaan penelitian
sampai penyusunan skripsi ini.
4. Dr. Ir. Supyani, MP selaku Dosen Pembimbing Pendamping atas masukan,
dukungan, dan bantuannya dalam teknis pelaksanaan penelitian sampai
penyusunan skripsi ini.
5. Prof. Dr. Ir Supriyono, MS selaku Dosen Pembahas atas masukan dalam
penyusunan skripsi ini.
6. Ir. Sukaya, MP selaku Dosen Pengampu Seminar Hasil atas masukan dalam
penyusunan skripsi ini.
7. Dra. Linayanti Darsana, MSi selaku Dosen Pembimbing Akademik atas
bimbingan selama kuliah, penelitian, dan skripsi ini.
8. Bapak Musawab selaku laboran Laboratorium Hama dan Penyakit Tanaman
atas bantuan dan masukannya selama penelitian berlangsung hingga akhir
penyusunan skripsi ini.
25
9. Keluarga tercinta Ayah, Ibu, Mamas & Mba Nungki, Mas Anto & Mba Aci,
Mas Agus & Mba Yayuk, Adek Uut, Adek Bayu, Adek Istie, Adek Fathin,
Adek Atha, Adek Nizar, serta Keluarga Semarang yang selalu mendukung dan
mendoakanku.
10. Teman satu tim penelitian (Nunu, Ipul, Putut) yang telah memberikan
bantuan dalam pelaksanaan penelitian sampai penyusunan skripsi.
11. Sahabatku Endang, Leny, Dewi, Niko, Dhita, Mei, Yani, Utik, Faz, Widhy,
Avi, Nit, dan Nanik yang telah memberikan dukungan dan doa selama ini.
12. Teman-teman Agronomi 2006, kakak tingkat dan adik tingkat yang telah
memberikan bantuan, dukungan, dan motivasinya selama ini.
13. Laskar PUSKOMDA SOLO RAYA (ATony, AArif, AAri, URetno,
UHesty, UWidhy dan semua jajaran pengurus PDa10) atas doa dan
semangat yang telah diberikan selama ini.
14. Teman-teman kos Wisma Almamater atas pemberian motivasi dan bantuannya
mulai dari awal penelitian hingga akhir penyusunan skripsi ini.
15. Semua pihak yang telah membantu demi kelancaran penelitian dan penulisan
skripsi ini yang tidak dapat disebutkan satu persatu.
Penulis menyadari bahwa penulisan skripsi ini masih jauh dari sempurna.
Penulis mengharapkan kritik dan saran yang membangun. Semoga skripsi ini
bermanfaat bagi penulis khususnya dan pembaca pada umumnya.
Surakarta,
Penulis
Juli 2010
26
DAFTAR ISI
Halaman
KATA PENGANTAR .................................................................................. iv
DAFTAR ISI .................................................................................................. vi
DAFTAR TABEL ........................................................................................ viii
DAFTAR GAMBAR ..................................................................................... ix
DAFTAR LAMPIRAN ....................................................................................x
RINGKASAN ................................................................................................. xi
SUMMARY ................................................................................................. xiii
I.
PENDAHULUAN .....................................................................................1
A. Latar Belakang ......................................................................................1
B. Perumusan Masalah ...............................................................................3
C. Tujuan Penelitian ..................................................................................4
D. Hipotesis ...............................................................................................4
II. TINJAUAN PUSTAKA ...........................................................................5
A. Cabai Merah (Capsicum annuum L.) .....................................................5
B. Fusarium sp ...........................................................................................6
C. Ketahanan Terimbas ............................................................................14
D. Mikovirus .............................................................................................16
III. METODE PENELITIAN ......................................................................17
A. Waktu dan Tempat Penelitian .............................................................17
B. Bahan dan Alat ....................................................................................17
C. Rancangan Percobaan .........................................................................17
27
D. Pelaksanaan Penelitian .........................................................................17
E. Variabel Pengamatan ...........................................................................20
F. Analisis Data ........................................................................................20
IV. HASIL DAN PEMBAHASAN ...............................................................21
A. Keadaan Umum Lokasi .......................................................................21
B. Isolasi dan Pembuatan Biakan Murni ..................................................22
C. Pengamatan Isolat Jamur Fusarium sp Secara Makroskopis ...............22
D. Pengamatan Isolat Jamur Fusarium sp Secara Mikroskopis ...............28
E. Uji Virulensi Isolat Jamur Fusarium sp ...............................................32
V. KESIMPULAN DAN SARAN ...............................................................36
A. Kesimpulan .........................................................................................36
B. Saran ....................................................................................................36
DAFTAR PUSTAKA ....................................................................................39
LAMPIRAN
28
29
DAFTAR TABEL
Nomor
Judul
Halaman
1. Pengamatan kelompok koloni isolat kontrol dan isolat perlakuan jamur
Fusarium sp secara makroskopis .....................................................................23
2. Pengamatan kelompok isolat kontrol jamur Fusarium sp secara mikroskopis.
...........................................................................................................................28
3. Pengamatan kelompok isolat perlakuan jamur Fusarium sp secara
mikroskopis .......................................................................................................29
DAFTAR GAMBAR
30
Nomor
Judul
Halaman
1. Diameter koloni isolat Fusarium sp pada umur 7 hari .....................................24
2. Penampakan secara makroskopis koloni isolat Fusarium sp ............................26
3. Penampakan secara mikroskopis koloni isolat Fusarium sp ............................30
4. Kerapatan spora isolat Fusarium sp ..................................................................32
5. Diameter kerusakan apel pada uji virulensi isolat Fusarium sp .......................33
31
ABSTRAK
Penelitian ini bertujuan untuk mengkaji karakter biologi dan keragaman virulensi isolat-isolat
Fusarium sp pada tanaman cabai merah (Capsicum annuum L.) asal Boyolali. Penelitian ini
dilaksanakan mulai bulan Oktober 2009 sampai dengan Mei 2010 di Laboratorium Hama dan Penyakit
Tanaman Fakultas Pertanian Universitas Sebelas Maret Surakarta.
Penelitian ini didesain sebagai penelitian eksploratif di lapang dan eksperimen di laboratorium.
Variabel pengamatan meliputi laju pertumbuhan koloni, fenotip koloni, sporulasi, dan uji virulensi. Data
dari hasil pengamatan laju pertumbuhan, fenotip koloni dan sporulasi disajikan dalam bentuk deskriptif.
Sedangkan data hasil uji virulensi dianalisis ragam dengan uji F pada taraf 5 %. Jika perlakuan
berpengaruh nyata maka dilanjutkan dengan Uji Jarak Berganda Duncans (DMRT) pada taraf 5 %.
Hasil penelitian menunjukkan bahwa cendawan Fusarium sp pada tanaman cabai merah asal
Boyolali mempunyai keragaman baik secara makroskopis ataupun mikroskopis, dengan tingkat virulensi
yang berbeda-beda. Kelompok koloni isolat Fusarium sp yang memiliki tingkat virulensi rendah adalah
kelompok isolat D, adapun karakter biologi isolat D adalah miseliumnya berwarna putih seperti kapas,
bentuk makrokonida panjang; ujungnya meruncing, makrokonidia bersekat 3-6 sekat, mikrokonidia
bersekat 0-1 sekat, ukuran [(5,35x3,15)-(4,75x2,5)] m x [(27,36x4,10)] m, kerapatan spora antara
25,64x106-27,76x106 spora/ml. Isolat ini memiliki potensi sebagai isolat hipovirulen yang dapat
digunakan sebagai agen pengendali hayati yang ramah lingkungan, yakni dengan menerapkan isolat
hipovirulen tersebut dalam sistem pengendalian hayati dengan metode ketahanan terimbas dan
virokontrol dengan mikovirus.
Kata Kunci : Fusarium sp, karakterisasi biologi, cabai merah
1) Peneliti adalah mahasiswa Jurusan/Program Studi Agronomi Fakultas Pertanian Universitas Sebelas
Maret Surakarta.
2) Pembimbing Utama
3) Pembimbing Pendamping
32
ABSTRAC
This research aimed to examine the biological characteristics and virulence diversity of
isolates of Fusarium sp on red chilli (Capsicum annuum L.) from Boyolali. This research was conducted
from October 2009 until May 2010 at the Laboratory of Plant Pests and Diseases Faculty of Agriculture,
University of Sebelas Maret Surakarta.
This study was designed as exploratory research in the field and in laboratory experiments.
Observed variables include the rate of growth of the colony, the colony phenotype, sporulation, spore
shape and size, and virulence test. Data from the observation colony phenotypes are presented in
descriptive form. While data were analyzed various virulence tests with the F test at level 5%. If
significant treatment then continued with Duncan's Multiple Range Test (DMRT) at 5% level.
The results showed that the isolates of fungi Fusarium sp in the red chilli plant origin has
Boyolali by macroscopic and microscopic diversity, with levels varying virulence. Group colony isolates
of Fusarium sp has a low level of virulence is the group D isolates, as for its biological isolate D is the
mycelium white as cotton, long-form macroconidia tapered tip, bulkhead 3-6 macroconidia sectional,
sectional microconidia 0-1 bulkhead, size [( 5.35 x3, 15) - (4.75 x2, 5)] m x [(27.36 x4, 10)] m,
spore density between 25.64 x106-27, 76x106 spores / ml. These isolates have potential as hipovirulen
isolates that can be developed as biological control agents are environmentally friendly, i.e., induced
resistance method and virocontrol with micovyrus method.
Keywords: Fusarium sp, biological characterization, red chilli
33
I.
PENDAHULUAN
A. Latar Belakang
Produk hortikultura seperti buah-buahan dan sayuran setiap hari selalu
dibutuhkan oleh masyarakat untuk memenuhi kebutuhan akan vitamin bagi
tubuh. Salah satu produk hortikultura yang setiap hari dibutuhkan masyarakat
adalah cabai merah, baik digunakan untuk sayuran maupun sebagai campuran
dalam bumbu masakan. Tanaman cabai merupakan salah satu komoditas
tanaman hortikultura yang buahnya memiliki nilai gizi cukup tinggi, terutama
kandungan vitamin A dan C. Kandungan gizi cabai dalam 100 gram bagian
yang dapat dimakan mengandung vitamin A sejumlah 71,00 mg dan vitamin C
sejumlah 18,00 mg (Wirakusumah, 1995 cit. Harpenas dan Dermawan, 2010).
Kebutuhan cabai merah dari tahun ke tahun semakin meningkat sejalan
dengan peningkatan jumlah penduduk, namun produksi cabai masih belum
mencukupi. Pada tahun 2006 luas areal panen cabai merah di Provinsi Jawa
Tengah mencapai sekitar 20.415 hektar dengan tingkat produksi 1.248.392
kwintal dan produktivitasnya sebesar 61,15 persen per tahun. Dalam pereode
2003-2006, luas areal panen cabai merah di Provinsi Jawa Tengah terlihat
mengalami kecenderungan penurunan sebesar 6,10 persen per tahun. Hal ini
disebabkan karena adanya serangan hama dan penyakit (Dinas Pertanian Jawa
Tengah 2006 cit. Supriyati dan Roosganda, 2009).
Usaha untuk meningkatkan produksi tanaman cabai masih mengalami
hambatan. Gangguan serangga, tungau, nematoda juga penyakit merupakan
34
ancaman yang selalu ada dalam setiap penanaman. Penyakit pada tanaman
dapat disebabkan oleh cendawan, bakteri, organisme mirip mikoplasma
(micoplasma-like organism), dan virus (Gunawan 2003 cit. Samoosir, 2007).
Salah satu penyakit yang disebabkan oleh cendawan adalah penyakit layu
fusarium yang disebabkan oleh cendawan Fusarium sp. Adanya serangan
cendawan ini menjadikan salah satu faktor pembatas yang menyebabkan
terjadinya penurunan produksi cabai merah. Penyebaran cendawan Fusarium
sangat cepat dan dapat menyebar ke tanaman lain dengan cara menginfeksi
akar tanaman dengan menggunakan tabung kecambah atau miselium. Akar
tanaman dapat terinfeksi langsung melalui jaringan akar, atau melalui akar
lateral dan melalui luka-luka, yang kemudian menetap dan berkembang di
berkas pembuluh. Setelah memasuki akar tanaman, miselium akan
berkembang hingga mencapai jaringan korteks akar. Pada saat miselium
cendawan mencapai xylem, maka miselium ini akan berkembang hingga
menginfeksi pembuluh xylem. Miselium yang telah menginfeksi pembuluh
xylem, akan terbawa ke bagian lain tanaman sehingga mengganggu peredaran
nutrisi dan air pada tanaman yang menyebabkan tanaman menjadi layu
(Semangun, 2005). Cendawan Fusarium tersebut membentuk polipeptida,
yang disebut likomarasmin yang dapat mengganggu permeabilitas membran
plasma dari tanaman (Walker, 1952 cit. Susetyo, 2010).
Setelah jaringan pembuluh mati dan keadaan udara lembab, cendawan
membentuk spora yang berwarna putih keunguan pada akar yang terinfeksi.
Penyebaran dapat terjadi melalui angin, air pengairan dan alat pertanian. Layu
total dapat terjadi antara 23 minggu setelah terinfeksi. Tanaman biasanya
layu mulai dari daun bagian bawah dan anak tulang daun menguning. Bila
infeksi berkembang, tanaman menjadi layu dalam 23 hari setelah infeksi.
Jika tanaman sakit dipotong dekat pangkal batang akan terlihat gejala cincin
coklat dari berkas pembuluh. Warna jaringan akar dan batang menjadi coklat.
Tempat luka infeksi tertutup hifa yang berwarna putih seperti kapas
(Direktorat Perlindungan Hortikultura, 2003 cit. Huda, 2010).
35
Penurunan produksi cabai merah di daerah Boyolali merupakan akibat
serangan Fusarium sp yang menimbulkan kerugian besar bagi petani. Upaya
pengendalian penyakit layu fusarium telah dilakukan namun petani belum
menemukan cara pengendalian yang benar-benar efektif dan ramah
lingkungan. Peyebaran penyakit layu fusarium yang cepat semakin
memperparah keadaan, sehingga penggunaan pestisida sintetis (fungisida)
menjadi alternatif terakhir untuk mengendalikan patogen Fusarium sp di
pertanaman cabai merah di daerah Boyolali. Penggunaan fungisida tersebut
telah mempertimbangkan berbagai hal karena di samping harganya mahal,
juga mengakibatkan patogen menjadi tahan terhadap fungisida, menimbulkan
ras Fusarium baru, serta dapat menimbulkan pencemaran lingkungan.
Pengendalian patogen Fusarium sp sebenarnya dapat dilakukan secara alami
tanpa harus menimbulkan residu negatif bagi lingkungan, yaitu dengan
menerapkan metode ketahanan terimbas dan virokontrol dengan mikovirus.
Menurut Istikorini (2002), mekanisme pengendalian hayati bisa terjadi melalui
berbagai mekanisme, dua diantaranya adalah virokontrol dengan mikovirus
dan ketahanan terimbas. Virokontrol dengan mikovirus adalah pengendalian dengan
virus yang dapat menginfeksi jamur.
Ketahanan terimbas adalah ketahanan yang
berkembang setelah tanaman diinokulasi lebih awal dengan elisitor biotik
(mikroorganisme avirulen, non patogenik, saprofit) dan elisitor abiotik (asam
salisilik, asam 2-kloroetil fosfonik).
B. Perumusan Masalah
Fusarium sp adalah jamur patogen yang dapat menginfeksi tanaman
dengan kisaran inang sangat luas. Jamur ini menyerang jaringan bagian
vaskuler dan mengakibatkan kelayuan pada tanaman inangnya dengan cara
menghambat aliran air pada jaringan xylem (De Cal et al., 2000). Salah satu
tanaman hortikultura yang diserang oleh Fusarium sp adalah tanaman cabai
merah (Capsicum annuum L.). Pada tanaman cabai merah, serangan ini
mempunyai arti ekonomi yang sangat penting dan menjadi salah satu
pembatas terjadinya penurunan produksi cabai merah di daerah Boyolali.
36
Berbagai upaya pengendalian patogen penyebab layu ini telah dilakukan,
seperti penggunaan bibit sehat hingga penggunaan fungisida tetapi kurang
memberikan hasil yang memuaskan. Hal tersebut dikarenakan patogen
Fusarium sp bersifat soil inhabitant yaitu patogen yang dapat bertahan dalam
tanah walaupun tanpa inang (Agrios, 1997 cit. Susetyo). Selain itu, jamur
Fusarium sp juga merupakan jamur tular tanah (soil borne) yang mempunyai
banyak spesies dan kisaran inang seperti cabai, tomat, kacang tanah, kacang
panjang, kedelai dan lain-lainnya (Semangun, 1998).
Pengendalian yang biasa dilakukan oleh petani untuk mengendalikan
layu fusarium yaitu membongkar dan membakar tanaman yang sakit.
Pengendalian cendawan penyebab penyakit layu fusarium ini perlu dikaji
lebih dalam untuk mengetahui metode pengendalian yang tepat khususnya
pengendalian yang ramah lingkungan. Sehingga perlu dikembangkan metode
pengendalian hayati berbasis keragaman ras fusarium, yaitu pengembangan
ketahanan terimbas dan pengembangan virokontrol dengan mikovirus.
Sebagai langkah awal dari usaha tersebut perlu dilakukan karakterisasi isolatisolat Fusarium sp, dan dari isolat-isolat yang telah dikarakterisasi diharapkan
diperoleh isolat-isolat hipovirulen yang potensial untuk dikembangkan sebagai
agen hayati yang ramah lingkungan. Hal tersebut akan menimbulkan suatu
pertanyaan mengenai karakter biologi isolat-isolat Fusarium sp yaitu
bagaimana keragaman karakter biologi isolat-isolat Fusarium sp dan karakter
yang bagaimana dari isolat Fusarium sp yang memiliki tingkat virulensi relatif
rendah?
C. Tujuan Penelitian
Penelitian ini bertujuan untuk mengkaji karakter biologi dan
keragaman virulensi isolat-isolat Fusarium sp pada tanaman cabai merah
(Capsicum annuum L.) asal Boyolali.
D. Hipotesis
37
1. Isolat-isolat Fusarium sp yang berhasil diisolasi dari tanaman cabai merah
(Capsicum annuum L.) asal Boyolali mempunyai karakter biologi yang
beragam.
2. Diperoleh beberapa isolat Fusarium sp dengan tingkat virulensi yang
relatif rendah (hipovirulen).
4) II. TINJAUAN PUSTAKA
5)
A. Cabai Merah (Capsicum annuum L.)
38
Cabai merah merupakan tanaman perdu dari famili Solanaceae yang
memiliki nama ilmiah Capsicum annuum L. Dalam Harpenas dan Dermawan
(2010) cabai merah diklasifikasikan sebagai berikut:
Divisio
: Spermatophyta
Subdivisio
: Angiospermae
Klasis
: Dicotyledoneae
Ordo
: Tubiflorae/ Solanales
Family
: Solanaceae
Genus
: Capsicum
Spesies
: Capsicum annuum L.
Cabai merah (Capsicum annuum L.) merupakan tanaman hortikultura
sayursayuran buah semusim untuk rempah-rempah yang diperlukan oleh
seluruh lapisan masyarakat sebagai penyedap masakan dan penghangat badan.
Kebutuhan terhadap mata dagangan ini semakin meningkat sejalan dengan
makin bervariasinya jenis dan menu makanan yang memanfaatkan produk ini.
Selain itu, cabai merah sebagai rempah-rempah merupakan salah satu mata
dagangan yang dapat mendatangkan keuntungan bagi petani dan pengusaha.
Karena selain dalam rangka untuk memenuhi kebutuhan dalam negeri juga
termasuk mata dagangan yang mempunyai peluang pemasaran ekspor non
migas yang sangat baik.
Tanaman cabai merah di Indonesia, banyak ditemukan dari Sabang
sampai Merauke. Sebagai salah satu negara tropis yang besar, hampir di
seluruh pelosok negeri Indonesia terdapat tanaman cabai. Menurut data BPS
tahun 2008 (Harpenas dan Dermawan, 2010) bahwa sentra penanaman cabai
terbesar berada di Jawa Tengah (17.079 ha), Jawa Barat (12.823 ha), Sumatra
Utara (12.047 ha), dan Jawa Timur (9.497 ha). Di setiap daerah di Indonesia
juga terdapat penanaman cabai, meskipun tidak seluas penanaman di daerah
tersebut. Konsumsi rata-rata cabai untuk rumah tangga di Jawa adalah 5,937
gram/kapita/hari (2,20kg/kapita/tahun). 5Pemakaian di perkotaan sedikit lebih
rendah dibandingkan dengan pedesaan (5,696 gram/kapita/hari untuk
pedesaan dan 5,900 gram/kapita/hari untuk perkotaan). Permintaan cabai rata-
39
rata untuk keperluan industri (sedang dan besar) adalah sebesar 2.221 ton pada
tahun 1990. Permintaan ini meningkat menjadi 3.419 ton pada tahun 1993.
Permintaan tersebut diduga terus meningkat sejalan dengan meningkatnya
permintaan yang datang dari industri olah lanjut. Sedangkan konsumsi rumah
tangga pada tahun 1990 di Jawa mencapai 233.600 ton. Sedangkan pada tahun
1998 konsumsi cabai rumah tangga di Jawa diperkirakan mencapai 258.100
ton dan pada tahun 2000 diproyeksikan mencapai 264.100 ton (Harpenas dan
Dermawan, 2010).
Penanaman famili Solanaceae secara umum tumbuh dan produksinya
sangat dibatasi oleh berbagai macam hama dan penyakit. Terutama di
Indonesia yang memiliki iklim ideal bagi beragam hama dan penyakit
tanaman serta sistem cocok tanamnya di lahan terbuka. Beragam hama dan
penyakit itulah yang menyebabkan tingginya proses produksi ( pengendalian
hama penyakit ) dan bahkan produksi tanaman bisa menurun (Firdaus, 2008).
B. Fusarium sp
Taksonomi Fusarium sp
Fusarium oxysporum (Fo) memiliki lebih dari 120 forma spesialis (f.
sp.) (Agrios, 1997). Fo. capsici (FOC) merupakan strain yang menyebabkan
penyakit layu fusarium pada cabai merah. Forma spesialis merupakan strainstrain fisiologi yang tidak dapat dibedakan dari strain saprofit pada spesies
yang sama tetapi menunjukkan ciri-ciri fisiologi yang berbeda dari segi
kemampuannya untuk memparasit inang yang khusus (Booth, 1985).
Genus Fusarium sp adalah patogen tular tanah yang termasuk
Hyphomycetes (sub divisio Deuteromycotina). Jamur ini menghasilkan
makrokonidia, mikrokonidia, dan klamidiospora (Akhsan, 1996). Sebagian
besar dari genus ini merupakan jamur saprofit yang umumnya terdapat di
dalam tanah, tetapi ada juga yang bersifat parasit. Fusarium sp yang
menyebabkan penyakit pembuluh dikelompokkan ke dalam spesies F.
oxysporum. Jenis ini dibagi lagi menjadi forma-forma spesialis (f.s.p) yang
menyesuaikan diri pada tumbuhan inang tertentu yang diinfeksi sehingga
40
jamur F. oxysporum yang menyerang tanaman cabai disebut F. oxysporum f.
sp. capsici (Semangun, 2001).
Menurut Alexopoulus dan Mims (1979) dalam Kristiana (2004),
bahwa jamur penyebab layu fusarium ini termasuk dalam forma-ordo
Moniliales forma-famili Tuberculariaceae. Klasifikasinya sebagai berikut:
Kingdom
: Mycetaceae
Divisi
: Amastigomycota
Subdivisi
: Deuteromycotina
Forma-kelas
: Deuteromycetes
Forma-subkelas
: Hypomycetidae
Forma-famili
: Moniales
Forma-subfamili : Tuberculariaceae
Genus
: Fusarium
Spesies
: Fusarium oxysporum f. sp. capsici
Morfologi Fusarium sp
Cendawan
Fusarium sp mempunyai 3 alat reproduksi, yaitu
mikrokonidia (terdiri dari 1-2 sel), makrokonidia (3-5 septa), dan
klamidospora
(pembengkakan
pada
hifa).
Makrokonidia
berbentuk
melengkung, panjang dengan ujung yang mengecil dan mempunyai satu atau
tiga buah sekat. Mikrokonidia merupakan konidia bersel 1 atau 2, dan paling
banyak dihasilkan di setiap lingkungan bahkan pada saat patogen berada
dalam pembuluh inangnya. Makrokonidia mempunyai bentuk yang khas,
melengkung seperti bulan sabit, terdiri dari 3-5 septa, dan biasanya dihasilkan
pada permukaan tanaman yang terserang lanjut. Klamidospora memiliki
dinding tebal, dihasilkan pada ujung miselium yang sudah tua atau didalam
makrokonidia, terdiri dari 1-2 septa dan merupakan fase atau spora bertahan
pada lingkungan yang kurang baik. Menurut Agrios (1997) dalam Susetyo
(2010), miselium yang dihasilkan oleh cendawan patogen penyebab penyakit
layu ini mulanya berwarna putih keruh, kemudian menjadi kuning pucat,
merah muda pucat sampai keunguan.
41
Cendawan ini tumbuh dari spora dengan struktur yang menyerupai
benang, ada yang mempunyai dinding pemisah dan ada yang tidak. Benang
secara individu disebut hifa, dan massa benang yang luas disebut miselium.
Miselium adalah struktur yang berpengaruh dalam absorbsi nutrisi secara
terus-menerus sehingga cendawan dapat tumbuh dan pada akhirnya
menghasilkan hifa yang khusus menghasilkan spora reproduktif (Foth, 1991
cit. Saragih 2009). Miselium terutama terdapat di dalam sel khususnya di
dalam pembuluh, juga membentuk miselium yang terdapat di antara sel-sel,
yaitu di dalam kulit dan di jaringan parenkim di dekat terjadinya infeksi.
Fusarium hidup sebagai parasit dan saprofit pada berbagai tanaman terutama
pada bagian pembuluhnya, sehingga tanaman menjadi mati karena toksin
(Sastrahidayat, 1989). Stadium terakhir merupakan stadium yang tahan pada
segala cuaca. Cendawan menginfeksi akar terutama melalui luka, menetap dan
berkembang di berkas pembuluh. Setelah jaringan pembuluh mati dan keadaan
udara lembab, cendawan membentuk spora yang berwarna putih keunguan
pada akar yang terinfeksi. Penyebaran spora dapat terjadi melalui angin, air
pengairan dan alat pertanian (Anonim, 2009c).
Cendawan Fusarium sp dapat tumbuh dengan baik pada bermacammacam media agar yang mengandung ekstrak sayuran. Mula-mula miselium
tidak berwarna, semakin tua warnanya semakin krem, akhirnya koloni tampak
mempunyai benang. Pada miselium yang lebih tua terbentuk klamidospora
yang berdinding tebal. Jamur membentuk banyak mikrokonidium bersel satu,
tidak berwarna, lonjong atau bulat telur, 6-15 x 2,5-4 m, makrokonidium
lebih jarang, berbentuk kumparan, tidak berwarna, kebanyakan bersekat dua
atau tiga, berukuran 25-33 x 3,5-5,5 m (Semangun, 2001).
Fisiologi Fusarium sp
Fisiologi dari jamur Fusarium sp yaitu bermula dari adanya
pembelahan reduksi dan penentuan jenis kelamin inti yang akan terjadi jika
zigot telah mengalami waktu istirahat. Dari zigot itu tumbuh suatu benang
dengan sporangium pada ujungnya. Sporangium ini berlainan dengan
42
sporangium biasa, sporangium ini hanya mempunyai satu inti saja, sebagian
bersifat positif (+) dan sebagian bersifat negatif (-). Miselium yang tumbuh
dari spora ini hanya mempunyai inti yang sama jenis kelaminnya, oleh sebab
itu spora tadi sebagian akan menjadi miselium positif (+) dan negatif (-). Pada
marga ini umumnya sporangiumnya memiliki banyak spora akan tetapi
terdapat juga sporangium yang hanya mengandung sedikit spora, bahkan ada
yang setiap sporangium yang hanya mengandung satu inti saja yang
dindingnya berdekatan dengan dinding sporangium (Damayanti, 2009).
Ekologi Fusarium sp
Beberapa forma spesialis, asosiasi paling utama yaitu dengan penyakit
akar atau umbi dari pada penyakit layu pembuluh. Fusarium termasuk ke
dalam patogen tanaman yang dapat menular melalui tanah (soil borne).
Cendawan ini dapat bertahan dalam tanah sebagai miselium atau spora tanpa
adanya inang. Jika terdapat inang maka akan menginfeksi akar, masuk ke
jaringan
vaskular
(xylem)
menyebar
dan
memperbanyak
diri,
dan
menyebabkan inang mengalami kelayuan (Agrious, 1996) karena sistem
pembuluh pada tanaman inang tersebut tersumbat (Anonim, 2008 cit. Huda,
2010).
Secara ekonomi Fusarium sp adalah patogen penting dalam pertanian
hortikultura di dunia (Windels cit. Singleton et al., 1993). Penyakit layu
fusarium menyerang akar dan menimbulkan kerugian yang cukup besar
(Semangun, 2000). Jamur Fusarium bersifat soil inhabitant sehingga dapat
bertahan sangat lama sampai beberapa tahun di dalam tanah tanpa adanya
inang dari jamur pathogen Fusarium tersebut (Suhardi, 1980 dan Kranz et al.,
1977 cit. Semangun, 2001).
F. oxysporum menyerang pertanaman dan penyebarannya sangat luas
hampir di seluruh dunia. Cendawan ini menghasilkan tiga macam toksin yang
menyerang pembuluh xylem yaitu: asam fusaric, asam dehydrofusaric, dan
lycomarasmin. Toksin-toksin tersebut akan mengubah permeabilitas membran
plasma dari sel tanaman inang sehingga mengakibatkan tanaman yang
43
terinfeksi lebih cepat kehilangan air daripada tanaman yang sehat (Anonim,
2009d).
Penyebaran jamur Fusarium sp juga dipengaruhi oleh keadaan pH
yaitu dari kisaran keasaman tanah yang memungkinkan jamur Fusarium sp
tumbuh dan melakukan kegiatannya. Sementara itu, suhu didalam tanah erat
kaitannya dengan suhu udara di atas permukaan tanah. Suhu udara yang
rendah akan menyebabkan suhu tanah yang rendah, begitu juga sebaliknya.
Suhu selain berpengaruh terhadap petumbuhan tanaman, juga terhadap
perkembangan penyakitnya. Jamur Fusarium sp mampu hidup pada suhu
tanah antara 10-240C, meskipun hal ini tergantung pula pada isolat jamurnya
(Soesanto, 2002). Patogen penyebab layu fusarium ini cepat berkembang pada
tanah yang terlalu basah atau becek, kelembaban udara yang tinggi, dan pH
tanah yang rendah (Tjahjadi, 1989). Cendawan ini sangat cocok pada tanahtanah asam yang mempunyai kisaran pH 4,5-6,0 (Sastrahidayat, 1989).
Menurut Semangun (1996) serangan cendawan ini lebih ditentukan oleh suhusuhu yang kurang menguntungkan tanaman inang. Jamur ini menginfeksi
tanaman lewat mulut kulit, lentisel, kutikula, luka (Anonim, 2009d).
Populasi patogen dapat bertahan secara alami di dalam tanah dan pada
akar-akar tanaman sakit. Apabila terdapat tanaman peka, melalui akar yang
luka
dapat
segera
menimbulkan
infeksi.
Sehingga
perkembangan
klamidospora dirangsang oleh keadaan akar tanaman yang lemah, pelukaan
pada akar akan memproduksi zat-zat (seperti asam amino, gulamin) yang
dapat mendorong pertumbuhan spora. Selain itu penyebaran cendawan yang
luas secara alami dapat disebabkan oleh adanya curah hujan dan angin, selain
oleh bantuan bibit atau partikel tanah. Adanya curah hujan yang tinggi akan
membantu sebaran cendawan patogen tular tanah ke daerah lain yang lebih
jauh, baik karena percikan maupun ikut aliran air. Jamur Fusarium sp
membentuk sporangium yang berperan di dalam sebaran patogen karena
hujan, selain karena angin (Damayanti, 2009).
Daur penyakit layu fusarium
44
Cendawan Fusarium sp mengalami 2 fase dalam siklus hidupnya yakni
patogenesa dan saprogenesa. Patogen ini hidup sebagai parasit pada tanaman
inang yang masuk melalui luka pada akar dan berkembang dalam jaringan
tanaman yang disebut sebagai fase patogenesa sedangkan pada fase
saprogenesa merupakan fase bertahan yang diakibatkan tidak adanya inang,
hidup sebagai saprofit dalam tanah dan sisa-sisa tanaman dan menjadi sumber
inokulum untuk menimbulkan penyakit pada tanaman yang lain. Agrios
(1997) dalam Susetyo (2010), mengemukakan bahwa patogen ini dapat
menimbulkan gejala penyakit karena mampu menghasilkan enzim, toksin,
polisakarida dan antibiotik dalam jaringan tanaman.
Cendawan mengadakan infeksi pada akar terutama melalui luka-luka.
Bila luka telah menutup, patogen berkembang sebentar dalam jaringan
parenkim, lalu menetap dan berkembang dalam berkas pembuluh. Huda
(2010) menyebutkan bahwa cendawan Fusarium tidak dapat menginfeksi
batang
atau
akar-rimpang
meskipun
bagian
ini
dilukai.
Nematoda
(Radopholus similis) membantu dalam infeksi Fusarium sp. Penularan
penyakit melalui bibit terinfeksi, pemindahan bibit, angin, air, tanah
terinfestasi, permukaan air drainase, pembubunan, luka karena serangga, alat
pertanian, dan lain-lain (Booth, 1985 dan Semangun, 2001). Maria et al
(2004) cit. Winarsih (2007) menerangkan bahwa inokulum patogen dapat
masuk melalui akar dengan penetrasi langsung atau melalui luka. Di dalam
jaringan tanaman, patogen dapat berkembang secara interseluler maupun
intraseluler. Klamidospora dapat berkecambah bila ada rangsangan eksudat
akar yang mengandung gula dan asam amino, juga dapat dirangsang dengan
penambahan residu tanaman ke dalam tanah (Sastrahidayat, 1986). Klon
tanaman yang rentan tidak dapat ditanam kembali hingga 30 tahun pada tanah
yang sudah terinfeksi Fusarium sp. Di dalam tanah, cendawan Fusarium sp
dapat bertahan sebagai parasit pada tanaman gulma yang bukan inangnya.
Ujung akar atau bagian permukaan rizoma yang luka merupakan daerah awal
utama dari infeksi (Ploetz, 2003).
Gejala penyakit layu fusarium pada cabai merah (Capsicum annuum L)
45
Layu fusarium umumnya terjadi pada pertengahan musim panas ketika
temperatur udara dan tanah tinggi. Awal terbentuknya penyakit tanaman ini
adalah perubahan warna daun yang paling tua menjadi kekuningan (daun yang
dekat dengan tanah). Seringkali perubahan warna menjadi kekuningan terjadi
pada satu sisi tanaman atau pada daun yang sejajar dengan petiole tanaman.
Daun yang terinfeksi akan layu dan mengering, tetapi tetap menempel pada
tanaman. Kelayuan akan berlanjut ke bagian daun yang lebih muda dan
tanaman akan segera mati. Batang tanaman akan tetap keras dan hijau pada
bagian luar, tetapi pada jaringan vaskular tanaman, terjadi diskolorisasi,
berupa luka sempit berwarna cokelat. Diskolorisasi dapat dilihat dengan
mudah dengan cara memotong batang tanaman didekat tanah dan akan terlihat
luka sempit berbentuk cincin berwarna cokelat, diantara daerah sumbu
tanaman dan bagian terluar batang (Cahyono, 2008).
Infeksi Fusarium sp terjadi pada bagian jaringan pembuluh xylem.
Akibat gangguan pada jaringan xylem, tanaman menunjukkan gejala layu,
daun menguning, dan akhirnya mati. Gejala layu seringkali disertai gejala
klorosis dan nekrosis pada daun. Gejala yang terjadi pada tanaman cabai
merah yang terserang penyakit layu fusarium adalah menguningnya daun dari
tepi daun selanjutnya menjadi coklat dan mati secara perlahan hingga tulang
daun. Menguning dan matinya daun-daun dimulai dari daun yang lebih tua.
Hal ini disebabkan patogen menginfeksi tanaman melalui luka pada akar dan
masuk kedalam jaringan xylem melalui aktivitas air sehingga merusak dan
menghambat proses menyebarnya air dan unsur hara keseluruh bagian
tanaman terutama pada bagian daun yang tua (www.doa.sarawak.gov cit.
Huda, 2010). Gejala lain pada organ daun yaitu perubahan bentuk dan ukuran
ruas daun yang baru muncul lebih pendek, dan kadang-kadang lapisan luar
batang terbelah dari permukaan tanah. Gejala yang paling khas adalah gejala
pada bagian dalam. Jika pengkal batang dibelah membujur, terlihat garis-garis
cokelat kehitaman menuju ke semua arah, dari batang ke atas melalui jaringan
pembuluh ke pangkal daun dan tangkai. Berkas pembuluh akar biasanya tidak
berubah warnanya, namun seringkali akar tanaman sakit berwarna hitam dan
46
membusuk. Indikasi pertama dari penyakit ini adalah daun bagian bawah
menguning. Pada tanaman yang masih sangat muda, penyakit ini dapat
menyebabkan matinya tanaman secara mendadak, karena pada pangkal batang
terjadi kerusakan atau kanker yang menggelang (Semangun, 2001).
Infeksi patogen menyebabkan gejala busuk akar yang berwarna coklat
kemerah-merahan yang seringkali diselimuti miselium cendawan berwarna
keputih-putihan. Ujung-ujung daun menguning kemudian keseluruhan daun
menjadi layu yang dimulai dari daun-daun luar yang lebih tua, tanaman
menjadi kerdil dan mati. Tanaman yang terinfeksi oleh cendawan Fusarium
mudah dicabut karena sebagian besar akarnya membusuk (Shwatz and
Michael, 2002). Perkembangan penyakit ini secara berurutan adalah daun
menguning, layu, dan mati. Tanaman menjadi terhambat pertumbuhannya,
bergerak menjadi layu permanen dan mati dengan daun berwarna coklat
melekat pada pangkal/ batang pohon. Pada tanaman yang sakit, bila bagian
tanaman yang berdekatan dengan pangkal batang dipotong dengan pisau akan
terlihat suatu cincin dari berkas pembuluh. Gejala ini terdapat pada bagian
tanaman sebelah atas bila terjadi serangan berat (Semangun, 2001).
Faktor-faktor yang mendukung perkembangan penyakit layu fusarium
Beberapa hal menjadi faktor yang mendukung perkembangan penyakit
layu sistem pembuluh yang khas ini. Faktor-faktor tersebut adalah temperatur,
kelembaban tanah yang rendah, panjang hari yang pendek, intensitas cahaya
yang rendah, nutrisi N dan P yang rendah, nutrisi K yang tinggi dan pH yang
rendah (Booth, 1985). Penyakit berkembang pada temperatur tanah 21-330C,
temperatur optimumnya adalah 280C (Semangun, 1996). Kelembaban tanah
yang diinginkan sesuai dengan tanaman inangnya. Kelembaban tanah yang
sangat rendah atau tinggi dapat menahan pertumbuhan tanaman dan juga
perkembangan penyakit layu fusarium (Mehrotra, 1980). Faktor lain yang
mempengaruhi perkembangan Fusarium adalah unsur-unsur yang terkandung
dalam tanah. Di banyak negara diketahui bahwa penyakit berkembang lebih
berat bila tanah mengandung banyak nitrogen tapi miskin akan kalium
(Semangun, 1996).
47
C. Ketahanan Terimbas
Mekanisme pengendalian hayati yang didasarkan pada mikrobia
antagonis dapat terjadi secara langsung (kompetisi dan antibiosis) atau tidak
langsung dengan ketahanan terimbas dari inang. Ketahanan terimbas adalah
ketahanan yang berkembang setelah tanaman diinokulasi lebih awal dengan
elisitor biotik (mikroorganisme avirulen, non patogenik, saprofit) dan elisitor
abiotik (asam salisilik, asam 2-kloroetil fosfonik) (Agrios, 1988 cit. Huda,
2010). Menurut Misaghi (1982) dalam Hadisutrisno (2004) tanggap tanaman
terhadap serangan patogen ada empat macam mekanisme ketahanan, yaitu
mekanisme
bawaan,
mekanisme
terimbas,
biokimiawi
bawaan,
dan
biokimiawi terimbas. Mekanisme ketahanan mekanis antara lain terbentuknya
tilosis yang dapat menghambat gerakan patogen, terbentuknya lapisan gabus,
dan kutikula yang tebal. Sedangkan mekanisme ketahanan biokimiawi antara
lain terbentuknya senyawa fenol bebas karena ada peningkatan aktivitas enzim
polifenol oksidasi, dan senyawa fitoaleksin. Fitoaleksin adalah senyawasenyawa yang dihasilkan oleh jaringan inang sebagai tanggapan terhadap
invasi patogen (Semangun, 1996). Senyawa ini terakumulasi sampai pada
suatu aras yang menghambat pertumbuhan dan perkembangan patogen.
Fitoaleksin berupa metabolit tanaman yang bersifat antimikrobia, pada
tanaman sehat kadarnya sangat rendah atau tidak terdeteksi, dan akan
terakumulasi sebagai akibat patologis, fisik dan rangsanganrangsangan lain
dari lingkungan. Pembentukan fitoaleksin dapat diinduksi oleh jamur, bakteri,
virus, nematoda, senyawa kimia toksik atau perlakuan fisik. Beberapa
fitoaleksin bersifat toksik terhadap bakteri, nematoda, jamur dan binatang
(Misaghi, 1982 dan Van Etten, 1971 cit. Hadisutrisno, 2004).
Preinokulasi tanaman dengan berbagai agen fisik, kimia, dan biologi
dapat menyebabkan perubahan reaksi penyakit yang diakibatkan oleh
inokulasi berikutnya dengan patogen sasaran. Fenomena ini dikenal sebagai
ketahanan
terimbas
atau
Induced
Resistance
Beberapa
penelitian
menyimpulkan bahwa asam salisilat atau 2-hidroksi-benzoat merupakan salah
48
satu molekul signal terjadinya aktivasi sistem pertahanan tanaman terhadap
patogen. Tanaman yang telah diinokulasi dengan patogen akan bereaksi
dengan membentuk senyawa pertahanan yang kemudian terakumulasi pada
daerah akar untuk menghambat invasi jamur patogen pada sistem perakaran
pada tanaman. Senyawa antimikrobia yang dibentuk tanaman ini merupakan
reaksi terhadap aksi patogen di dalam jaringan tanaman yang berupa
fitoaleksin atau senyawa antimikrobia lainnya (Misaghi, 1982 dan Conrath et
al., 1995 cit. Hadisutrisno, 2004)
Jika pada bagian tertentu tanaman diinokulasi suatu patogen atau
patogen lemah, maka dalam tubuh tanaman akan timbul reaksi yang
menghasilkan suatu sistem pertahanan sehingga tanaman akan tahan terhadap
serangan patogen sama yang lebih virulen, atau bahkan tahan terhadap
patogen yang lain. Ketahanan terinduksi terjadi karena perlakuan fisik,
khemis, atau agensia biotik sebelum infeksi atau inokulasi patogen. Terjadinya
induksi ketahanan karena infeksi lokal diduga disebabkan oleh cairan sel
tanaman yang terinfeksi tidak mempunyai persediaan makanan yang cukup
atau cocok, dan karena di dalam tanaman yang terinfeksi terbentuk senyawa
yang bersifat racun sehingga menghambat perkembangan patogen. Sedangkan
induksi ketahanan sistemik merupakan bentuk ketahanan yang ekspresinya
tampak merata pada seluruh bagian tanaman (Misaghi, 1982; Caruso dan Kuc,
1979 cit. Hadisutrisno, 2004)
D. Mikovirus
Jamur, sebagaimana organisme eukariotik yang lain, dapat terinfeksi
oleh sejumlah virus, dan mikovirus (virus yang menginfeksi jamur) ditemukan
pada semua kelompok mayoritas jamur. Dewasa ini, lebih dari 200 mikovirus
telah diidentifikasi (Fauquet et al., 2005 cit. Supyani, 2009). Mikovirus ini telah
diidentifikasi dari beberapa jamur patogen. Sejauh ini hasil dari identifikasi mikovirus yang
telah dilakukan memiliki genom RNA untai ganda dengan lebih dari satu segmen RNA per
virus partikel. Mikovirus menunjukkan kemampuan untuk ditransmisikan, dengan kata lain
dapat menginfeksi jamur sehat lainnya. Gejala yang ditimbulkan oleh mikovirus pada jamur
patogen antara lain mengurangi produksi
spora, lambat dan pertumbuhan miselium
49
menyimpang, malformasi,
dan prematur pematangan. Gejala tersebut menunjukkan bahwa
jamur tidak tahan terhadap virus (http://en.wikipedia.org/wiki/Talk:Mycovirus).
Meskipun mikovirus secara umum tersebar luas, namun yang telah
diisolasi dan dipelajari secara intensif hanya dari inang yang terbatas seperti
misalnya ragi Saccharomyces serevisiae, jamur-jamur yang dikonsumsi
manusia dan jamur patogen tumbuhan yang menarik bagi peradaban manusia.
Secara klasik mikovirus tidak infeksius sebab infeksi tidak dapat diinisiasi
dengan perlakuan hifa sehat dengan ekstrak hifa dari strain terinfeksi.
Kebanyakan mikovirus menginfeksi inangnya secara persisten yang biasanya tanpa perubahan
fenotip yang dapat dikenali.
sitoplasma
setelah
Mikovirus terutama ditularkan secara percampuran
terjadinya
fusi
hifa
(anastomosis)
atau
dengan
pembentukan spora aseksual (Ghabrial, 2001 dan Nuss, 2005 cit. Supyani, 2009).
.
III. METODE PENELITIAN
A. Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan mulai bulan Oktober 2009 sampai dengan
Mei 2010 di Laboratorium Hama dan Penyakit Tanaman Fakultas Pertanian
Universitas Sebelas Maret Surakarta.
B. Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah bagian tanaman
cabai yang terinfeksi Fusarium sp (pangkal batang, batang tengah, batang
atas, akar), apel, aquades, alkohol 90%, dan media PDA (Potato Dextrose
Agar).
50
Alat yang digunakan dalam penelitian ini adalah termos pendingin,
refrigerator, LAF (Laminar Air Flow), outoclaf, jarum inokulasi, jarum ose,
petridish steril, lampu bunzen, pisau silet, pinset, beaker glass, kertas label,
kertas saring, dan kamera digital.
C. Rancangan Penelitian
Penelitian ini didesain sebagai penelitian eksploratif di lapang dan
eksperimen di laboratorium.
D. Pelaksanaan Penelitian
1. Koleksi isolat-isolat Fusarium sp
Isolat-isolat Fusarium sp dikoleksi dari daerah Boyolali. Koleksi
dilakukan dengan mendatangi daerah tersebut. Cabai merah yang
menunjukkan gejala umum berupa layu digali dengan sekop. Seluruh
pertanaman (termasuk seluruh perakarannya) diangkat, kemudian butiranbutiran tanah yang menempel dilepaskan dengan cara direndam di dalam
air. Bagian tanaman terutama pangkal batang serta perakaran diperiksa
adanya gejala penyakit tambahan yaitu berupa becak-becak, luka, busuk,
atau adanya tanda penyakit berupa sklerotia.
17
Bagian tanaman yang menunjukkan gejala ataupun tanda penyakit
tersebut kemudian dimasukkan ke dalam kantong plastik dan diberi label,
kemudian secepatnya dimasukkan ke dalam termos pendingin. Setelah
sampai di laboratorium, sampel-sampel tanaman segera dipindah ke
refrigerator bersuhu 40 C, untuk selanjutnya dikulturkan di medium PDA.
2. Kultur isolat-isolat Fusarium sp pada media PDA
Kultur isolat-isolat Fusarium sp dilakukan di LAF (Laminar Air
Flow). Permukaan jaringan yang mengandung becak-becak, luka, atau
busuk disterilkan dengan alkohol 90 %. Bagian kecil dari daerah
perbatasan antara jaringan tanaman yang sakit dan sehat dipotong,
diambil, dan diletakkan di tengah petridish steril berdiameter 8 cm yang
mengandung 20 ml PDA (Potato Dextrose Agar). Preparasi diinkubasikan
di bawah kondisi standar pada 22260 C selama 710 hari. Seluruh isolat
51
diberi nomor identitas sesuai dengan identitas pada label saat isolasi dari
lapang. Saat kultur berumur 1 minggu dilakukan pemotretan untuk
dokumentasi.
Pada saat pemotretan itu pula masing-masing isolat dibuat stok,
yaitu dengan cara dikulturkan pada medium regenerasi di dalam petridish
berdiameter 4 cm. Pembuatan stok ini dimulai dengan menginokulasikan
3x3x3 mm kubik inokulum yang diambil dari bagian tepi biakan,
kemudian diletakkan di tengah medium yang telah disediakan. Preparasi
diinkubasikan di bawah kondisi standar pada 22 26 0C selama 1 minggu.
Setelah itu preparasi disimpan di dalam refrigerator bersuhu 40C sebagai
stok untuk pengujian-pengujian berikutnya. Masing-masing stok ini diberi
nomor identitas yang sesuai dengan nomor identitas isolat pada medium
PDA di atas.
3. Karakterisasi isolat-isolat Fusarium sp
Karakterisasi morfologi dilakukan dengan menginokulasikan 3x3x3
mm3 inokulum, diambil dari bagian tepi biakan stok berumur 1 minggu,
pada bagian tengah petridish berdiameter 8 cm yang mengandung 20 ml
PDA. Petridis lalu diinkubasikan dibawah kondisi standar 22-260C.
Bersamaan dengan itu, dikulturkan pula preparat Fusarium sp bebas virus
sebagai pembanding. Biakan diamati pada hari ke 3, 5, dan 7. Karakter
yang diamati dan dicatat adalah: laju pertumbuhan koloni, fenotip koloni,
dan sporulasi. Apabila dari isolat-isolat yang diamati ditemukan karakterkarakter yang berbeda, misalnya laju pertumbuhan koloni yang
ditunjukkan dengan diameter koloni yang lebih kecil, fenotip koloni
dengan warna yang lebih gelap/terang, permukaan koloni yang tidak halus,
maka
isolat-isolat
yang
bersangkutan
ditandai/dipilih
dan
didokumentasikan. Isolat-isolat tersebut mempunyai peluang besar
mempunyai tingkat virulensi yang rendah (hipovirulen). Isolat-isolat
terpilih selanjutnya diuji dengan pengujian virulensi yang menggunakan
buah apel dan tanaman cabai.
4. Uji Virulensi
52
Uji virulensi dilakukan pada buah apel dengan menggunakan isolatisolat hipovirulen terpilih berdasarkan karakterisasi isolat. Isolat-isolat
terpilih dilakukan uji virulensi. Apel yang sudah masak didesinfeksi
dengan alkohol 90 %. Ditentukan 4 titik disekeliling buah dengan posisi
menyebar seimbang. Pada masing-masing titik kemudian diinokulasi
dengan isolat-isolat jamur Fusarium sp pada bagian yang telah dilukai.
Inokulum dimasukkan ke dalam masing-masing luka dengan posisi
menghadap ke dalam. Kemudian ditekan dengan spatula steril sampai
terjadi kontak yang sempurna dengan jaringan apel. Bagian yang
diinokulasi lalu dibalut dengan parafilm untuk mencegah kering, lalu buah
apel diinkubasi di baki plastik berukuran 35x25x7 cm pada suhu ruang.
Diameter lesio diukur pada hari ke 5, 7, 9, dan 12. Dari hasil uji virulensi
ini dapat ditentukan isolat-isolat Fusarium sp yang virulensinya lebih
rendah (hipovirulen) dibanding kontrol (virulen).
E. Variabel Pengamatan
1. Laju Pertumbuhan
Pengamatan laju pertumbuhan isolat dilakukan dengan mengukur
diameter miselia jamur pada petridish.
2. Fenotip koloni
Karakter fenotipe koloni isolat yang diamati meliputi warna,
struktur permukaan, dan ada tidaknya hifa udara.
3. Sporulasi
Pengamatan dilakukan dengan menggunakan haemositometer
kemudian diamati dengan mikroskop cahaya dan jumlah sporanya dihitung
dengan menggunakan alat caunter.
4. Virulensi
Pengamatan dilakukan dengan mengamati diameter lesio buah apel
yang ditimbulkan oleh isolat Fusarium sp.
F. Analisis Data
53
Data laju pertumbuhan, fenotip koloni dan sporulasi disajikan dalam
bentuk deskriptif. Data hasil uji virulensi yang diperoleh selanjutnya dianalisis
ragam dengan uji F pada taraf 5 %. Jika perlakuan berpengaruh nyata maka
dilanjutkan dengan Uji Jarak Berganda Duncans (DMRT) pada taraf 5 %.
IV. HASIL DAN PEMBAHASAN
54
A. Keadaan Umum Lokasi
Lokasi pengambilan sampel berada di Kabupaten Boyolali. Kabupaten
Boyolali memiliki ketinggian 400 m dpl (diatas permukaan laut) di lokasi
pengambilan sampel, dengan curah hujan rata-rata 3000-4000 mm/tahun,
kelembaban
udara
70%
serta
suhu
rata-rata
21-300
C/bulannya
(www.scbdp.net). Lahan pertanaman cabai merah di tempat pengambilan
sampel terlihat cukup kering (khususnya tanah) dan kurang pengairan
disebabkan saat pengambilan sampel bertepatan dengan bulan/musim kemarau
dan sulitnya mencari air untuk pengairan. Sekitar lokasi tersebut ditanami ubi
kayu dan kacang tanah yang merupakan tanaman pangan yang dibudidayakan.
Kondisi pertanaman cabai merah saat pengambilan sampel, terjadi
kelayuan pada daun, batang berwarna coklat dan tanaman terlihat sudah tidak
berpotensi untuk memproduksi cabai merah lagi (Lampiran 8). Hal ini diduga
disebabkan karena adanya serangan cendawan patogen Fusarium sp yang
merupakan salah satu faktor pembatas produksi cabai merah di daerah
Boyolali. Berbagai upaya pengendalian patogen penyebab layu ini telah
dilakukan, seperti penggunaan bibit sehat hingga penggunaan fungisida tetapi
kurang memberikan hasil yang memuaskan.
Gejala yang ditimbulkan oleh petogen Fusarium sp terhadap tanaman
cabai merah ini adalah tanaman yang terserang menjadi layu dan mati. Jamur
ini menyerang jaringan bagian vaskuler dan mengakibatkan kelayuan pada
tanaman inangnya dengan cara menghambat aliran air pada jaringan xylem
(De Cal et al., 2000). Gejala yang paling khas adalah gejala pada bagian
dalam batang tanaman. Jika pangkal batang dibelah membujur, terlihat garisgaris cokelat kehitaman menuju ke semua arah, dari batang ke atas melalui
jaringan pembuluh ke pangkal daun dan tangkai. Berkas pembuluh akar
biasanya tidak berubah warnanya, namun seringkali akar tanaman sakit
berwarna hitam dan membusuk.
B. Isolasi dan Pembuatan Biakan Murni
21
55
Isolat patogen diambil dari batang atas, batang tengah, pangkal batang,
dan akar tanaman cabai merah yang sakit layu fusarium, bagian tersebut
kemudian disayat secara aseptik dan ditumbuhkan pada media PDA dan
diisolasi (Lampiran 9). Hasil isolasi cendawan Fusarium sp yang diperoleh
dari pertanaman cabai merah asal Boyolali ini adalah 100 isolat yang memiliki
keragaman
morfologi.
Dari
100
isolat
yang
diperoleh
kemudian
dikelompokkan menjadi lima kelompok yang didasarkan pada warna koloni
miselium yang terbentuk pada media PDA yaitu koloni berwarna krem, ungu,
merah jambu, putih, dan putih krem. Pengelompokkan koloni isolat tersebut
juga didasarkan adanya variasi ciri-ciri/karakter morfologi lainnya secara
makroskopis. Menurut Machmud et al., (2003) salah satu cara untuk
mengetahui jenis patogen adalah dengan mengetahui karakter biologisnya.
Dengan mempelajari berbagai ciri-ciri biologi dan ekologi mikroba patogen
juga berkaitan dengan epifitologi dan pengendalian penyakit tanaman
pertanian.
C. Pengamatan Isolat Jamur Fusarium sp Secara Makroskopis
Pengamatan secara makroskopis koloni isolat Fusarium sp dilakukan
mulai pada hari ke-3 sampai hari ke-7 setelah isolasi. Pengamatan
makroskopis dilakukan secara langsung dengan melihat perkembangan
masing-masing koloni yaitu mulai dari diameter koloni, warna koloni,
miselium udara, dan profil koloni. Berdasarkan perbedaan morfologi tersebut,
isolat Fusarium sp dikelompokkan menjadi lima kelompok koloni yakni
kelompok A, kelompok B, kelompok C, kelompok D, dan kelompok E
(Lampiran 10). Pada masing-masing kelompok isolat yang telah berhasil
diisolasi, terdapat 5 isolat terpilih yang terdiri dari 1 isolat yang paling cepat
pertumbuhan koloninya (isolat kontrol: K) dan 4 isolat yang pertumbuhan
koloninya relatif lambat (isolat perlakuan). Isolat-isolat kontrol digunakan
sebagai pembanding dengan isolat-isolat perlakuan. Hasil pengamatan isolatisolat Fusarium sp secara makroskopis disajikan dalam tabel 1 berikut.
56
Tabel 1. Pengamatan kelompok koloni isolat kontrol dan bukan kontrol jamur Fusarium sp secara makroskopis
Isolat
Diameter
Isolat Kontrol
(cm)
Purata Diameter
Isolat Perlakuan
(cm)
7,8
5,6
6,5
4,2
6,8
4,5
7,3
4,8
7,5
5,3
Warna Koloni
Miselium Udara
Profil Koloni
Bagian dasar koloni berwarna krem,
bagian atas berwarna putih dengan
permukaan yang halus
Bagian dasar koloni berwarna ungu,
bagian atas berwarna putih
Bagian dasar koloni berwarna merah
jambu, bagian atas berwarna putih
Berwarna putih seperti kapas.
sedikit
halus
sedang
halus
sedang
bergelombang
sedikit
seperti kapas,
tepi tidak rata
kasar,
membentuk
cincin
Bagian dasar koloni berwarna putih
krem
sedikit
Keterangan:
A : Kelompok A
B : Kelompok B
C : Kelompok C
D : Kelompok D
E : Kelompok E
23
57
Hasil pengamatan menunjukkan bahwa isolat yang berhasil diisolasi
dapat diidentifikasi berdasarkan karakter makroskopis yang dimunculkan,
antara lain diameter koloni, warna koloni, miselium udara dan profil koloni
(Tabel 1). Pada masing-masing isolat terpilih memunculkan karakter
morfologi yang berbeda-beda. Bagian tanaman cabai merah yang diambil
sebagai bahan isolasi petogen layu fusarium dapat mempengaruhi karakteristik
isolat cendawan Fusarium sp. Kelompok koloni isolat A adalah isolat-isolat
yang berasal dari bagian batang atas tanaman cabai merah, kelompok koloni
isolat B adalah isolat-isolat yang berasal dari bagian batang tengah tanaman
cabai merah, kelompok koloni isolat C adalah isolat-isolat yang berasal dari
pangkal batang tanaman cabai merah. Sedangkan kelompok koloni isolat D
dan E adalah isolat-isolat yang berasal dari akar tanaman cabai merah.
Gambar 1. Diameter koloni isolat Fusarium sp pada umur 7 hari
Keterangan:
A : Koloni isolat A
B : Koloni isolat B
C : Koloni isolat C
D : Koloni isolat D
E : Koloni isolat E
58
Pengamatan tingkat laju pertumbuhan koloni isolat dilihat dari ukuran
diameter koloni pada setiap kelompok yang menunjukkan nilai diameter isolat
koloni yang berbeda (Gambar 1). Isolat kontrol pada setiap kelompok koloni
memiliki laju pertumbuhan yang lebih tinggi bila dibandingkan dengan isolatisolat perlakuan. Pada koloni isolat kontrol dan isolat perlakuan menunjukkan
kelompok koloni yang memiliki nilai diameter terintti dan terendah pada
kelompok koloni A dan kelompok koloni B. Pada koloni isolat kontrol nilai
diameter koloni tertinggi terdapat pada isolat kelompok A sebesar 7,8 cm
sedangkan nilai diameter terendah terdapat pada kelompok isolat B sebesar
6,5 cm. Pada koloni isolat perlakuan, nilai diameter koloni tertinggi terdapat
pada kelompok isolat A sebesar 5,6 cm sedangkan nilai purata diameter
terendah terdapat pada kelompok isolat B sebesar 4,2 cm. Gandjar (1999),
menyatakan bahwa Fusarium
sp pada media PDA mempunyai koloni
mencapai diameter 3,5-5,0 cm. Hal ini menunjukkan bahwa isolat-isolat yang
diperoleh dari isolasi tanaman cabai merah memiliki laju pertumbuhan yang
tinggi. Diameter koloni isolat berpengaruh pada proses pembentukan konidia,
yang pada akhirnya juga akan mempengaruhi tingkat perkembangan
cendawan Fusarium sp. Pertumbuhan koloni isolat cendawan berikutnya akan
tetap terjadi meskipun pertumbuhannya lambat, hal ini dikarenakan konidia
merupakan alat perkembangan pada kelas Deuteromycetes yang dihasilkan
secara aseksual, sehingga jumlahnya menentukan perkembangan pada
generasi berikutnya, dan dalam kondisi yang menguntungkan jumlah konidia
cenderung berbanding lurus dengan laju perkembangan cendawan Fusarium
(Burnett and Hunter, 1988). Selain pengamatan pada laju pertumbuhan koloni,
juga dilakukan pengamatan terhadap warna koloni pada masing-masing
kelompok. Penampakan warna koloni isolat Fusarium sp pada masing-masing
kelompok koloni isolat berbeda-beda. Perbedaan warna koloni isolat ini
didasarkan pada warna yang muncul pada bagian dasar koloni dan bagian
permukaan atas koloni.
59
Gambar 2. Penampakan secara makroskopis koloni isolat Fusarium sp
Keterangan:
A : koloni isolat A
B : koloni isolat B
C : koloni isolat C
D : koloni isolat D
E : koloni isolat E
Warna koloni yang tampak adalah krem halus, ungu, merah jambu,
putih seperti kapas, putih krem (Gambar 2). Pada kelompok koloni isolat A
mempunyai kenampakan warna koloni krem, permukaan koloni halus,
pembentukan miselium udara sedikit dan penampakan miselium hialin.
Kelompok koloni isolat B mempunyai kenampakan warna koloni ungu,
permukaan koloni halus, miselium udara sedang. Kelompok koloni isolat C
mempunyai
kenampakan
warna
koloni
merah
jambu,
bagian
tepi
bergelombang, dan miselium udara sedang. Kelompok koloni isolat D
mempunyai kenampakan koloni putih seperti kapas, bagian tepi tidak rata, dan
miselium udara sedikit. Kelompok koloni isolat E mempunyai kenampakan
warna putih krem, profil koloni yang kasar dan membentuk cincin,
pembentukan miselium udara sedikit.
Berdasarkan pengamatan secara makroskopis tersebut dapat dikatakan
bahwa pada kultur jamur di media padat seperti pada agar dekstrosa kentang
(PDA), jamur Fusarium sp dapat memiliki penampilan yang berbeda-beda
60
meskipun berasal dari tanaman inang yang sama. Dan secara umum, miselium
udara pertama kali muncul berwarna putih, dan kemudian dapat berubah
menjadi berbagai warna sesuai dengan regangan (atau bentuk khusus) dari
Fusarium sp. Beberapa isolat Fusarium sp juga akan membentuk pigmen
merah di dalam medium (Agrios, 1997 dalam Susetyo, 2010). Menurut
Semangun (1996), pigmen hifa Fusarium sp umumnya bervariasi, berpigmen
hialin (tidak berwarna), jika berwarna berarti jamur tersebut berpigmen,
umumnya adalah pigmen melanin yang terikat pada dinding sel hifa. Dalam
Sastrahidayat (1989), jamur yang ditumbuhkan pada medium PDA mula-mula
miselium berwarna putih, semakin tua warna menjadi krem atau kuning pucat,
dalam keadaan tertentu berwarna merah muda agak ungu dengan miselium
bersekat
dan
membentuk
percabangan.
Pengaruh
cahaya
terhadap
pertumbuhan hifa vegetatif jamur biasanya berupa penghambatan ataupun
pemicuan pertumbuhannya sehingga cahaya dapat berpengaruh pada
konsentrasi produksi pigmen dan pertumbuhan hifa. Secara umum cendawan
yang ditumbuhkan pada kondisi terang terus akan mempunyai miselium udara
yang lebih banyak dibandingkan pada kondisi yang lain. Hal ini disebabkan
adanya sifat jamur yang tumbuh mengikuti arah cahaya (fototropi).
61
D. Pengamatan Jamur Fusarium sp Secara Mikrokskopis
Pengamatan jamur Fusarium sp secara mikroskopis adalah dengan mengamati ukuran dan bentuk dari bagian-bagian
jamur Fusarium sp serta mengukur kerapatan spora setiap isolat dari masing-masing kelompok koloni.
Tabel 2. Pengamatan isolat kontrol jamur Fusarium sp secara mikroskopis
Isolat
A0
B0
C0
D0
E0
Konidia/Spora
Bentuk
Ovoid
(mikrokonidia),
makrokonidia ujungnya
meruncing
Ovoid
(mikrokonidia),
makrokonidia ujungnya
meruncing
Ovoid
(mikrokonidia),
makrokonidia ujungnya
meruncing
Ovoid
(mikrokonidia),
makrokonidia ujungnya
meruncing
Ovoid
(mikrokonidia),
makrokonidia ujungnya
meruncing
Keterangan:
A0 : Kolono isolat kontrol A
B0 : Koloni isolat kontrol B
Ukuran
Mikrokonidia 3,75x2,5m,
Makrokonidia 29,76x3,12 m
Septa Konidia
Sporulasi
Makrokonidia terdiri dari 2-6sel
17,86x106
Mikrokonidia 5,25x1,87m,
Makrokonidia 27,36x2,20 m
Makrokonidia terdiri dari 2-5sel
44,20x106
Mikrokonidia 4,38x1,5m,
Makrokonidia 31,56x4,10 m
Makrokonidia terdiri dari 3-5sel
15,34x106
Mikrokonidia 5,35x3,15m,
Makrokonidia 27,36x4,10 m
Makrokonidia terdiri dari 5-6sel
27,76x106
Mikrokonidia 3,05x1,75m,
Makrokonidia 30,16x3,26 m
Makrokonidia terdiri dari 2-4sel
37,18x106
C0 : Koloni isolat kontrol C
D0 : Koloni isolat kontrol D
62
E0 :Koloni isolat kontrol E
Tabel 3. Pengamatan isolat perlakuan jamur Fusarium sp secara mikroskopis
28
Isolat
Konidia/Spora
Septa Konidia
Purata Sporulasi
Bentuk
Purata Ukuran
Ovoid
(mikrokonidia),
makrokonidia ujungnya
meruncing
Ovoid
(mikrokonidia),
makrokonidia ujungnya
meruncing
Ovoid
(mikrokonidia),
makrokonidia ujungnya
meruncing
Ovoid
(mikrokonidia),
makrokonidia ujungnya
meruncing
Ovoid
(mikrokonidia),
makrokonidia ujungnya
meruncing
Mikrokonidia 3,15x1,5m,
Makrokonidia 27,26x2,72 m
Makrokonidia terdiri dari 2-5sel
15,94x106
Mikrokonidia 3,25x2,15m,
Makrokonidia 24,16x1,6 m
Makrokonidia terdiri dari 2-5sel
42,76x106
Mikrokonidia 2,52x2,5m,
Makrokonidia 29,36x3,2 m
Makrokonidia terdiri dari 2-4sel
13,82x106
Mikrokonidia 4,75x2,5m,
Makrokonidia 31,16x3,2 m
Makrokonidia terdiri dari 3-6sel
25,64x106
Mikrokonidia 2,64x1,45m,
Makrokonidia 28,76x2,16 m
Makrokonidia terdiri dari 2-6sel
36,25x106
Keterangan:
A : Koloni isolat A
B : Koloni isolat B
63
C : Koloni isolat C
D : Koloni isolat D
E :Koloni isolate
E
29
64
Tabel 2 dan 3 menunjukkan perbedaan bentuk, ukuran, septa konidia dan kerapatan
spora pada isolat-isolat Fusarium sp kontrol dan perlakuan. Secara umum, isolat Fusarium sp
secara mikroskopis memiliki bentuk mikrospora ovoid yang umumnya memiliki 0-1 sekat
sedangkan bentuk makrospora umumnya panjang ujungnya meruncing dan memiliki 2-6
sekat.
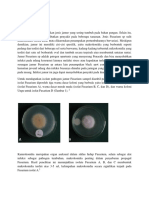
Gambar 3. Penampakan secara mikroskopis isolat Fusarium sp
Pengamatan isolat jamur Fusarium sp secara mikroskopis adalah dengan mengamati
ukuran dan bentuk konidia/spora isolat,dan kerapatan spora Fusarium sp. Hasil pengukuran
koloni pada isolat kontrol didapatkan ukuran makrokonidia terpanjang terdapat pada
kelompok koloni isolat C sebesar 31,56x4,10 m; 3-5 sekat dengan ukuran mikrokonidianya
sebesar 4,38x1,5m; 0-1 sekat. Sedangkan ukuran makrokonidia terkecil terdapat pada
kelompok koloni isolat B sebesar 27,36x2,20 m; 2-5 sekat dengan ukuran mikrokonidia
3,25x2,15m; 0-1 sekat. Sedangkan pada isolat perlakuan ukuran makrokonidia terpanjang
terdapat pada kelompok isolat D sebesar 31,16x3,2 m; 3-6 sekat dengan ukuran
mikrokonidia 4,75x2,5m. Sedangkan ukuran makrokonidia terkecil terdapat pada kelompok
koloni B sebesar 24,16x1,6 m; 2-5 sekat dengan ukuran mikrokonidia sebesar
3,25x2,15m; 0-1 sekat (Lampiran 12). Ukuran mikrokonidia dan makrokonidia pada setiap
isolat berbeda-beda baik pada koloni isolat kontrol maupun isolat perlakuan, namun bentuk
makrokonidia dan mikrokonidianya secara umum adalah sama yaitu berbentuk ovoid
65
(mikrokonidia) dan berbentuk memanjang dengan ujung meruncing (makrokonidia). Dalam
Domsch et al., (1993), makrokonidium berbentuk gelendong, lonjong, ujung tajam,
mempunyai 3-5 sekat, dan ukuran sporanya [(20-27) (46-60) x (3,5-4,5)] m. Mikrokonidia
tersusun 1 sel, transparan, tersusun membentuk rantai basipetal yang panjang. Menurut
Agrios (1996) bahwa mikrokonidium mempunyai satu atau dua sel, terdapat dalam jumlah
yang banyak, dan sering dihasilkan pada semua kondisi. Jenis spora ini banyak dijumpai di
dalam jaringan tanaman terinfeksi. Sementara itu, makrokonidium mempunyai dua sampai
lima sel dan berbentuk lengkung. Jenis spora ini umumnya banyak dijumpai di permuakaan
tanaman yang mati karena infeksi jamur ini.
Pengamatan kerapatan spora isolat-isolat Fusarium sp pada kelima kelompok koloni
dilihat dari jumlah spora masing-masing isolat. Pengamatan kerapatan spora dilakukan
dengan cara membuat suspensi pada masing-masing isolat, yaitu melakukan pengenceran
pada biakan jamur dengan 10 ml aquades ke dalam petridish berdiameter 8 cm, kemudian
permukaan biakan jamur digaruk dengan L glass selama 5 menit. Setelah itu disaring dan
dimasukkan ke dalam falcon yang sudah disiapkan. Pengenceran suspensi dilakukan sampai
pengenceran ke tiga. Hasil pengenceran ini digunakan untuk menghitung kerapatan spora
isolat-isolat Fusarium sp. Kerapatan spora isolat kontrol tertinggi terdapat pada kelompok
koloni isolat B sebesar 72,38x106 spora/ml, sedangkan kerapatan spora terendah terdapat
pada kelompok koloni isolat C yaitu 15,34x106 spora/ml. Sedangkan pada isolat perlakuan,
kerapatan spora tertinggi terdapat pada koloni isolat B sebesar 38,42x106 spora/ml sedangkan
kerapatan terendah terdapat pada kelompok koloni isolat D sebesar 14,45x106 spora/ml
(Tabel 2 dan 3).
66
Gambar 4. Kerapatan spora isolat Fusarium sp
Keterangan:
A : Koloni isolat A
B : Koloni isolat B
C : Koloni isolat C
D : Koloni isolat D
E : Koloni isolat E
Berdasarkan hasil pengamatan kerapatan spora isolat-isolat Fusarium sp yang telah
diperoleh dan diidentifikasi dapat diketahui bahwa isolat-isolat tersebut mempunyai
kerapatan spora yang nilainya hampir sama, yaitu bahwa kerapatan spora baik pada isolat
kontrol maupun perlakuan mempunyai nilai kerapatan spora yang berkisar pada angka 106
spora/ml.
E. Uji Virulensi Isolat Fusarium sp
Isolat yang telah diidentifikasi secara makroskopis dan mikroskopis kemudian
dilakukan uji virulensi untuk mengetahui tingkat kemampuan isolat jamur Fusarium sp
dalam menimbulkan baik gejala maupun kerusakan pada buah apel. Parameter yang diamati
adalah diameter kerusakan apel yang ditimbulkan oleh isolat Fusarium sp yang telah berhasil
dikarakterisasi secara makroskopis dan mikroskopis (Lampiran 13). Diameter kerusakan
tertinggi pada uji virulensi isolat kontrol terdapat pada kelompok koloni isolat A sebesar 7,65
cm, sedangkan yang terendah terdapat pada kelompok koloni isolat D sebesar 3,74 cm.
67
Demikian juga dengan diameter kerusakan pada isolat perlakuan, yaitu diameter kerusakan
tertinggi pada kelompok koloni isolat A sebesar 5,92 cm, dan diameter kerusakan terendah
terdapat pada isolat D sebesar 2,94 cm (Gambar 5).
Hasil pengukuran diameter kerusakan yang ditimbulkan oleh isolat Fusarium sp pada
uji virulensi menunjukkan bahwa kelompok koloni isolat A yang memiliki kenampakan
warna koloni krem, permukaan koloni halus, pembentukan miselium udara sedikit dan
penampakan miselium hialin serta laju pertumbuhan koloni cepat dengan nilai diameter
koloni yang tinggi, memberikan kerusakan yang tertinggi saat uji virulensi pada apel.
Berbeda dengan kelompok koloni isolat D yang memiliki laju pertumbuhan koloni lambat
dengan nilai diameter rendah, kenampakan warna koloni berpigmen (ungu, merah jambu),
permukaan koloni halus, miselium udara sedang memberikan kerusakan yang rendah saat uji
virulensi pada apel.
Gambar 5. Diameter kerusakan apel pada uji virulensi Fusarium sp
Keterangan:
A : Koloni isolat A
B : Koloni isolat B
C : Koloni isolat C
D : Koloni isolat D
E : Koloni isolat E
Uji virulensi isolat-isolat jamur Fusarium sp dilakukan untuk mengetahui tingkat
kemampuan isolat Fusarium sp yang telah diisolasi pada kultur buatan (PDA) didalam
68
menginfeksi buah apel. Berdasarkan hasil pengamatan diketahui bahwa isolat jamur
Fusarium sp setiap koloni memiliki tingkat kemampuan menginfeksi yang berbeda-beda.
Boisson & Lahlou, 1984; Hadisutrisno, 1987 dalam Hadisutrisno (2004) menyatakan, bahwa
jamur yang dilakukan dengan perlakuan kultur, akan kehilangan patogenisitasnya setelah
dipindahkan beberapa kali dalam medium, atau setelah isolat disimpan dalam waktu yang
lama. Perkecualian untuk hal ini adalah varian yang hialin, dari jamur varian tersebut dapat
diperoleh varian stabil yang mempunyai patogenisitas lemah atau kuat.
Pada hasil pengamatan secara makroskopis, mikroskopis dan pengujian virulensi pada
setiap kelompok koloni dapat diketahui kelompok isolat yang virulen dan isolat yang
hipovirulen. Isolat yang dianggap virulen adalah isolat kontrol yang memiliki laju
pertumbuhan yang tinggi dan cepat serta memberikan kerusakan yang tinggi saat dilakukan
uji virulensi pada buah apel. Sedangkan isolat yang dianggap sebagai isolat hipovirulen
adalah isolat yang memiliki laju pertumbuhan koloni yang lambat dan memberikan
kerusakan ynag rendah saat uji virulensi pada buah apel. Isolat hipovirulen yang
diinokulasikan pada apel menunjukkan gejala penyakit yang kecil, berbeda dengan apel
kontrol yang telah diinokulasi dengan isolat yang virulen yaitu menunjukkan kerusakan yang
tinggi. Menurut Latterot (1982) dalam Hadisutrisno (2004) bahwa varian yang dicirikan
dengan miselium yang bening atau hialin dengan miselium udara seperti kapas disebut une
souche faible atau isolat lemah yang diidentikkan dengan isolat avirulen, sedangkan varian
yang mempunyai miselium udara tipis diidentikkan dengan isolat kuat atau isolat virulen.
Untuk isolat avirulen berbeda dengan isolat virulen dalam hal morfologi, laju pertumbuhan
produksi makromikrokonidium, dan kandungan proteinnya. (Susanto, 2000). Selain itu,
mekanisme yang menyebabkan patogen berubah menjadi nonpatogenik ini, disebabkan oleh
adanya perubahan biokimia pada strain nonpatogenik tersebut, yaitu berkurangnya produksi
enzim pectik lyase ekstraseluler, menurunnya aktifitas polygalacturonase, dan terjadinya
defisensi sekresi enzim ekstraseluler (Yamaguchi et al., 1992).
Berkaitan dengan mekanisme pengendalian hayati yang didasarkan pada mikrobia
antagonis dapat terjadi secara langsung (kompetisi dan antibiosis) atau tidak langsung dengan
ketahanan terimbas dari inang. Ketahanan terimbas adalah ketahanan yang berkembang
setelah tanaman diinokulasi lebih awal dengan elisitor biotik (mikroorganisme avirulen, non
69
patogenik, saprofit) dan elisitor abiotik (asam salisilik, asam 2-kloroetil fosfonik) (Agrios,
1988). Jamur hipovirulen dapat dimanfaatkan dalam pengendalian hayati mekanisme
virokontrol dengan mikovirus, yakni dengan memanfaatkan virus yang ada dalam jamur yang
berperan melemahkan pertumbuhan cendawan tersebut sehingga pertumbuhan cendawan
terhambat. Sedangkan pengendalian mekanisme ketahanan terimbas yaitu ketahanan yang
berkembang setelah tanaman diinokulasi lebih awal dengan elisitor biotik (mikroorganisme
avirulen, non patogenik, saprofit) dan elisitor abiotik (asam salisilik, asam 2-kloroetil
fosfonik) (Agrios, 1988). Jika pada bagian tertentu tanaman atau buah diinokulasi suatu
patogen atau patogen lemah, maka dalam tubuh tanaman akan timbul reaksi yang
menghasilkan suatu sistem pertahanan sehingga tanaman akan tahan terhadap serangan
patogen sama yang lebih virulen, atau bahkan tahan terhadap patogen yang lain. Terjadinya
induksi ketahanan karenan infeksi lokal diduga disebabkan oleh adanya cairan sel tanaman
yang terinfeksi tidak mempunyai persediaan makanan yang cukup atau cocok, atau karena di
dalam tanaman yang terinfeksi tersebut terbentuk senyawa yang bersifat racun sehingga
menghambat perkembangan patogen (Caruso dan Kuc, 1979 cit. Hadisutrisno 2004).
70
V. KESIMPULAN DAN SARAN
A. Kesimpulan
1. Isolat cendawan Fusarium sp pada tanaman cabai merah asal Boyolali yang telah berhasil
diisolasi didapatkan lima kelompok koloni isolat.
2. Kelompok koloni isolat Fusarium sp yang memiliki tingkat virulensi tinggi adalah
kelompok koloni isolat A, adapun karakter biologi isolat A adalah miseliumnya berwarna
krem, bentuk makrokonida panjang; ujungnya meruncing,
makrokonidia 2-6 sekat,
mikrokonidia 0-1 sekat, ukuran konidia [(3,15 x 1,5) - (3,75 x 2,5)] m x [(27,26 x 2,72)
- (29,76 x 3,12)] m, kerapatan spora antara (15,94x106-17,86x106 ) spora/ml.
3. Kelompok koloni isolat Fusarium sp yang memiliki tingkat virulensi rendah adalah
kelompok koloni isolat D, adapun karakter biologi isolat D adalah miseliumnya berwarna
putih seperti kapas, bentuk makrokonida panjang; ujungnya meruncing, makrokonidia 36 sekat, mikrokonidia 0-1 sekat, ukuran konidia [(4,75 x 2,5) - (5,35 x 3,15)] m x
[(31,16 x 3,2) - (27,36 x 4,10)] m, kerapatan spora antara (25,64x106-27,76x106 )
spora/ml.
4. Kelompok koloni isolat D memiliki potensi sebagai isolat hipovirulen yang dapat
dikembangkan sebagai agen pengendali hayati yang ramah lingkungan, yakni dengan
metode ketahanan terimbas.
B. Saran
Perlu dilakukan penelitian lanjutan untuk mengetahui peranan isolat-isolat
hipovirulen yang telah diperoleh dari penelitian ini (isolat D) sehingga dapat diketahui
peluangnya untuk dapat dikembangkan sebagai agen hayati (sebagai agen elisitor).
36
71
DAFTAR PUSTAKA
Agrios GN. 1996. Ilmu Penyakit Tumbuhan. Busnia, M penerjemah. Yogyakarta: Gadjah Mada
University Press. Terjemahan dari Plant Pathology 3rd ed.
Agromedia. 2008. Panduan Lengkap Budidaya dan Bisnis Cabai. PT Agromedia Pustaka.
Jakarta
Akhsan, N. 1996. Studi Keberadaan Populasi Fusarium (Fusarium oxysporum f.sp. licopersici
(Sacc) Snyd & Hans) di Palaran, Loa Jaran dan Tanah Merah. Bul. Budidaya Pert. 2 (1):
11-15.
Alexopoulos, C. J & C. W. Mims. 1979. Introductory Mycology. Third Edition. John Wiley and
Sons. New York.
Anonim. 1999. Crop Profile for Onions. New York. www.google.com
Anonima. 2009. Pangkalan Data OPT Dinas Pertanian dan Kehutanan Provinsi DKI Jakarta.
http://www.pangkalan-opt.net. [11 Desember 2009].
Anonimb. 2009. Pangkalan Data OPT Dinas Pertanian dan Kehutanan Provinsi DKI Jakarta.
http://www.pangkalan-opt.net. [11 Desember 2009].
Anonimc.
2009.
Hama,
Penyakit
Dan
Defisiensi
Pada
Tanaman
Cabai.
http://indonesiachili.com/pestanddiseasesmanagement.htm. [5 September 2009].
Anonimd. 2009. Fusarium oxysporum. http://sciweb.nybg.org/science2/hcol/fusarium3.asp. [9
Maret 2009].
Barnet dan Hunter. 1988. Illustrated Genera of Imperfect Fungi. Ed ke-2. West Virginia :
Burgress Publishing Company.
Boisson, C and H. Lahlou. 1982. Etude du polymorphisme intraclonal chez le Verticillium
alboatrum, forme a microsclerotes. II. Morphologie et morphogenese comparees de
deux isolats de phenotype sauvage et de leurs principaux variants. Can.J.Bot. 61:
188196.
Booth S. 1985. The Genus Fusarium. England. The Lavenham Press Ltd.
Cook, RJ & Baker, KF. 1983. The Nature and Practice of Biological Co Plant Patogen. The
American Phytopathological Soceity. USA.
Damayanti, Desi. Jamur Fusarium Oxysporum. http://lookaroundusnow.blogspot.com/ [14 Maret
2009].
37
72
De Cal A, Garcia-Lepe R & Melgarejo P. 2000. Induced resistance by Penicillium oxalicum
against F. oxysporum f.sp. lycopersici: Histological studies of infected and induced
tomato stem. Phytopathology 90: 260-268.
[DIR TPH]. 2007. Hasil diskusi dan kesepakatan koordinasi kelompok kerja penanggulangan
penyakit layu pisang. Diskusi dan Kesepakatan Koordinasi Kelompok Kerja:
Banjarmasin,18 20 April 2007. Direktur Perlindungan Tanaman Hortikultura. Hlm 18.
Domsch KH, Anderson TH, Gams W,. 1993. Compendium of Soil Fungi. Vol I. IHW-Velag.
Djumhana, Nana. 2007. Biologi Untuk SMA. Universitas Pendidikan Indonesia. Bandung.
Firdaus.
2008.
Varitas
Cabe Tahan
Penyakit Tanpa Obat
&
http://www.kilasberita.com/kb-news/kilas-dunia. [15 September 2009].
Pestisida.
Freeman S, Zveibel A, Vintal H & Maymon M. 2002. Isolation of nonpathogenic mutants of
Fusarium oxysporum f.sp. melonis for biological control of Fusarium wilts in cucurbits.
Phytopathology 92:164-168.
Gandjar I. 1999. Pengenalan Kapang Tropik. Depok: Yayasan Obor Indonesia.
Gunawan AW, Dharmaputra OS, Rahayu G. 2004. Cendawan dalam Praktik Laboratorium.
Bogor: IPB Press.
Hadisutrisno, B. 1987. Etude de la variabilite intraclonale du pouvoir pathogene du Verticillium
dahlia Klebahn visvis de la tomate et du cotonnier. These de Docteur Ingenieur de
lEnsam. Unpublished.
-------------------. 2004. Pemanfaatan Isolat Avirulen Dalam Pengendalian Penyakit Tanaman.
Disampaikan pada pertemuan teknis Pengembangan Teknologi Perkebunan Regional
Kalimantan, 2528 Agustus di Pontianak. Fakultas Pertanian. Universitas Gadjah Mada.
Harpenas, Asep dan R. Dermawan. 2010. Budidaya Cabai Unggul. Penebar Swadaya. Jakarta.
Heale, J.B. and Isaac, I. 1965. Enviromental factors in the production of dark resting structures
in Verticillium alboatrum, V. dahliae, and V, tricorpus. Trans. Br. Mycol. Soc. 48
39.50
Huda, Miftahul. 2010. Pengendalian Layu Fusarium pada Tanaman Pisang (Musa paradisiaca
L.) secara Kultur Teknis dan Hayati. Skripsi. Fakultas Pertanian. Institut Pertanian
Bogor.
73
Hutcheson, S. W. 1998.Current Concepts of Active Defense in Plants. Ann. Rev. Phytopathol. 36
: 59 90.
Hwang, SC. 1980. Incidene, spread, and control of fusarium wilt of banana in Taiwan. SEA
Symp. Pl. Dis. Tropics II, Bangkok, Okt. 1980:63.
Istikorini, Yunik. 2002. Pengendalian Penyakit Tumbuhan Secara Hayati Yang Ekologis Dan
Berkelanjutan. Makalah Falsafah Sains (PPs 702) Program Pasca Sarjana / S3 Institut
Pertanian Bogor.
Jeger MJ. 2001. Biotic Interaction and plant-pathogen association. In: jeger MJ, Spence NJ.
Biotic Interaction In Plant. Pathogen Assosiation. New York (USA): CABL publishing.
Juanda, Ilham Febby. 2003. Potensi Rhizobakteria sebagai Agen Biofungisida untuk
Pengendalian Jamur Fitopatogen Fusarium sp. Jurusan Pendidikan Biologi Program
Studi Biologi (Non Kependidikan) Universitas Pendidikan Indonesia (UPI) Regional
Sales Office (RSO): Bandung.
Kanti, Atit dan Ilyas, Muhamad. 2006. Isolasi dan Identifikasi Kapang pada Relung Rizhosfer
Tanaman di Kawasan Cagar Alam Gunung Mutis, Timoor, NTT. Pusat Penelitian
Biologi. LIPI.
Kartapraja, R. T. Sutater, dan I Djatnika. 1996. Pengendalian Fusarium Oxysporum secara
Kultur Teknik. Prosiding Tanaman Hias 1996. Balai Penelitian Tanaman Hias, Jakarta.
p. 169-175.
Kristiana, Riajeng. 2004. Integrasi Pengendalian Penyakit Layu Fusarium Pada Bawang Merah
(Allium cepa var. ascalonicum) Dengan Binucleate Rhiozoctonia, Dolomit, dan Kalium
Fosafat. Skripsi. Fakultas Pertanian. Universitas Sebelas Maret Surakarta.
Kusumainderawati, E.P., Yuniarti, Sarwono, Dzamnuri, E. Sugiarti dan B. Pikukuh. 1995.
Introduksi dan Uji Adaptasi Varietas Cabai (Capsicum annuum L.). Balai Pengkajian
Teknologi Pertanian Karangploso. h 182 193.
Lahlou, H and Boisson, C. 1984. Variabilite intraclonale du pouvoir pathogene de Verticillium
alboatrum R. et B forme a microsclerote visvis de la tomate. In Variation et
variabilite des agents phytopathogenes, 25 emme calloque SPP, Avignon 1011 mai
1984. Ed. INRA Publ., 1984 (Ls Colloques de IINRA, n26) p 6978.
Lily dan Barnet (1951) dalam Djajati, Mulyadi, Wahyudi. 1998. Pengaruh Pemberian Dolomit
terhadap Serangan Cendawan Fusarium oxysporum pada Tanaman Pisang Varietas
Ambon Kuning di Rumah Kaca. Prosiding Seminar Nasional. Seminar IV Perhimpunan
Fitopatologi Indonesia (PFI) Komisariat Daerah Jateng dan DIY: 157. FP UNS.
Surakarta.
74
Loon, L. C., P. A. H. M. Bakker and C. M. J. Plieterse. 1998. Systemic Resistance Induced by
Rhizosphere Bacteria. Ann. Rev. Phytopathol. 36 : 453 483.
Machmud, M., M. A. Suhendar, Y. Suryadi, Jumanto, dan M. Sudjadi. 2003. Seleksi dan
Karakterisasi
Patogen
Tanaman.
http://biogen.litbang.deptan.go.id/terbitan/prosiding/fulltext_pdf. Diakses pada tanggal
10 Mei 2009.
McKay, M. E. and I. Hughes.1982. Growing Gladioli. Queensland Agriculture Journal. 180:
127-139.
Mehrotra, R.S. 1980. Plant Pathology. Tata McGrw Hill Publ. Lim., New Delhi, 771p
Mujiono, Ahmad. 2008. Pengaruh Aplikasi Agensia Hayati dan Pestisida Terhadap Populasi
Musuh Alami Thrips pada Tanaman Cabai Merah
(Capsicum annum L.).
http://digilib.ac.id/go.php.id.[16 September 2009].
Pegg, G.F. 1957. A Hyalin variant of Verticillium alboatrum R. & B. Nature (London), 208,
1228,1229.
Purnomo, Bambang. 2006. Dasar-dasar Perlindungan Tanaman: Penggolongan Penyakit
Pathogen Tumbuhan. http://www.ristek.go.id. [16 September 2009].
Rahayu, E dan N. Berlian. 1994. Bawang Merah. Penebar Swadaya. Jakarta.
Samoosir, Jenti. 2007. Inventarisasi Penyebab Penyakit Pada Tanaman Stroberi (Vragaria vesca
L.) di Kecamatan Bertasgi. Skripsi. Fakultas Pertanian. Universitas Sumatra Utara.
Medan
Saragih, Saud Daniel. 2009. Jenis-jenis Fungi pada Beberapa Tingkat Kematangan Gambut.
Skripsi. Fakultas Pertanian. Universitas Sumatra Utara.
Sastrahidayat, I. R. 1986. Ilmu Penyakit Tumbuhan. Usaha Nasional. Surabaya.
-----------------------. 1989. Ilmu Penyakit Tumbuhan. Usaha Nasional. Surabaya.
Schwartz, HF and Michael. E. 2002. Fusarium Bassal Rot. www.googlw.com
Semangun (1971) dalam Djajati, Mulyadi, Wahyudi. 1998. Pengaruh Pemberian Dolomit
terhadap Serangan Cendawan Fusarium oxysporum pada Tanaman Pisang Varietas
Ambon Kuning di Rumah Kaca. Prosiding Seminar Nasional. Seminar IV Perhimpunan
Fitopatologi Indonesia (PFI) Komisariat Daerah Jateng dan DIY: 157. Fakultas
Pertanian. Universitas Sebelas Maret Surakarta.
Semangun H. 1996. Pengantar Ilmu Penyakit Tumbuhan. UGM Press. Yogyakarta.
75
----------------. 1998. Penyakit-Penyakit Tanaman Hortikultura di Indonesia. Yogyakarta: Gajah
Mada University Press.
----------------. 2000. Penyakit-Penyakit Tanaman Hortikultura di Indonesia. Yogyakarta: Gajah
Mada University Press.
----------------. 2001. Pengantar Ilmu Penyakit Tumbuhan. Yogyakarta: Gajah Mada University
Press. 754 hal.
----------------. 2004. Penyakit-Penyakit Tanaman Hortikultura di Indonesia. Gadjah Mada
University Press. Yogyakarta. 850 hal.
----------------. 2007. Penyakit-penyakit Tanaman Hortikultura di Indonesia. Gadjah Mada
University Press. Yogyakarta.
Sinaga, M. S., 2006. Dasar-dasar Ilmu Penyakit Tumbuhan. Penebar Swadaya, Jakarta. 154 hal.
Singleton, L. L, D. Mihail, and C. M. Rush. 1992. Methods for Research on Soil Borne
Phytopathogenic Fungi. APS Press. St. Paul. Minnesota. 265 p.
Soesanto, L. 2000. Ecology and Biological Control of Verticillium dahliae. Ph.D Thesis.
Wageningen University, Wageningen, The Netherlands.
--------------. 2002. Penyakit Busuk Rimpang Jahe di Sentra Produksi Jahe Jawa Tengah : 2.
Intensitas dan Pola Sebaran Penyakit. Proyek Pembinaan Kelembagaan Litbang
Pertanian (ARMPII) Jawa Tengah.
Sunaryono, Hendro. 2000. Budidaya Cabai Merah. Sinar Baru Algendiso. Bandung.
Supriyati dan E, Roosganda. 2009. Pensejahteraan Petani dan Pengembangan Agribisnis
melalui Pengembangan Kelembagaan Kemitraan dalam Pemasaran Cabai Merah.
Disampaikan dalam Seminar Nasional Peningkatan Daya Saing Agribisnis Berorientasi
Kesejahteraan Petani. Bogor.
Supyani, 2009. Mikovirus: Virus-virus Pada Jmaur Yang Dapat Dikembangkan Sebagai Agens
Pengendali Hayati. Disampaikan dalam Simposium Mikrobiologi: Perhimpunan
Mikrobiologi Indonesia (PERMI) Cabang Solo.
Susetyo, Aryo Pratomo. 2010. Hubungan Keanekaragaman Cendawan Rizosfer Tanaman Pisang
(Musa spp.) dan Penyakit Layu Fusarium. Skripsi. Fakultas Pertanian. Institut Pertanian
Bogor.
Tjahjadi, N. 1989. Hama dan Penyakit Tanaman. Kanisius. Yogyakarta.
76
Weller, D. M., J. M. Raaijmakers, B. B. M. Gardener, and L. S. Thomashow. 2002. Microbial
Populations Responsible for Spesific Soil Suppressivenes to Plant Pathogens. Ann. Rev.
Phytopathol. 40 : 309 348.
Winarsih, Sri. 2007. Pengaruh bahan organik pada pertumbuhan Gliocladium virens dan daya
antagonisnya terhadap Fusarium oxysporum secara in-vitro. ISSN 1411 0067 Jurnal
Ilmu-Ilmu Pertanian Indonesia. Edisi Khusus, No. 3 2007, Hlm. 386 - 390 386
Yamaguchi K, Kida, Arita M & Takahashi M. 1992. Induction of systemic resistance by
Fusarium oxysporum MT0062 in solanaceaous crops. Ann. Phytopath. Soc. Japan. 58:
16-22.
77
You might also like
- PHT Bawang MerahDocument19 pagesPHT Bawang MerahZola Puti RahmaNo ratings yet
- Alat Mulut SeranggaDocument11 pagesAlat Mulut SeranggaRumaishaNo ratings yet
- SITOKININ DAN PERTUMBUHAN TANAMANDocument16 pagesSITOKININ DAN PERTUMBUHAN TANAMANMikorizaNo ratings yet
- MagnesiumDocument4 pagesMagnesiumResita FathanyNo ratings yet
- Mikrin JadiDocument11 pagesMikrin JadiEky WardaniNo ratings yet
- Penyakit Kudis Pada Ubi JalarDocument8 pagesPenyakit Kudis Pada Ubi Jalarlylalaila100% (1)
- Modul Praktikum Ekologi PertanianDocument23 pagesModul Praktikum Ekologi PertanianDikfenidnef Funasura100% (1)
- Laporan PraktikumDocument9 pagesLaporan PraktikumSiti RikayantiNo ratings yet
- Lap Uji Bioogis 2,4-DDocument4 pagesLap Uji Bioogis 2,4-Dr1zk1_L_3No ratings yet
- AUKSIN DAN TUMBUHANDocument19 pagesAUKSIN DAN TUMBUHANayu lestariNo ratings yet
- DinaDocument11 pagesDinaAsy Shafa Audina SaragihNo ratings yet
- Persepsi Petani Terhadap Status Dan Prospek Penggunaan SeNPV Pada Usahatani Bawang MerahDocument16 pagesPersepsi Petani Terhadap Status Dan Prospek Penggunaan SeNPV Pada Usahatani Bawang Merahvicianti1482100% (2)
- Aspek Mikrobiologis Dalam Pengelolaan Nitrogen Di Lahan BasahDocument11 pagesAspek Mikrobiologis Dalam Pengelolaan Nitrogen Di Lahan BasahMuhammad Sadiqul ImanNo ratings yet
- Kultur ProtoplasDocument28 pagesKultur ProtoplasHeanSafiraNo ratings yet
- Pengendalian Hama Ulat Krop (Crocidolomia Binotalis Zell.) Pada Tanaman Kubis (Brassica Oleracea L.) Dengan Agen HayatiDocument21 pagesPengendalian Hama Ulat Krop (Crocidolomia Binotalis Zell.) Pada Tanaman Kubis (Brassica Oleracea L.) Dengan Agen Hayatidiankarnain100% (1)
- GEJALA PENYAKIT DI LAPANGANDocument56 pagesGEJALA PENYAKIT DI LAPANGANMar'atun SolihaNo ratings yet
- Miko PatogenDocument23 pagesMiko PatogenYekti Rinni0% (1)
- HormonTumbuhanDocument14 pagesHormonTumbuhanFadhilah RoviyantiNo ratings yet
- Makalah Dipt Bulai JagungDocument6 pagesMakalah Dipt Bulai JagungAnonymous xkgkbOINo ratings yet
- Laporan KP Anggi FixDocument60 pagesLaporan KP Anggi Fixanggi marlianaNo ratings yet
- Laporan Praktikum Tpah ParasitoidDocument19 pagesLaporan Praktikum Tpah ParasitoidRafida MahmudahNo ratings yet
- Pemurnian Jamur Patogen Dan AntagonisDocument13 pagesPemurnian Jamur Patogen Dan AntagonisAdam_Kurniawan94No ratings yet
- OPTIMASI PENGENDALIAN HAYATIDocument10 pagesOPTIMASI PENGENDALIAN HAYATIRizky UchihaNo ratings yet
- LAP Pengukuran Potensial Osmotik Dan Air Jaringan TumbDocument15 pagesLAP Pengukuran Potensial Osmotik Dan Air Jaringan TumbCiciNo ratings yet
- Paper Physoderma MaydisDocument2 pagesPaper Physoderma MaydisNurIndah100% (1)
- Busuk Buah StroberiDocument3 pagesBusuk Buah StroberiAhmad SyamsNo ratings yet
- BIOCHARPADIDocument25 pagesBIOCHARPADIYulet KonayNo ratings yet
- Pengertian BiotikDocument3 pagesPengertian BiotikYudhistira BagasNo ratings yet
- Piper AuksinDocument10 pagesPiper AuksinVhi OchiNo ratings yet
- Aktivitas Kapang Parasit TanamanDocument47 pagesAktivitas Kapang Parasit TanamanAz Jabr Cosmetic100% (1)
- Makro FaunaDocument13 pagesMakro FaunaFerdy Ardiansyah Cagh CassudthNo ratings yet
- Propagasi BramaDocument16 pagesPropagasi BramaYusufMuftiBNo ratings yet
- Cendawan EndofitDocument75 pagesCendawan EndofitankardiansyahpNo ratings yet
- Makalah Perlindungan Tanaman PertanianDocument10 pagesMakalah Perlindungan Tanaman PertaniansaraholiviyanisaNo ratings yet
- ALELOPATI CABAIDocument16 pagesALELOPATI CABAIShilvi ShinhwaNo ratings yet
- Virologi 4Document5 pagesVirologi 4Dito AbimanyuNo ratings yet
- Mas'ud, 2011 PDFDocument14 pagesMas'ud, 2011 PDFNoah GenNo ratings yet
- FusariumDocument4 pagesFusariumlathifah laila ulfaNo ratings yet
- Teknik Produksi Bawang PutihDocument15 pagesTeknik Produksi Bawang PutihMuhammadHilmyFuadiNo ratings yet
- Kultur Fusi ProtoplasmaDocument19 pagesKultur Fusi Protoplasmasantika dewiNo ratings yet
- Laporan Akhir Praktikum KuljarDocument51 pagesLaporan Akhir Praktikum KuljarGiyo Alam W100% (1)
- Laporan 6Document12 pagesLaporan 6MulkyAdamNo ratings yet
- Genetika TumbuhanDocument19 pagesGenetika TumbuhanShela SoniaNo ratings yet
- Metode Deteksi VirusDocument5 pagesMetode Deteksi VirusSefa FalahudinNo ratings yet
- AlelopatiDocument53 pagesAlelopatiAndrea AllenNo ratings yet
- Tugas Makalah Ekologi TanamanDocument19 pagesTugas Makalah Ekologi TanamanIndah PratiwiNo ratings yet
- JENIS JANGKRIK TWADocument21 pagesJENIS JANGKRIK TWASiti YuanichitaNo ratings yet
- XANTHAN GUMDocument11 pagesXANTHAN GUMDea Apriyani50% (2)
- Makalah Ekologi (Faktor Biotik)Document14 pagesMakalah Ekologi (Faktor Biotik)Ghio NajoanNo ratings yet
- AGROKLIM-Pengaruh Cahaya Matahari Dan SuhuDocument34 pagesAGROKLIM-Pengaruh Cahaya Matahari Dan SuhuKiki FatmawatiNo ratings yet
- LAPORAN AKHIR PRAKTIKUM FistanDocument144 pagesLAPORAN AKHIR PRAKTIKUM Fistanriri faridaNo ratings yet
- Laporan Protozoa Eimeria Dan LeucocytozoonDocument11 pagesLaporan Protozoa Eimeria Dan LeucocytozoonHerren LazuardiNo ratings yet
- Tanaman Penutup TanahDocument6 pagesTanaman Penutup TanahAndi Anindita Rahmayani RusmanNo ratings yet
- KAJIAN SERANGGADocument6 pagesKAJIAN SERANGGAhanif amirusdiNo ratings yet
- Wholemount 1Document25 pagesWholemount 1Asri Nur Ratri0% (1)
- Identifikasi Lichenes & Bryophyta IAIN TulungagungDocument31 pagesIdentifikasi Lichenes & Bryophyta IAIN TulungagungIlmi Indah AyuNo ratings yet
- Kelas ChilopodaDocument7 pagesKelas ChilopodaDevis RefaniNo ratings yet
- Karakterisasi Biologi Isolat-Isolat Fusarium SP PADA TANAMAN CABAI MERAH (Capsicum Annuum L.) Asal BoyolaliDocument57 pagesKarakterisasi Biologi Isolat-Isolat Fusarium SP PADA TANAMAN CABAI MERAH (Capsicum Annuum L.) Asal BoyolaliYolma hendraNo ratings yet
- 135010908201008531Document75 pages135010908201008531Satrul JamilNo ratings yet
- OPTIMALKAN KUBISDocument58 pagesOPTIMALKAN KUBISTismi Dipalaya100% (1)
- Skripsi Trichoderma PDFDocument49 pagesSkripsi Trichoderma PDFAdnanLasuardaNo ratings yet
- BacillusDocument17 pagesBacillusAdnanLasuardaNo ratings yet
- Tanaman Jati UnggulDocument89 pagesTanaman Jati UnggulAdnanLasuardaNo ratings yet
- 16 Pupuk Dan PemupukanDocument9 pages16 Pupuk Dan PemupukanWurie SylianeNo ratings yet
- Jahardi JurnalDocument9 pagesJahardi JurnalJeyho Siq AllonaNo ratings yet
- Papper Hukum MendelDocument6 pagesPapper Hukum MendelAdnanLasuardaNo ratings yet
- Biodegradasi Sludge Minyak BumiDocument8 pagesBiodegradasi Sludge Minyak BumiSisca Wiryawan0% (1)
- Galur JagungDocument11 pagesGalur JagungAdnanLasuardaNo ratings yet
- BakteriDocument6 pagesBakteriAdnanLasuardaNo ratings yet
- 110 336 1 PBDocument5 pages110 336 1 PBAdnanLasuardaNo ratings yet
- JURNAL 1.pdfnbmDocument7 pagesJURNAL 1.pdfnbmCarla Rindi LestariNo ratings yet
- Kembang Kerut Tanah VertisolDocument8 pagesKembang Kerut Tanah VertisolAdnanLasuardaNo ratings yet
- Alkana Alkohol PDFDocument28 pagesAlkana Alkohol PDFAdnanLasuardaNo ratings yet
- Karakteristik Potensi, Dan Teknologi Pengelolaan Tanah Ultisol Untuk An Pertanian Lahan Kering Di IndonesiaDocument9 pagesKarakteristik Potensi, Dan Teknologi Pengelolaan Tanah Ultisol Untuk An Pertanian Lahan Kering Di Indonesiadaudsajo100% (14)
- Sistem Reproduksi Tumbuhan 2013Document34 pagesSistem Reproduksi Tumbuhan 2013AdnanLasuardaNo ratings yet
- Alkana Alkohol PDFDocument28 pagesAlkana Alkohol PDFAdnanLasuardaNo ratings yet
- Biokimia KarbohidratDocument17 pagesBiokimia KarbohidratJoseph Gilbert100% (26)
- Data Curah HujanDocument3 pagesData Curah HujanAdnanLasuardaNo ratings yet
- KIMIA (Stoikiometri)Document72 pagesKIMIA (Stoikiometri)AdnanLasuardaNo ratings yet
- Matrik Invers EditingDocument71 pagesMatrik Invers EditingAdnanLasuardaNo ratings yet