Professional Documents
Culture Documents
Ficha 8
Uploaded by
fa1978Original Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Ficha 8
Uploaded by
fa1978Copyright:
Available Formats
CIÊNCIAS FÍSICO-QUÍMICAS – 8ºANO
NOME : ___________________________________________________________________________________________ Nº
_______TURMA_______
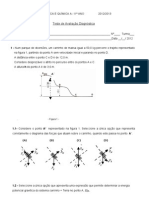
1. Completa correctamente a tabela seguinte:
Representação simbólica Significado da representação
O
1 átomo de carbono
4Cl
2 moléculas de água
3H2
2. Escreve simbolicamente:
2.1. três moléculas de acetona (cada molécula é formada por 3 átomos de carbono, 6
átomos de hidrogénio e 1 átomo de oxigénio). _______________
2.2. cinco moléculas de peróxido de hidrogénio (cada molécula é formada por 2 átomos de
hidrogénio e 2 átomos de oxigénio). _______________
2.3. dois átomos de cobre livres. _______________
2.4. um átomo de azoto livres. _______________
2.5. o ião que resulta de um átomo de oxigénio após captar dois electrões. ____________
2.6. o ião que resulta de um grupo formado por um átomo de hidrogénio, um átomo de
carbono e três átomos de oxigénio, que captou um electrão. ________________
3. Consultando a tabela de iões seguinte,
Iões Positivos ou Catiões Iões negativos ou Aniões
Mg2+- ião magnésio Cl− - ião cloreto
Al 3+ - ião alumínio HO− - ião hidróxido
+
K - ião potássio S2-- ião sulfureto
+ −
Ag - ião prata NO 3 - ião nitrato
3.1. Escreve as fórmulas químicas dos seguintes compostos iónicos:
3.1.1. Cloreto de magnésio;
3.1.2. Hidróxido de alumínio;
3.1.3. Sulfureto de prata;
3.1.4. Nitrato de prata.
3.2. Escreve o nome:
3.2.1. KCl;
3.2.2. Mg(NO3)2;
3.2.3.Mg(HO)2.
4. A seguinte equação química, representa a síntese de ácido clorídrico:
H2 (g) + Cl2 (g) HCl (g)
4.1.Acerta a reacção química.
4.2.Faz a leitura da equação.
5. Para obter 64 g de dióxido de enxofre (SO 2) gasoso, fez-se reagir enxofre elementar
(S8) sólido com 32 g de oxigénio gasoso molecular (O2). Responde às questões.
5.1 Escreve a equação química que traduz a reacção.
5.2 Identifica os reagentes e os produtos desta reacção química.
5.3 Das substâncias envolvidas na reacção química, indica as substâncias elementares.
Justifica a tua resposta.
5.4 Calcula a massa de enxofre que reagiu com o oxigénio.
5.5 Enuncia a lei que te permitiu responder à alínea anterior.
6. Escreve e acerta os esquemas químicos que traduzem as seguintes reacções:
6.1. O sódio no estado sólido reage com o oxigénio molecular no estado gasoso para
formar o óxido de sódio (NaO2) no estado sólido.
6.2. Reacção do metano (CH4) com o oxigénio molecular, formando-se vapor de água e
libertando-se dióxido de carbono.
6.3. A água decompõe-se por electrólise originando oxigénio molecular e hidrogénio
molecular.
6.4. O potássio no estado sólido reage com a água no estado líquido, originando o
hidróxido de potássio (KHO) em solução aquosa, e libertando hidrogénio molecular no
estado gasoso.
7. Acerta os esquemas químicos que se seguem de forma a estarem de acordo com a lei de
Lavoisier.
a) C (s) + O2 (g) CO (s)
b) NO (g) + O2 (g) NO2 (g)
c) CaCO3 (s) CaO (s) + CO2 (g)
d) CuSO4 (aq) + NaOH (aq) Cu(OH)2 (s) + Na2SO4 (aq)
e) Na (s) + H2O (l) NaHO (aq) + H2 (g)
f) Al (s) + HCl (aq) AlCl3 (aq) + H2 (g)
g) N2 (g) + H2 (g) NH3 (g)
h) CH4 (g) + O2 (g) CO2 (g) + H2O (g)
i) NO (g) + Br 2 (g) NOBr (g)
j) P4(s) + Cl2(g) PCl3(l)
Bom trabalho!
You might also like
- Planilha para Cálculo de AgitadoresDocument29 pagesPlanilha para Cálculo de AgitadoresElton Neves da Silva100% (1)
- VX-7R Yaesu - Manual de Operação - PortuguêsDocument94 pagesVX-7R Yaesu - Manual de Operação - PortuguêsWanderley Moreira100% (1)
- Pedi e ObtereisDocument71 pagesPedi e ObtereisMárcia Ap RodriguesNo ratings yet
- Rev TesteDocument3 pagesRev Testefa1978No ratings yet
- Itn Gas RadaoDocument7 pagesItn Gas Radaofa1978No ratings yet
- Prep SolDocument3 pagesPrep Solfa1978No ratings yet
- 3.reações Nucleares1Document5 pages3.reações Nucleares1fa1978No ratings yet
- Estrutura e Origem Do UniversoDocument19 pagesEstrutura e Origem Do Universofa1978No ratings yet
- Soluções e Coloides - Docs ApoioDocument5 pagesSoluções e Coloides - Docs Apoiofa1978No ratings yet
- Teste Diagnostico 2012 13Document6 pagesTeste Diagnostico 2012 13fa1978No ratings yet
- Ficha de RevDocument3 pagesFicha de Revfa1978No ratings yet
- TESTE 8.2aDocument4 pagesTESTE 8.2afa1978No ratings yet
- Acido BaseDocument2 pagesAcido Basefa1978No ratings yet
- Reacções QuímicasDocument1 pageReacções Químicasfa1978No ratings yet
- Guia Prático de Autodefesa Psíquica - Parte 22 PDFDocument5 pagesGuia Prático de Autodefesa Psíquica - Parte 22 PDFSefer Ha BahirNo ratings yet
- Docsity Prova de Quimica 1o Ano Ensino Medio 1o BimestreDocument6 pagesDocsity Prova de Quimica 1o Ano Ensino Medio 1o BimestreJulia NoronhaNo ratings yet
- Check List - Serra de BancadaDocument1 pageCheck List - Serra de BancadaKarina MeloNo ratings yet
- Festa Do Divino Pai Eterno: Representações Do Patriarca em Panamá (Go)Document13 pagesFesta Do Divino Pai Eterno: Representações Do Patriarca em Panamá (Go)eloane rodriguesNo ratings yet
- 21 Aula Af 2019 Obsessao AutoobsessaoDocument11 pages21 Aula Af 2019 Obsessao AutoobsessaoMarcos MarosticaNo ratings yet
- Memorial Descritivo Processamento Cisão HidrolíticaDocument10 pagesMemorial Descritivo Processamento Cisão HidrolíticaJorgeRodriguesBelfortFilhoNo ratings yet
- 10 Melhores Casa de Repouso para Idosos em Poços de Caldas Preços - CronoshareDocument1 page10 Melhores Casa de Repouso para Idosos em Poços de Caldas Preços - CronoshareJuciene DiasNo ratings yet
- Aula 09 PDFDocument22 pagesAula 09 PDFjeozadaqueNo ratings yet
- Mandalas Do Baralho CiganoDocument9 pagesMandalas Do Baralho CiganoSally V. RodriguesNo ratings yet
- Missa Da Sagrada FaceDocument4 pagesMissa Da Sagrada FaceSacerdote Eguimar Matias Dos SantosNo ratings yet
- CATALOGODocument28 pagesCATALOGOGABRIELNo ratings yet
- Rádio Comunitária - ApostilaDocument27 pagesRádio Comunitária - ApostilaLondulade BezerraNo ratings yet
- Atividade de Física - 3° AnoDocument3 pagesAtividade de Física - 3° Anokaique reinaldoNo ratings yet
- A Vaca Já Foi Pro Brejo - Tião Carreiro e Pardinho - Cifras de ViolaboabomDocument1 pageA Vaca Já Foi Pro Brejo - Tião Carreiro e Pardinho - Cifras de ViolaboabomJair Golfinho Bantos de AruandaNo ratings yet
- Maçonaria e Clube de ServiçosDocument25 pagesMaçonaria e Clube de ServiçosWagner Cruz da CruzNo ratings yet
- Folha de Respostas Pep-R - Com VocêDocument14 pagesFolha de Respostas Pep-R - Com VocêEstágio EspecíficoNo ratings yet
- Triplo X, Duplo Y - Guilherme Pereira Albert, 3DDocument9 pagesTriplo X, Duplo Y - Guilherme Pereira Albert, 3DGuilherme AlbertNo ratings yet
- Abraco RP Pac 002 Rev. 0 Maio 2018 2Document18 pagesAbraco RP Pac 002 Rev. 0 Maio 2018 2PaulaNo ratings yet
- Folder MeditacaoDocument2 pagesFolder MeditacaoRafael AméricoNo ratings yet
- Cartilha de EsperantoDocument12 pagesCartilha de EsperantoJonay SosaNo ratings yet
- Animador de Festa Infantil 3Document21 pagesAnimador de Festa Infantil 3Manu AlencarNo ratings yet
- 2º Ano-Filosofia V.02-EM-EJA-Semana 17Document2 pages2º Ano-Filosofia V.02-EM-EJA-Semana 17Bruna DPC AbellanedaNo ratings yet
- Laringe Falsas Cordas Vocais e As Cordas Verdadeiras PDFDocument7 pagesLaringe Falsas Cordas Vocais e As Cordas Verdadeiras PDFJuliano GamoNo ratings yet
- Volume1-ManualTecnicoparaMapeamentodePerigoeRiscoaMovimentos CPRMDocument218 pagesVolume1-ManualTecnicoparaMapeamentodePerigoeRiscoaMovimentos CPRMPaulo BuenoNo ratings yet
- Bons Sebenta-DIP TeóricaDocument78 pagesBons Sebenta-DIP TeóricaFilipe Rodrigues BandeiraNo ratings yet
- EbookOReinoInabalavel PDFDocument200 pagesEbookOReinoInabalavel PDFThiago CamposNo ratings yet
- Muraplast FK 65 B 01 - 2008Document2 pagesMuraplast FK 65 B 01 - 2008Kristy WilliamsNo ratings yet