Professional Documents
Culture Documents
Analisis de La Estructura Atomica
Uploaded by
brandon_jhordanCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Analisis de La Estructura Atomica
Uploaded by
brandon_jhordanCopyright:
Available Formats
Tampico, Tamps, Mx.
05/16/03/2012
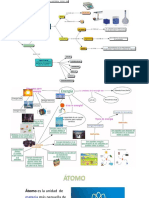
ANALISIS DE LA ESTRUCTURA ATOMICA
ESTRUCTURA Y MASA DEL TOMO. La teora atmica constituy tan slo inicialmente una hiptesis de trabajo, muy fecundada en el desarrollo posterior de la Qumica, pues un fue hasta fines del siglo XIX en que fue universalmente aceptada al conocerse pruebas fsicas concluyentes de la existencia real de los tomos. Pero fue entonces cuando se lleg a la conclusin de que los tomos eran entidades complejas formadas por partculas ms sencillas y que los tomos de un mismo elemento tenan en muchsimos casos masa distinta. Estas modificaciones sorprendentes de las ideas de Dalton acerca de la naturaleza de los tomos no invalidan en el campo de la Qumica los resultados brillantes de la teora atmica. Los tomos estn constituidos por protones, neutrones y electrones. Los protones estn cargados positivamente y se encuentran reunidos con los neutrones (sin carga) en el ncleo. Los electrones, que tienen una carga negativa igual en magnitud a la carga positiva del protn, se mueven en el espacio que rodea al ncleo. Los protones y los neutrones tienen masas semejantes, aproximadamente 1800 veces mayor que la masa de un electrn. Casi toda la masa del tomo reside en el ncleo, pero son los electrones los que toman parte en los enlaces y en las reacciones qumicas. Cada elemento se distingue por el nmero de protones en su ncleo. Por lo general, el nmero de neutrones es semejante al nmero de protones, aunque puede variar. Los tomos que tienen el mismo nmero de protones, pero diferente nmero de neutrones se llaman istopos. Por ejemplo, la especie ms comn de tomo de carbono tiene en su ncleo seis protones y seis neutrones. Su nmero de masa (la suma de protones y neutrones) es 12, y representamos su smbolo 12C. Aproximadamente 1% de los tomos de carbono tienen siete neutrones; el nmero de masa es 13, y el smbolo es 13C. ESTRUCTURA ELECTRNICA DEL TOMO. Las propiedades qumicas de un elemento se determinan por el nmero de protones en su ncleo y el correspondiente nmero de electrones alrededor del mismo. Los electrones son los que forman enlaces y determinan la estructura de las molculas resultantes. Como son pequeos y livianos, muestran propiedades tanto de partculas como de ondas; en muchos aspectos, los electrones en los tomos y las molculas se comportan mas como ondas que como partculas. Los electrones que estn unidos a los ncleos se encuentran en orbtales. El principio de incertidumbre de Heidelberg afirma que nunca se puede determinar con exactitud dnde se encuentra el electrn; pero aun cuando no se conozca su lugar exacto, podemos hablar de la densidad electrnica, que es la probabilidad de encontrar al electrn en una parte determinada del orbital. Por tanto, un orbital es un estado permitido de energa de un electrn, con una funcin asociada de probabilidad que define la distribucin de la densidad electrnica en el espacio.
Brandon Jhordan
Tampico, Tamps, Mx.
Estructura del tomo En el tomo distinguimos dos partes: el ncleo y la corteza.
05/16/03/2012
El ncleo es la parte central del tomo y contiene partculas con carga positiva, los protones, y partculas que no poseen carga elctrica, es decir son neutras, los neutrones. La masa de un protn es aproximadamente igual a la de un neutrn. Todos los tomos de un elemento qumico tienen en el ncleo el mismo nmero de protones. Este nmero, que caracteriza a cada elemento y lo distingue de los dems, es el nmero atmico y se representa con la letra Z. La corteza es la parte exterior del tomo. En ella se encuentran los electrones, con carga negativa. stos, ordenados en distintos niveles, giran alrededor del ncleo. La masa de un electrn es unas 2000 veces menor que la de un protn. Los tomos son elctricamente neutros, debido a que tienen igual nmero de protones que de electrones. As, el nmero atmico tambin coincide con el nmero de electrones. Istopos La suma del nmero de protones y el nmero de neutrones de un tomo recibe el nombre de nmero msico y se representa con la letra A. Aunque todos los tomos de un mismo elemento se caracterizan por tener el mismo nmero atmico, pueden tener distinto nmero de neutrones. Llamamos istopos a las formas atmicas de un mismo elemento que se diferencian en su nmero msico. Para representar un istopo, hay que indicar el nmero msico (A) propio del istopo y el nmero atmico (Z), colocados como ndice y subndice, respectivamente, a la izquierda del smbolo del elemento.
Brandon Jhordan
You might also like
- Determinación de Enlaces QuímicosDocument7 pagesDeterminación de Enlaces QuímicosSozhil MartinezNo ratings yet
- Tarea Tercer Parcial QuimicaDocument5 pagesTarea Tercer Parcial QuimicaAlejandro GarciaNo ratings yet
- Guías 5 y 6 Bioquímica.Document8 pagesGuías 5 y 6 Bioquímica.Emanuel CastellanosNo ratings yet
- Ley Del Tránsito de La Cantidad A La CalidadDocument9 pagesLey Del Tránsito de La Cantidad A La CalidadEricAtaídesNo ratings yet
- Apuntes de Lógica ProposicionalDocument38 pagesApuntes de Lógica ProposicionalDavid Méndez Martín50% (2)
- Experimentación Animal - Debate Grupo 6Document12 pagesExperimentación Animal - Debate Grupo 6Jordin Solano Rojas100% (1)
- Calor de Formación y ReacciónDocument6 pagesCalor de Formación y ReacciónRobertoCarlosOrrilloMendozaNo ratings yet
- Tarea #3. Capitulos 2 y 3 (Bernard Nevel)Document8 pagesTarea #3. Capitulos 2 y 3 (Bernard Nevel)Maria Del Carmen Escobar100% (1)
- Distintos Problemas de Quimica Basica General UsacDocument6 pagesDistintos Problemas de Quimica Basica General UsacJunior OrellanaNo ratings yet
- Hoja de Trabajo Capítulo 14Document8 pagesHoja de Trabajo Capítulo 14Haitry SamayoaNo ratings yet
- Bioquimica Taller 6Document12 pagesBioquimica Taller 6Victor alfonso gualteroNo ratings yet
- Aplicación de La Matemática en La IngenieríaDocument6 pagesAplicación de La Matemática en La IngenieríaFranciscoNo ratings yet
- Trabajo#1Document12 pagesTrabajo#1María MoralesNo ratings yet
- Instituciones ColonialesDocument2 pagesInstituciones ColonialesHector ponce100% (2)
- Teoria de La ElectrolisisDocument4 pagesTeoria de La ElectrolisisdulceNo ratings yet
- Reseña Historica de La ElectrostaticaDocument1 pageReseña Historica de La ElectrostaticaÁndrýuss Flores100% (1)
- Estado de Los AltosDocument3 pagesEstado de Los AltosValo HerreraNo ratings yet
- Prelab Practica 8 Emision de Luz de CationesDocument13 pagesPrelab Practica 8 Emision de Luz de CationesKrisztofer CzollerNo ratings yet
- Carga Nuclear Efectiva - Ejercicios PropuestosDocument2 pagesCarga Nuclear Efectiva - Ejercicios PropuestoshectorhernandomsNo ratings yet
- Tension SuperficialDocument7 pagesTension SuperficialRonalexNo ratings yet
- Lab Tension Superficial y CapilaridadDocument15 pagesLab Tension Superficial y CapilaridadCarlosBladimirEspinolaRosarioNo ratings yet
- Reacciones ReversiblesDocument5 pagesReacciones Reversiblesitana15No ratings yet
- La Sangre de Un Ser Humano Adulto Contiene El Promedio de 7000Document1 pageLa Sangre de Un Ser Humano Adulto Contiene El Promedio de 7000saraNo ratings yet
- Escuela NeoclásicaDocument13 pagesEscuela NeoclásicaEricka CoboxNo ratings yet
- JUSTIFICACIÓN DE LA CONTAMINACIÓN AMBIENTAL PDF - 013054Document1 pageJUSTIFICACIÓN DE LA CONTAMINACIÓN AMBIENTAL PDF - 013054Estefani AvalosNo ratings yet
- Analisi de La Vida Republicana de PanamaDocument5 pagesAnalisi de La Vida Republicana de PanamaEmlismi MimorNo ratings yet
- Pre-Laboratorio Reacciones QuímicasDocument5 pagesPre-Laboratorio Reacciones QuímicasDiana Karolina Duque100% (1)
- Normas Académicas, Normas Disciplinarias y Normas Financieras de La UMG.Document1 pageNormas Académicas, Normas Disciplinarias y Normas Financieras de La UMG.Mateo Isaias MoralesNo ratings yet
- Analisis DimensionalDocument38 pagesAnalisis DimensionalMagaly Avellaneda PonceNo ratings yet
- La Ley de Las Proporciones MultiplesDocument9 pagesLa Ley de Las Proporciones MultiplesManuel MendézNo ratings yet
- Fisica - Guía No. 3Document5 pagesFisica - Guía No. 3Samuel SicajolNo ratings yet
- Requerimiento CalóricoDocument42 pagesRequerimiento CalóricoHappy HOffers Hh'sNo ratings yet
- Informe de Laboratorio #1 Manejo de Soluciones FisiológicasDocument7 pagesInforme de Laboratorio #1 Manejo de Soluciones FisiológicasEduardo Santana Reynoso MendozaNo ratings yet
- Justificación Ley de Faraday y Ley de OhmDocument3 pagesJustificación Ley de Faraday y Ley de OhmErick L. VegaNo ratings yet
- Dialéctica Del Amo y Del EsclavoDocument6 pagesDialéctica Del Amo y Del EsclavoRoberto Cruz Bravo0% (1)
- ELASTICIDADDocument55 pagesELASTICIDADMiguel Bocanegra100% (1)
- Manual de Organización EFPEMDocument148 pagesManual de Organización EFPEMAmerico Xitumul100% (1)
- Informe #3 Mechero y BalanceDocument26 pagesInforme #3 Mechero y BalanceDe Hoyos BrayanNo ratings yet
- 1554810871523Document19 pages1554810871523Cristhian Horna PastorNo ratings yet
- UNIDAD II Estructura Electronica de Los AtomosDocument60 pagesUNIDAD II Estructura Electronica de Los Atomoscarlosdaniel05140% (1)
- Bioquímica en El Sector Productivo y de Servicios Del EntornoDocument1 pageBioquímica en El Sector Productivo y de Servicios Del Entornoeduardo02280No ratings yet
- Temario Biologia UsacDocument45 pagesTemario Biologia UsacPablo HernandezNo ratings yet
- Edoc - Pub - Fis 3ro Sec 2014 PDFDocument240 pagesEdoc - Pub - Fis 3ro Sec 2014 PDFMarcelo PérezNo ratings yet
- Ensayo de Realidad NacionalDocument3 pagesEnsayo de Realidad NacionalAlexander BrionesNo ratings yet
- Reporte de Química Orgánica Práctica 6Document4 pagesReporte de Química Orgánica Práctica 6EDY FERNANDO REYES BETANCOURTHNo ratings yet
- Resumen Campo ElectricoDocument2 pagesResumen Campo ElectricoArmando QuezadaNo ratings yet
- Reglas Del Octeto y Dueto.Document8 pagesReglas Del Octeto y Dueto.EUGENIO VIDAL LOPEZ LOPEZNo ratings yet
- Enlaces Químicos y EstequiometriaDocument16 pagesEnlaces Químicos y EstequiometriaReinaldoGruberNo ratings yet
- Citoquímica e Histoquímica. Inmunohistoquímica y Enzimohistoquímica. Mapa ConceptualDocument1 pageCitoquímica e Histoquímica. Inmunohistoquímica y Enzimohistoquímica. Mapa ConceptualMarilyn Castro BroncaNo ratings yet
- Antecedentes Históricos de La UniversidadDocument5 pagesAntecedentes Históricos de La UniversidadSherry RCNo ratings yet
- Caso Lactancia, MuralDocument9 pagesCaso Lactancia, MuralthelmaNo ratings yet
- Energía Cinética - EjercicioDocument6 pagesEnergía Cinética - EjercicioWilver OvandoNo ratings yet
- U4 CalorimetriaDocument42 pagesU4 CalorimetriaAndres Zárate Ortiz100% (1)
- Cuestionario Previo. Entalpia de Transformación Del AguaDocument3 pagesCuestionario Previo. Entalpia de Transformación Del AguaDiego CárdenasNo ratings yet
- Cambios y Estados de La MateriaDocument5 pagesCambios y Estados de La MateriaAntoJfNo ratings yet
- CONCEPTOS No. 8 "Ley de Hooke"Document7 pagesCONCEPTOS No. 8 "Ley de Hooke"Nick FoxNo ratings yet
- ESTEQUIOMETRIADocument57 pagesESTEQUIOMETRIAlizNo ratings yet
- TareaDocument35 pagesTareaAnonymous iBRwVtHClyNo ratings yet
- Caracterizacion de La Estructura Atómica de La MateriaDocument3 pagesCaracterizacion de La Estructura Atómica de La MateriaMartin BarreraNo ratings yet
- UNIDAD #2 ATOMO MOLECULAS IONES Final EstudiantesDocument38 pagesUNIDAD #2 ATOMO MOLECULAS IONES Final EstudiantesJonxthxnAghxsakxbasNo ratings yet
- HWMonitorDocument6 pagesHWMonitorbrandon_jhordanNo ratings yet
- Síntesis Del BullyngDocument3 pagesSíntesis Del Bullyngbrandon_jhordanNo ratings yet
- Particulas Fundamentales Del AtomoDocument2 pagesParticulas Fundamentales Del Atomobrandon_jhordan50% (2)
- Historia Del ConalepDocument3 pagesHistoria Del Conalepbrandon_jhordanNo ratings yet
- Reporte de Calificaciones Correspondiente Al Primer PeriodoDocument2 pagesReporte de Calificaciones Correspondiente Al Primer Periodobrandon_jhordanNo ratings yet
- Lista de Codigos AsciiDocument1 pageLista de Codigos Asciibrandon_jhordanNo ratings yet
- Terremotos de 1955 (Tampico) y 1985 (México)Document1 pageTerremotos de 1955 (Tampico) y 1985 (México)brandon_jhordanNo ratings yet
- Resumen de Viaje Al Centro de La TierraDocument9 pagesResumen de Viaje Al Centro de La Tierrabrandon_jhordan75% (4)
- Cultura TzeltalDocument4 pagesCultura Tzeltalbrandon_jhordanNo ratings yet
- Cultura OtomiDocument3 pagesCultura Otomibrandon_jhordanNo ratings yet
- Cultura MixtecaDocument2 pagesCultura Mixtecabrandon_jhordanNo ratings yet
- Proyecto de Recursamiento (El Reciclaje)Document9 pagesProyecto de Recursamiento (El Reciclaje)brandon_jhordanNo ratings yet
- Proyecto de Aula - ConsolidadoDocument13 pagesProyecto de Aula - ConsolidadoAlexander YupanguiNo ratings yet
- Tema El AtomoDocument8 pagesTema El AtomoJuan Luis Calizaya LeigueNo ratings yet
- CIENCIASNATDocument19 pagesCIENCIASNATMilagros Peralta RequenaNo ratings yet
- Relación Entre Enlaces Químicos y Las Propiedades de Las SustanciasDocument10 pagesRelación Entre Enlaces Químicos y Las Propiedades de Las SustanciasYarianna CabreraNo ratings yet
- Brennan Trbajo Cta.Document13 pagesBrennan Trbajo Cta.anon_110771258No ratings yet
- TesisDocument28 pagesTesisPAGOS COLEGIO ALTER ALTERIS100% (1)
- Ejercicios Balance de Materia Ingeniería PDFDocument52 pagesEjercicios Balance de Materia Ingeniería PDFCarla Gicela Osina Lizon0% (1)
- Tabla Periodica de Los Elementos QuimicosDocument8 pagesTabla Periodica de Los Elementos QuimicosOdelCharmer CharmerNo ratings yet
- Malla Curricular QuimicaDocument21 pagesMalla Curricular QuimicaTu Muñequito Anthony Calderon100% (1)
- ASIGNATURADocument40 pagesASIGNATURAJohan AmadoNo ratings yet
- Diapositivas para Imprimir de QuimicaDocument13 pagesDiapositivas para Imprimir de Quimicaanon_737972468No ratings yet
- Introducción NomenclaturaDocument6 pagesIntroducción NomenclaturaJorge Yonel Terrones Hernandez100% (3)
- ACT. 3 QuimicaDocument3 pagesACT. 3 QuimicaAlexis EduardoNo ratings yet
- Tarea 1 Investigacion Procesos de Manufactura AutomotrizDocument8 pagesTarea 1 Investigacion Procesos de Manufactura AutomotrizJesus SanchezNo ratings yet
- Elemento QuimicoDocument6 pagesElemento QuimicojezuxxNo ratings yet
- Solucionario Fe U04Document2 pagesSolucionario Fe U04diego pelusaNo ratings yet
- Qui Mica 10 So Lucio NarioDocument138 pagesQui Mica 10 So Lucio NarioAngela Huertas0% (1)
- Metalurgia Cobre, Oro, ZincDocument168 pagesMetalurgia Cobre, Oro, ZincJESUS ELMER SIMON QUILCANo ratings yet
- Guia de Quimica SustanciasDocument3 pagesGuia de Quimica SustanciasKarina Y MaiteNo ratings yet
- Banco de Preguntas QuímicaDocument41 pagesBanco de Preguntas QuímicaLuz María Santiago PonceNo ratings yet
- Cta3 Unidad2 PDFDocument4 pagesCta3 Unidad2 PDFFreddy Vallejo Leon100% (1)
- Alquimia CosmicaDocument19 pagesAlquimia CosmicaAlan Machaca ArocutipaNo ratings yet
- Andres Belloguia Ejercicios Qui 001-2-1Document178 pagesAndres Belloguia Ejercicios Qui 001-2-1numenoNo ratings yet
- Actividad de La Tabla PeriódicaDocument3 pagesActividad de La Tabla PeriódicaEduardo J Romero PNo ratings yet
- Apuntes Física y Química 3º EsoDocument8 pagesApuntes Física y Química 3º EsoLazaro Paez Ruiz100% (1)
- TP Continuidad QUIMICA 3 AÑODocument2 pagesTP Continuidad QUIMICA 3 AÑOGeorgina CarrilloNo ratings yet
- Estructura de La Materia.201102 - 241 Quimica GeneralDocument20 pagesEstructura de La Materia.201102 - 241 Quimica GeneralMerly Julieth Cardona AriasNo ratings yet
- Trabajo 6 Quimica InorDocument20 pagesTrabajo 6 Quimica InorGeorge Chang Kai TongNo ratings yet
- Sistemas Contra Incendios ExposicionDocument25 pagesSistemas Contra Incendios ExposicionJavier LerouxNo ratings yet
- Electrometalurgia FinalDocument12 pagesElectrometalurgia FinalJorge VidalNo ratings yet