Professional Documents
Culture Documents
Trabajo Mapa Conceptual Enlaces Quimicos
Uploaded by
Amyl JensCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Trabajo Mapa Conceptual Enlaces Quimicos
Uploaded by
Amyl JensCopyright:
Available Formats
CORPORACIN UNIVERSITARIA RAFAEL NUEZ
FACULTAD DE CIENCIAS DE LA SALUD ENFERMERA - BIOQUIMICA
PROFESOR: FELIZ BARRIOS
ALUMNO: AMYLKAR CONSUEGRA OVIEDO
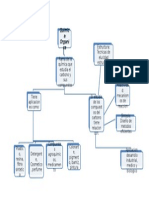
MAPA CONCEPTUAL Concepto rdenes de enlace Propiedades de enlace Polaridad de los enlaces qumicos
CARTAGENA DE INDIAS Octubre 2012
Regla Del Octeto tomo diferente al hidrgeno enlace qumico adquiere, cede o comparte electrones configuracin electrnica del gas noble ms cercano. elementos del segundo periodo
Estructura de Lewis Electrones de valencia (ltimo nivel energtico) sistema de puntos, smbolo del elemento y un punto por cada electrn de valencia.
Formas De Resonancia: misma posicin de los tomos, diferente localizacin enlaces y pares electrnicos solitarios no son ilustraciones reales de enlace.
Hbrido de Resonancia: promedio formas de resonancia, especie molecular, no forma resonante un instante y otra resonante siguiente
La deslocalizacin densidad electrnica distribuye sobre varios tomos en lugar de permanecer entre dos, difunde la densidad electrnica sobre un mayor volumen, Que reduce las repulsiones electrn- electrn y as se estabiliza la molcula. La resonancia es muy comn, y varias molculas con enlace doble seguido de enlace sencillo en sus estructuras de Lewis hbridos
Solapamiento: atraccin de electrones de otro atomo entre s. deformando la nube electrnica de cada uno
hasta que las dos nubes se solapan un enlace un enlace qumico qumico. igualan fuerzas de atraccin y de repulsin . formado
Enlace Covalente : mayor densidad electrnica se encuentra en la mitad de la distancia de los dos ncleos
Carcter Inico diferencia de electronegatividades entre los tomos A y B es muy grande, por lo general mayor a 1 .7 se mantiene covalente pero con menor el carcter intensidad
. Propiedades enlace qumico: la energa de enlace y lo longitud de enlace.
Energa de enlace: equilibrio entre las atracciones ncleo-electrones vecinos y las repulsiones ncleoncleo La ruptura enlace proceso endotrmico (absorbe energa), entalpa positiva. La formacin de enlace proceso exotrmico (libera energa), entalpa es negativo.
Longitud de enlace: distancia entre los ncleos de dos tomos enlazados, la longitud de enlace se relaciona con los radios de los tomos unidos, por Un par de tomos dado, un orden de enlace ms alto produce una longitud de enlace ms corto y uno energa de enlace ms alta
Polaridad de los enlaces y las molculas: enlaces qumicos solapamiento, tomos que interactan son idnticos A - A, la densidad electrnica (solapamiento) misma distancia del ncleo atmico, enlace covalente puro o no polar. Si los tomos que interactan no son idnticos A - B, lo mayor densidad electrnico solapamiento) se hallo hacia el ncleo atmico que presente mayor electronegatividad, formando un enlace polar
Enlace
simple. El hidrgeno (H2) presento enlace qumico simple, que se forma cuando se comparte un y se representa con una lnea (-), para el enlace simple el orden de enlace es uno par de electrones
Orden de enlace qumicos Es el nmero de pares de electrones compartidos entre dos tomos enlazados.
Enlace doble. se comparten pares enlazantes) el orden representa con dos lneas (=).
cuatro electrones de enlace
(dos
es dos
Enlace triple. se comparten seis electrones (tres pares enlazantes), orden de enlace es tres y se representa con tres lneas ( = = par de electrones ) compartidos pertenece solo a uno de los tomos se presenta un enlace qumico coordinado o dativo tomo que aporta el par de electrones se llama donador y el que los recibe receptor o aceptor, en las molculas el donador es el elemento menos electronegativo.
You might also like
- Mapa SemanticoDocument1 pageMapa SemanticoMariané ChávezNo ratings yet
- Mapa Conceptual AdolescenciaDocument1 pageMapa Conceptual AdolescenciaCelesteAvilaArmellinoNo ratings yet
- Mapa Conceptual Higiene Industrial Carmen CardenasDocument1 pageMapa Conceptual Higiene Industrial Carmen CardenasAmyl Jens83% (6)
- Mapa Conceptual Higiene Industrial Carmen CardenasDocument1 pageMapa Conceptual Higiene Industrial Carmen CardenasAmyl Jens40% (5)
- Guía Orgánica I 2020Document67 pagesGuía Orgánica I 2020giuliana0% (1)
- Mapa Conceptual TermodinámicaDocument1 pageMapa Conceptual TermodinámicaJacob CamarenaNo ratings yet
- Cuadros Comparativos de Los Sistemas CirculatorioDocument5 pagesCuadros Comparativos de Los Sistemas CirculatorioLouisiana EspinozaNo ratings yet
- Cuadro ComparativoDocument7 pagesCuadro ComparativoMafe ViverosNo ratings yet
- Mapa Conceptual Del ÁtomoDocument1 pageMapa Conceptual Del ÁtomoJeison Mosquera Mosquera100% (1)
- Cuadro Comparativo Entre Mito y LeyendaDocument4 pagesCuadro Comparativo Entre Mito y LeyendaEugenio La RosaNo ratings yet
- Cuadro Comparativo Sistema Nervioso Simpatico y Parasimpatico 4Document1 pageCuadro Comparativo Sistema Nervioso Simpatico y Parasimpatico 4killjoyNo ratings yet
- Mapa ConceptualDocument2 pagesMapa Conceptualaura perez100% (1)
- Cuadro Comparativos de Los Modelos AtomicosDocument1 pageCuadro Comparativos de Los Modelos AtomicosJuan Cruz EmmaNo ratings yet
- Mapa BullyingDocument1 pageMapa Bullyingjoluot2100% (2)
- Mapas ConceptualesDocument1 pageMapas ConceptualesAdrián ZarateNo ratings yet
- 6 - Mapa ConceptualDocument1 page6 - Mapa ConceptualMERCADO BENZAQUEN JOANNA MICHELLENo ratings yet
- Cuadro Comparativo 20Document8 pagesCuadro Comparativo 20felix nuñezNo ratings yet
- El Petroleo EducarchileDocument2 pagesEl Petroleo EducarchilepamrvNo ratings yet
- Mapas Conceptuales Enlaces QuimicosDocument5 pagesMapas Conceptuales Enlaces QuimicosAnonymous u7auloU7K0% (1)
- Cuadro Sinoptico de HistoriaDocument1 pageCuadro Sinoptico de HistoriaJesus VelardeNo ratings yet
- Metales y No MetalesDocument12 pagesMetales y No MetalesCiber San JuditasNo ratings yet
- Teorías Del Origen Del Universo MAPA CONCEPTUALDocument1 pageTeorías Del Origen Del Universo MAPA CONCEPTUALGrace MirandaNo ratings yet
- La Celula Cuadro SinopticoDocument1 pageLa Celula Cuadro Sinopticobelen arevaloNo ratings yet
- Mapa Conceptual 2Document2 pagesMapa Conceptual 2yhshNo ratings yet
- Biologia Mapa Conceptual NeuronasDocument1 pageBiologia Mapa Conceptual NeuronasNelson Alemán SánchezNo ratings yet
- Cuadro LuisDocument4 pagesCuadro Luisluchbass1980No ratings yet
- El PrincipitoDocument8 pagesEl PrincipitoDafne MaldonadoNo ratings yet
- Cuadro Comparativo Ácidos - BasesDocument1 pageCuadro Comparativo Ácidos - BasesBryan Avila HernandezNo ratings yet
- Mapa Conceptual LenguaDocument5 pagesMapa Conceptual LenguaMarcela Pestana TroaqueroNo ratings yet
- Mapas Conceptuales Unidad 1 (Reacciones Quimicas II)Document2 pagesMapas Conceptuales Unidad 1 (Reacciones Quimicas II)elaprendizerrante100% (3)
- MAPA CONCEPTUAL DE FISICA 1 3 Alfaro CarboniDocument1 pageMAPA CONCEPTUAL DE FISICA 1 3 Alfaro CarboniJosé Daniel Anaya López50% (2)
- Cuadro Comparativo Temas 1 y 2Document2 pagesCuadro Comparativo Temas 1 y 2Marco Rodríguez Jiménez50% (2)
- Cuadro Comparativo Modelos Atomicos.Document3 pagesCuadro Comparativo Modelos Atomicos.Andres CanoNo ratings yet
- Mapa Conceptual Derechos Del Ámbito de La Igualdad 1Document1 pageMapa Conceptual Derechos Del Ámbito de La Igualdad 1davidtapia13No ratings yet
- Mapa Conceptual El SonidoDocument1 pageMapa Conceptual El SonidoYany MuñozNo ratings yet
- Mapa Conceptual RacionalismoDocument1 pageMapa Conceptual RacionalismoMARIAHM NICOOL ALVAREZ GONZALESNo ratings yet
- Mapa ConceptualDocument1 pageMapa ConceptualJOSENo ratings yet
- Mapa Conceptual Sobre ValoresDocument3 pagesMapa Conceptual Sobre ValoresNANDO AGUILANo ratings yet
- Mapa Conceptual 2Document1 pageMapa Conceptual 2Maria Fernanda MeloNo ratings yet
- Mapa Conceptual de La Nutricion 2Document1 pageMapa Conceptual de La Nutricion 2KRYSTIENo ratings yet
- Internet Mapa ConceptualDocument1 pageInternet Mapa ConceptualJorge Martinez67% (3)
- Mapa Conceptual de AsiaDocument3 pagesMapa Conceptual de AsiaCarmen Valera50% (2)
- Mapa Conceptual FisicaDocument6 pagesMapa Conceptual FisicaElías AbregoNo ratings yet
- Lengua y Literatura. Cuento y Novela.Document2 pagesLengua y Literatura. Cuento y Novela.juanNo ratings yet
- Cuadro Comparativo 1 y 2 Guerra MundialDocument3 pagesCuadro Comparativo 1 y 2 Guerra MundialBalmiro Machado SerranoNo ratings yet
- Cuadro Sinoptico AcosoDocument1 pageCuadro Sinoptico AcosoSINDY CRISTHEL HERNANDEZ GARCIA100% (1)
- Hoja de Aplicación Del Sistema LocomotorDocument1 pageHoja de Aplicación Del Sistema LocomotorLesli DiazNo ratings yet
- Mapa ConceptualDocument3 pagesMapa ConceptualManuel F Duran0% (1)
- Mapa Conceptual Química OrgánicaDocument1 pageMapa Conceptual Química OrgánicaSebastian DelgadilloNo ratings yet
- Mapa Conceptual de La Poblacion.Document1 pageMapa Conceptual de La Poblacion.Justin Lewis67% (3)
- Mapa Conceptual AdministracionDocument1 pageMapa Conceptual AdministracionJuan Ignacio RiveraNo ratings yet
- Mapa Conceptual Del AtomoDocument1 pageMapa Conceptual Del AtomoYendi MejiaNo ratings yet
- Mapa Conceptual-Clasificación de La MateriaDocument1 pageMapa Conceptual-Clasificación de La MateriaElmer MontoyaNo ratings yet
- Mapa Conceptual PlantasDocument1 pageMapa Conceptual Plantasangela8507No ratings yet
- Mapa Mental de Sangre PDFDocument2 pagesMapa Mental de Sangre PDFCynthia Duran CastroNo ratings yet
- Mapa Mental y Epistola de Melchor Ocampo (Lo QDocument2 pagesMapa Mental y Epistola de Melchor Ocampo (Lo Qjose100% (1)
- Formato Mapa Conceptual TIPOS de TEXTODocument1 pageFormato Mapa Conceptual TIPOS de TEXTOMayra Alejandra GelvesNo ratings yet
- Cuadro Comparativo.Document2 pagesCuadro Comparativo.Ingrid SanchezNo ratings yet
- Cuadro Comparativo de Modelos AtómicosDocument10 pagesCuadro Comparativo de Modelos AtómicosBaeta Jesus0% (1)
- Mapa Conceptual Mixto Cadena AlimentariaDocument3 pagesMapa Conceptual Mixto Cadena Alimentariaadrianadp69No ratings yet
- Guia Quimica Decimo Periodo 1 Aprendizaje 3Document8 pagesGuia Quimica Decimo Periodo 1 Aprendizaje 3Luis Miguel Lopez EspinosaNo ratings yet
- CuestioDocument7 pagesCuestioMiriam Llanque CallisayaNo ratings yet
- Enlace Químico TeoríaDocument15 pagesEnlace Químico TeoríaDara AguilaNo ratings yet
- Casos Clinicos Sobre VacunacionDocument1 pageCasos Clinicos Sobre VacunacionAmyl JensNo ratings yet
- Diabetes Insipida PDFDocument6 pagesDiabetes Insipida PDFAmyl JensNo ratings yet
- HomeostasisDocument9 pagesHomeostasisAmyl JensNo ratings yet
- Administracion de Los Servicios de EnfermeriaDocument19 pagesAdministracion de Los Servicios de EnfermeriaAmyl JensNo ratings yet
- Homeostasis 1Document28 pagesHomeostasis 1Amyl JensNo ratings yet
- Adulto Mayorrr PDFDocument10 pagesAdulto Mayorrr PDFAmyl JensNo ratings yet
- Trabajo Caracteristicas DESAFIOS EDUACION SIGLO XXI Humberto DoriaDocument4 pagesTrabajo Caracteristicas DESAFIOS EDUACION SIGLO XXI Humberto DoriaAmyl JensNo ratings yet
- Cardiopatia IsquemicaDocument44 pagesCardiopatia IsquemicaAmyl Jens0% (1)
- Reclutamiento y Seleccion Del PersonalDocument21 pagesReclutamiento y Seleccion Del PersonalAmyl JensNo ratings yet
- Cuadro-Comparativo DoriaDocument3 pagesCuadro-Comparativo DoriaAmyl JensNo ratings yet
- 2.SEMIOLOGIA NeurologicaDocument63 pages2.SEMIOLOGIA NeurologicaAmyl JensNo ratings yet
- TRABAJO Medico Quirurgica 2013Document15 pagesTRABAJO Medico Quirurgica 2013Amyl JensNo ratings yet
- Examen FisicoDocument100 pagesExamen FisicoAmyl JensNo ratings yet
- TRABAJO Medico Quirurgica 2013Document15 pagesTRABAJO Medico Quirurgica 2013Amyl JensNo ratings yet
- Lab Quimica Inorganica - Oxido Cobalto JulianDocument31 pagesLab Quimica Inorganica - Oxido Cobalto JulianJulian Ticona ChambiNo ratings yet
- Química Inorgánica Industrial Oxoborato PDFDocument8 pagesQuímica Inorgánica Industrial Oxoborato PDFStiven Martinez GiraldoNo ratings yet
- Fip QuimicaDocument5 pagesFip QuimicaLic Martín Renteria GomezNo ratings yet
- Abastecimiento de AguaDocument21 pagesAbastecimiento de AguaManuelRamírez100% (2)
- Cuestionario T.9y10Document4 pagesCuestionario T.9y10FranNo ratings yet
- Informe de Tecnología de Los MaterialesDocument97 pagesInforme de Tecnología de Los MaterialesNarjax100% (1)
- Manual Flotacion MineralesDocument41 pagesManual Flotacion MineralesMaritssa HuillcaNo ratings yet
- Guia Enlace Quimico UcnDocument64 pagesGuia Enlace Quimico UcnShikifen kkkNo ratings yet
- Enlaces QuìmicosDocument11 pagesEnlaces QuìmicosGladys Alburez0% (1)
- Los Elementos Traza en Los Procesos ÍgneosDocument29 pagesLos Elementos Traza en Los Procesos ÍgneosGuevara C. AngelNo ratings yet
- El Gabinete de Linneo - Biología 2ºbachilleratoDocument216 pagesEl Gabinete de Linneo - Biología 2ºbachilleratoKatell EsponjaNo ratings yet
- Basicidad de Los OxoanionesDocument5 pagesBasicidad de Los OxoanionesJose Manuel RodriguezNo ratings yet
- Silabo de QuimicaDocument8 pagesSilabo de QuimicaRônny Coaqu'iraNo ratings yet
- Compuesto DavidDocument3 pagesCompuesto DavidCélimo Rodriguez HerreraNo ratings yet
- Teoría de LewisDocument5 pagesTeoría de LewisAlex Garcia RabadeNo ratings yet
- Programa Contenidos Promocionales 4to Química IFD 12Document2 pagesPrograma Contenidos Promocionales 4to Química IFD 12Fisicoquímica San MArtínNo ratings yet
- Practica Calificada #7-Enlace QuimicoDocument4 pagesPractica Calificada #7-Enlace QuimicoVictor Anchante100% (5)
- Examen 1Document2 pagesExamen 1NicolásNo ratings yet
- Guias de QuimicaDocument144 pagesGuias de QuimicaIgnacio Arturo Pabón Salom0% (1)
- SimetriaTablas de Caracteres PDFDocument7 pagesSimetriaTablas de Caracteres PDFKaren Dayanna GaitanNo ratings yet
- G4 - Informe #10 Química InorgánicaDocument22 pagesG4 - Informe #10 Química Inorgánicayanina mily ratachi rojasNo ratings yet
- Circuito ElectricoDocument2 pagesCircuito ElectricoDiana Carolina Burbano Ruano0% (2)
- Trabajo de Quimica 2Document5 pagesTrabajo de Quimica 2juan carlos cordoba cabreraNo ratings yet
- Taller de ProteinasDocument10 pagesTaller de ProteinasDaniel Otaku Gomez DominguezNo ratings yet
- I. Introduccion. Geoquim, Estruc, PargenDocument26 pagesI. Introduccion. Geoquim, Estruc, PargenHugo García InostrozaNo ratings yet
- Cuadernillo Quimica I ISADocument74 pagesCuadernillo Quimica I ISAKarim Zgaib100% (1)
- Sesion BioelementosDocument15 pagesSesion BioelementosPatricia28No ratings yet
- Taller 3 2023-2Document4 pagesTaller 3 2023-2Jhennifer Tatiana Meza EscuderoNo ratings yet
- Matemáticas, Cuerpo Humano y Biodiversidad U3S11Document64 pagesMatemáticas, Cuerpo Humano y Biodiversidad U3S11Jesus Martinez PechNo ratings yet