Professional Documents
Culture Documents
Aula 3
Uploaded by
Camila Souza0 ratings0% found this document useful (0 votes)
4 views22 pagesCopyright
© Attribution Non-Commercial (BY-NC)
Available Formats
PDF, TXT or read online from Scribd
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Attribution Non-Commercial (BY-NC)
Available Formats
Download as PDF, TXT or read online from Scribd
0 ratings0% found this document useful (0 votes)
4 views22 pagesAula 3
Uploaded by
Camila SouzaCopyright:
Attribution Non-Commercial (BY-NC)
Available Formats
Download as PDF, TXT or read online from Scribd
You are on page 1of 22
TD Aula 3
Existe uma forma de energia,
conhecida como energia interna
(U), que para fluidos homogneos
existindo em equilbrio no sistema
PVT uma propriedade do material
e uma funo de T,P,z.
Energia Interna
Energia que se refere s molculas internas
substncia;
Energia de rotao, tanslao, vibrao e
potencial das foras intermoleculares;
Chamada interna para diferenciar da cintica
e potencial, que so externas;
Adio de Q ou realizao de W pode
aumentar sua energia interna;
No tem uma definio concisa na TD
Clssica;
No pode ser medida diretamente;
No so conhecidos valores absolutos;
S utilizamos variaes da energia interna.
A energia total de um sistema e sua
vizinhana conservada; energia
pode ser transferida de um sistema
para sua vizinhana de uma forma
para outra, mas a quantidade total
permanece constante
Primeira Lei da TD
Energia pode existir em diferentes
formas. A energia total do sistema (E)
constituda de formas macroscpica e
microscpica. As formas macroscpicas
so aquelas que o sistema possui em
relao a sua vizinhana, tal como
energias cintica (KE) [movimento] e
potencial (PE) [posio].
Macroscpica E = KE + PE
A soma de todas as formas de energias
microscpicas chamada de energia
interna (U) do sistema.
Ela leva em conta os movimentos internos
das molculas que movem com alguma
velocidade (translao), vibram em
relao a outra (vibracional, interao) e
movem em torno de um eixo durante o
movimento randmico (rotao).
Total E = U + KE + PE
Calor (Q) uma palavra que denota
energia em trnsito como o
resultado de um gradiente de
temperatura (Experimento de Joule)
No uma propriedade do sistema
Representa uma quantidade de
energia transferida entre um sistema
e sua vizinhana
Conservao de energia:
Apesar da energia assumir diferentes formas, a quantidade
total de energia constante, e quando uma energia
desaparece em uma forma, ela aparece simultaneamente
em outras formas.
Em outras palavras: Energia no pode ser criada ou
destruda, apenas transformada.
Esta lei se aplica para o sistema e sua vizinhana:
(energia do sistema) + (energia da vizinhana) = 0
(energia do sistema) + (energia da vizinhana) = 0
Esta eq. assume formas prticas.
Para um sistema fechado
(energia da vizinhana) = - Q W
Q e W referem-se para o sistema. Para vizinhana tem
sinal oposto.
(energia do sistema) = Q + W
(energia do sistema) = Q + W
Para sistema fechado, geralmente, s
tem variao da energia interna do
sistema, ento:
(nU) = Q + W
Esta eq pode ser tomada como uma definio explcita de
U; a definio exata no conhecida; o postulado da
existncia de U pode ser testado com esta eq atravs
de experimentos com fluidos homogneos
Experimento
Com 1 mol (ou 1 unidade de massa) de
um fluido homogneo com composio
constante em um equipamento do tipo
pisto-cilindro; T e P so variveis
independentes; variao em T e/ou P
leva adio/remoo de Q, realizao
de W (deslocamento do pisto);
experimento lento, equilbrio interno,
variaes infinitesimais, equilbrio
sistema-vizinhana, processo
reversvel
Observa-se ( Qrev + Wrev )
constante
A observao confirma parcialmente
os postulados
Qrev + Wrev visto como uma
variao de uma propriedade, a U
A restrio de reversvel devido ao
experimento e no aos postulados
Um exame adicional dos dados
experimentais leva para cada
experimento:
Eq. bem conhecida para W
dWrev = - PdV
A variao de V tem uma medida direta
}
= A
2
1
P
dWrev
V
Quando um sistema
levado do estado a
para o estado b ao
longo da trajetria
acb, 100 J de calor
fluem para dentro do
sistema e o sistema
realiza 40 J de
trabalho.
A) Qual a quantidade
de calor que flui para
dentro do sistema ao
longo da trajetria
aeb, se o trabalho
realizado pelo
sistema for de 20 J?
B) O sistema retorna
de b pela trajetria
bda. Se o trabalho
realizado pelo
sistema for de 30 J,
o sistema absorvera
ou liberar calor?
Qual ser a
quantidade?
REGRA DAS FASES
F = C P + 2 F = N t + 2
Qual F para:
A) gua lquida em equilbrio com seu
vapor?
B) gua lquida em equilbrio com uma
mistura de vapor de gua e N2?
C) Uma soluo lquida de lcool etlico
em gua em equilbrio com seu vapor?
REAO QUMICA REVERSVEL
CO2 + CaO CaCO3
Zn + 2HCl H2 + ZnCl2
PROOCESSOS A V E A P cte
Pd(nV) - dQ d(nU)
reversivel nte mecanicame fechado, sistema processo, -Pd(nV) dW
) (
=
=
+ = dW dQ nU d
Da primeira lei da TD
Processos a V e P constantes
FLUIDOS HOMOGNEOS; SISTEMA FECHADO
constante) (pressao H n Q
) (
Pd(nV) nU) ( dQ
constante) (volume U n Q
Pd(nV) - dQ d(nU)
A =
=
+ =
A =
=
nH d dQ
d
Como U e V so funes de estado, H
tambm funo de estado
Capacidade Calorfica
constante) (P
constante) (V
2
1
2
1
T
T
T
T
dT C n Q
dT C n Q
dT
dH
C
dT
dU
C
dT
dQ
C
P
V
P
P
V
V
}
}
=
=
|
.
|
\
|
=
|
.
|
\
|
=
=
Um corpo tem uma
capacidade para o calor;
quanto menor a variao
de T em um corpo causada
pela transferncia de uma
dada quantidade de calor,
maior sua capacidade
Para processo a P
constante,
mecanicamente
reversvel
W=-P(nV)
You might also like
- Livro IAVE FQA 2018 (Aconselhável) PDFDocument350 pagesLivro IAVE FQA 2018 (Aconselhável) PDFMaria100% (7)
- Dentistica 1 Materiais Dentarios CompletoDocument166 pagesDentistica 1 Materiais Dentarios CompletoLucas ThiesenNo ratings yet
- Armadura de Estacas Strauss FlexionadasDocument45 pagesArmadura de Estacas Strauss FlexionadasFranciele SouzaNo ratings yet
- Plano de ManutençãoDocument320 pagesPlano de ManutençãoFrancisco Wilson Bezerra Francisco100% (1)
- Relatório 8 - Movimento Retilíneo Com Aceleração ConstanteDocument13 pagesRelatório 8 - Movimento Retilíneo Com Aceleração ConstanteMarcoStalinNo ratings yet
- Festo - Automacao HidraulicaDocument79 pagesFesto - Automacao HidraulicaCli Santos67% (3)
- Teste 8º D - 1ºDocument4 pagesTeste 8º D - 1ºhugocamilo3109100% (1)
- EB2,3 Avaliação Ciências Naturais 8oDocument4 pagesEB2,3 Avaliação Ciências Naturais 8oDaniel LourençoNo ratings yet
- Termodinâmica emDocument23 pagesTermodinâmica emCamila SouzaNo ratings yet
- Dossie MineraisDocument0 pagesDossie MineraisValeriaNo ratings yet
- Técnico em Segurança No TrabalhoDocument25 pagesTécnico em Segurança No TrabalhoCamila SouzaNo ratings yet
- Doenças fúngicas pós-colheita em frutasDocument16 pagesDoenças fúngicas pós-colheita em frutasSamantha Caixeta de OliveiraNo ratings yet
- Modelo RelatorioDocument2 pagesModelo RelatorioCamila SouzaNo ratings yet
- Gordura Saturada e Insaturada Quase ProntoDocument14 pagesGordura Saturada e Insaturada Quase ProntoCamila SouzaNo ratings yet
- Problemas MSolidos24Document39 pagesProblemas MSolidos24tiagotapadaNo ratings yet
- Criptografia Quântica: Uma Nova Forma de Transmitir Informações SecretasDocument10 pagesCriptografia Quântica: Uma Nova Forma de Transmitir Informações Secretasjose teixeiraNo ratings yet
- Cálculo pressão absoluta instalação hidráulicaDocument4 pagesCálculo pressão absoluta instalação hidráulicaGraziele PeresNo ratings yet
- Física Atômica Pós-GraduaçãoDocument181 pagesFísica Atômica Pós-GraduaçãoGabriel Nunes da SilvaNo ratings yet
- Física I - Cinemática de Um Ponto MaterialDocument3 pagesFísica I - Cinemática de Um Ponto MaterialFrancisco Júlio ComéNo ratings yet
- Apostila de Física FENÔMENOS ONDULATÓRIOSDocument4 pagesApostila de Física FENÔMENOS ONDULATÓRIOSRoseberg Pereira de Sousa100% (1)
- Lista 1 - Estrutura Cristalina + Propriedades MecânicasDocument5 pagesLista 1 - Estrutura Cristalina + Propriedades MecânicasJuninho AlvesNo ratings yet
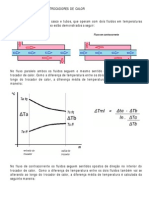
- Cálculo da troca térmica em trocadores de calorDocument6 pagesCálculo da troca térmica em trocadores de calorPriscila KatzerNo ratings yet
- Dilatação Do Tempo, Referenciais Acelerados e o Paradoxo Dos Gêmeos PDFDocument14 pagesDilatação Do Tempo, Referenciais Acelerados e o Paradoxo Dos Gêmeos PDFmatth cedoNo ratings yet
- Pacote Mini Simulados Fisica Eduardo StelleDocument114 pagesPacote Mini Simulados Fisica Eduardo Stellematheusoliveira321No ratings yet
- Primeira lista de exercícios de conformação mecânicaDocument5 pagesPrimeira lista de exercícios de conformação mecânicaRobertodeOLiveiraNo ratings yet
- Teste de Reprodutibilidade e Linearidade da Taxa de Kerma no ArDocument3 pagesTeste de Reprodutibilidade e Linearidade da Taxa de Kerma no ArVicenteLaurencio0% (1)
- 6 17 2021 13 45 Prova Paralelo Bimensal 1 em 2 Bi 2021 2Document4 pages6 17 2021 13 45 Prova Paralelo Bimensal 1 em 2 Bi 2021 2Julia Rodrigues Correia FernandesNo ratings yet
- Diagrama de MohrDocument8 pagesDiagrama de MohrNeldes McNo ratings yet
- Sistemas mecânicos rotativosDocument30 pagesSistemas mecânicos rotativosLuiz Filipe SantosNo ratings yet
- Liquefação de rejeitos de mineração: Teoria dos estados críticos e método de OlsonDocument56 pagesLiquefação de rejeitos de mineração: Teoria dos estados críticos e método de OlsonLuiz EduardoNo ratings yet
- 2021 03 23T15 50 04 717418 Lista - EstaticaDocument22 pages2021 03 23T15 50 04 717418 Lista - EstaticaJoão Vítor QueirozNo ratings yet
- Resistência dos materiais: introduçãoDocument57 pagesResistência dos materiais: introduçãoJhonata SabinoNo ratings yet
- Lista Exercícios Sistema de ForçasDocument7 pagesLista Exercícios Sistema de ForçasRaquel Gomes CruzNo ratings yet
- Apontamento - Estudo Dos Fluidos - F. AplicadaDocument43 pagesApontamento - Estudo Dos Fluidos - F. AplicadaJaime ChogaNo ratings yet
- Termometro A GasDocument15 pagesTermometro A GasDébora AlvesNo ratings yet
- 10ano - Capacidade Termica MassicaDocument6 pages10ano - Capacidade Termica MassicaViviNo ratings yet