Professional Documents
Culture Documents
Modelos Atómicos A Traves Del Tiempo
Uploaded by
matiaskbOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Modelos Atómicos A Traves Del Tiempo
Uploaded by
matiaskbCopyright:
Available Formats
QUIMICA I COMISION I
BONELLI, Matas GIAILEVRA, Franco
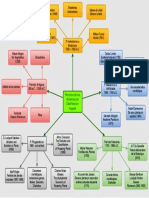
MODELOS ATMICOS A TRAVES DEL TIEMPO Aproximadamente. 400 A.C.: DEMCTRITO Y LEUCIPO Ambos presentaron el atomismo, es decir, la materia no era continua y llegaramos a un punto donde no se puede separar ms: el tomo (que significa indivisible). Demcrito era cotidiano a Aristteles y por prestigio se eligi la teora de Aristteles, as que Demcrito y con el su teora desapareci. Aproximadamente 360 A.C.: ARISTTELES Segn l la materia estaba constituida por cuatro elementos: fuego, aire, tierra y agua en un crculo sin principio ni fin y relacionados entre s mediante:
Transcurre un largo perodo en la historia de la Qumica, la Alquimia, donde la preocupacin primordial es tratar de convertir los metales conocidos en oro.
1794: JOHN DALTON: Formul la teora del daltonismo basada en cuatro postulados: o Los elementos estn formados por partculas bsicas: los tomos. o Los tomos de distintos elementos son distintos en propiedad y masa. o La combinacin de distintos elementos para dar molculas tienen que ser fijas. o Cuando dos o ms clases de tomos se mezclan lo hacen en proporciones sencillas. 1874: GEORGE JOHNSTONE STONEY: Estableci la hiptesis segn la cual la electricidad era creada por unos corpsculos elementales que llam electrones, cuya carga intent calcular. 1886: SEUGEN GOLSTEIN: Realiz la misma experiencia que Thomson pero con el ctodo perforado y observ que se producen los rayos catdicos pero hacia la parte de atrs del ctodo aparece una radiacin, llamados: rayos canales. Esto le hizo pensar en la existencia de otras partculas con carga positiva llamadas protones. 1897: JOSEPH JOHN THOMPSON Realiza una serie de experimentos y descubre el electrn. En tubos de gases a baja presin en los que se establece una diferencia de potencial superior a 10.000 voltios, se comprob que aparecan partculas con carga elctrica negativa a las que se llam electrones, y demostr que haban sido arrancados de los tomos (los cuales eran neutros). Tal descubrimiento modific el modelo
QUIMICA I COMISION I
BONELLI, Matas GIAILEVRA, Franco
atmico de Dalton, que lo consideraba indivisible. Thompson supuso el tomo como una esfera homognea e indivisible cargada positivamente en la que se encuentran incrustados los electrones. A este modelo le llam modelo de budn de pasas, 1909: ROBERT ANDREWS MILLIKAN Tras el experimento de la gota de aceite descubri la carga del electrn= 1.602 x 10-19 Columbios. 1911: ERNEST RUTHERFORD
Realiz una serie de experimentos. Hizo incidir sobre una lmina finsima de oro un delgado haz de partculas cargadas positivamente de masa mucho mayor que el electrn y dotadas de energa cintica alta. En el choque observ distintos comportamientos: o La mayora atravesaban la lmina sin desviarse o Algunas se desviaban o Muy pocas retrocedan Conclusiones: o Su modelo se bas en un modelo fsico y no energtico. o El tomo estara formado por una corteza ms un ncleo. o El ncleo sera positivo, muy pequeo y compacto: 10.000 veces ms pequeo que el tomo, y estara contenida la masa del tomo. o La corteza seran los electrones cargados negativamente y girando en rbitas alrededor del ncleo. Fallos o No tiene en cuenta el neutrn: segn Rutherford la masa del ncleo tiene que ser igual a la de los protones pero esto no es as puesto que en el ncleo existen las llamadas partculas subatmicas. o No tiene en cuenta los espectros. o El electrn pierde energa y esto hace que pierda velocidad. Esto hace que salte hacia dentro y que pierda energa que se recoge en los anteriores espectros. Esto lo demuestra la estabilidad de la materia: menor energa, mayor estabilidad. 1913: NIELS BOHR Se bas en el tomo de hidrgeno para realizar el modelo que lleva su nombre. Bohr intentaba realizar un modelo atmico capaz de explicar la estabilidad de la materia y los espectros de emisin y absorcin discretos que se observan en los gases. Describi el tomo de hidrgeno con un protn en el ncleo, y girando a su alrededor un electrn. El modelo atmico de Bohr parta conceptualmente del modelo atmico de Rutherford y de las incipientes ideas sobre cuantizacin que haban surgido unos aos antes con las investigaciones de Max Planck y Albert Einstein. Debido a su simplicidad el modelo de Bohr es todava utilizado frecuentemente como una simplificacin de la estructura de la materia.
QUIMICA I COMISION I
BONELLI, Matas GIAILEVRA, Franco
En este modelo los electrones giran en rbitas circulares alrededor del ncleo, ocupando la rbita de menor energa posible, o la rbita ms cercana posible al ncleo. Desarroll su clebre modelo atmico de acuerdo a cuatro postulados fundamentales: Los electrones orbitan el tomo en niveles discretos y cuantizados de energa, es decir, no todas las rbitas estn permitidas, tan slo un nmero finito de stas. Los electrones pueden saltar de un nivel electrnico a otro sin pasar por estados intermedios. El salto de un electrn de un nivel cuntico a otro implica la emisin o absorcin de un nico cuanto de luz (fotn) cuya energa corresponde a la diferencia de energa entre ambas rbitas. Las rbitas permitidas tienen valores discretos o cuantizados del momento angular orbital L de acuerdo con la siguiente ecuacin: Donde n = 1,2,3, es el cuntico principal. nmero cuntico angular o nmero
1916: ARNOLD SOMMERFELD Perfeccion el modelo atmico de Bohr intentando paliar los dos principales defectos de ste. Para eso introdujo dos modificaciones bsicas: rbitas cuasi-elpticas para los electrones y velocidades relativistas. En el modelo de Bohr los electrones slo giraban en rbitas circulares. La excentricidad de la rbita dio lugar a un nuevo nmero cuntico: el nmero cuntico azimutal, que determina la forma de los orbitales, se lo representa con la letra l y toma valores que van desde 0 hasta n-1. Las rbitas con: l = 0 se denominaran posteriormente orbitales s o sharp l = 1 se denominaran 2 p o principal. l = 2 se denominaran d o diffuse. l = 3 se denominaran f o fundamental. Para hacer coincidir las frecuencias calculadas con las experimentales, Sommerfeld postul que el ncleo del tomo no permanece inmvil, sino que tanto el ncleo como el electrn se mueven alrededor del centro de masas del sistema, que estar situado muy prximo al ncleo al tener este una masa varios miles de veces superior a la masa del electrn. 1916: ERWIN RUDOLF JOSEF ALEXANDER SCHRDINGER El modelo de Bohr funcionaba muy bien para el tomo de hidrgeno. En los espectros realizados para otros tomos se observaba que electrones de un mismo nivel energtico tenan energas ligeramente diferentes. Esto no tena explicacin en el modelo de Bohr, y sugera que se necesitaba alguna correccin. La propuesta fue que dentro de un mismo nivel energtico existan subniveles. La forma concreta en que surgieron de manera natural estos subniveles, fue incorporando rbitas elpticas y correcciones relativistas. As, en 1916, Arnold Sommerfeld modific el modelo atmico de Bohr, en el cual los electrones slo giraban en rbitas circulares, al decir que tambin podan girar en rbitas elpticas ms complejas 1925 1927: ERWIN SCHRDINGER- WERNER KARL HEISENBERG Es el modelo cuntico actual, denominado modelo mecanocuntico o modelo orbital. En ste, las orbitas de los electrones del modelo de BohrSommerfeld son sustituidas por los orbitales, regiones del espacio donde hay una gran probabilidad de encontrar a un electrn. En el primer subnivel (s) slo hay un orbital; en el segundo subnivel (p) hay tres orbitales; en el tercer subnivel (d) hay cinco orbitales y en el cuarto subnivel (f) hay siete orbitales. En cada orbital puede haber como mximo dos electrones.
QUIMICA I COMISION I
BONELLI, Matas GIAILEVRA, Franco
1932: JAMES CHADWICK Interpret correctamente los resultados de los experimentos realizados en aquella poca por los fsicos franceses Irne y Frdric Joliot-Curie y otros cientficos. Los Joliot-Curie haban producido un tipo de radiacin anteriormente desconocida mediante la interaccin de partculas alfa con ncleos de berilio. Cuando esta radiacin se haca pasar a travs de una capa de parafina, las colisiones entre la radiacin y los tomos de hidrgeno de la parafina producan protones fcilmente detectables. Chadwick se dio cuenta de que la radiacin estaba formada por neutrones. 1963: QUARKS Una de las seis partculas que, segn se cree, son los constituyentes bsicos de las partculas elementales llamadas hadrones, como el protn, el neutrn o el pin. El concepto de quark fue propuesto independientemente en 1963 por los fsicos estadounidenses Murray Gell-Mann y George Zweig (el trmino quark se tom de la obra Finnegans Wake del escritor irlands James Joyce). Al principio se pens que existan tres tipos de quark: up, down y strange. Se cree, por ejemplo, que el protn est formado por dos quarks up y dos quarks down. Ms tarde, los tericos postularon la existencia de un cuarto quark; en 1974 se confirm experimentalmente la existencia de este quark, denominado charm. Posteriormente se plante la hiptesis de un quinto y sexto quark denominados respectivamente bottom y top por razones tericas de simetra. En 1977 se obtuvieron pruebas experimentales de la existencia del quark bottom, pero el quark top no fue hallado por los investigadores hasta abril de 1994, cuando los fsicos del Fermi National Accelerator Laboratory (Fermilab), en Estados Unidos, anunciaron que haban encontrado pruebas experimentales de su existencia. Cada tipo de quark tiene su antipartcula correspondiente, y hay tres clases o colores diferentes dentro de cada quark o antiquark. Los quarks pueden ser rojos, azules o verdes, mientras que los antiquarks pueden ser antirrojos, antiazules o antiverdes. Los colores de los quarks y antiquarks no tienen nada que ver con los colores que distingue el ojo humano, sino que representan una propiedad cuntica. Cuando se combinan para formar hadrones, los quarks y antiquarks slo pueden existir en determinadas agrupaciones de colores. El portador hipottico de la fuerza entre quarks se denomina glun.
You might also like
- La Reforma y El Cisma ReligiosoDocument8 pagesLa Reforma y El Cisma ReligiosoMarita Boy ValdezNo ratings yet
- Canción Del Buen TratoDocument1 pageCanción Del Buen TratoCarla Cancino100% (1)
- Latidos Que No DijeDocument12 pagesLatidos Que No DijeIris Gisela Resendiz MéndezNo ratings yet
- Método CientíficoDocument8 pagesMétodo CientíficoJUAN DAVID HUAYANAY SANTOSNo ratings yet
- Mapa Conceptual de La Edad Media Y FUNCIONES DEL LENGUAJEDocument2 pagesMapa Conceptual de La Edad Media Y FUNCIONES DEL LENGUAJEMarina MuñozNo ratings yet
- FICHAS DE SEMANA 2 VI UNIDAD CCSS 5TO DE SEC El Regreso de Democracia en LatinoaméricaDocument6 pagesFICHAS DE SEMANA 2 VI UNIDAD CCSS 5TO DE SEC El Regreso de Democracia en LatinoaméricaDavid Arana TorresNo ratings yet
- Semana 17 Matematica Del Blog (Medidas de Tendencia Central en Datos No Agrupados) - Rodrigo Olivares Vino-3ADocument2 pagesSemana 17 Matematica Del Blog (Medidas de Tendencia Central en Datos No Agrupados) - Rodrigo Olivares Vino-3Aola100% (1)
- RADIACIÃ"N DEL CUERPO NEGRO Lab 3Document13 pagesRADIACIÃ"N DEL CUERPO NEGRO Lab 3YosidJoseOñateCanovaNo ratings yet
- 2el Anhidrido CarbónicoDocument9 pages2el Anhidrido CarbónicoKleberth Aldo CamposNo ratings yet
- Leng T3Document34 pagesLeng T3Anonymous 7za15o050% (2)
- El CorazónDocument9 pagesEl CorazónJuan Manuel Rodriguez PiñerosNo ratings yet
- Qué Es La BiologíaDocument3 pagesQué Es La Biologíalabcompu100% (2)
- Barbarismosprosdicos 140116140208 Phpapp02Document8 pagesBarbarismosprosdicos 140116140208 Phpapp02pilcheritoNo ratings yet
- Teorìa Del Universo PulsanteDocument2 pagesTeorìa Del Universo PulsanteGustavo AlmendaresNo ratings yet
- Semana 1 - Semántica, EtimologíaDocument17 pagesSemana 1 - Semántica, Etimologíaalanwolk2000No ratings yet
- Postulados de EuclidesDocument4 pagesPostulados de EuclidesEsthela MezaNo ratings yet
- Nervios de La Cavidad TorácicaDocument6 pagesNervios de La Cavidad TorácicaPamela CruzNo ratings yet
- Reacción Endotérmica y Exotérmica Vela 1Document4 pagesReacción Endotérmica y Exotérmica Vela 1Maicol FlorezNo ratings yet
- TAREA No EstasticaDocument4 pagesTAREA No EstasticaAlexander LimonesNo ratings yet
- Mapa ConceptualDocument3 pagesMapa ConceptualBruno Marsilli SpinelliNo ratings yet
- Cuadrilateros 2 163414651Document10 pagesCuadrilateros 2 163414651CuentaSCRIBDDNo ratings yet
- Diapositivas PitagorasDocument13 pagesDiapositivas PitagorasarelysNo ratings yet
- Períodos BotánicosDocument1 pagePeríodos BotánicosC AndresNo ratings yet
- Historia Del Peru Primer Año de Secundaria Falta Segundo BimestreDocument66 pagesHistoria Del Peru Primer Año de Secundaria Falta Segundo BimestreRonald MamaniNo ratings yet
- EBA 4to. Avanzado-prueba-DPC-Cuadernillo 2Document21 pagesEBA 4to. Avanzado-prueba-DPC-Cuadernillo 2Nelson L. Blacido AparicioNo ratings yet
- Estereotipos Sociales, MonografiaDocument23 pagesEstereotipos Sociales, MonografiaheinrichvoNo ratings yet
- Biografia de Carlos LinneoDocument2 pagesBiografia de Carlos Linneonancy guzmanNo ratings yet
- Principios Básicos de La GeografíaDocument7 pagesPrincipios Básicos de La GeografíavictorraulNo ratings yet
- Ríos de HuancayoDocument2 pagesRíos de HuancayoDerico Martinez RamirezNo ratings yet
- Fundamentos Del BaloncestoDocument2 pagesFundamentos Del BaloncestoSolibanNo ratings yet
- Quimica Moderna 10-2Document2 pagesQuimica Moderna 10-2Jose Luis Ayala MolinaNo ratings yet
- Replicacion Del AdnDocument14 pagesReplicacion Del AdnCristian ViloriaNo ratings yet
- 50 Oraciones Pasivas PerifrásticasDocument4 pages50 Oraciones Pasivas PerifrásticasLou GuerreroNo ratings yet
- Diapositivas PitagorasDocument13 pagesDiapositivas PitagorasarelysNo ratings yet
- La Importancia de La Fuerza en El EntrenamientoDocument34 pagesLa Importancia de La Fuerza en El EntrenamientoFederico CapriccioniNo ratings yet
- Sinónimos y Antónimos UcsmDocument5 pagesSinónimos y Antónimos UcsmLuigiBrosNo ratings yet
- Cuadernillo 20210129 105504XZI2 FusionadoDocument42 pagesCuadernillo 20210129 105504XZI2 Fusionadoyubert saurius100% (1)
- Discurso Sobre Amor PropioDocument2 pagesDiscurso Sobre Amor PropioAlejandra Monterroza100% (1)
- Unidad 3 Astronomía en La Época Colonial - David Felipe BarrosDocument15 pagesUnidad 3 Astronomía en La Época Colonial - David Felipe BarrosDiego A. Bernal B.No ratings yet
- Razonamiento Verbal - Marco TeoricoDocument55 pagesRazonamiento Verbal - Marco TeoricoChristianMasnaFloresNo ratings yet
- Fórmulas Del Volumen de Las Figuras GeométricaDocument5 pagesFórmulas Del Volumen de Las Figuras GeométricaMario EstradaNo ratings yet
- La Geometria-IntroDocument3 pagesLa Geometria-IntroPaula Pacheco PaleroNo ratings yet
- Ejercicios de VocalizacionDocument1 pageEjercicios de VocalizacionJonyfer FloresNo ratings yet
- El TerremotoDocument2 pagesEl TerremotoEleonora Pajuelo MelladoNo ratings yet
- Problemas Con Fracciones para Cuarto de SecundariaDocument5 pagesProblemas Con Fracciones para Cuarto de SecundariaClase UMSSNo ratings yet
- II BIM - 1ero. - RV - Guía 5 - Terminos ExcluidosDocument4 pagesII BIM - 1ero. - RV - Guía 5 - Terminos ExcluidosDiego Alegria Felices100% (2)
- Descomposicion de Alimentos-Metodo CientificoDocument9 pagesDescomposicion de Alimentos-Metodo CientificoLuis Lauro Escalante Maldonado100% (1)
- Situaciones de Emergencia y Prevencion de AccidentesDocument2 pagesSituaciones de Emergencia y Prevencion de AccidentesMARIN ZAMUDIO ULISESNo ratings yet
- Cuy ChactadoDocument2 pagesCuy ChactadoDylan Fabrizio SierraNo ratings yet
- Habilidad Verbal Planea 2016Document40 pagesHabilidad Verbal Planea 2016Roly Ortega MarcatomaNo ratings yet
- BREVE RESEÑA HISTORICA DE LA I.E Tnte. DIEGO FERRÉ SOSADocument2 pagesBREVE RESEÑA HISTORICA DE LA I.E Tnte. DIEGO FERRÉ SOSADios ES LoveNo ratings yet
- Diapositivas de Sistema ReproductorDocument78 pagesDiapositivas de Sistema ReproductorDante Díaz75% (4)
- Cuestionario de La Homeostasis de La TemperaturaDocument8 pagesCuestionario de La Homeostasis de La TemperaturaEsmeralda DMNo ratings yet
- Enunciado, Proposición, Enunciado Abierto y Proposición Simple y Compuesto.Document8 pagesEnunciado, Proposición, Enunciado Abierto y Proposición Simple y Compuesto.Shantal Moreno EscobarNo ratings yet
- Historia de La TermometriaDocument15 pagesHistoria de La Termometriamrmonzonm0% (1)
- Tabla Periódica EvoluciónDocument31 pagesTabla Periódica Evoluciónana palenciaNo ratings yet
- Breve Historia Del Modelo AtómicoDocument8 pagesBreve Historia Del Modelo AtómicoJavier Zúñiga100% (1)
- Evolucion Del Modelo AtomicoDocument4 pagesEvolucion Del Modelo Atomicojohnlovecraft100% (3)
- Linea Del Tiempo AtomoDocument8 pagesLinea Del Tiempo AtomoLESLY MICHEL MORALES GARCIANo ratings yet
- Historia de Los Modelos AtomicosDocument3 pagesHistoria de Los Modelos AtomicosLorenaNo ratings yet
- PartículaDocument4 pagesPartículaAlexanderPilataxiNo ratings yet
- Estructura Atomica para Quinto de SecundariaDocument6 pagesEstructura Atomica para Quinto de SecundariaMiguel Jhair Bernilla VilchezNo ratings yet
- FQ3.CAP 1.activadosDocument18 pagesFQ3.CAP 1.activadosCarola JamesNo ratings yet
- Evideon El Universo Creado EsDocument45 pagesEvideon El Universo Creado EsOmniColore100% (1)
- Investigación y Ciencia 358 - Julio 2006 PDFDocument99 pagesInvestigación y Ciencia 358 - Julio 2006 PDFNabor Gallo100% (1)
- 02 - Teoria Atomica - CepreDocument6 pages02 - Teoria Atomica - Ceprerenejusto13No ratings yet
- Estructura de LewisDocument22 pagesEstructura de LewisErick David0% (1)
- Berkeley Physics Course Vol 2 Electricidad y Magnetismo (Purcell) - TextDocument492 pagesBerkeley Physics Course Vol 2 Electricidad y Magnetismo (Purcell) - TextO que será que eu coloco aqui?No ratings yet
- Fuerza Nuclear FuerteDocument7 pagesFuerza Nuclear FuerteStaicy LuceroNo ratings yet
- Resumen de GeoquimicaDocument43 pagesResumen de GeoquimicaClaudia Viviana Avila VeraNo ratings yet
- Particulas Constituyentes Del AtomoDocument6 pagesParticulas Constituyentes Del AtomoWENDY FLORES LoPEZNo ratings yet
- El Self y Sus Pluralidades PDFDocument11 pagesEl Self y Sus Pluralidades PDFAngy Valencia100% (1)
- Giribet Cuerdas y Supercuerdas LibroDocument81 pagesGiribet Cuerdas y Supercuerdas LibroDolores Loaldi100% (1)
- MK24-1 Los Mensajeros de Las FuerzasDocument357 pagesMK24-1 Los Mensajeros de Las FuerzasManuel Susarte RogelNo ratings yet
- DcasdDocument2 pagesDcasdtito floresNo ratings yet
- Tarea de Quimica UPSEDocument2 pagesTarea de Quimica UPSEOswaldo Jose Quimi CruzNo ratings yet
- Unidad 01 - Química Materia y ÁtomoDocument9 pagesUnidad 01 - Química Materia y ÁtomoIsmael Cabello CarrilloNo ratings yet
- Particulas ElementalesDocument18 pagesParticulas ElementalesCarlos AndresNo ratings yet
- Preguntas Teoricas y Redaccion 22Document19 pagesPreguntas Teoricas y Redaccion 22paquitovb325No ratings yet
- Alvaro de RujulaDocument6 pagesAlvaro de RujulaMenteMasterNo ratings yet
- Cuadernillo de DatosDocument18 pagesCuadernillo de DatosMaría José López ThienelNo ratings yet
- QuarksDocument8 pagesQuarksCoordinador de Matematicas - UECBANo ratings yet
- M-15 La Naturaleza de Las Cosas, Manuel SusarteDocument191 pagesM-15 La Naturaleza de Las Cosas, Manuel SusarteManuel Susarte RogelNo ratings yet
- Cta5-U9-Sesion 01Document11 pagesCta5-U9-Sesion 01janNo ratings yet
- 2 - Átomo - Teoría CuánticaDocument32 pages2 - Átomo - Teoría Cuánticamadyuridramos25No ratings yet
- HilemorfismoDocument7 pagesHilemorfismoemanuel valenciaNo ratings yet
- PAG. 365 Ejercicios Del 13 Al 23Document30 pagesPAG. 365 Ejercicios Del 13 Al 23Maria José PenasNo ratings yet
- Origen de La Teoría AtómicaDocument15 pagesOrigen de La Teoría AtómicaJaime ChaconNo ratings yet
- El Mesón PiDocument4 pagesEl Mesón PidanteNo ratings yet
- 02 Atomo-Practica PDFDocument6 pages02 Atomo-Practica PDFErick Mamani ZuñigaNo ratings yet