Professional Documents
Culture Documents
Informe Lab1 Corrosion
Uploaded by
Jose David AparicioOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Informe Lab1 Corrosion
Uploaded by
Jose David AparicioCopyright:
Available Formats
LOCALIZACIN DE ZONAS ANDICAS Y CATDICAS
EDISSON AYALA TORRES; JOS DAVID APARICIO; SUSAN VILLAMIZAR; LADY VIVIANA PINZN. Escuela De Ingeniera Qumica. Universidad Industrial De Santander
OBJETIVOS Observar el fenmeno de corrosin a travs de la aparicin de zonas andicas y catdicas en diferentes tipos de metales. Afianzar los conceptos de corrosin, ctodo, nodo y par galvnico. Analizar las reacciones de oxido-reduccin presentes en cada uno de los casos estudiados en el laboratorio.
Resumen: Durante el desarrollo de la prctica se determino visualmente las zonas andicas y catdicas en materiales metlicos como el Zinc, Hierro, puntillas de Acero y cobre. Utilizando lminas y celdas de concentracin, las cuales presentaban metales diferentes unidos por un remache y pares galvnicos, los cuales se encontraban conectados por un cable elctrico. El electrolito usado fue un gel en solucin agar-agar al 3% NaCl con presencia de fenolftalena (como indicador) y ferricianuro de Potasio para observar la aparicin de zonas andicas cuando presentaran un color azul y zonas catdicas un color rojizo. Abstract: During the course of our practical activity, the anodic and catodic zones were determined in metallic materials such as Zinc, Iron, steel and copper nails. This was accomplished by using concentration cells and sheets which shown different materials bond by a rivet and galvanic pairs which, in turn, were linked by an electric wire. The electrolite used was a gel in an agar-agar solution at 3% concentration of NaCl with the presence of phenolphthalein (as the indicator) and ferrocyanide of potasium to observe the existence of anodic zones when presenting a blue color and catodic zones when presenting a red color
Palabras claves: corrosin, nodo, ctodo, celda de concentracin, electrolito, par galvnico, indicadores. INTRODUCCION La corrosin es un fenmeno espontneo que se presenta prcticamente en todos los materiales procesados por el hombre. Esta se lleva a cabo mediante un proceso electroqumico en el cual un material (habitualmente un metal) reacciona con el medio ambiente para formar oxido o algn otro compuesto. Para que se forme una celda electroqumica, o celda de corrosin, se requiere la presencia de un material que cede electrones en contacto con otro que los acepta, y de un medio conductor de iones. El material que pierde electrones se conoce como nodo y es el que experimenta la reaccin de oxidacin, mientras que el material que acepta los electrones se reduce y se Le llama ctodo; el medio en el que se encuentran el
nodo y el ctodo y que permite el flujo de iones se conoce como electrolito. MATERIALES Y EQUIPOS Solucin agar-agar al 3% de NaCl Solucin de Ferricianuro de Potasio al 5% Solucin de fenolftalena Puntillas de acero recubiertas y con la cabeza deformada Laminas de Zinc, Acero y Cobre Cable elctrico Vidrios de reloj Agitador Vaso de precipitado Plancha de calentamiento Balanza Esptula Micro pipeta
METODOLOGIA 1. Todos los materiales metlicos fueron lijados para retirar impurezas de prcticas anteriores. 2. Sobre una plancha de calentamiento se calent un vaso de precipitado en el que se preparo una solucin compuesta por: 500 ml de agua, 25 gramos de NaCl, 9.8 ml de ferrocianuro de potasio(al 5%) y 2 ml de fenolftalena, se agitando la solucin hasta obtener una fase homognea. 3. De esta solucin se extrajo una pequea cantidad, la cual se deposito en un disco y una lmina de acero. 4. A la solucin restante se le agrego 6.8 gramos de agar-agar y con agitacin constante se procedi a calentar. 5. Luego la solucin se verti en 4 vidrios de reloj, dejndose enfriar hasta la solidificacin superficial. en estos se pusieron diferentes clases de metales (laminas de Cu, Fe y Zn) y de dejo actuar por unos minutos para observar los cambios de coloracin.
Imgenes materiales
MARCO TEORICO La corrosin se ha definido como la destruccin de un metal por reaccin qumica o electroqumica en un ambiente agresivo, en este fenmeno uno de los materiales busca alcanzar su forma ms estable, es decir, su estado de menor energa. Se puede clasificar de la siguiente manera: Corrosin qumica: Se disuelve un material en un medio lquido corrosivo y se contina disolviendo hasta que se consuma totalmente o se sature el lquido. Corrosin electroqumica: Se basa en la circulacin de electrones entre zonas de diferente potencial, debe estar en contacto con el medio conductor. En este caso tenemos la corrosin galvnica. La corrosin ocurre en muchas y muy variadas formas, pero su clasificacin generalmente se basa en uno de los tres siguientes factores: 1.- Naturaleza de la substancia corrosiva. La corrosin puede ser clasificada como hmeda o seca, para la primera se requiere un lquido o humedad mientras que para la segunda, las reacciones se desarrollan con gases a alta temperatura. 2.- Mecanismo de corrosin. Este comprende las reacciones electroqumicas o bien, las reacciones qumicas. 3.- Apariencia del metal corrodo. La corrosin puede ser uniforme y entonces el metal se corroe a la misma velocidad en toda su superficie, o bien, puede ser localizada, en cuyo caso solamente resultan afectadas reas pequeas.
La clasificacin por apariencia, uniforme o localizada, es muy til para una discusin preliminar que en caso de requerirse en forma ms completa, necesita del establecimiento de las diferencias entre la corrosin localizada de tipo macroscpico y el ataque microscpico local. PARES GALVANICOS La corrosin galvnica se presenta, cuando dos metales diferentes en contacto o conectados por medio de un conductor elctrico, son expuestos a una solucin conductora. En este caso, existe una diferencia en potencial elctrico entre los metales diferentes y sirve como fuerza directriz para el paso de la corriente elctrica a travs del agente corrosivo, de tal forma que el flujo de corriente corroe uno de los metales del par formado. Mientras ms grande es la diferencia de potencial entre los metales, mayor es la probabilidad de que se presente la corrosin galvnica debindose notar que este tipo de corrosin slo causa deterioro en uno de los metales, mientras que el otro metal del par casi no sufre dao. En general, se llama par galvnico al formado por dos metales distintos, que al contacto con un electrolito, tienen una diferencia de potencial, por lo que se forma una pila galvnica en la que el nodo se corroe mientras que el ctodo no sufre ninguna corrosin. Corrosin Galvnica Es una de las formas ms comunes de corrosin que se encuentran en instalaciones de la industria petrolera y en general de transporte de fluidos, esto se debe a que los dispositivos de transporte integran una
variada cantidad de aditamentos, mismos que estn fabricados de distintos materiales que entran en contacto generando celdas de corrosin galvnica.[2] Si se quiere evitar o disminuir la corrosin galvnica, debe usarse materiales del mismo tipo entre conexiones; si se tienen metales diferentes sin flujo elctrico sino solo a travs del agua, tambin es necesario aislarlos; si no pueden aislarse la unin debe ser de un metal ms noble que el de las piezas a las que sujetan.
Imgenes Lmina acero
ANALISIS Y RESULTADOS PRUEBA DE LA GOTA Material Pasivo Rojizo
A dos laminas de acero se le agregaron a cada una 3 gotas de solucin (3% NaCl, Ferricianuro de Potasio y Fenolftalena)al cabo de los primeros minutos se pudo observar que las en las gotas se presentaron dos colores la mitad de la gota es rojiza (zona catdica) y la otra mitad es azul (zona andica). Con el transcurrir de los minutos, el color azul se va transformando en amarillo (Hidrofilico en Hidrfobo) como se observa en las imgenes.
PLACAS METALICAS EN VIDRIOS DE RELOJ
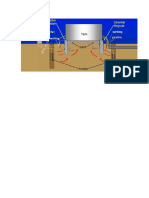
En el laboratorio se llenaron 4 vidrios de reloj con la solucin de fenolftalena y ferrocianuro de potasio anteriormente preparado y en ellos se introdujeron diferentes electrodos de cobre, acero y zinc ordenados en la siguiente forma:
1. En este vidrio de reloj se introdujeron en la solucin un par galvnico cobre-acero, una par de electrodos acero-cobre unidos por un cable y otro par de electrodos acerozinc unidos por un cable. Imgenes Lmina redonda acero
2. En el siguiente vidrio de reloj se introdujo en la solucin de agar un par galvnico cobre-acero, un electro de acero y otro de zinc.
Zinc Acero-cobre Acero
Acero-cobre
Acero cobre
Acero-cobre
Zinc-acero Imgenes primer vidrio de reloj Imgenes segundo vidrio de reloj
Se pudo observar que el Cobre del par galvnico es el ctodo pues sobre l aparece la coloracin rosa producto del indicador fenolftalena que se torna rosa en presencia de iones OH- que resultan de la reduccin del oxigeno en el ctodo. Por otro lado sobre el acero conectado al cobre por medio de cable aparece la coloracin azul lo que indica que este es el nodo donde ocurre la oxidacin y que el acero se est corroyendo. En la conexin zinc-acero vemos que en el acero apareci un poco de color azul lo que significa que se corroy un poco pero luego ces la corrosin, esto es debido a que el zinc tiene menor potencial que el acero y por tanto sirve de nodo de sacrificio, lo que indica que se corroe en lugar del acero pero sobre este no aparece ningn indicador de color ya que los indicadores utilizados no tienen efecto sobre el zinc. Tambin es probable que hubiera algn defecto con la conexin del cable entre estos dos electrodos motivo por el cual el acero tuvo un poco de corrosin.
En este caso vemos que el ctodo sigue siendo el cobre y el nodo el acero y ambos estn localizados en el par galvnico cobreacero. Vemos que el electrodo de acero no se corroe y por el contrario inicialmente aparece sobre l un poco de coloracin rosa lo que indica que acta tambin como ctodo respecto al zinc, el cual se corroe y hace que despus de un tiempo cese la corrosin en el acero del par galvnico.
3. En este vidrio de reloj introdujimos un electrodo de cobre, uno de acero y dos de zinc en ese orden, como se ve en las imgenes. En este caso vemos que el electrodo de acero primero acta como ctodo pues adquiere una coloracin rosa, esto debido a la presencia del zinc oxidndose muy cerca pero luego la coloracin se torna azul sobre este mismo electrodo de acero lo cual se puede explicar debido a que a su lado tambin se encuentra el electrodo de cobre quien empieza a actuar como ctodo y relega al acero a la oxidacin por estar cerca suyo.
Reacciones en el nodo y ctodo Cobre Acero Reaccin responsable de la coloracin azul [ Zinc nodo de zinc: ( ) ] [ ( ) ] nodo de hierro:
Ctodo de Cobre:
Imgenes tercer vidrio de reloj
Esta ltima es la responsable de la presencia de color rosa en el ctodo.
4. En el ltimo vidrio de reloj introducimos a la solucin de agar tres puntillas que tenan la cabeza achatada por un golpe. Vemos que el color azul que indica oxidacin aparece donde el rea de exposicin al medio es mayor mientras que en las cabezas achatadas el rea de contacto es menor y no se oxida, al contrario al principio aparece una coloracin rosa en las cabezas achatadas.
CONCLUSIONES En el caso de la lmina de AceroZinc, el Zinc se oxida porque es ms activo que el Hierro, por lo tanto es de esperarse que se utilice como protector de metal en el Hierro galvanizado. En la lmina de Fe-Cu, el Fe se oxida porque el Cu tiene un potencial mayor, generando una tendencia a reducirse; ocurre lo mismo con el ZnCu.
Imgenes del cuarto vidrio de reloj
Cuando tenemos electrodos de Cu, Acero y Zinc, el Cobre se reduce por tener mayor potencial de electrodo, y entre el acero y el Zinc, este ltimo tiene menor potencial y ocasiona su oxidacin. Si se tienen reacciones con zinc, se debe tener tambin un reactivo capaz de detectar los iones liberados de Zn para mayor seguridad en los resultados. La coloracin producida en el experimento deja al descubierto evidencia que indica el lugar y la intensidad con que se lleva la reaccin y se forman los electrodos. La oxidacin de los materiales se presenta donde hay mayor desgaste o deformacin
BIBLIOGRAFA [1]. Donald Askeland, Ciencia e ingeniera de los materiales. 3ra edicin. [2]. Marn Lusnelkis, Marcano Andrelys. Fundamentos de corrosin. Universidad Gran [3]. Botia Florez, jose salomon. Ingenieria de corrosin. Instituto nacional del acero. Bogota 1985. [4]. Galvele R. Jose. Corrosin. Secretaria General de la Organizacin de Estados Americanos. Programa Regional de desarrollo cientfico y tecnolgico Washington.
You might also like
- Tesis Catalizadores Soportados Cobre (Universidad de Madrid)Document224 pagesTesis Catalizadores Soportados Cobre (Universidad de Madrid)Jose David AparicioNo ratings yet
- Calculo EvaporadorDocument21 pagesCalculo EvaporadorAlberto HMNo ratings yet
- Apunte Prop TermodinamicasDocument47 pagesApunte Prop TermodinamicasdariojvrpioNo ratings yet
- Atlas de Páramos Colombia IAvHDocument31 pagesAtlas de Páramos Colombia IAvHFelipe CelyNo ratings yet
- Taller Bio 2Document1 pageTaller Bio 2Jose David AparicioNo ratings yet
- Defectos e Imperfecciones CristalinasDocument9 pagesDefectos e Imperfecciones CristalinasAyner ZamoraNo ratings yet
- MPC Corrosion y Limpieza Quimica Aceros InoxidablesDocument7 pagesMPC Corrosion y Limpieza Quimica Aceros Inoxidablespower125No ratings yet
- Ceper Cables Catalogo GeneralDocument143 pagesCeper Cables Catalogo GeneralEdward West OrtizNo ratings yet
- 612 BP JSPDocument5 pages612 BP JSPmichNo ratings yet
- Tipos de CorrosionDocument26 pagesTipos de Corrosionarizai moranNo ratings yet
- BRAZING Presentación Curso 2022-3Document193 pagesBRAZING Presentación Curso 2022-3clase procesos de conformaciónNo ratings yet
- Catalogo RemachesDocument84 pagesCatalogo RemachesAlfredoScribd28No ratings yet
- Mantenimiento 2.5 3.5CV 4TDocument11 pagesMantenimiento 2.5 3.5CV 4TAMADOR nogueraNo ratings yet
- Guia de Usuario LotiteDocument44 pagesGuia de Usuario LotiteAnonymous 50FYYM2No ratings yet
- GRUPO Nº3-TRABAJO DE INVESTIGACION - ManuelDocument25 pagesGRUPO Nº3-TRABAJO DE INVESTIGACION - ManuelSara Yanac HuamanNo ratings yet
- Informe 1. Zonas Anodicas y CatodicasDocument6 pagesInforme 1. Zonas Anodicas y CatodicasJose CantilloNo ratings yet
- Estudio de Corrosión Galvánica en Pares Latón Acero Inoxidable y Latón Fundición de HierroDocument3 pagesEstudio de Corrosión Galvánica en Pares Latón Acero Inoxidable y Latón Fundición de HierroDan NoNo ratings yet
- Trabajo de Quimica Entrega 3Document21 pagesTrabajo de Quimica Entrega 3patriciaNo ratings yet
- Tomo 5 Itea Protección - CorrosionDocument107 pagesTomo 5 Itea Protección - CorrosionCarlo Monsalve100% (3)
- Lineas de TransmisiónDocument61 pagesLineas de TransmisiónelocouniNo ratings yet
- Comportamiento de Los Materiales de ServicioDocument57 pagesComportamiento de Los Materiales de ServicioMarina Pérez González100% (2)
- PRÁCTICO 2 TM MEC 2 Luisa Estefany Filigrana FloresDocument14 pagesPRÁCTICO 2 TM MEC 2 Luisa Estefany Filigrana FloresLuisa FiligranaNo ratings yet
- Fundamentos Básicos Sobre Corrosion 1Document28 pagesFundamentos Básicos Sobre Corrosion 1joel gerardo aguero llanasNo ratings yet
- Manual de Cerramiento Electrico GedienclousedDocument218 pagesManual de Cerramiento Electrico GedienclousedGregor RojasNo ratings yet
- Presentación Final PDFDocument4 pagesPresentación Final PDFCristina García TrascasaNo ratings yet
- Proteccion Catodica en Tanques de AlmacenamientoDocument143 pagesProteccion Catodica en Tanques de AlmacenamientoAlex Jimenez100% (2)
- Acabados Del Acero InoxidableDocument89 pagesAcabados Del Acero InoxidableDelfina Vazquez LozanoNo ratings yet
- Corrosion y Factores Que InfluyenDocument4 pagesCorrosion y Factores Que InfluyenJesus SerranoNo ratings yet
- Proceso de FosfatadoDocument13 pagesProceso de FosfatadoEMILIANONo ratings yet
- Laboratorio 8 de QuimicaDocument14 pagesLaboratorio 8 de QuimicaNicolasMinayaOrtegaNo ratings yet
- Corrosion Marina y MicrobiologicaDocument24 pagesCorrosion Marina y Microbiologicajesusjesus1994No ratings yet
- Pemex RP 4 B Modificado Norma 053Document6 pagesPemex RP 4 B Modificado Norma 053Pao RM100% (1)
- TEMA 4 Parte I Formas de CorrosionDocument69 pagesTEMA 4 Parte I Formas de CorrosionMichael melendezNo ratings yet
- Ficha Conec Perno PartidoDocument2 pagesFicha Conec Perno PartidoMoises PinedaNo ratings yet
- Tratamientos Del AceroDocument8 pagesTratamientos Del AceroEsthefany Davila RojasNo ratings yet
- Analisis de Falla DesgasteDocument24 pagesAnalisis de Falla DesgasteRichard Sequeiros Alvarez100% (2)