Professional Documents
Culture Documents
1 - A Quimica Dos Aminoacidos
Uploaded by
terassa0 ratings0% found this document useful (0 votes)
218 views16 pagesOriginal Title
1 - A Quimica Dos Aminoacidos (1)
Copyright
© Attribution Non-Commercial (BY-NC)
Available Formats
DOCX, PDF, TXT or read online from Scribd
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Attribution Non-Commercial (BY-NC)
Available Formats
Download as DOCX, PDF, TXT or read online from Scribd
0 ratings0% found this document useful (0 votes)
218 views16 pages1 - A Quimica Dos Aminoacidos
Uploaded by
terassaCopyright:
Attribution Non-Commercial (BY-NC)
Available Formats
Download as DOCX, PDF, TXT or read online from Scribd
You are on page 1of 16
1
Universidade Federal de Sergipe
Centro de Cincias Biolgicas e da Sade
Departamento de Fisiologia
Apostila
A qumica dos aminocidos e peptdeos
Professor: Paulo de Tarso Gonalves Leopoldo
So Cristvo,
2008
2
I - Tema Central: Aminocidos e Peptdeos.
II - Durao: 2 horas/aulas
III - Estratgia: Aula Expositiva
IV - Objetivos:
4.1. Geral
O aluno dever identificar as propriedades qumicas dos aminocidos,
objetivando a compreenso do estudo dos peptdeos e das protenas.
4.2. Especficos
Ao final desta aula o aluno ser capaz de:
4.2.1 - Conceituar aminocidos e descrever a sua estrutura geral.
4.2.2 - Nomear e representar os aminocidos usando as abreviaturas de
uma letra e de trs letras.
4.2.3. - Descrever a estereoqumica dos aminocidos.
4.2.4 - Classificar os aminocidos segundo a polaridade de sua cadeia
lateral.
4.2.5 - Classificar aminocidos de acordo com as suas necessidades na
alimentao.
4.2.6 - Conceituar aminocidos especiais, exemplificando-os e
diferenciando-os dos aminocidos padres.
4.2.7 - Conceituar peptdeos, descrever a sua formao e citar exemplos
de ocorrncia biolgica.
V - Contedo Programtico:
5.1. - Introduo.
5.2. - Estrutura geral e nomenclatura dos aminocidos.
5.3. - Estereoqumica dos aminocidos.
5.4. - Classificao dos aminocidos.
5.4.1. - Baseada na polaridade da cadeia lateral.
5.4.2. - Baseada nas suas necessidades na alimentao.
5.5. - Aminocidos especiais.
5.6. - Peptdeos
5.7.1 - Peptdeos de importncia biolgica
3
Captulo 1
A qumica dos aminocidos e peptdeos
1. Introduo:
Os aminocidos apresentam diversas funes biolgicas (figura 1) tais como:
- So as unidades estruturais das protenas e peptdeos;
- So componentes estruturais dos glicerofosfolipdios, uma das classes
de lipdios das membranas biolgicas, como o aminocido serina, grupo
polar da fosfatidilserina;
- Precursores na sntese de molculas. Os aminocidos so precursores
de vrias molculas complexas contendo nitrognio. Exemplos incluem
as bases nitrogenadas componentes dos nucleotdeos e cidos nuclicos,
o heme (grupo orgnico contendo ferro) e clorofila (pigmento de
importncia crtica na fotossntese).
- Fonte de grupos metila (-CH
3
) em reaes de metilao. S-
Adenosilmetionina, um derivado da metionina, transfere grupos metilas
em reaes de metilao.
- So componentes de coenzimas. O aminocido |-alanina que
encontrada na coenzima A.
- Intermedirios metablicos. Vrios aminocidos atuam como
intermedirios metablicos como arginina, citrulina e ornitina
componentes do ciclo da uria. A sntese da uria, uma molcula
formada no fgado, o principal mecanismo de excreo do excesso de
nitrognio proveniente do catabolismo dos aminocidos.
- Mensageiros qumicos. Vrios aminocidos ou seus derivados atuam
como mensageiros qumicos entre as clulas. Por exemplo, glicina,
glutamato, arginina, cido -aminobutrico (GABA, um derivado do
glutamato) e triptofano so neurotransmissores, substncias liberadas de
uma clula nervosa e que influenciam outras clulas vizinhas (nervosas
ou musculares). A tiroxina (um derivado da tirosina produzida pela
glndula tireide) e cido indolactico (um derivado do triptofano e
encontrado nas plantas) so exemplos de hormnios.
Figura 1. Funes biolgicas dos aminocidos.
4
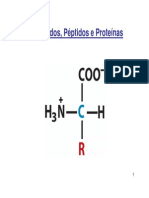
Todos os 20 aminocidos encontrados nas protenas so o-aminocidos. Eles so
formados por um grupo amino, um grupo carboxila, um tomo de hidrognio e um
grupo R, radical ou cadeia lateral, ligados a um tomo de carbono. Os aminocidos
diferem entre si apenas na natureza do grupo qumico das suas cadeias laterais (figura
2a). Os aminocidos em pH 7,0 so encontrados na forma ionizada, isto , o grupo
carboxila com carga negativa e o grupo amino com carga positiva. Essa forma apresenta
tanto um grupo cido (
+
NH
3
), como um grupo bsico (COO
-
), sendo denominada on
dipolar, zwitterion ou on hbrido (figura 1b). Formas que apresentam grupos cidos e
bsicos nas suas estruturas so chamadas de anflitos.
Figura 2: a) Estrutura geral dos aminocidos. Esta estrutura comum a todos os o-aminocidos das
protenas, exceto um. (a prolina, um aminocido cclico, a exceo). O grupo R, ou cadeia lateral ligada
ao carbono o diferente em cada um dos aminocidos b) zwitterion ou on hbrido, forma ionizada do
aminocido em pH 7,0 ou ambiente aquoso.
Os aminocidos mais comumente encontrados em protenas so os aminocidos
primrios ou padres. Esses aminocidos compreendem um total de 20 unidades. Duas
convenes que acarretam na prtica uma certa confuso, so utilizadas para identificar
os carbonos de um aminocido. Os carbonos adicionais em um grupo R so designados
por |, , o, c, etc., e so assim nomeados a partir do carbono o (figura3). Para a maioria
das outras molculas orgnicas, os tomos de carbono so simplesmente numerados a
partir de uma extremidade, com maior prioridade para os carbonos com substituintes
contendo tomos com os nmeros atmicos mais elevados. Por esta ltima conveno, o
grupo carboxila de um aminocido seria C-1 e o carbono o seria C-2. Em alguns casos,
tais como nos aminocidos com grupos R heterocclicos, o sistema que utiliza letras
gregas ambguo e, por esse motivo, utiliza-se a conveno numrica.
Figura 3. Numerao orgnica dos carbonos dos aminiocidos que utilizam tantos numerais
quanto letras gregas. O carbono de todos os aminocidos o carbono 2.
O quadro 1 lista os 20 aminocidos padres, acompanhados das abreviaturas de
uma e de trs letras. Essas abreviaturas so utilizadas para descrever de forma prtica a
seqncia de aminocidos de protenas. A regra seguida na abreviatura de trs letras da
maioria dos aminocidos consiste em escrever as trs primeiras letras iniciais do seu
nome em ingls. A abreviatura de uma letra usada em textos cientficos quando se
quer comparar as seqncias de aminocidos de diversas protenas. Essa abreviatura
feita, para a maior parte dos aminocidos, usando a primeira letra do nome do
aminocido correspondente. Alguns tm smbolos que no tm nenhuma relao com os
seus nomes, como por exemplo, o triptofano e a lisina, que so representados por W e
K, respectivamente. Como j existem dois aminocidos representados pelas letras L,
leucina e T, treonina, convencionou-se representar a lisina com a letra K e o triptofano
com a letra W.
b)
a)
C H H
3
+
N
COO
-
R
C H H
2
N
COOH
R
5
Quadro 1: Nome e Abreviatura dos Aminocidos
Aminocido Abreviatura de trs
letras
Abreviatura de
uma letra
Alanina Ala A
Arginina Arg R
Asparagina Asn N
cido asprtico Asp D
cido glutmico Glu E
Cistena Cys C
Glicina Gly G
Glutamina Gln Q
Histidina His H
Isoleucina Ile I
Leucina Leu L
Lisina Lys K
Metionina Met M
Fenilalanina Phe F
Prolina Pro P
Serina Ser S
Tirosina Tyr Y
Treonina Thr T
Triptofano Trp W
Valina Val V
2. Nomenclatura dos aminocidos
Os aminocidos so denominados com nomes comuns de acordo com trs
critrios, a saber: 1) a fonte a partir da qual eles foram pela primeira vez obtidos na
forma pura, como por exemplo, a tirosina, (tyros, do grego, que significa queijo)
nomeada assim por ter sido obtida do queijo. A asparagina, por que foi obtida do
aspargo; 2) uma caracterstica qumica do aminocido, como por exemplo a
fenilalanina, denominada assim por apresentar um grupo fenil ligado ao aminocido
alanina e 3) uma propriedade do aminocido, como por exemplo a glicina, que recebe
esse nome, por ter o sabor doce, lembrando os glicdios (acares).
A maioria dos aminocidos tem seus nomes terminados com o sufixo ina,
como: prolina, glicina, alanina asparagina, etc. Outros tm nomes terminados em ano,
como o triptofano e em ico, como o cido asprtico e o cido glutmico. O cido
asprtico e o cido glutmico em suas formas ionizadas, em apresentam carga lqida
negativa, so nomeados aspartato e glutamato, respectivamente, uma vez que a
terminao ato usada para designar os cidos carregados negativamente.
6
3. Estereoqumica dos aminocidos
3.1 Molculas assimtricas e ismeros pticos
Vivemos num mundo em que todas as coisas passam a ser conhecidas por suas
formas. Na Qumica no diferente isto pode ser constatado pelo fato das molculas
no serem estruturas amorfas, mas ao contrrio, possuem formas definidas. O
conhecimento da estrutura tridimensional de uma molcula de importncia
fundamental, porque ela determina a sua funo. A estereoqumica a parte da Qumica
que estuda o arranjo espacial dos tomos nas molculas.
Um carbono que faz ligao com quatro grupos qumicos diferentes denominado
carbono assimtrico ou carbono quiral, enquanto o carbono simtrico faz ligao com
pelo menos dois grupos qumico iguais. A maioria dos aminocidos tem carbono
assimtrico, sendo a glicina a nica exceo, por apresentar um tomo de hidrognio na
cadeia lateral (figura 4).
Figura 4. Estruturas dos aminocidos glicina e alanina.
Uma das conseqncias para molculas que apresentam em suas estruturas
carbono assimtrico, que elas podem apresentar ismeros pticos, ou esteroismeros.
Os esteroismeros so definidos como sendo imagens especulares no superpostas
(figura 5). Os estereismeros apresentam as mesmas propriedades qumicas e quase
todas as propriedades fsicas, diferindo apenas na maneira como desviam a luz
planopolarizada no polarmetro. O ismero ptico que desvia a luz para a direita
dextrorrotatrio e o que a desvia para a esquerda levorrotatrio. Neste ponto
conveniente lembrar que as letras maisculas D e L antes do nome dos nomes dos
aminocidos no se referem ao desvio da luz planopolarizada, mas, configurao
absoluta dessas molculas. Para se referir ao desvio da luz planopolarizada so
utilizados os smbolos (+), para dextrorrotatrio e (-) para levorrotatrio, escritos aps
as letras D e L, seguido do nome do aminocido. Por exemplo, aminocido L (-) serina,
apresenta configurao absoluta L e levorrotatrio, enquanto L (+) serina, apresenta
configurao absoluta L e dextrorrotatrio.
Glicina Alanina
C
COOH
H H
2
N
CH
3
C
COOH
H H
2
N
H
(molcula simtrica) (molcula assimtrica)
7
Figura 5 - Ismeros pticos. Os ismeros pticos so imagens especulares no superpostas.
A importncia das molculas serem estruturas assimtricas explicada por duas
razes principais: 1. A enorme diversidade de formas percebidas na natureza somente
poderia ser possvel com molculas assimtricas. Se as biomolculas fossem simtricas,
teramos um mundo pobre em formas, previsvel e montono, enfim, sem a riqueza da
diversidade observada na biosfera. 2. As molculas que entram na composio da
matria viva, na sua grande maioria, no esto isoladas no ambiente celular, mas
interagindo entre si, e essa interao ocorre com o encaixe de uma molcula na outra
atravs da complementaridade das suas formas. A forma da molcula determinada por
sua estrutura assimtrica.
Para John Kendrew, famoso bioqumico ingls, as caractersticas mais notveis
das molculas so a sua complexidade e a sua assimetria. A estrutura molecular parece
ser quase que totalmente destituda de regularidade, regularidade essa que seria esperada
se as molculas fossem estruturas simtricas. Louis Pasteur, bilogo francs escreveu:
A vida, como ela se manifesta a ns , uma funo de assimetrias do universo. (...) O
Universo assimtrico, pois se todos os corpos em movimento, que constituem o
sistema solar, fossem colocados diante de um espelho, sua imagem no poderia ser
superposta real. (...) O magnetismo terrestre (...) a oposio entre eletricidade positiva
e negativa, so apenas resultantes de aes assimtricas. Posso imaginar que todas as
espcies vivas representem, primordialmente, em sua estrutura e em sua formas
externas, funes da assimetria csmica.
3.2 Configurao absoluta dos aminocidos
A configurao absoluta a estrutura tridimensional das molculas feitas a partir
da configurao dos ismeros D- e L- do gliceraldedo, que so usados como referncia
na determinao de configurao das molculas orgnicas. Para se determinar a
configurao dos aminocidos, preciso desenhar a sua estrutura utilizando a projeo
em perspectiva (figura 6), em que se posiciona o grupo carboxila na parte superior da
molcula, na mesma posio do grupo aldedo do gliceraldedo. Se o grupo amino
(NH
2
) estiver para o lado direito, coincidindo com a mesma posio da hidroxila no D-
gliceraldedo, diz-se que a configurao do aminocido D, se o grupo amino estiver
para a esquerda, coincidindo com a mesma posio da hidroxila no L-gliceraldedo a
configurao ser L (figura 6).
8
Figura 6. Determinao da configurao absoluta dos aminocidos em relao ao D e L gliceraldedo.
Nessas frmulas em perpectiva, os carbonos so alinhados verticalmente, com o tomo quiral no centro.
Os carbonos nessas molculas so numerados iniciando-se pelo grupo aldedo (do gliceraldedo) ou a
carboxila de uma extremidade (do aminocido alanina). De 1 a 3 de cima para baixo, conforme mostrado.
Quando apresentado desta forma, o grupo R do aminocido (neste caso, o grupo metila da alanina) est
sempre abaixo do carbono o. Os L-aminocidos so aqueles que apresentam o o-aminogrupo esquerda
e os D-aminocidos os que o tem direita.
A maioria dos aminocidos encontrados em protenas apresenta configurao
absoluta L, e isto, pode ser, em parte, explicado pela propriedade estereospecfica das
enzimas, denominada estereoespecificidade, que as capacitam a reconhecer molculas
de acordo com as suas formas, podendo elas distinguirem entre duas molculas bastante
semelhantes como os D- e L- aminocidos.
As enzimas so as unidades funcionais do metabolismo, catalisando reaes de
sntese ou de quebra de molculas na clula. Ento, como a estrutura do stio ativo das
enzimas formada por aminocidos assimtricos, ela tem uma informao que faz com
que elas somente sintetizem os aminocidos com configurao L. Uma outra explicao
para a configurao absoluta dos aminocidos ser da srie L, que, se a formao das
estruturas proticas ocorresse com misturas de D e L aminocidos, haveria uma quebra
da sua estrutura regular. Um dos princpios gerais observados na organizao das
biomolculas de que as suas subunidades apresentam a mesma orientao espacial e
de serem complexas e organizadas, portanto, desordem no plano molecular no
compatvel com a vida.
Os aminocidos com configurao absoluta D no so encontrados em protenas,
mas so comuns em certos peptdeos bacterianos, tomando parte da parede celular. Os
D-aminocidos so produzidos a partir de modificao enzimtica sofrida pelos L-
aminocidos. Os D-aminocidos na parede celular bacteriana conferem a essa estrutura
uma resistncia aumentada ao das enzimas hidrolticas, porque esses aminocidos
no so substratos das peptidases, enzimas que clivam peptdeos.
4. Classificao dos aminocidos quanto polaridade da cadeia lateral (R)
Os aminocidos so classificados de acordo com a polaridade da sua cadeia lateral
em apolares (ou hidrofbicos), polar neutro (ou hidroflico), polar com carga negativa
(ou cidos) e polares com carga positiva. A polaridade a capacidade de um grupo
qumico se solubilizar em gua por interagir com ela por pontes de hidrognio ou por
formao de uma camada de solvatao ou hidratao. Como os aminocidos apolares
s apresentam hidrocarboneto em sua cadeia lateral, no so solveis em gua. Os
aminocidos polares, por apresentar grupos OH, SH, NH e C=O, so solveis em gua.
Os aminocidos polares solubilizam-se na gua, atravs da formao de pontes de
hidrognio Os aminocidos bsicos apresentam cargas positivas lquida no pH 7,0,
enquanto os aminocidos cidos apresentam carga negativa lquida no pH 7,0,
C
CHO
OH H C
CHO
H HO C
COOH
H H
2
N
C
COOH
CH
3
H
CH
2
OH
NH
2
CH
2
OH CH
3
D-Gliceraldedo D-alanina L-Gliceraldedo L-alanina
9
permitindo a esses aminocidos formarem uma camada de hidratao, quando
adicionados gua, portanto, so hidroflicos.
4.1 Aminocidos apolares ou hidrofbicos.
Os grupos R nesta classe de aminocidos so apolares ou hidrofbicos (figura 7).
So formados em sua maioria por grupos hidrocarbonetos ou por tomos com valores
prximos de eletronegatividade. As volumosas cadeias laterais de alanina, valina,
leucina e isoleucina, com suas formas caractersticas, so importantes na estabilizao
da estrutura das protenas pela promoo de interaes hidrofbicas em seu interior,
como tambm em alguns casos causam impedimento estrico, ou seja, impedimento
esse devido a proximidade desses grupos qumicos grandes numa cadeia polipeptdica.
Valina, leucina e isoleucina so aminocidos de cadeia lateral ramificada.
Figura 7. Aminocidos apolares ou hidrofbicos apresentam em sua cadeia lateral (R) hidrocarbonetos ou
tomos com baixo valor de eletronegatividade.
4.2 Aminocidos polares ou polares neutros.
Os grupos R destes aminocidos so solveis em gua, ou hidroflicos. Isso se
deve aos grupos funcionais de suas cadeias laterais que formam pontes de hidrognio
com a gua. Esta classe de aminocidos inclui serina, treonina, cistena, prolina,
asparagina, glutamina e glicina. A polaridade da serina e da treonina devida aos seus
respectivos grupos hidroxila; a da cistena ao seu grupo sulfidrila e a polaridade da
asparagina e da glutamina aos seus grupos amida. A prolina possui uma estrutura cclica
distintiva e apenas moderadamente polar. O grupo amino secundrio (imino) dos
resduos de Pro mantido numa conformao rgida que leva a uma reduo na
flexibilidade estrutural de regies polipeptdicas contendo prolina. Asparagina e
glutamina so amidas de dois outros aminocidos tambm encontrados em protenas,
aspartato e glutamato, respectivamente, aos quais so facilmente hidrolisadas por cidos
ou bases (Figura 8). Glicina o aminocido de estrutura mais simples. Embora seja
formalmente apolar, sua cadeia lateral pequena (apresenta um tomo de hidrgnio) no
contribui efetivamente para a existncia de interaes hidrofbicas (Figura 8).
10
Figura 8. Aminocidos polares. Os aminocidos polares apresentam em sua cadeia lateral grupos
qumicos que interagem com a gua por pontes de hidrognio.
4.3 Aminocidos polares bsicos (com carga lquida positiva) e cidos (com carga
lquida negativa) no pH 7,0.
Os aminocidos nos quais os grupos R tm uma carga positiva lquida em pH 7,0
so aminocidos bsicos, que so lisina, arginina e histidina. Lisina, que tem um
segundo grupo amino protonado na posio c (ou carbono 6) da sua cadeia aliftica;
arginina, que tem um grupo carregado positivamente, o grupo guanidino; histidina, que
contm um grupo imidazol. Histidina o nico aminocido primrio que possui uma
cadeia lateral com um pK
a
prximo da neutralidade. Em muitas reaes catalisadas por
enzimas, um resduo de histidina facilita a reao ao servir como um doador ou aceptor
de prtons (figura 9).
Os aminocidos cidos apresentam grupos R com uma carga lquida negativa em
pH 7,0 que so aspartato e glutamato; cada um deles possui na cadeia lateral um
segundo grupo carboxila (figura 5C).
Figura 9. Aminocidos cidos e bsicos. Os aminocidos cidos glutamato e aspartato apresentam carga
lquida negativa no pH 7,0, enquanto os aminocidos bsicos arginina, histidina e lisina apresentam carga
lquida positiva.
11
4.4 Aminocidos aromticos
Os aminocidos que apresentam em sua cadeia lateral um grupo fenil so
denominados aminocidos aromticos, que so tirosina, triptofano e fenilalanina (figura
10). Os aminocidos fenilalanina, tirosina e triptofano com suas cadeias laterais
aromticas so relativamente apolares (hidrofbicos). Todos eles podem participar de
interaes hidrofbicas. O grupo hidroxila da tirosina pode formar pontes de hidrognio
e por isso atua como um grupo funcional importante na atividade de algumas enzimas.
A tirosina e o triptofano so significativamente mais polares do que a fenilalanina
devido ao grupo hidroxila da tirosina e o nitrognio do anel indol do triptofano.
Triptofano e tirosina promovem a absoro de luz na regio ultravioleta (200 a
300nm) do espectro. Este fato o responsvel pela forte e caracterstica absorbncia da
luz pelas protenas no comprimento de onda de 280nm e uma propriedade muito
explorada pelos pesquisadores na caracterizao de protenas.
Figura 10. Os aminocidos aromticos fenilalanina, tirosina e triptofano apresentam em sua
cadeia lateral o grupo funcional fenil ou anel aromtico.
5. Classificao dos aminocidos quanto as suas necessidades nutricionais
De acordo com as necessidades nutricionais os aminocidos so classificados em
essenciais e no essenciais. Os aminocidos essenciais no so sintetizados nas clulas e
por isso devem ser obtidos da alimentao, j os aminocidos no essenciais so
produzidos pelas clulas. O quadro 2 lista os aminocidos essenciais e no essenciais.
Quadro 2: Aminocidos essenciais e no-essenciais
Aminocidos essenciais Aminocidos no essenciais
Triptofano Glutamato
Valina Glutamina
Treonina Prolina
Fenilalanina Aspartato
Isoleucina Asparagina
Metionina Alanina
Histidina Glicina
Arginina Serina
Lisina Tirosina
Leucina Cistena
12
6. Aminocidos derivados ou especiais
Os aminocidos derivados ou especiais so formados a partir de um dos 20
aminocidos padres ou primrios e so encontrados em certas protenas. Esses
aminocidos resultam de modificaes qumicas sofridas por um dos aminocidos
primrios aps a sntese da cadeia polipeptdica. Como esses aminocidos derivados no
apresentam um cdon para que ocorra sua sntese nos ribossomos, essas modificaes
qumicas so denominadas mudanas ps-translacionais ou ps-traduo.
Cistina um aminocido derivado encontrado em muitas protenas da matriz
extracelular ou que esteja voltada para esse compartimento aquoso, como por exemplo,
algumas protenas das membranas biolgicas. Cistina formada a partir da oxidao de
duas molculas de cistena (figura 11).
Figura 11. Formao de cistina a partir da oxidao de duas molculas de cistena. Duas cistenas
so oxidadas no grupo sulfidrila (SH) formando uma ligao covalente denomida ponte
dissulfeto (S-S) resultando na formao de cistina.
O aminocido -carboxiglutmico, cuja funo ligar o clcio, encontrado na
protena da coagulao sangnea, a protombina. O aminocido 4-hidroxiprolina,
derivado da prolina, e a 5-hidroxilisina, derivado da lisina, so encontrados no
colgeno, protena fibrosa, que desempenha uma funo estrutural. 6-N-metilisina,
encontrado na miosina, protena da contrao muscular (figura 12).
Desmosina e isodesmosina so aminocidos derivados formados a partir da
reao de quatro molculas de lisina. A elastina, uma protena de propriedade elstica,
rica em desmosina e isodemosina. Esses aminocidos tm importncia fundamental na
atividade biolgica dessa protena, pois so eles que conferem a ela elasticidade, uma
vez que esses aminocidos interligam cadeias polipeptdicas (figura 12).
13
Figura 12. Estruturas qumicas dos aminocidos derivados ou especiais.
Aproximadamente 300 aminocidos adicionais foram encontrados nas clulas e
tm uma grande variedade de funes, mas eles nunca aparecem em protenas. A
ornitina e a citrulina (Figura 13) merecem uma nota especial, porque so
intermedirias importantes na biossntese da arginina e no ciclo da uria, sendo
portanto, metablitos, substncias que atuam numa via metablica.
Figura 13. Estruturas dos aminocidos metablicos (metablitos) ornitina e citrulina, envolvidos
na sntese de arginina e no ciclo da uria .
7. Peptdeos
Os peptdeos so cadeias pequenas de aminocidos, que podem ser formados
pela reao dos aminocidos, ou pela hidrlise de protenas. O grupo carboxila de um
aminocido reage com o grupo amino de um outro aminocido, produzindo uma ligao
covalente denominada ligao peptdica (figura 14). Uma unidade de aminocido na
cadeia polipeptdica denominado resduo devido perda de uma hidroxila pelo grupo
carboxila de um aminocido e a eliminao de um tomo de hidrognio pelo grupo
amino.
14
Figura 14. Formao de um peptdeo. O grupo carboxila (COOH) de um aminocido reage com
um grupo amino (NH
2
) de outro aminocido, com eliminao de H
2
O, produzindo uma ligao
covalente denominada ligao peptdica.
A extremidade de uma cadeia polipeptdica que contm o grupo amino
corresponde ao primeiro resduo de aminocido e a que contm o grupo carboxila
corresponde ao ltimo resduo de aminocido. Os resduos de aminocidos na cadeia
polipeptdica so nomeados por substituio do sufixo ina por il, como serina, que passa
a ser denominada seril e glicina de glicil. Aminocidos como tirosina, so nomeados
apenas por substituio da letra a por il, portanto, tirosinil. O ltimo aminocido de uma
cadeia polipeptdica nomeado sem qualquer alterao no seu nome. O peptdeo
Ser-Gly-Ala-Val-Phe-Met-Ala formado por 7 resduos de aminocidos, quais sejam:
serina, glicina, valina, fenilalanina, metionina e alanina nomeado
serilglicilalanilvalilfenilalanilmetionilalanina.
Os peptdeos que apresentam at dez resduos de aminocidos, so nomeados
empregando os prefixos di, tri, tetra, penta, hexa, hepta, octa, nona e deca ao nome
peptdeo. Por exemplo: o peptdeo formado por dois aminocidos denominado
dipeptdeo, por trs, tripeptdeo, por quatro, tetrapeptdeo, por cinco, pentapeptdeo, etc.
Para os peptdeos que apresentam mais de dez resduos de aminocidos utilizamos os
termos oligopeptdeos ou polipeptdeos.
Os oligopeptdeos so cadeias pequenas de aminocidos. Esse termo se aplica a
peptdeos com um nmero mximo de 20 resduos de aminocidos. Polipeptdio um
termo empregado par se referir a peptdeos com mais de 20 resduos de aminocidos.
Esse termo empregado tambm como sinnimo de protena ou de uma cadeia de
protena. Alguns autores divergem na diferenciao de peptdeos de protenas. Segundo
Lehninger, um polmero de aminocidos considerado uma protena quando apresentar
uma cadeia com 100 unidades de aminocidos. Para Devlin uma protena deve conter
uma cadeia com um nmero mnimo de 70 aminocidos e para Donald Voet, a partir de
40 aminocidos. Ento, para evitar dvidas ao se nomear peptdeo com mais de dez
aminocidos conveniente cham-los simplesmente de peptdeos.
15
Quadro 3: Peptdeos de ocorrncia biolgica
Nmero de
unidades de
aminocidos
Exemplos Funes
2 Carnosina Tamponamento do pH em clulas
musculares
Anserina Tamponamento do pH em clulas
musculares
3
Fator liberador de
tireotrofina
Hormnio hipotalmico estimula a
liberao de tireotrofina, hormnio da
hipfise anterior
Glutationa Agente antioxidante
9
Ocitocina
Hormnio da hipfise anterior, estimula as
contraes uterinas
Bradicinina Produzido no plasma ou estmago, um
potente vasodilatador
10 Gramicidina S
Antibitico
Amanitina Veneno de fungo
29
Glucagon
Secretado pelas clulas o do pncreas,
tendo a funo de elevar os nveis de
glicose no sangue
39 Corticotrofina Hormnio da hipfise anterior, estimula o
crtex adrenal
O aspartame um dipeptdeo formado por fenilalanina e aspartato. O aspartame
um adoante de baixa caloria, obtido por processos industrializados, bastante
utilizado em dietas de emagrecimento.
Metionina-encefalina e a leucina-encefalina pertencem a classe dos peptdeos
opiceos, encontrados predominantemente nas clulas do tecido nervoso. Os
pentapeptdeos leucina-encefalina e metionina-encefalina diferem entre si somente pelos
resduos de aminocidos dos Cterminais. So pentapeptdeos que atenuam a dor e
produzem sensaes agradveis. A substncia P e a bradicinina so nonapeptdeos
liberados em processos inflamatrios estimulando a percepo de dor, dessa forma
apresentando efeitos opostos aos peptdeos opiceos (figura 15).
a) Tyr-Gly-Gly-Phe-Met b) Tyr-Gly-Gly-Phe-Leu
Figura 15. Alguns peptdeos de ocorrncia biolgica. a) Metionina encefalina b)
leucina encefalina
16
8 Referncias bibliogrficas:
01. CRICK, F. Vida, o mistrio da sua origem. 1
a
edio, Editora Gradiva, 193p,
1988
02. HORTON, H.ROBERT, MORAN, LAURENCE. A., OCHS, RAYMOND.
S., RAWN, J.DAVID,SCRIMGEOUR, K. GRAY. Fundamentos de
Bioqumica, Editora Prentice-Hall do Brasil.
03. LEHNINGER, A. Princpios de Bioqumica. 4
a
edio, Editora Sarvier,
1986.
04.. LEHNINGER, A. Princpios de Bioqumica. 3
a
edio, Editora Sarvier,
1995.
05. MOTTA, Valter. Bioquimica. editora: Educs, 2005
9. Estudo dirigido
1. O que so aminocidos?
2. Defina aminocidos padres ou primrios.
3. Explique o significado das letras D- e L- antes dos nomes de aminocidos
seguidas dos sinais (+) e (-).
4. Como definida a configurao absoluta de uma molcula?
5. O que so ismeros pticos ou estereoismeros?
6 Qual a condio para que uma molcula apresente ismeros pticos?
7. Pode a glicina apresentar ismeros pticos e configurao absoluta L?
8. Por que todos os aminocidos encontrados em protenas tm configurao (L-)?
9. Em que estruturas so encontrados aminocidos com configurao D na
natureza? Qual a funo biolgica desses aminocidos?
10. Como so classificados os aminocidos de acordo com sua polaridade?
11. O que so aminocidos essenciais e no-essenciais? Exemplifique-os.
12.O que so aminocidos especiais?
13. O que so aminocidos neurotransmissores? Exemplifique-os
14. O que so peptdeos?
15. Como podem ser formados os peptdeos e como eles so denominados?
16. Diferencie peptdeos de protenas?
17. Exemplifique alguns peptdeos de ocorrncia biolgica.
You might also like
- IOB - DIREITO ADMINISTRATIVO - Carreiras Superior Não JurídicasDocument158 pagesIOB - DIREITO ADMINISTRATIVO - Carreiras Superior Não JurídicasterassaNo ratings yet
- 78 - Etica - CSNDocument50 pages78 - Etica - CSNterassaNo ratings yet
- Anapaula Direitofinanceiro Teoriaexercicios Modulo01 001Document130 pagesAnapaula Direitofinanceiro Teoriaexercicios Modulo01 001Cleiton Silvestre OrofinoNo ratings yet
- Anatomia vegetal frutoDocument21 pagesAnatomia vegetal frutoterassaNo ratings yet
- Matematica FinanceiraDocument82 pagesMatematica FinanceiraterassaNo ratings yet
- 13122011131216anexo LegalDocument86 pages13122011131216anexo LegalterassaNo ratings yet
- 13122011131216anexo LegalDocument86 pages13122011131216anexo LegalterassaNo ratings yet
- Apostila de Consultoria Empresarial FSLDocument43 pagesApostila de Consultoria Empresarial FSLterassaNo ratings yet
- Enzimas e ProteínasDocument8 pagesEnzimas e ProteínasAna Cristina DiasNo ratings yet
- ENZIMA - Uma Senhora BiomoléculaDocument82 pagesENZIMA - Uma Senhora BiomoléculaCecília Anita Sequeira CiciNo ratings yet
- Biologia PPT - Vitaminas IIDocument56 pagesBiologia PPT - Vitaminas IIBiologia ppt100% (5)
- Biologia Molecular E1675804108Document67 pagesBiologia Molecular E1675804108Rawlinson TeixeiraNo ratings yet
- DMT Bioq 2021-1 Aula # 24Document59 pagesDMT Bioq 2021-1 Aula # 24Pedro Henrique SantosNo ratings yet
- Atividade 2Document2 pagesAtividade 2Regiane RezendeNo ratings yet
- 01 Apostila Engenharia GenéticaDocument44 pages01 Apostila Engenharia GenéticamonikitinhaNo ratings yet
- Tabela KFCDocument2 pagesTabela KFCDaniel VasconcellosNo ratings yet
- Bioquímica - Vitaminas PDFDocument39 pagesBioquímica - Vitaminas PDFfnsfrazaoNo ratings yet
- Lipídeos digestão metabolismoDocument5 pagesLipídeos digestão metabolismoEdsonclight0% (1)
- DNA e RNA: estrutura e funçãoDocument6 pagesDNA e RNA: estrutura e funçãoDavid FernandesNo ratings yet
- Proteínas Enzimas FunçõesDocument20 pagesProteínas Enzimas FunçõesEdson Pereira de LimaNo ratings yet
- Aminoácidos pK pH estruturaDocument2 pagesAminoácidos pK pH estruturaBianca VasconcelosNo ratings yet
- Biotina: função, metabolismo e deficiênciaDocument3 pagesBiotina: função, metabolismo e deficiênciaANA CAROLINA FERNANDES RIBEIRONo ratings yet
- Aminoácidos e Peptídeos: Estrutura e FunçõesDocument28 pagesAminoácidos e Peptídeos: Estrutura e FunçõesMaurício RibeiroNo ratings yet
- Resumos de Bioquímica para MedicinaDocument57 pagesResumos de Bioquímica para Medicinavinicius dinizNo ratings yet
- Proteínas e ácidos nucleicos: exercíciosDocument2 pagesProteínas e ácidos nucleicos: exercíciosMariana Garvil100% (1)
- Suplemento líquido para saúde gastrointestinalDocument2 pagesSuplemento líquido para saúde gastrointestinalJucimar OliveiraNo ratings yet
- Vitaminas e compostos naturais na endometrioseDocument1 pageVitaminas e compostos naturais na endometrioseFernanda Maria de Sousa SantosNo ratings yet
- Suplementação de ProteínaDocument5 pagesSuplementação de ProteínaVanessa BarrosNo ratings yet
- 2aula Aminoacidos (Modo de Compatibilidade)Document38 pages2aula Aminoacidos (Modo de Compatibilidade)Elizael De Jesus GonçalvesNo ratings yet
- Bioquímica EstruturalDocument13 pagesBioquímica EstruturalNayla LimaNo ratings yet
- Atividades Sobre AlimentaçãoDocument8 pagesAtividades Sobre AlimentaçãoMaria Angela Marcolino Rosa100% (1)
- 2 - DNA e Sintese ProteicaDocument9 pages2 - DNA e Sintese ProteicaLucas Vinícius GonçalvesNo ratings yet
- Transcrição: processo e etapasDocument56 pagesTranscrição: processo e etapasFrancielli Valerio de OliveiraNo ratings yet
- 1C Lípidos TerpenosDocument25 pages1C Lípidos Terpenosapi-27441481100% (2)
- Estudo Dirigido 01 - Aminoácidos e Água (Solução Tampão) e Propriedades Ácido-Base Dos Aminoácidos (Nota 90 de 100)Document12 pagesEstudo Dirigido 01 - Aminoácidos e Água (Solução Tampão) e Propriedades Ácido-Base Dos Aminoácidos (Nota 90 de 100)Emmanuelle FernandesNo ratings yet
- Lista de Exercícios - Aula 03 (Gabarito)Document3 pagesLista de Exercícios - Aula 03 (Gabarito)Maria VitoriaNo ratings yet
- Ácidos grasos saturados y sus estructurasDocument2 pagesÁcidos grasos saturados y sus estructurasAngel Aguilar0% (1)
- Lit - COPPER PEPTIDEO PDFDocument3 pagesLit - COPPER PEPTIDEO PDFerika8682100% (2)