Professional Documents
Culture Documents
Apostila - Maquinas - 2009A
Uploaded by
Nadjanara EduardoOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Apostila - Maquinas - 2009A
Uploaded by
Nadjanara EduardoCopyright:
Available Formats
UNIVERSIDADE DO SUL DE SANTA CATARINA UNISUL
CURSO DE ENGENHARIA QUMICA
X SEMESTRE- PERODO LETIVO 2009/1
MQUINAS TRMICAS
Professor Dr. Dile Pontarolo Stremel
1.0 INTRODUO .................................................................................................................. 2
1.1 Conceitos Bsicos ...................................................................................................................... 3
1.2 Estado e Propriedades de uma Substncia ................................................................................. 4
1.3 Mudana de Estado de um Sistema Termodinmico ................................................................ 5
1.4 Lei Zero da Termodinmica ...................................................................................................... 6
1.5 Classificao das Mquinas Trmicas ....................................................................................... 6
2.0 PROPRIEDADES TERMODINMICAS ....................................................................... 9
2.1 Propriedades de uma Substncia Pura ....................................................................................... 9
2.1.1 Substncia Pura ..................................................................................................................... 9
2.2 Propriedades Independentes das Substncias Puras ................................................................ 13
2.3 Equaes de Estado ................................................................................................................. 14
2.4 Tabelas de Propriedades Termodinmicas .............................................................................. 19
2.5 Diagramas de Propriedades Termodinmicas ......................................................................... 35
3.0 CALOR E TRABALHO ...................................................................................................... 51
3.1 Trabalho Termodinmico ........................................................................................................ 51
3.2 Transferncia de Calor e Convenes ..................................................................................... 61
4.0 PRIMEIRA LEI DA TERMODINMICA APLICADA A SISTEMAS ......................... 63
4.1 Primeira Lei para Um Sistema Percorrendo Um Ciclo ........................................................... 63
4.2 Primeira Lei para Mudana de Estado de um Sistema ............................................................ 64
4.2.1 O processo a Temperatura Constante ................................................................................... 67
4.2.2 O processo a Volume Constante .......................................................................................... 67
4.2.3 O processo a Presso Constante .......................................................................................... 67
4.2.4 O processo adiabtico ........................................................................................................... 68
4.2.5 O processo politrpico .......................................................................................................... 69
4.3 Primeira lei da Termodinmica em termos de fluxo ............................................................... 71
4.3.1 Formulao Geral para Volumes de Controle ..................................................................... 71
4.3.2 A primeira Lei Aplicada a Volumes de Controle ................................................................. 74
4.4 Exerccios com aplicao em sistemas trmicos ..................................................................... 78
5.0 SEGUNDA LEI DA TERMODINMICA APLICADA MQUINAS TRMICAS
....................................................................................................................................................... 79
5.1 Conceitos Bsicos .................................................................................................................... 79
5.2 Enunciados da Segunda Lei da Termodinmica..................................................................... 84
5.3 Ciclo de Carnot (Ou Motor de Carnot) ................................................................................... 85
5.4 Entropia ................................................................................................................................... 91
5.4.1 Entropia para processo Cclico ............................................................................................. 91
5.4.2 Variao de Entropia para Substncias nas Fases Vapor, Slido e Lquido ....................... 94
5.4.3 A desigualdade de Clausius .................................................................................................. 95
6.0 CICLOS DE POTNCIA E REFRIGERAO A VAPOR ....................................... 96
6.1 Ciclo Rankine ......................................................................................................................... 96
6.2 Eficincia do Ciclo Rankine ................................................................................................. 100
6.3 Ciclo com Reaquecimento ..................................................................................................... 107
6.4 Efeito de perdas de Eficincia dos Ciclos de Potncia .......................................................... 109
6.5 Ciclo de Refrigerao a Vapor .............................................................................................. 111
Captulo 1 Introduo MAQUINAS TRMICAS - EQM/UNISUL
2
1.0 INTRODUO
Nos referimos a um dispositivo operando segundo um ciclo termodinmico como uma
mquina trmica um motor, uma bomba de calor ou um refrigerante. Se o objetivo do
dispositivo for adicionar trabalho, ento ele ser um motor trmico. Se o objetivo for adicionar
calor para um corpo (aquecimento), ento ele ser uma bomba de calor. Se o objetivo for retirar
calor de um corpo (resfriamento), ento ele ser um refrigerador. Genericamente, uma bomba
de calor e um refrigerador tm os mesmos ciclos como base. Motores convertem calor em
trabalho, enquanto refrigeradores e bombas de calor convertem trabalho em calor.
O projeto de sistemas envolvendo mquinas trmicas de interesse ao Engenheiro, que
pode estar voltado especificao de um ar condicionado at uma Usina Nuclear. O escoamento
de um fluido atravs de tal sistema pode ser visto como um meio contnuo, cujas quantidades
mensurveis, como presso, temperatura e velocidade, so obtidas a partir da mdia do
comportamento de suas molculas constituintes. Em uma mquina, frequentemente a energia
pode ser armazenada, convertida em outra ou transferida atravs das fronteiras do sistema na
forma de calor (Q) e Trabalho (W). A termodinmica a cincia que estuda o armazenamento, a
converso e a transferncia de energia. Na termodinmica obteremos equaes que relacionam
as converses e as transferncias de energia s propriedades como temperatura, presso e
densidade. As substncias e suas propriedades, portanto, so muito importantes pois envolvem
aplicaes amplas para inmeros dispositivos transformadores de energia. Muitas destas
equaes so baseadas em experimentaes que foram organizadas em enunciados matemticos
ou leis, como a primeira e a segunda leis da termodinmica, que no caso desta disciplina estar
voltada aos ciclos de refrigerao, potncia e vapor.
Captulo 1 Introduo MAQUINAS TRMICAS - EQM/UNISUL
3
1.1 Conceitos Bsicos
Sistema Termodinmico
Sistema termodinmico consiste em uma quantidade de matria ou regio para a qual
nossa ateno est voltada. Demarcamos um sistema termodinmico em funo daquilo que
desejamos calcular. Tudo que se situa fora do sistema termodinmico chamado MEIO ou
VIZINHANA. O sistema termodinmico a ser estudado demarcado atravs de uma
FRONTEIRA ou SUPERFCIE DE CONTROLE a qual pode ser mvel, fixa, real ou imaginria.
Sistema Fechado
o sistema termodinmico no qual no h fluxo de massa atravs das fronteiras que
definem o sistema.
Volume de Controle
Ao contrrio do sistema fechado, o sistema termodinmico no qual ocorre fluxo de
massa atravs da superfcie de controle que define o sistema. Assim, dependendo da interao
entre o sistema termodinmico definido para estudo, e a vizinhana, chamaremos a essa regio de
Sistema Fechado (demarcado pela fronteira) ou Volume de Controle (demarcado pela superfcie
de controle) conforme se verifique as definies acima citadas.
Exemplos de Sistema Fechado e Volume de Controle
A Figura 1.1 um sistema termodinmico fechado, pois no h fluxo de massa atravs
das fronteiras do sistema, embora haja fluxo de calor.
Figura 1.1 - Sistema fechado
A Figura 1.2, por sua vez, constitui um volume de controle pois temos fluxo de massa
atravessando a superfcie de controle do sistema.
Captulo 1 Introduo MAQUINAS TRMICAS - EQM/UNISUL
4
Figura 1 .2 - Volume de controle
Sistema Isolado
Dizemos que um sistema termodinmico isolado quando no existe qualquer interao
entre o sistema termodinmico e a sua vizinhana. (ou seja, atravs das fronteiras no ocorre
fluxo de calor, massa, trabalho etc. )
1.2 Estado e Propriedades de uma Substncia
Se considerarmos uma massa de gua, reconhecemos que ela pode existir sob vrias
formas. Se inicialmente lquida pode-se tornar vapor aps aquecida ou slida quando resfriada.
Assim nos referimos s diferentes fases de uma substncia: uma fase definida como uma
quantidade de matria totalmente homognea; quando mais de uma fase est presente, as fases se
acham separadas entre si por meio dos contornos das fases. Em cada fase a substncia pode
existir a vrias presses e temperaturas ou, usando a terminologia da termodinmica, em vrios
estados. O estado pode ser identificado ou descrito por certas propriedades macroscpicas
observveis; algumas das mais familiares so: temperatura, presso, volume, etc. Cada uma das
propriedades de uma substncia num dado estado tem somente um valor definido e essa
propriedade tem sempre o mesmo valor para um dado estado, independente da forma pela qual a
substncia chegou a ele. De fato, uma propriedade pode ser definida como uma quantidade que
depende do estado do sistema e independente do caminho (isto , da histria) pelo qual o
sistema chegou ao estado considerado. Inversamente, o estado especificado ou descrito pelas
propriedades.
Propriedades Termodinmicas - As propriedades termodinmicas podem ser divididas
em duas classes gerais, as intensivas e as extensivas.
Propriedade Extensiva - Chamamos de propriedade extensiva quela que depende do tamanho
(extenso) do sistema ou volume de controle. Assim, se subdividirmos um sistema em vrias
Captulo 1 Introduo MAQUINAS TRMICAS - EQM/UNISUL
5
partes (reais ou imaginrias) e se o valor de uma dada propriedade for igual soma das
propriedades das partes, esta uma varivel extensiva. Por exemplo: Volume, Massa, etc.
Propriedade Intensiva - Ao contrrio da propriedade extensiva, a propriedade intensiva,
independe do tamanho do sistema. Exemplo: Temperatura, Presso etc.
Propriedade Especfica - Uma propriedade especfica de uma dada substncia obtida dividindo-
se uma propriedade extensiva pela massa da respectiva substncia contida no sistema. Uma
propriedade especfica tambm uma propriedade intensiva do sistema. Exemplo de propriedade
especfica:
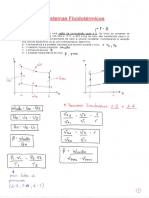
Volume especfico
M
V
v =
Energia Interna especfica:
M
U
u =
onde: M a massa do sistema, V o respectivo volume e U a energia interna total do sistema.
1.3 Mudana de Estado de um Sistema Termodinmico
Em uma mquina trmica, comum encontrarmos sucesso de estados, cada um
caracterizado por um processo. Quando qualquer propriedade do sistema alterada, por exemplo;
presso, temperatura, massa, volume, entalpia, etc. dizemos que houve uma mudana de estado
no sistema termodinmico.
Processo pode ser definido pela sucesso de estados atravs dos quais o sistema passa.
Quando um fluido percorre um ciclo em uma mquina, o mesmo sofre transformaes, alterando
suas propriedades. Dependendo do equipamento ou dispositivo em que o fluido atravessa neste
ciclo , podemos caracterizar e identificar os processos como:
- Processo Isobrico (presso constante)
- Processo Isotrmico (temperatura constante)
- Processo Isocrico (isomtrico) (volume constante)
- Processo Isoentlpico (entalpia constante)
- Processo Isoentrpico (entropia constante)
- Processo Adiabtico (sem transferncia de calor)
Captulo 1 Introduo MAQUINAS TRMICAS - EQM/UNISUL
6
Ciclo Termodinmico - Quando um sistema (substncia), em um dado estado inicial, passa
por certo nmero de mudana de estados ou processos e finalmente retorna ao estado inicial, o
sistema executa um ciclo termodinmico. Deve ser feita uma distino entre ciclo
termodinmico, descrito acima, e um ciclo mecnico. Um motor de combusto interna de quatro
tempos executa um ciclo mecnico a cada duas rotaes. Entretanto o fluido de trabalho no
percorreu um ciclo termodinmico dentro do motor, uma vez que o ar e o combustvel so
queimados e transformados nos produtos de combusto, que so descarregados para a atmosfera.
1.4 Lei Zero da Termodinmica
Quando dois corpos tem a mesma temperatura dizemos que esto em equilbrio trmico entre si.
Podemos definir a lei zero da termodinmica como: " Se dois corpos esto em equilbrio trmico
com um terceiro eles esto em equilibrio trmico entre si ". A lei zero da termodinmica define os
medidores de temperatura, os termmetros.
1.5 Classificao das Mquinas Trmicas
Chamam-se mquinas trmicas a todos aqueles sistemas que funcionando periodicamente
sejam susceptveis de transformar calor em trabalho. O calor pode proceder, na maioria dos
casos, de uma reao qumica (combusto), sendo absorvido pelo fluido, o agente motor,
encarregado de colocar em movimento os mecanismos que exercem as foras sobre o meio
exterior.
A combusto pode se realizar:
a) Fora da mquina trmica (motores de combusto externa):
- De movimento alternativo, como as mquinas de pisto a vapor
- De movimento rotativo, como as turbinas de vapor
b)Dentro do mesmo cilindro(motores de combusto interna)
- De movimento alternativo, como os motores a exploso
- De movimento rotativo como as turbinas gs
Captulo 1 Introduo MAQUINAS TRMICAS - EQM/UNISUL
7
O agente motor pode ser:
a) A gua que vaporizada em uma caldeira se expande contra um cilindro de trabalho ou em uma
turbina.
b) Uma mistura de gases, resultantes da combusto de produtos derivados do petrleo, na forma
explosiva ou progressiva, no interior de um cilindro de trabalho.
A condio bsica para o estudo destas mquinas reside no Segundo Princpio da Termodinmica
segundo o qual as mquinas trmicas retiram calor de uma fonte a uma temperatura T
1
e cedem
uma frao do mesmo a outra fonte a uma temperatura mais baixa T
2
(refrigerante),
transformando o restante em trabalho
Figura 1.1 Esquema de Funcionamento de uma Central Trmica
Captulo 1 Introduo MAQUINAS TRMICAS - EQM/UNISUL
8
Na Figura 1.1 a gua (ou qualquer fluido condensvel) contido na caldeira recebe calor de
uma fonte e se transforma em vapor a uma temperatura temperatura determinada que depende da
presso na caldeira. O vapor saturado seco eleva ainda mais a sua temperatura se o mesmo passa
atravs de um reaquecedor conectado diretamente na caldeira, obtendo um vapor reaquecido
com a entalpia determinada pela presso e temperatura correspondente. O vapor passa atravs das
lminas de uma turbina, ou se dirige contra o mbolo de um cilindro de expanso, obtendo-se
assim, trabalho e provocando uma reduo da presso e temperatura do vapor, o que corresponde
a uma reduo da entalpia. O estado final do vapor pode ser o vapor reaquecido ou de vapor
mido, no ltimo caso haver condensao parcial, passando para um condensador, onde se
liquefaz o vapor restante, temperatura ambiente, cedendo o calor de condensao ao
refrigerante que pode ser o prprio ar ou a gua. O lquido condensado haver cedido nesta
operao Q
2
calorias ao refrigerante. Este lquido condensado, se adiciona ao sistema com ajuda
de uma bomba, a um pr-aquecedor, ou diretamente na caldeira, encerrando-se o ciclo.
Captulo 2 Propriedades Termodinmicas MAQUINAS TRMICAS - EQM/UNISUL
9
2.0 PROPRIEDADES TERMODINMICAS
2.1 Propriedades de uma Substncia Pura
2.1.1 Substncia Pura
Substncia pura aquela que tem composio qumica invarivel e homognea. Pode
existir em mais de uma fase, mas a sua composio qumica a mesma em todas as fases. Assim
gua lquida e vapor d'gua ou uma mistura de gelo e gua lquida so todas substncia puras,
pois cada fase tem a mesma composio qumica. Por outro lado uma mistura de ar lquido e
gasoso no uma substncia pura, pois a composio qumica da fase lquida diferente daquela
da fase gasosa. Neste trabalho daremos nfase quelas substncias que podem ser chamadas de
substncia simples compressveis. Por isso entendemos que efeitos de superfcie, magnticos e
eltricos, no so significativos quando se trata com essas substncias.
Equilbrio de Fase Lquido - Vapor - Considere-se como sistema 1 kg de gua contida no
conjunto mbolo-cilindro como mostra a Figura 2.1. Suponha que o peso do mbolo e a presso
atmosfrica local mantenham a presso do sistema em 1,014 bar e que a temperatura inicial da
gua seja de 15
O
C. medida que se transfere calor para a gua a temperatura aumenta
consideravelmente e o volume especfico aumenta ligeiramente (Figura. 2.1 B) enquanto a
presso permanece constante. Quando a gua atinge 100
O
C uma transferncia adicional de calor
implica em uma mudana de fase como mostrado na Figura. 2.1 B para a Figura. 2.1 C, isto :
uma parte do lquido torna-se vapor e, durante este processo, a presso permanecendo constante,
a temperatura tambm permanecer constante mas a quantidade de vapor gerada aumenta
consideravelmente (aumentado o volume especfico), como mostra a Figura. 2.1 C. Quando a
ltima poro de lquido tiver vaporizado (Figura. 2.1 D) uma adicional transferncia de calor
resulta em um aumento da temperatura e do volume especfico como mostrado nas Figuras. 2.1 E
e . 2.1 F
Captulo 2 Propriedades Termodinmicas MAQUINAS TRMICAS - EQM/UNISUL
10
Figura 2.1 - Representao da terminologia usada para uma substncia pura presso P e Temperatura T, onde
Tsat a temperatura de saturao na presso de saturao P.
Temperatura de saturao - O termo designa a temperatura na qual se d a vaporizao de
uma substncia pura a uma dada presso. Essa presso chamada presso de saturao para a
temperatura dada. Assim, para a gua (estamos usando como exemplo a gua para facilitar o
entendimento da definio dada acima) a 100
o
C, a presso de saturao de 1,014 bar, e para a
gua a 1,014 bar de presso, a temperatura de saturao de 100
o
C. Para uma substncia pura h
uma relao definida entre a presso de saturao e a temperatura de saturao correspondente.
Lquido Saturado - Se uma substncia se encontra como lquido temperatura e presso
de saturao diz-se que ela est no estado de lquido saturado, Figura.2.1 B.
Lquido Subresfriado - Se a temperatura do lquido menor que a temperatura de
saturao para a presso existente, o lquido chamado de lquido sub-resfriado (significa que a
temperatura mais baixa que a temperatura de saturao para a presso dada), ou lquido
comprimido, Figura. 2.1 A, (significando ser a presso maior que a presso de saturao para a
temperatura dada).
Ttulo (x) - Quando uma substncia se encontra parte lquida e parte vapor, vapor
mido, Figura. 2.1C, a relao entre a massa de vapor pela massa total, isto , massa de lquido
mais a massa de vapor, chamada ttulo. Matematicamente:
Captulo 2 Propriedades Termodinmicas MAQUINAS TRMICAS - EQM/UNISUL
11
t
v
l v
v
m
m
m m
m
x =
+
= 2.1
Vapor Saturado - Se uma substncia se encontra completamente como vapor na
temperatura de saturao, chamada vapor saturado, Figura. 2.1 D, e neste caso o ttulo igual
a 1 ou 100% pois a massa total (mt) igual massa de vapor (mv), (freqentemente usa-se o
termo vapor saturado seco).
Vapor Superaquecido - Quando o vapor est a uma temperatura maior que a temperatura
de saturao chamado vapor superaquecido Figura. 2.1-1e. A presso e a temperatura do
vapor superaquecido so propriedades independentes, e neste caso, a temperatura pode ser
aumentada para uma presso constante. Em verdade, as substncias que chamamos de gases so
vapores altamente superaquecidos. A Figura. 2.1 retrata a terminologia que acabamos de definir
para os diversos estados termodinmicos em que se pode encontrar uma substncia pura.
Consideraes importantes
1) Durante a mudana de fase de lquido-vapor presso constante, a temperatura se
mantm constante; observamos assim a formao de patamares de mudana de fase em um
diagrama de propriedades no plano T x v ou P x v, como mostrado na Figura. 2.2. Quanto maior a
presso na qual ocorre a mudana de Fase lquido-vapor maior ser a temperatura.
2) Aumentando-se a presso observa-se no diagrama que as linhas de lquido saturado e
vapor saturado se encontram. O ponto de encontro dessas duas linhas define o chamado "Ponto
Crtico". Presses mais elevadas que a presso do ponto crtico resulta em mudana de fase de
lquido para vapor superaquecido sem a formao de vapor mido.
Figura 2.2 - diagrama T x v e diagrama P x v
Captulo 2 Propriedades Termodin
3) A linha de lquido saturado levemente inclinada em relao vertical
volumtrica (quanto maior a temperatura maior o volume
de vapor superaquecido fortemente inclinada
do vapor. A Figura. 2.2 b
temperatura constante e o
para a gua, :
Pcrtica = 22,09 MPa;
Tcrtica = 374,14
O
C
Vcritico = 0,003155 m3 / kg
Ponto Triplo - Corresponde ao estado no qual as trs fases (slido, lquido
encontram em equilbrio. A
outra substncia o formato do diagrama o mesmo.
acima da presso do ponto
temperatura correspondente na curva de presso de vapor. Resfriando o sistema ainda mais
atingida uma temperatura na qual o lquido ir se solidificar. Este processo
linha horizontal 123 na
Figura 2.3 Diagrama de fases para a gua (sem escala)
Para uma substncia
aquecida observe que, mantendo a presso constante, ser atingida
passa da fase slida diret
mostrado na Figura. 2.3 no processo 4
triplo para a gua corresponde a 0,6113 kPa e 0,01
Propriedades Termodinmicas MAQUINAS TRMICAS
12
3) A linha de lquido saturado levemente inclinada em relao vertical
volumtrica (quanto maior a temperatura maior o volume ocupado pelo lq
fortemente inclinada em sentido contrrio devido compressibilidade
b mostra o diagrama P -V no qual fcil visualizar as linhas de
ponto de inflexo da isoterma crtica Como exemplo, o ponto crtico
Vcritico = 0,003155 m3 / kg
Corresponde ao estado no qual as trs fases (slido, lquido
encontram em equilbrio. A Figura. 2.3 mostra um diagrama de fases
outra substncia o formato do diagrama o mesmo. Uma substncia na fase vapor com presso
acima da presso do ponto triplo muda de fase (torna-se lquido) ao ser resfriada at a
orrespondente na curva de presso de vapor. Resfriando o sistema ainda mais
atingida uma temperatura na qual o lquido ir se solidificar. Este processo
na Figura. 2.3.
Diagrama de fases para a gua (sem escala)
Para uma substncia na fase slida com presso abaixo da presso do ponto
mantendo a presso constante, ser atingida uma temperatura na qual ela
diretamente para a fase vapor, sem passar
. 2.3 no processo 45. Como exemplo a presso e a
corresponde a 0,6113 kPa e 0,01
O
C respectivamente
micas MAQUINAS TRMICAS - EQM/UNISUL
3) A linha de lquido saturado levemente inclinada em relao vertical pelo efeito da dilatao
ocupado pelo lquido), enquanto a linha
em sentido contrrio devido compressibilidade
V no qual fcil visualizar as linhas de
Como exemplo, o ponto crtico
Corresponde ao estado no qual as trs fases (slido, lquido e gasosa) se
mostra um diagrama de fases (P x T). Para qualquer
Uma substncia na fase vapor com presso
se lquido) ao ser resfriada at a
orrespondente na curva de presso de vapor. Resfriando o sistema ainda mais ser
atingida uma temperatura na qual o lquido ir se solidificar. Este processo est indicado pela
com presso abaixo da presso do ponto triplo ao ser
uma temperatura na qual ela
passar pela fase lquida, como
Como exemplo a presso e a temperatura do ponto
Captulo 2 Propriedades Termodinmicas MAQUINAS TRMICAS - EQM/UNISUL
13
2.2 Propriedades Independentes das Substncias Puras
Uma propriedade de uma substncia qualquer caracterstica observvel dessa substncia.
Uns nmeros suficientes de propriedades termodinmicas independentes constituem uma
definio completa do estado da substncia. As propriedades termodinmicas mais comuns so:
temperatura (T), presso (P), e volume especfico (v) ou massa especfica (). Alm destas
propriedades termodinmicas mais familiares, e que so diretamente mensurveis , existem outras
propriedades termodinmicas fundamentais usadas na anlise de transferncia de energia (calor e
trabalho), no mensurveis diretamente, que so: energia interna especfica (u), entalpia
especfica (h) e entropia especfica (s).
Energia Interna (U) - a energia possuda pela matria devido ao movimento e/ou foras
intermoleculares. Esta forma de energia pode ser decomposta em duas partes:
a - Energia cintica interna, a qual devida velocidade das molculas e, b - Energia
potencial interna, a qual devida s foras de atrao que existem entre as molculas. As
mudanas na velocidade das molculas so identificadas macroscopicamente pela alterao da
temperatura da substncia (sistema), enquanto que as variaes na posio so identificadas pela
mudana de fase da substncia (slido, liquido ou vapor).
Entalpia (H) - na anlise trmica de alguns processos especficos, freqentemente
encontramos certas combinaes de propriedades termodinmicas. Uma dessas combinaes
ocorre quando temos um processo a presso constante, resultando sempre uma combinao (U +
PV). Assim considerou-se conveniente definir uma nova propriedade termodinmica chamada
ENTALPIA, representada pela letra H, determinada matematicamente pela relao:
PV U H + = 2.2
ou a entalpia especfica,
pv u h + = 2.3
Entropia (S) - Esta propriedade termodinmica representa, segundo alguns autores, uma
medida da desordem molecular da substncia ou, segundo outros, a medida da probabilidade de
ocorrncia de um dado estado da substncia. Matematicamente a definio de entropia
reversvel
T
Q
dS |
\
|
=
2.4
Captulo 2 Propriedades Termodinmicas MAQUINAS TRMICAS - EQM/UNISUL
14
2.3 Equaes de Estado
2.3.1 Equao de Estado para Gs ideal
Equao de estado de uma substncia pura uma relao matemtica que correlaciona
presso temperatura e volume especfico para um sistema em equilbrio termodinmico. De uma
maneira geral podemos expressar de forma genrica essa relao na forma da Eq. (2.5).
( ) 0 , , = T v P f 2.5
Existem inmeras equaes de estado, muitas delas desenvolvidas para relacionar as
propriedades termodinmicas para uma nica substncia, outras mais genricas, por vezes
bastante complexas, com objetivo de relacionar as propriedades termodinmicas de vrias
substncias. Uma das equaes de estado mais conhecida e mais simples aquela que relaciona
as propriedades termodinmicas de presso, volume especfico e temperatura absoluta do gs
ideal, que ;
T R v P = 2.6
onde P, a presso absoluta (manomtrica + baromtrica), em Pascal, v volume molar
especfico , em m
3
/kmol, R a constante universal do gs, que vale 8,314 kJ/kmol-K, e T a
temperatura absoluta, em Kelvin. Uma forma interessante de escrever a Eq. (2.6) usando o
volume especfico e a constante particular do gs, como na Eq. (2.7).
RT Pv = 2.7
onde v , o volume especfico do gs, em m3/kg e R a constante particular do gs. O valor de R
est relacionado constante universal dos gases pela massa molecular da substncia (M). Isto :
M R R / = 2.8
O fator de compressibilidade Z ajuda a determinar se a equao do gs ideal pode ser
usada ou no. O fator definido como:
RT
Pv
Z = 2.9
Se Z=1, ou um valor bem prximo a 1, a equao do gs ideal pode ser usada. O fator de
compressibilidade pode ser determinado para qualquer gs, usando-se uma carta de
compressibilidade generalizada.
Captulo 2 Propriedades Termodin
Na carta generalizada a presso reduzida P
Elas so calculadas por:
C
R
P
P
P = e
R
T =
Figura 2.1 Carta do Fator de Compressibilidade Generalizada.
FAIRES,V.M Problems on Thermodynamics.
2.3.1 Equao de Estado para Gs No ideal
Como sabemos, a Eq. (2.
presses. Para gases reais a presses um pouco mais
obtidos com a equao do gs ideal
de equaes mais elaboradas.
der Waals (1873) e foi apresentada como uma melhoria semi
que na forma molar ;
( ) RT b v
v
a
P =
|
|
\
|
+
2
Propriedades Termodinmicas MAQUINAS TRMICAS
15
Na carta generalizada a presso reduzida P
R
e a temperatura reduza T
C
T
T
=
.1 Carta do Fator de Compressibilidade Generalizada.
FAIRES,V.M Problems on Thermodynamics. Nova York: Macmillan, 1962
2.3.1 Equao de Estado para Gs No ideal
Como sabemos, a Eq. (2.6) ou (2.7) s representa satisfatoriamente
presses. Para gases reais a presses um pouco mais elevadas e gases poliatmicos os resultados
obtidos com a equao do gs ideal no satisfatrio, sendo necessrio, para gs real, lanar mo
elaboradas. A equao de estado para gs real mais antiga a equao de
(1873) e foi apresentada como uma melhoria semi-terica da equao de
RT
micas MAQUINAS TRMICAS - EQM/UNISUL
e a temperatura reduza T
R
devem ser usadas.
2.10
) s representa satisfatoriamente gases reais a baixas
elevadas e gases poliatmicos os resultados
o, para gs real, lanar mo
A equao de estado para gs real mais antiga a equao de van
terica da equao de gases ideais,
2.9
Captulo 2 Propriedades Termodinmicas MAQUINAS TRMICAS - EQM/UNISUL
16
O objetivo da constante "b" na equao corrigir o volume ocupado pelas molculas e o termo "
2
/ v a
" uma correlao que leva em conta as foras intermoleculares de atrao das molculas.
As constantes "a " e "b " so calculadas a partir do comportamento do gs. Estas constantes so
obtidas observando-se que a isoterma crtica (Figura. 2.2 b) tem um ponto de inflexo no ponto
crtico e portanto nesse ponto a inclinao nula. Os valores das constantes " a " e " b " so
determinados em funo das propriedades do ponto crtico, presso crtica , P
C
, e temperatura
crtica, T
C
, para cada gs.
c
2
c
2
P
T R
64
27
a =
c
c
P 8
RT
b = 2.10 e 2.11
Uma outra equao, considerada mais precisa que a equao de van der Waals e com o
mesmo nvel de dificuldade a equao de Redlich - kwong (1949), que para propriedades
molares :
( )
( )
2 / 1
T b v v
a
b v
RT
P
+
= 2.12
Esta equao de natureza emprica, as constantes "a " e " b " valem;
P
T
a
c
2 / 5
2
4278 , 0 =
c
c
P
RT
b 0866 , 0 = 2.13
Constantes para as equaes de estado de van der Waals e de Redlich-Kwong para
algumas substncias so dadas na tabela 2.3 -1. As constantes dadas na tabela (2.3-1) so para
presso, P, em bar, volume especfico molar, v em m3 / kmol e temperatura, T, em Kelvin.
Tabela 2.1
Captulo 2 Propriedades Termodinmicas MAQUINAS TRMICAS - EQM/UNISUL
17
Exerccio 2.1
Um tanque cilndrico vertical contm 4,0 kg de monxido de carbono gs temperatura de -50
O
C. O dimetro interno do tanque , D=0,2 m e o comprimento, L=1,0 m. Determinar a presso,
em bar, exercida pelo gs usando:
O modelo de gs ideal, b) O modelo de van der Waals, c) O modelo de Redlich Kwong, d)
Fator de compressibilidade.
Hipteses:
1) Como mostrado na Figura a seguir o gs adotado como sistema fechado
2) O sistema est em equilbrio termodinmico
Anlise:
O volume molar especfico do gs necessrio nos modelos requeridos, assim:
( )
3
2 2
m 0314 , 0
4
1 2 , 0 14159 , 3
4
L d
V = =
=
O volume molar especfico ser:
( ) kmol m kg m x kmol kg
m
V
M Mv v / 2198 , 0 /
4
0314 , 0
/ 28
3 3
= |
\
|
= = =
(a) A equao de estado para o gs ideal resulta:
( )
bar 41 , 84
Pa 10
bar
m
J
2198 , 0
15 , 273 50 8314
v
T R
P
5 3
=
|
\
|
|
\
| +
= = onde
K kmol
J
8314 R = e J/m
3
= Pa
(b) Para a Equao de estado de van der Waals as constantes a e b podem ser lidas
diretamente na tabela 2.1 , ento:
Captulo 2 Propriedades Termodinmicas MAQUINAS TRMICAS - EQM/UNISUL
18
|
|
\
|
=
|
|
\
|
=
kmol
m
b
kmol
m
bar a
3
2
3
0395 , 0 e 474 , 1 substituindo,
( )
( )
2 2
RT
P ou
v
a
b v
RT b v
v
a
P
= =
|
|
\
|
+
( )
( )
( )
bar
Pa
bar
3 , 72
2198 , 0
474 , 1
10
0395 , 0 2198 , 0
273,15 50 - 8314
P
2 5
=
|
|
\
|
+
=
(c)Tambm, para a equao de estado de Redlich-Kwong, da tabela 2.1, obtm-se:
|
|
\
|
=
|
|
\
|
=
kmol
m
b
kmol
K m
bar a
3
2
2 / 1 6
02737 , 0 e 22 , 17
Substituindo na respectiva equao, temos:
( )
( )
( ) ( )
( )( )
2 / 1 5 2 / 1
15 , 223 24717 , 0 21980 , 0
22 , 17
10
02737 , 0 2198 , 0
15 , 273 50 8314
|
|
\
|
+
=
+
=
Pa
bar
T b v v
a
b v
RT
P
bar 2 , 75 = P
(d) O fator de Compressibilidade encontrado a partir da carta generalizada de
compressibilidade, Figura 2.1. Para usar a carta devemos conhecer a temperatura e presso
reduzida.
( )
( ) 0,9 , T Z - - - 4 , 2
1 , 0
5 , 3
84,41bar
P 67 , 1
133
15 , 223
133
15 , 273 50
R
= > = |
\
|
= = = =
+
= =
R
c
R
c
R
P
bar
MPa
MPa P
P
T
T
T
( )
bar
Pa
bar x
v
ZRT
P 76
10
2198 , 0
15 , 273 50 8314 9 , 0
5
=
|
|
\
| +
= =
Comparando os valores calculados de Presso, a equao do modelo de gs ideal resulta
em 11% maior que a equao de van der Waals. Comparando o valor de Presso obtido pela
equao de van der Waals com dados obtidos do diagrama de compressibilidade este 5%
menor. O valor obtido pelo modelo de R-K 1% menor que o valor obtido no diagrama de
compressibilidade
Captulo 2 Propriedades Termodinmicas MAQUINAS TRMICAS - EQM/UNISUL
19
2.4 Tabelas de Propriedades Termodinmicas
Existem tabelas de propriedades termodinmicas para todas as substncias de interesse em
engenharia, so obtidas atravs das equaes de estado, do tipo mostrado anteriormente e esto
divididas em trs categorias, uma que relaciona as propriedades do lquido comprimido (ou
lquido subresfriado), outra que relaciona as propriedades de saturao (lquido saturado e vapor
saturado) e as tabelas de vapor superaquecido. As propriedades esto tabeladas em funo da
temperatura ou presso e em funo de ambas. Para a regio de liquido+vapor, (vapor mido)
conhecido o ttulo, x, as propriedades devem ser determinadas atravs das seguintes equaes:
( )
ls vs ls
u u x u u + = 2.14
( )
ls vs ls
h h x h h + = 2.15
( )
ls vs ls
v v x v v + = 2.16
( )
ls vs ls
s s x s s + = 2.17
As tabelas de (2.4-1) at (2.4-12) so exemplos de tabelas de propriedades
termodinmicas. Observe nessas tabelas que para condies de saturao basta conhecer apenas
uma propriedade para obter as demais, que pode ser temperatura ou presso, propriedades
diretamente mensurveis. Para as condies de vapor superaquecido e lquido comprimido
necessrio conhecer duas propriedades. Nas tabelas de propriedades saturadas, aqui apresentadas,
pode-se observar que para temperatura de 0
o
C e lquido saturado, o valor numrico de entalpia
igual a 100,00 kcal/kg para os refrigerantes R-12, R-22, e R-717, sendo igual a 200,00 kJ/kg para
o R- 134a, e a entropia, vale 1,00 para todas as tabelas dadas independente das unidades usadas.
Estes valores so adotados arbitrariamente como valores de referncia e os demais valores, so
calculados em relao a esses valores de referncia. Outros autores podem construir tabelas dos
mesmos refrigerantes com referncias diferentes. Quando as referncias so diferentes, como
dissemos, as propriedades tm outros valores nessas tabelas, entretanto, a diferena entre mesmos
estados igual para qualquer referncia adotada. Assim, o valor numrico da entalpia (h), e
entropia (S) em diferentes tabelas podem apresentar valores completamente diferentes para o
mesmo estado termodinmico, sem, contudo, modificar os resultados de nossas anlises trmicas,
bastando para tanto que se utilize dados de entalpia e entropia de uma mesma tabela, ou de
tabelas que tenham a mesma referncia. Para dados retirados de duas ou mais tabelas com
referncias diferentes estes devem ser devidamente corrigidos para uma nica referncia.
Captulo 2 Propriedades Termodin
Propriedades Termodinmicas MAQUINAS TRMICAS
20
micas MAQUINAS TRMICAS - EQM/UNISUL
Captulo 2 Propriedades Termodin
Propriedades Termodinmicas MAQUINAS TRMICAS
21
micas MAQUINAS TRMICAS - EQM/UNISUL
Captulo 2 Propriedades Termodin
Propriedades Termodinmicas MAQUINAS TRMICAS
22
micas MAQUINAS TRMICAS - EQM/UNISUL
Captulo 2 Propriedades Termodinmicas MAQUINAS TRMICAS - EQM/UNISUL
23
Captulo 2 Propriedades Termodin
Propriedades Termodinmicas MAQUINAS TRMICAS
24
micas MAQUINAS TRMICAS - EQM/UNISUL
Captulo 2 Propriedades Termodin
Propriedades Termodinmicas MAQUINAS TRMICAS
25
micas MAQUINAS TRMICAS - EQM/UNISUL
Captulo 2 Propriedades Termodinmicas MAQUINAS TRMICAS - EQM/UNISUL
26
Captulo 2 Propriedades Termodinmicas MAQUINAS TRMICAS - EQM/UNISUL
27
Captulo 2 Propriedades Termodin
Propriedades Termodinmicas MAQUINAS TRMICAS
28
micas MAQUINAS TRMICAS - EQM/UNISUL
Captulo 2 Propriedades Termodinmicas MAQUINAS TRMICAS - EQM/UNISUL
29
Captulo 2 Propriedades Termodin
Propriedades Termodinmicas MAQUINAS TRMICAS
30
micas MAQUINAS TRMICAS - EQM/UNISUL
Captulo 2 Propriedades Termodin
Propriedades Termodinmicas MAQUINAS TRMICAS
31
micas MAQUINAS TRMICAS - EQM/UNISUL
Captulo 2 Propriedades Termodinmicas MAQUINAS TRMICAS - EQM/UNISUL
32
(Exerccio 2.2)
a) Determine o volume especfico, a energia interna especfica, a entalpia especfica, e a
entropia especfica para lquido e vapor saturado da gua na presso de saturao de 2,5
MPa.
b) Determine o volume especfico, a entalpia especfica e a entropia especfica para a gua
com presso de 10 bar e temperatura de 300
O
C.
Soluo:
a) gua Saturada
Da tabela de propriedades da gua saturada (Tab. 2.4-1) para P = 25 bar (2,5MPa) temos a
correspondente temperatura de saturao, T = 224
O
C
As demais propriedades so:
kgK / kJ 2575 , 6 s kgK / kJ 5547 , 2 s
kg / kJ 1 , 2603 u kg / kJ 11 , 959 u
kg / kJ 1 , 2803 h kg / kJ 11 , 962 h
kg / m 0800 , 0 v kg / m 001973 , 0 v
kg / kJ 1 , 2603 u ; kg / kJ 11 , 959 u
vs s 1
vs s 1
vs s 1
3
vs
3
s 1
vs ls
= =
= =
= =
= =
= =
b) gua na presso de 10 bar (1Mpa) e Temperatura de 300
O
C
Da tabela de propriedades saturadas para P = 10 bar temos T = 179,9
O
C.
Logo, a gua a 300
O
C est superaquecida, na tabela de propriedades da gua superaquecida
(Tab. 2.4-3) temos:
K kg kJ 1229 7 s
kg kJ 2 3051 h
kg m 2579 0 v
3
/ ,
/ ,
/ ,
=
=
=
Captulo 2 Propriedades Termodinmicas MAQUINAS TRMICAS - EQM/UNISUL
33
(Exemplo 2.3) Considere um sistema composto de 2 kg de gua no estado lquido
temperatura de 80
O
C e presso de 50 bar. Determine o volume especfico e a entalpia para
o sistema.
a) atravs da tabela de propriedades comprimidas da gua
b) atravs da tabela de propriedades saturadas da gua
c) comente os desvios dos valores obtidos pelas duas formas.
Soluo:
a) Da tabela (2.4-4) de lquido comprimido para a gua a 50 bar (5MPa) e temperatura de
80
O
C temos; v = 0,0010268 m3 /kg e h = 338,85 kJ/kg
(observe que a temperatura de saturao correspondente presso de 50 bar de 263,99
O
C).
b) Como podemos observar, a tabela disponvel para propriedades saturadas, tabela (2.4-1),
no tem a temperatura de 80
O
C sendo necessrio fazermos interpolaes lineares, que
resulta em:
v = 0,0010291 m3 / kg e h= 334,91 kJ /kg
c) Os desvios da tabela de lquido comprimido em relao de saturao so:
% , x
,
, ,
h
% , x
,
, ,
v
16 1 100
85 338
91 334 85 338
22 0 100
0010268 0
0010291 0 0010268 0
=
=
=
=
Pelos resultados, observamos, observamos ser insignificantes os desvios dos valores das
propriedades obtidas pela tabela correta (liquido comprimido) e na forma aproximada, como
lquido saturado na temperatura em que se encontra a substncia sem levar em conta a presso.
A presso de saturao a 80
O
C de 0,4739 bar, bem inferior aos 50 bar do lquido comprimido.
Conclumos assim que, as propriedades de lquido comprimido so aproximadamente iguais s
de lquido saturado na mesma temperatura para substncias que podem ser admitidas como
incompressveis (para qualquer substncia incompressvel).
Captulo 2 Propriedades Termodinmicas MAQUINAS TRMICAS - EQM/UNISUL
34
(Exemplo 2.4) Considere um cilindro de volume interno igual a 0,14 m3, contendo 10 kg de
refrigerante R-134a. O cilindro usado para fins de reposio de refrigerante em sistemas
de refrigerao. Em um dado dia a temperatura ambiente de 26
o
C. Admita que o
refrigerante dentro do cilindro est em equilbrio trmico com o meio ambiente e determine
a massa de refrigerante no estado lquido e no estado vapor no interior do cilindro.
Soluo:
Conhecemos: tanque cilndrico de dimenses conhecidas contendo 10 kg de refrigerante R-134a
em equilbrio trmico a 26
O
C, determinar: massa no estado lquido e massa no estado vapor
Hiptese:
1) O gs no interior do cilindro o sistema termodinmico fechado
2) O sistema est em equilbrio termodinmico
Se no interior do cilindro tivermos de fato as duas fases: lquido+ vapor, ento o sistema
est na condio de vapor mido e podemos determinar o ttulo, x, da mistura. O volume
especfico da mistura, pela definio de volume especfico :
kg / m 014 , 0
kg 0 , 10
m 140 , 0
m
V
v
3
3
= = =
Da equao que relaciona volume especfico com ttulo temos;
( )
( )
( )
|
|
\
|
= + =
v v
v v
x v v x v v
ls vs
ls
ls vs ls
Da tabela de propriedades saturadas para o refrigerante R-134 a obtemos os valores de
volume especfico do lquido e do vapor que valem:
kg / m 0300 , 0 v e kg / m 0008 , 0 v
3
vs
3
ls
= =
Substituindo no ttulo, obtemos;
452 , 0
0008 , 0 03 , 0
0008 , 0 0140 , 0
=
= x
Da definio de ttulo, em que x= mv/m
l
, obtemos:
vapor de kg 52 , 4 kg 10 x 452 , 0 m
v
= = lquido de kg 48 , 5 kg 52 , 4 kg 10 m m m
v t l
= = =
lquido de kg 48 , 5 m
l
=
Captulo 2 Propriedades Termodinmicas MAQUINAS TRMICAS - EQM/UNISUL
35
2.5 Diagramas de Propriedades Termodinmicas
As propriedades termodinmicas de uma substncia, alm de serem apresentadas atravs
de tabelas, so tambm apresentadas na forma grfica, chamados de diagramas de propriedades
termodinmicas. Estes diagramas podem ter por ordenada e abscissa respectivamente T x v
(temperatura versus volume especfico), P x h (presso versus entalpia especfica), T x s
(temperatura versus entropia especfica) ou ainda h x s (entalpia especfica versus entropia
especfica). O mais conhecido desses diagramas o diagrama h x s conhecido como diagrama de
Mollier. Uma das vantagem do uso destes diagramas de propriedades que eles apresentam numa
s Figura as propriedades de lquido comprimido, do vapor mido e do vapor superaquecido
como est mostrado esquematicamente nas Figuras 2.5-1, 2.5-2 e 2.5-3.
Esses diagramas so teis tanto como meio de apresentar a relao entre as propriedades
termodinmicas como porque possibilitam a visualizao dos processos que ocorrem em parte do
equipamento sob anlise ou no todo. As trs regies caractersticas dos diagramas esto assim
divididas:
a) A regio esquerda da linha de liquido saturado (x=0) a regio de lquido comprimido ou
lquido sub-resfriado (aqui esto os dados referentes s tabelas de lquido comprimido)
b) A regio compreendida entre a linha de vapor saturado (x=1) e a linha de lquido saturado (x =
0) a regio de vapor mido. Nesta regio, em geral os diagramas apresentam linhas de ttulo
constante como esquematizadas nas Figuras.
c) A regio direita da linha de vapor saturado seco (x = 1) a regio de vapor superaquecido.
(nesta regio esto os dados contidos nas tabelas de vapor superaquecido). Dado o efeito de
Captulo 2 Propriedades Termodinmicas MAQUINAS TRMICAS - EQM/UNISUL
36
visualizao, aconselhvel, na anlise dos problemas termodinmicos, representar
esquematicamente os processos em um diagrama, pois a soluo torna-se clara. Assim, o
completo domnio destes diagramas essencial para o estudo dos processos trmicos.
As Figuras 2.5-4 e 2.5-5 a seguir, so diagramas de Mollier para a gua. Diagramas
completos e diagramas T x s para a gua podem ser encontrados na bibliografia citada. Para o
estudo de sistemas de refrigerao mais conveniente apresentar as propriedades em diagramas
que tenham como ordenada a presso absoluta e como abscissa a entalpia especfica. A Figura
2.5-6 o diagrama para o refrigerante R-12, a Figura 2.5-7 o diagrama para o refrigerante R-22,
a Figura 2.5-8 o diagrama para o refrigerante R-134a e a Figura 2.5-9 o diagrama P x h para a
amnia, que pela classificao da ASHRAE (American Society of Heating, Refrigerating, and
Air-Conditioning Engineers.) o refrigerante R-717.
Captulo 2 Propriedades Termodin
Figura 2.5-4 Partes do Diagrama de Mollier (h x s) para a gua
Propriedades Termodinmicas MAQUINAS TRMICAS
37
Partes do Diagrama de Mollier (h x s) para a gua
micas MAQUINAS TRMICAS - EQM/UNISUL
Captulo 2 Propriedades Termodin
Figura 2.5-5 Partes do Diagrama de Mollier (h x s) para a gua
Propriedades Termodinmicas MAQUINAS TRMICAS
38
5 Partes do Diagrama de Mollier (h x s) para a gua
micas MAQUINAS TRMICAS - EQM/UNISUL
Captulo 2 Propriedades Termodin
Figura 2.5-6 Diagrama Pxh para o refrigerante R12
Propriedades Termodinmicas MAQUINAS TRMICAS
39
6 Diagrama Pxh para o refrigerante R12
micas MAQUINAS TRMICAS - EQM/UNISUL
Captulo 2 Propriedades Termodin
Figura 2.5-7 Diagrama Pxh para o refrigerante R22
Propriedades Termodinmicas MAQUINAS TRMICAS
40
7 Diagrama Pxh para o refrigerante R22
micas MAQUINAS TRMICAS - EQM/UNISUL
Captulo 2 Propriedades Termodinmicas MAQUINAS TRMICAS - EQM/UNISUL
41
Figura 2.5-8 Diagrama Pxh para o refrigerante R134a
Captulo 2 Propriedades Termodin
Figura 2.5-7 Diagrama Pxh(sem a parte central) para o refrigerante R
Propriedades Termodinmicas MAQUINAS TRMICAS
42
7 Diagrama Pxh(sem a parte central) para o refrigerante R-717(amnia)
micas MAQUINAS TRMICAS - EQM/UNISUL
Captulo 2 Propriedades Termodinmicas MAQUINAS TRMICAS - EQM/UNISUL
43
Exemplo 2.5) Vapor de gua inicialmente a 4,0 MPa ( 40bar) e 300
o
C (estado 1) est
contido em um conjunto mbolo - cilindro. A gua ento resfriada a volume constante at
sua temperatura alcanar 200
o
C (estado 2). A seguir a gua comprimida isotermicamente
at um estado onde a presso de 2,5 MPa (estado 3).
a) Determine o volume especfico nos estados 1, 2 e 3, em m
3
/ kg e o ttulo no estado 2 se o
estado 2 for de vapor mido.
b) Localize os estados 1, 2 e 3 e esquematize os processos em um diagrama T- v e P- v.
Soluo: - Hipteses:
O vapor de gua o nosso sistema termodinmico - Em cada estado o sistema est em
equilbrio termodinmico.
Conhecido:
O estado inicial (1) P= 40 bar e T= 300
o
C e os processos subseqentes
a-1) da tabela de vapor saturado para a gua na presso de 40 bar a correspondente
temperatura de saturao 250,4
o
C. Assim a gua a 40 bar e 300
o
C est superaquecida. Da
tabela de vapor superaquecido temos v
1s
= 0,05884 m3/kg
a-2) Para determinarmos o estado (2) temos o volume especfico que igual ao volume
especfico do estado 1, v
2
= 0,05884 m3 /kg e a temperatura de 200
o
C. Da tabela de vapor
saturado, para a temperatura de 200
o
C, a respectiva presso de saturao 15,54 bar. O
volume especfico do lquido saturado vale v
2ls
= 0,0011565 m3/kg e do vapor saturado seco,
v
2vs
= 0,1274 m3/kg.
Como o volume especfico do estado 2 est entre o volume especfico do lquido e do
vapor saturado, ento inferimos que o estado 2 de vapor mido. Nos dois diagramas, o
processo de 1 para 2 indicado atravs de uma linha vertical desde o estado 1 at o estado 2
cuja temperatura de 200
o
C e a presso de 15,54 bar, na regio de vapor mido.
O ttulo no estado 2 obtido usando as relaes matemticas entre ttulo e volume
especfico, como j mostrado anteriormente, assim:
% 7 , 45 457 , 0
0011565 , 0 1274 , 0
0011565 , 0 05884 , 0
v v
v v
x
ls 2 vs 2
ls 2 2
2
= =
=
Captulo 2 Propriedades Termodinmicas MAQUINAS TRMICAS - EQM/UNISUL
44
a-3) O estado 3 cuja presso de 25 bar a temperatura a mesma do estado (2), 200
o
C. Como
a presso, 25 bar maior que a presso de saturao correspondente podemos facilmente inferir
do diagrama T x v que o estado de lquido comprimido. O processo de 2 para 3 est indicado
nas figuras do item b).
a-4) O volume do estado 1 e 2 so iguais, e seu valor lido da tabela de vapor superaquecido,
0,05884 m3/kg. O volume especfico do estado 3 deve ser obtido em uma tabela de lquido
comprimido, cujo valor , v
3
= 0,0011555 m3/kg ou de forma aproximada, de uma tabela de
saturao na temperatura de 200
o
C, independentemente da presso de saturao
correspondente, que v
3
= 0,0011565 m3/kg.
b) Representao dos estados e dos processos nos planos T x v e P x v
Captulo 2 Propriedades Termodinmicas MAQUINAS TRMICAS - EQM/UNISUL
45
(Exemplo 2.6) Em um equipamento de refrigerao industrial, cujo fluido de trabalho a
amnia, (R-717) o dispositivo de expanso (vlvula de expanso termosttica) reduz a
presso do refrigerante de 15,850 kgf/cm2 e lquido saturado (estado1) para a presso de
1,940 kgf/cm2 e ttulo, x = 0,212 (estado 2). Determinar:
a) O volume especfico, a temperatura e a entalpia especfica nos estados 1 e 2
b) Representar o processo de expanso na vlvula nos diagramas h-s e P-h
c) A que processo ideal mais se aproxima o processo de expanso na vlvula de expanso
termosttica (isocrico, isotrmico, isentrpico, isentlpico, isobrico)
Soluo:
a-1) Da tabela de saturao para a amnia obtemos as propriedades do lquido saturado na
presso de 15,850 kgf/cm2 (estado 1) T
1
= 40 0C, v
1s
= 0,0017257 m3/kg, h
1s
=145,53 kcal/kg,
s
1s
=1,1539 kcal/kg-K
a-2) As propriedades do estado 2 devem ser determinadas utilizando-se a definio de ttulo.
Assim, para a presso de 1,940 kgf/cm
2
as propriedades de lquido e vapor saturado so:
T = - 20
o
C.
Da tabela da amnia
kg / m 6237 , 0 v e kg / m 0,0015037 v
3
vs 2
3
ls 2
= =
kg / kcal 67 , 395 h e kg / kcal 17 , 78 h
vs 2 ls 2
= =
kcal/kg K 1717 , 2 s e K kg / kcal 9173 , 0 s
vs 2 ls 2
= =
Captulo 2 Propriedades Termodinmicas MAQUINAS TRMICAS - EQM/UNISUL
46
( ) v v x v v
ls 2 vs 2 2 ls 2 2
+ =
( )
ls 2 vs 2 ls 2 2
h h x h h + =
( )
ls 2 vs 2 ls 2 2
s s x s s + =
( ) 0,0015037 6237 , 0 212 , 0 0,0015037 v
2
+ = /kg m 1334 , 0 v
3
2
=
) 17 , 78 67 , 395 ( 212 , 0 17 , 78 h
2
+ = kg / kcal 48 , 145 h
2
=
( ) 9173 , 0 1717 , 2 212 , 0 9173 , 0 s
2
+ = K kg / kcal 1832 , 1 s
2
=
c) O processo ideal mais prximo o processo ISENTLPICO. (em qualquer processo de
estrangulamento o processo ideal o processo a entalpia constate, o fluido neste caso
acelerado, de forma que, o tempo de contato entre o fluido e a superfcie envolvente
extremamente pequeno no havendo tempo suficiente para a troca de calor, ento, h1 = h2).
Captulo 2 Propriedades Termodinmicas MAQUINAS TRMICAS - EQM/UNISUL
47
Exemplo 2.7) Uma turbina a vapor pode ser operada em condies de carga parcial
estrangulando-se o vapor que entra na turbina atravs de uma vlvula. (o processo de
estrangulamento um processo isentlpico) . As condies do vapor de gua na linha de
alimentao so P
1
=10 bar e T
1
=300
O
C. O vapor deixa a turbina com presso, P
3
= 0,1bar.
Como hiptese simplificadora adotemos que a turbina uma mquina adiabtica reversvel
(processo de expanso isentrpico). Pede-se indicar os processos em um diagrama h x S e
obter os dados de h, s, x, T,
a) Turbina operando a plena carga
b) Turbina operando em carga parcial com presso saindo da vlvula de estrangulamento
(V.R.P), P
2
= 5,0 bar
Soluo:
(caso a)
Neste caso, turbina operando a plena carga, significa que a vlvula controladora na entrada da
turbina no opera ( o mesmo que no existir) estado 1, P
1
= 10 bar e T
1
= 300
o
C como j
sabemos, da soluo anterior, este um estado de vapor superaquecido, assim da tabela de
vapor superaquecido, obtemos;
h
1
= 3051,2 kJ / kg v
1
= 0,2579 m3 /kg s
1
= 7,1229 kJ /kg-K
Estado 3
Processo isentrpico do estado 1 ao estado 3, ento, s
3
= s
1
= 7,1229 kJ/kg-K(da soluo
anterior, tambm sabemos que o estado 3 de vapor mido(se no tivssemos a soluo grfica
direta no diagrama de Mollier, teramos que verificar esta condio !) e presso de P
3
= 0,1 bar
. Assim obtemos das tabelas de saturao os valores para vapor saturado e para lquido
Captulo 2 Propriedades Termodinmicas MAQUINAS TRMICAS - EQM/UNISUL
48
saturado, e com a equao que relaciona ttulo com as demais propriedades na regio de vapor
mido podemos calcular o ttulo pois sabemos o valor da entropia.
Assim;
kg / kJ 83 , 191 h
ls
= ; kg / kJ 7 , 2584 h
vs
=
kg / m 0010103 , 0 v
3
ls
= kg / m 674 , 14 v
3
vs
=
K kg / kJ 6493 , 0 s
ls
= K kg / kJ 1502 , 8 s
vs
=
) s s ( x s s
ls vs 3 ls 3
+ =
86,3% ou 863 , 0
6494 , 0 1502 , 8
6493 , 0 1229 , 7
x
3
=
=
Logo:
kg / m 664 , 12 ) 0010102 , 0 674 , 14 ( 863 , 0 0010102 , 0 v
kg / kJ 9 , 2256 ) 83 , 191 7 , 2584 ( 863 , 0 83 , 191 h
3
3
3
= + =
= + =
(caso b)
Aqui, antes de ocorrer a expanso na turbina, ocorre o estrangulamento na vlvula controladora
da presso de 10 bar para 5 bar. Como o processo isentlpico, a entalpia do estado 2 igual
entalpia do estado 1, e como sabemos, o estado 2 de vapor superaquecido, da tabela de vapor
superaquecido para P
2
= 5,0 bar e h
2
= 3 051,2 kJ/kg, interpolando na tabela (2.4-3), obtemos:
T
2
= 293,6
o
C , v
2
= 0,5164 m3 /kg, s
2
= 7,4344 kJ/kg-K.
O estado 3, como sabemos da soluo anterior , de vapor mido, o procedimento para se obter
os dados o mesmo do item a) resultando: para P
3
= 0,1 bar e s
3
= s
2
.
x
3
= 90,46 %, h
3
= 2356,35 kJ/kg, s
3
=7,4344
kJ/kg-K,
v
3
= 13,2738 m3/kg
90,46% ou 9046 , 0
6494 , 0 1502 , 8
6493 , 0 4344 , 7
x
3
=
=
Assim, conclumos que a soluo grfica bem mais rpida e significativa, ver a seguir a
soluo atravs do diagrama de Mollier
Captulo 2 Propriedades Termodinmicas MAQUINAS TRMICAS - EQM/UNISUL
49
Valores lidos do prprio diagrama de MOLLIER , portanto, valores aproximados.
Captulo 2 Propriedades Termodinmicas MAQUINAS TRMICAS - EQM/UNISUL
50
EXERCCIOS PROPOSTOS:
2-6) Em que fase se encontra a gua, contida em um recipiente de paredes rgidas, em que a
temperatura de 100
o
C e a presso de a) 10 MPa, b) 20 kPa. Obs.: Use a tabela de
Propriedades saturadas para inferir a resposta.
2-7) Em um gerador de vapor industrial a gua entra com presso de 10 bar e temperatura de 150
o
C (estado 1). A gua sai desse gerador aps receber calor em um processo isobrico
temperatura de 250
o
C, (estado 2). Pede-se:
a) em que fase se encontram os estados 1 e 2 ?
b) Represente esquematicamente o processo de aquecimento da gua nos seguintes diagramas de
propriedades:
b-1) Coordenadas h x s (Entalpia versus Entropia)
b-2) Coordenadas T x s (Temperatura versus Entropia)
b-3) Coordenadas P x h (Presso versus Entalpia
2-8) Um tanque, cujo volume de 0,053 m
3
, contm freon 12, (R-12) a 40
o
C. O volume inicial
de lquido no tanque igual ao volume de vapor. Uma quantidade adicional de Freon - 12
forada para dentro do tanque at que a massa total dentro do tanque atinja 45 kg. Pede-se;
a) Qual o volume final de lquido no tanque admitindo-se que a temperatura seja de 40
o
C?
b) Que quantidade de massa foi adicionada ao tanque?
2-9) Em uma geladeira domestica, o condensador, que um trocador de calor de conveco
natural, (fica atrs da geladeira) projetado para que o refrigerante saia deste no estado de lquido
saturado. Em particular, em uma geladeira domestica cujo refrigerante o R-134a, o condensador
apresenta problemas e o refrigerante sai com presso de 1682,76 kPa e ttulo de 0,15.
Determinar;
a) A temperatura e o volume especfico do refrigerante neste estado.
b) Esquematizar o processo de resfriamento do refrigerante se este foi resfriado isobaricamente
da temperatura de 90
o
C at o estado final, em um diagrama P-h (Presso - Entalpia).
2-10) O compressor de um sistema frigorfico deve sempre aspirar vapor superaquecido.
Determinar as propriedades termodinmicas do R-22 quando a presso de suco for de 2,0
kgf/cm
2
e estiver superaquecido de 15
o
C.
2-11) Determine as propriedades termodinmicas do R-12 presso de 10 kgf/cm
2
e temperatura
de 34
o
C. Em que regio se encontra a substncia.
Captulo 3 Calor e Trabalho MAQUINAS TRMICAS - EQM/UNISUL
51
3.0 CALOR E TRABALHO
3.1 Trabalho Termodinmico
Trabalho e calor so a essncia da termodinmica. Assim fundamental que o estudante
de termodinmica entenda claramente as duas definies tendo em vista que a anlise correta de
muitos problemas trmicos depende da distino entre elas. Podemos definir o trabalho
termodinmico como: "Um sistema realiza trabalho se o nico efeito sobre o meio (tudo externo
ao sistema) PUDER SER o levantamento de um peso." Note-se que o levantamento de um peso
realmente uma fora que age atravs de uma distncia. Observe tambm que nossa definio no
afirma que um peso foi realmente levantado ou que uma fora agiu realmente atravs de uma
dada distncia, mas que o nico efeito externo ao sistema poderia ser o levantamento de um peso.
O trabalho realizado por um sistema considerado positivo e o trabalho realizado sobre o sistema
negativo. O smbolo W designa o trabalho termodinmico.
Em geral falaremos de trabalho como uma forma de energia. Vamos ilustrar a definio de
trabalho fazendo uso de dois exemplos. Considere como sistema a bateria e o motor eltrico
delimitados pela fronteira como mostrados na figura 3.1-1a , e faamos com que o motor acione
um ventilador. A pergunta que segue a seguinte: O trabalho atravessar a fronteira do sistema
neste caso? Para responder a essa pergunta usando a definio de trabalho termodinmico dada
anteriormente vamos substituir o ventilador por um conjunto de polia e peso como mostra a
figura 3.1-1b.
Figura 3.1 -1 a) Trabalho Termodinmico Figura 3.1 -1 b) Trabalho Termodinmico
Com a rotao do motor um peso pode ser levantado e o nico efeito no meio to
somente o levantamento de um peso. Assim para o nosso sistema original da Fig. 3.1-1a
conclumos que o trabalho atravessa a fronteira do sistema. Agora, faamos com que o nosso
sistema seja constitudo somente pela bateria como mostra a figura 3.1-2. Neste caso quem cruza
a fronteira do sistema a energia eltrica da bateria.
Captulo 3 Calor e Trabalho MAQUINAS TRMICAS - EQM/UNISUL
52
Constitui trabalho termodinmico a energia eltrica cruzando a fronteira do sistema?. Sem
dvida, como o conjunto o mesmo do caso anterior, poder ocorrer o levantamento de um peso,
ento energia eltrica cruzando a fronteira do sistema tambm constitui trabalho como definido
anteriormente.
Figura 3.1.2) Trabalho Termodinmico
Unidades de Trabalho - Como j foi observado, consideramos trabalho realizado por um
sistema, tal como o realizado por um gs em expanso contra um mbolo, como positivo, e o
trabalho realizado sobre o sistema, tal como o realizado por um mbolo ao comprimir um gs,
como negativo. Assim, trabalho negativo significa que energia acrescentada ao sistema. Nossa
definio de trabalho envolve o levantamento de um peso, isto , o produto de uma unidade de
fora ( Newton) agindo atravs de uma distncia ( metro). Essa unidade de trabalho no sistema
Internacional chamada de Joule, ( J ).
1 J = 1N.m
Definimos POTNCIA como trabalho por unidade de tempo, e a representamos por
s
J
W Watt
dt
w
W
1
) ( =
=
&
3.1
Trabalho Realizado Devido ao Movimento de Fronteira de um Sistema Compressvel
Simples num Processo Quase-Esttico - J observamos que h vrias maneiras pelas quais o
trabalho pode ser realizado sobre ou por um sistema. elas incluem o trabalho realizado por um
eixo rotativo, trabalho eltrico e o trabalho realizado devido ao movimento da fronteira do
sistema, tal como o efetuado elo movimento do mbolo num cilindro. Neste curso vamos
considerar com alguns detalhes o trabalho realizado pelo movimento da fronteira do sistema
compressvel simples durante um processo quase-esttico.
Captulo 3 Calor e Trabalho MAQUINAS TRMICAS - EQM/UNISUL
53
Consideremos como sistema o gs contido num cilindro com mbolo, como mostrado na
Fig 3.1.3. Vamos tirar um dos pequenos pesos do mbolo provocando um movimento para cima
deste, de uma distncia dx. Podemos considerar este pequeno deslocamento de um processo
quase- esttico e calcular o trabalho, W, realizado pelo sistema durante este processo. A fora
total sobre o mbolo P. A, onde P a presso do gs e A a rea do mbolo. Portanto o
trabalho infinitesimal W :
PAdx W = 3.2
Porm verificamos que de 3.2 Adx dV= , a variao do volume dogs devido ao deslocamento,
dx, ento
PdV W = 3.3
Figura 3.1-3 - Exemplo de trabalho efetuado pelo movimento de fronteira de um sistema
O trabalho realizado devido ao movimento de fronteira , durante um dado processo quase-
esttico, pode ser determinado pela integrao da Eq. 3.3. Entretanto essa integrao somente
pode ser efetuada se conhecermos a relao entre P e V durante esse processo. Essa relao pode
ser expressa na forma de uma equao ou pode ser mostrada na forma grfica. Consideremos "em
primeira" a soluo grfica, usando como exemplo um processo de compresso tal como o que
ocorre durante a compresso de ar em um cilindro como mostra a Fig. 3.1-4.
Figura 3.1-4 Uso do diagrama PxV para mostrar o trabalho efetuado pelo movimento de fronteira de um sistema
Captulo 3 Calor e Trabalho MAQUINAS TRMICAS - EQM/UNISUL
54
No inicio do processo o mbolo est na posio 1 e a presso relativamente baixa. Esse
estado est representado no diagrama P x V como mostra a figura. No fim do processo, o mbolo
est na posio 2 e o estado correspondente do sistema mostrado pelo ponto 2 no
diagrama P x V. Vamos admitir que essa compresso seja um processo quase-esttico e que,
durante o processo, o sistema passe atravs dos estados mostrados pela linha que liga os pontos 1
e 2 do diagrama P x V. A hiptese de um processo quase-esttico, aqui, essencial, porque cada
ponto da linha 1-2 representa um estado definido e estes estados correspondero aos estados reais
do sistema somente se o desvio do equilbrio for infinitesimal. O trabalho realizado sobre o gs
durante este processo de compresso pode ser determinado pela integrao da Eq. 3.3, resultando:
= =
2
1
2
1
2 1
PdV W W 3.4
O smbolo W
1-2
deve ser interpretado como o trabalho realizado durante o processo, do
estado 1 ao estado 2. Pelo exame do diagrama P x V, evidente que o trabalho realizado durante
esse processo representado pela rea sob a curva 1-2, ou seja a rea, a-1-2-b-a. Neste exemplo,
o volume diminuiu e a rea a-1-2-b-a representa o trabalho realizado sobre o sistema (trabalho
negativo). Se o processo tivesse ocorrido do estado 2 ao estado 1, pelo mesmo caminho, a mesma
rea representaria o trabalho realizado pelo sistema (trabalho positivo). Uma nova considerao
do diagrama P x V, Fig. 3.1-5, conduz a uma outra concluso importante.
Figura 3.1-5 Vrios processos quase estticos entre dois estados dados.
possvel ir do estado 1 ao estado 2 por caminhos quase-estticos muito diferentes, tais
como A, B ou C. Como a rea sob a curva representa o trabalho para cada processo evidente
que o trabalho envolvido em cada caso uma funo no somente dos estados iniciais e finais do
processo, mas tambm, do caminho que se percorre ao ir de um estado a outro. Por esta razo, o
trabalho chamado de funo de linha, ou em linguagem matemtica, W uma diferencial
inexata. Na determinao da integral da Eq. 3.4 devemos sempre lembrar que estamos
Captulo 3 Calor e Trabalho MAQUINAS TRMICAS - EQM/UNISUL
55
interessados na determinao da rea situada sob a curva da Fig. 3.1-4. Relativamente a este
aspecto, identificamos duas classes de problemas:
1- A relao entre P e V dada em termos de dados experimentais ou na forma grfica ( como,
por exemplo, o trao em um osciloscpio ). Neste caso podemos determinar a integral da
Eq. 3.4 por integrao grfica ou numrica.
2- A relao entre P e V tal que seja possvel ajustar uma relao analtica entre eles, e podemos
ento, fazer diretamente a integrao.
Um exemplo comum desse segundo tipo de relao o caso de um processo chamado
politrpico, no qual
n
2 2
n
1 1
n
V P V P constante PV = = = . O valor de n pode estar entre - a +,
dependendo do tipo de processo.
n
n
2 2
n
n
1 1
n
V
V P
V
V P
V
constante
P = = = 3.5
Para esse tipo de processo, podemos integrar a Eq. 3.4, resultando em:
( )
n 1
V V constante
1 n -
V
constante
V
dV
constante W W
n 1
1
n 1
2
2
1
1 n -
2
1
n
2
1
2 1
=
|
|
\
|
+
= = =
+
( ) ( )
n 1
V P V P
n 1
V V P V V P
PdV
1 1 2 2
2
1
n 1
1
n
1 1
n 1
2
n
2 2
3.6
Note que o resultado, Eq. 3.6, vlido para qualquer valor do expoente n, exceto n = 1.
No caso onde n = 1, tem-se;
2 2 1 1
V P V P constante PV = = = e portanto
1
2
1 1
2
1
2
1
1 1
V
V
ln V P
V
dV
V P PdV = =
3.7
Deve-se observar que nas Eqs. 3.6 e 3.7 no dissemos que o trabalho igual s expresses
dadas por aquelas equaes. Aquelas expresses fornecem o valor de uma certa integral, ou seja,
um resultado matemtico. Considerar ou no, que aquela integral corresponde ao trabalho num
dado processo, depende do resultado de uma anlise termodinmica do processo. importante
manter separado o resultado matemtico da anlise termodinmica, pois h muitos casos em que
o trabalho no dado pelas Eqs. 3.6 ou 3.7. O processo politrpico conforme j descrito, expe
uma relao funcional especial entre P e V durante um processo. H muitas relaes possveis,
algumas das quais sero examinadas nos problemas apresentados no final deste captulo.
Captulo 3 Calor e Trabalho MAQUINAS TRMICAS - EQM/UNISUL
56
Exemplo 3.1) Considere como sistema o gs contido no cilindro mostrado na figura, provido
de um mbolo sobre o qual so colocados vrios pesos pequenos. A presso inicial de 200
kPa e o volume inicial do gs de 0,04 m3.
a) Coloquemos um bico de Bunsen embaixo do cilindro e deixemos que o volume do gs
aumente para 0,1 m
3
, enquanto a presso permanece constante. Calcular o trabalho
realizado pelo sistema durante esse processo. C
Como a presso, neste caso constante, conclumos pela Eq. 3.4
( ) ( ) kJ 0 , 12 m 04 , 0 1 , 0 kPa 200 V V P PdV W W
3
1 2
2
1
2
1
2 1
= = = = =
b) Consideremos o mesmo sistema e as mesmas condies iniciais e finais, porm, ao
mesmo tempo que o bico de Bunsen est sob o cilindro e o mbolo se levanta,
removamos os pesos deste, de tal maneira que durante o processo a temperatura se
mantm constante.
Se admitirmos que o gs se comporta como gs ideal, ento mRT PV = e notamos que
este processo politrpico com o expoente n = 1, pois a massa, m, do sistema constante, R a
constante do gs e sendo T constante, mRT = constante. Da nossa anlise anterior, conclumos
que o trabalho dado pela Eq. 3.7, Portanto:
( ) kJ 33 , 7
04 , 0
1 , 0
ln m 04 , 0 kPa 200
V
dV
V P PdV W
3
2
1
2
1
1 1 2 1
= = = =
Captulo 3 Calor e Trabalho MAQUINAS TRMICAS - EQM/UNISUL
57
c) Consideremos o mesmo sistema porm, durante a troca de calor removamos os pesos de
tal maneira que a expresso PV
1,3
= constante descreva a relao entre a presso e o
volume durante o processo. Novamente o volume final 0,1 m
3
. Calcular o trabalho.
Esse processo politrpico , no qual n = 1,3. Analisando o processo, conclumos
novamente que o trabalho dado pela Eq. 3.6, assim:
kPa 77 , 60
1 , 0
04 , 0
200
V
V
P P
3 , 1 3 , 1
2
1
1 2
= |
\
|
=
|
|
\
|
=
e
( )
kJ 41 , 6
3 , 1 1
04 , 0 x 200 1 , 0 x 77 , 60
PdV W
2
1
2 1
=
= =
d) Consideremos o sistema e o estado inicial dados nos trs primeiros exemplos, porm
mantenhamos o mbolo preso por meio de um pino, de modo que o volume permanea
constante. Alm disso faamos com que o calor seja transferido do sistema para o meio
at que a presso caia a 100kPa. Calcular o trabalho.
Como dW= P.dV, para um processo quase-esttico, o trabalho igual a zero porque,
neste caso, no h variao do volume, isto , dV=0. O processo em cada um dos quatro
exemplos est mostrado na Figura ao lado. O processo 1-2a um processo a presso constante e
a rea 1-2a-f-e-1 representa o respectivo trabalho. Analogamente, a linha 1-2-b representa o
processo em que PV = constante, a linha 1-2c representa o processo em que PV
1,3
= constante
e a linha 1-2d representa o processo a volume constante. O estudante deve comparar as reas
relativas sob cada curva com os resultados numricos obtidos acima.
Figura 3.1-7 Diagrama Presso-volume mostrando o trabalho realizado nos vrios processos.
Captulo 3 Calor e Trabalho MAQUINAS TRMICAS - EQM/UNISUL
58
Exemplo 3.2) Um cilindro com mbolo mvel, como mostrado na figura, contm 3 kg
dgua no estado de vapor mido com ttulo igual a 15 % e presso de 2,0 bar (estado 1 ).
Esse sistema aquecido presso constante at se obter o ttulo igual a 85 % ( estado 2 ).
Pede-se: a) Representar o processo em um diagrama P-V. e b) Calcular o trabalho
realizado pelo vapor durante o processo.
Da definio de Trabalho termodinmico devido ao movimento de fronteira, e sendo a
massa do sistema constante, temos:
( )
1 2
2
1
2
1
2 1
v v Pm dv Pm PdV W = = =
Propriedades do vapor umido a 2 bar: kg / m 8857 , 0 v kg / m 0010605 , 0 v
3
vs
3
ls
= =
Da definio de ttulo e da relao entre ttulo e uma propriedade qualquer na regio de
vapor mido temos:
kg / m 133756 , 0 ) 0010605 , 0 8857 , 0 ( 15 , 0 0010605 , 0 ) v v ( x v v
3
ls vs ls 1
= + = + =
kg / m 7530 , 0 ) 0010605 , 0 8857 , 0 ( 85 , 0 0010605 , 0 ) v v ( x v v
3
ls vs ls 2
= + = + =
Substituindo na expresso do trabalho, temos:
( )
kJ 5 , 371 W
133756 , 0 7530 , 0 x 3 x 10 x 2 W
2 1
5
2 1
=
=
Captulo 3 Calor e Trabalho MAQUINAS TRMICAS - EQM/UNISUL
59
Exemplo 3.3) Um cilindro com mbolo mvel, como mostrado na figura anterior (exemplo
3.2), contm 5 kg dgua no estado de vapor mido com ttulo igual a 20 % e presso de 5,0
bar (estado 1). Esse sistema aquecido presso constante at se obter a temperatura de
200
O
C (estado 2). Pede-se: a) Representar o processo em um diagrama P-v e h-s. b)
Determinar o trabalho realizado pela substncia de trabalho contra o mbolo, em kJ
Captulo 3 Calor e Trabalho MAQUINAS TRMICAS - EQM/UNISUL
60
H sistemas que envolvem outras formas de trabalho, como por exemplo: sistemas que
envolvem trabalho magntico e sistemas que envolvem trabalho eltrico. Tambm existem outros
sistemas que envolvem trabalho devido ao movimento de fronteira; um fio esticado sujeito a uma
fora e uma pelcula superficial. Deve-se observar tambm que h outras formas de trabalho que
podem ser identificadas em processos que no sejam quase-estticos. Um exemplo disso o
trabalho realizado por foras de cisalhamento, num processo que envolve atrito num fluido
viscoso, ou trabalho realizado por um eixo rotativo que atravessa a fronteira do sistema. A
identificao do trabalho um aspecto importante de muitos problemas termodinmicos. J
mencionamos que o trabalho s pode ser identificado nas fronteiras do sistema. Por exemplo,
consideremos a Fig 3.1-8 que mostra um gs separado do vcuo por uma membrana. Fazendo
com que a membrana se rompa, o gs encher todo o volume.
Figura 3.1-8 Exemplo de um processo, que envolve
variao de volume, para o qual o trabalho igual a zero.
Figura 3.1-9 - Exemplo mostrando como a escolha
do sistema determina se o trabalho est ou no
envolvido no processo.
Desprezando-se qualquer trabalho associado com a ruptura da membrana, podemos
indagar se h trabalho envolvido no processo. Se tomarmos como nosso sistema o gs e o espao
evacuado, conclumos prontamente que no h trabalho envolvido, pois nenhum trabalho
identificado na fronteira do sistema. Se, entretanto, tomarmos o gs como sistema, teremos uma
variao do volume e poderemos ser induzidos a calcular o trabalho pela integral. Entretanto este
no um processo quase esttico e, portanto, o trabalho no pode ser calculado, ao contrrio,
como no h resistncia na fronteira do sistema quando o volume aumenta, conclumos que, para
este sistema no h trabalho envolvido. Na Fig. 3.1-9a, o sistema consiste no recipiente mais o
gs. O trabalho atravessa a fronteira do sistema no ponto onde a fronteira intercepta o eixo e pode
ser associado como foras de cisalhamento no eixo rotativo. Na Fig. 3.1-9b, o sistema inclui o
eixo e o peso, bem como o gs e o recipiente. Neste caso no h trabalho atravessando a fronteira
do sistema, quando o peso se move para baixo.
Captulo 3 Calor e Trabalho MAQUINAS TRMICAS - EQM/UNISUL
61
3.2 Transferncia de Calor e Convenes
A definio termodinmica de calor um tanto diferente da interpretao comum da
palavra. Portanto, importante compreender claramente a definio de calor dada aqui, porque
ela se envolve em muitos problemas trmicos da engenharia. Se um bloco de cobre quente for
colocado em um bquer de gua fria, sabemos, pela experincia, que o bloco de cobre se resfria e
a gua se aquece at que o cobre e a gua atinjam a mesma temperatura. O que causa essa
diminuio de temperatura do cobre e o aumento de temperatura da gua? Dizemos que isto
resultado da transferncia de energia do bloco de cobre gua. dessa transferncia de energia
que chegamos a uma definio de calor. Calor definido como sendo a forma de energia
transferida, atravs da fronteira de um sistema a uma dada temperatura, a um outro sistema (ou
meio ) numa temperatura inferior, em virtude da diferena de temperatura entre os dois sistemas.
Isto , o calor transferido do sistema de maior temperatura ao sistema de temperatura menor e a
transferncia de calor ocorre unicamente devido diferena de temperatura entre os dois
sistemas. Um outro aspecto dessa definio de calor que um corpo ou sistema nunca contm
calor. Ou melhor, calor s pode ser identificado quando atravessa a fronteira. Assim o calor um
fenmeno transitrio. Se considerarmos o bloco quente de cobre como um sistema e a gua fria
do bquer como outro sistema reconhecemos que originalmente nenhum sistema contm calor
(eles contm energia, naturalmente). Quando o cobre colocado na gua e os dois esto em
"comunicao trmica", o calor transferido do cobre gua, at que seja estabelecido o
equilbrio de temperatura. Nenhum sistema contm calor no fim do processo. Infere-se, tambm,
que o calor identificado somente na fronteira do sistema, pois o calor definido como sendo a
energia transferida atravs da fronteira do sistema. Unidades de Calor - Conforme j discutimos,
o calor, como o trabalho, uma forma de transferncia de energia para ou de um sistema.
Portanto, as unidades de calor, ou sendo mais geral, para qualquer outra forma de energia, so as
mesmas do trabalho, ou pelo menos, so diretamente proporcionais a ela. No sistema
Internacional, SI, a unidade de calor ( e de qualquer outra forma de energia ) o Joule. Calor
transferido para um sistema considerado positivo e transferido de um sistema negativo. O
calor normalmente representado pelo smbolo Q. Um processo em que no h troca de calor
(Q = 0), chamado de processo adiabtico. Do ponto de vista matemtico o calor, como o
trabalho, uma funo de linha e reconhecido como tendo uma diferencial inexata. Isto , a
quantidade de calor transferida quando o sistema sofre uma mudana, do estado 1 para o estado
Captulo 3 Calor e Trabalho MAQUINAS TRMICAS - EQM/UNISUL
62
2, depende do caminho que o sistema percorre durante a mudana de estado. Como o calor uma
funo de linha, a sua diferencial escrita como Q. Na integrao escrevemos:
2 1
2
1
=Q Q
em outras palavras, Q
1-2
o calor transferido durante um dado processo entre o estado 1 e o
estado 2. O calor transferido para um sistema na unidade de tempo, chamado taxa de calor, e
designado pelo smbolo Q
&
, a respectiva unidade Watt.
dt
Q
Q
=
&
Comparao entre Calor e Trabalho - evidente, a esta altura, que h muita semelhana entre
calor e trabalho, que passaremos a resumir:
a) O calor e o trabalho so, ambos, fenmenos "transitrios". Os sistemas nunca possuem calor
ou trabalho, porem qualquer um deles ou, ambos, atravessam a fronteira do sistema, quando o
sistema sofre uma mudana de estado.
b) Tanto o calor como o trabalho so fenmenos de fronteira. Ambos so observados somente nas
fronteiras do sistema, e ambos representam energia atravessando a fronteira do sistema.
c) Tanto o calor como o trabalho so funes de linha e tm diferenciais inexatas. Deve-se
observar que na nossa conveno de sinais, +Q representa calor transferido ao sistema e, da
energia acrescentada ao sistema, e +W representa o trabalho realizado pelo sistema, que energia
que sai do sistema.
Captulo 4 Primeira Lei da Termodinmica aplicada a sistemas MAQUINAS TRMICAS - EQM/UNISUL
63
4.0 PRIMEIRA LEI DA TERMODINMICA APLICADA A SISTEMAS
4.1 Primeira Lei para Um Sistema Percorrendo Um Ciclo
A primeira lei da termodinmica comumente chamada de " lei da conservao da
energia". Nos cursos elementares de fsica, o estudo da conservao de energia d nfase s
transformaes de energia cintica e potencial e suas relaes com o trabalho. Uma forma mais
geral de conservao de energia inclui os efeitos de transferncia de calor e a variao de energia
interna. Esta forma mais geral chamada de " Primeira Lei da Termodinmica ". Outras formas
de energia podem tambm serem includas, tais como: energia eletrosttica, energia de campos
magnticos tenso superficial, etc. Energia uma noo familiar, e j conhecemos a maioria dos
detalhes sobre ela. A idia bsica, aqui, que a energia pode ser armazenada dentro de um
sistema, transformada de uma para outra forma de energia e transferida entre sistemas. Para o
sistema fechado a energia pode ser transferida atravs do trabalho e da transferncia de calor. A
quantidade total de energia conservada em todas as transformaes e transferncias.
A primeira lei da termodinmica estabelece que, durante um processo cclico qualquer,
percorrido por um sistema, a integral cclica (somatrio sobre todo o ciclo), do calor
proporcional integral cclica do trabalho, matematicamente:
= W Q
= W Q 4.1
Toda a experincia efetuada at agora provou a veracidade direta ou indiretamente da
primeira lei. A primeira lei nunca foi contestada e tem sido satisfeita por muitas experincias
fsicas diferentes. Como exemplo de grandes sistemas industriais, que operam em um ciclo
termodinmico, pode-se citar as termoeltricas a vapor e os sistemas de refrigerao. Estes dois
sistemas so projetados, operados e controlados atravs da anlise termodinmica, mais
especificamente atravs dos princpios da termodinmica.
A unidade de calor e trabalho, para o sistema internacional, SI, o joule ou seus mltiplos,
outras unidades so freqentemente usadas, tais como aquelas do sistema prtico ingls e do
sistema prtico mtrico, respectivamente, BTU (British thermal units) e a kcal (quilocaloria).
1 kcal=4,18kJ=3,9744BTU 1BTU=1,0533 kJ 1 kW=860kcal/h=3412BTU/h
1 HP=641kcal/h=2545BTU/h
Captulo 4 Primeira Lei da Termodinmica aplicada a sistemas MAQUINAS TRMICAS - EQM/UNISUL
64
4.2 Primeira Lei para Mudana de Estado de um Sistema
A Eq. 4.1-1 estabelece a primeira lei da termodinmica para um sistema operando em um
ciclo. Muitas vezes, entretanto, estamos mais interessados a respeito de um processo que em um
ciclo. Assim interessante obter uma expresso da primeira lei da termodinmica para um
processo. Isto pode ser feito introduzindo-se uma nova propriedade, a energia total, a qual
representada pelo smbolo E. Considere-se um sistema que percorre um ciclo, mudando do estado
1 ao estado 2 pelo processo A e voltando do estado 2 ao estado 1 pelo processo B. Este ciclo est
mostrado na Fig. 4.2-1. Da primeira lei da termodinmica temos;
Figura 4.2-1 Demonstrao da propriedade termodinmica E
Considerando os dois processo que constituem o ciclo separadamente obtemos;
+ = +
1
2
B
2
1
A
1
2
B
2
1
A
W W Q Q 4.2
Agora, consideremos outro ciclo, com o sistema mudando do estado 1 ao estado 2 pelo
mesmo processo A e voltando ao estado 1 pelo processo C como indicado na Fig 4.2-1. Para este
ciclo podemos escrever:
+ = +
1
2
C
2
1
A
1
2
C
2
1
A
W W Q Q 4.3
Subtraindo a segunda destas equaes da primeira, temos,
=
1
2
1
2
1
2
1
2
C B C B
W W Q Q 4.4
ou, reordenando
=
1
2
1
2
) ( ) (
C C B B
W Q W Q 4.5
Captulo 4 Primeira Lei da Termodinmica aplicada a sistemas MAQUINAS TRMICAS - EQM/UNISUL
65
Visto que B e C representam caminhos arbitrrios entre os estados 1 e 2 conclumos que a
quantidade (Q - W) a mesma para qualquer processo entre o estado 1 e o estado 2. Em
conseqncia, (Q - W) depende somente dos estados inicial e final no dependendo do
caminho percorrido entre os dois estados. Isto nos faz concluir que a quantidade, (Q - W ),
uma funo de ponto, e portanto, a diferencial exata de uma propriedade do sistema. Essa
propriedade a energia total do sistema e representada pelo smbolo E. Assim podemos
escrever.:
dE W Q =
4.6
W dE Q + = 4.7
Observe-se que, sendo E uma propriedade, sua diferencial escrita dE. Quando a Eq. 4.8
integrada, de um estado inicial 1 a um estado final 2, temos:
2 1 1 2 2 1
+ = W E E Q 4.8
onde, Q
1-2
o calor transferido para o sistema durante o processo do estado 1 para o estado 2, E
1
e E
2
so os valores inicial e final da energia total do sistema e W
1-2
o trabalho efetuado pelo
sistema durante o processo. O significado fsico da propriedade E o de representar toda a
energia de um sistema em um dado estado. Essa energia pode estar presente em uma
multiplicidade de formas, tais como; energia cintica, energia potencial, energia associada
estrutura do tomo, energia qumica, etc. No estudo da termodinmica conveniente considerar-
se separadamente as energias cintica e potencial, as demais formas de energia do sistema so
agrupadas em uma nica varivel, j definida, a energia interna, representada pelo smbolo U.
Assim,
EP EC U E + + = 4.9
A razo para trabalhar separadamente que a energia cintica, (EC), e a energia potencial,
(EP), esto associadas a um sistema de coordenadas que escolhemos, e podem ser determinadas
pelos parmetros macroscpicos de massa, velocidade e elevao. A energia interna U est
associada ao estado termodinmico do sistema. Como cada uma das parcelas uma funo de
ponto, podemos escrever.
dEP dEC dU dE + + = 4.10
A primeira lei da termodinmica para uma mudana de estado de um sistema pode,
Captulo 4 Primeira Lei da Termodinmica aplicada a sistemas MAQUINAS TRMICAS - EQM/UNISUL
66
ento, ser escrita como;
W ) EP ( d ) EC ( d dU Q + + + = 4.11
Trs observaes podem ser feitas relativa a essa equao:
1 - A energia total, E, realmente existe e podemos fazer uso desta para escrever a primeira lei.
Entretanto mais conveniente, em termodinmica, trabalhar separadamente com a energia
interna, U, a energia cintica, EC, e com a energia potencial EP.
2 - As equaes 4.8 e 4.11 so de fato o enunciado da conservao de energia. A variao lquida
de energia do sistema sempre igual transferncia lquida de energia atravs da fronteira do
sistema , na forma de calor e trabalho.
3 - As equaes 4.8 e 4.11 somente tratam com variaes de energia interna, energia cintica e
energia potencial. No podemos nos informar sobre os valores absolutos dessas quantidades
atravs dessas equaes, se quisermos atribuir valores energia interna, energia cintica e
potencial, precisamos admitir estados de referncia e atribuir valores s quantidades nesses
estados.
A seguir, a primeira lei aplicada em uma srie de processos, para um gs ideal,
considerando energia cintica, EC e energia potencial EP desprezveis.
Captulo 4 Primeira Lei da Termodinmica aplicada a sistemas MAQUINAS TRMICAS - EQM/UNISUL
67
4.2.1 O processo a Temperatura Constante
U W Q =
4.12
Para um gs que se aproxima de um gs ideal, a energia interna depende somente da
temperatura e, portanto: U=0 para um processo isotrmico. Para tal processo,
W Q =
4.13
Usando a equao de gs ideal, o trabalho para um processo isotrmico de quase-equilbrio
envolvendo um sistema pode ser encontrado por:
2
1
1
2
V
V
V
V
p
p
ln mRT
V
V
ln mRT
V
dV
mRT
V
dV
p W
2
1
2
1
= = = =
onde
2 2 1 1
V P V P = 4.14
4.2.2 O processo a Volume Constante
O trabalho de compresso (ou contrao) e expanso zero para um processo a volume
constante. Para tal processo a primeira lei fica:
U Q = 4.15
( )
1 2 v
2 T
1 T
v
T T mc dT c m U = =
4.16
( )
1 2 v
T T mc Q =
4.17
4.2.3 O processo a Presso Constante
Para um processo de quase-equilbrio de presso constante
U W Q = , isolando --------- > W U Q + = , 4.18
V P U Q + = , 4.19
sabendo-se que PV U H + = , resulta H Q = 4.20
Como a entalpia somente funo de T para um gs ideal, ( )
1 2 p
2 T
1 T
p
T T mc dT c m H = =
( )
1 2 p
T T mc Q =
4.21
Captulo 4 Primeira Lei da Termodinmica aplicada a sistemas MAQUINAS TRMICAS - EQM/UNISUL
68
4.2.4 O processo adiabtico
H inmeros exemplos de processos para o quais no h nenhuma transferncia de energia
por calor, ou, se houver insignificante (por exemplo, a compresso e expanso de ar em
cilindros de motor de automvel).
A forma diferencial da primeira lei para um processo adiabtico sem nenhuma variao
nas energias cintica e potencial :
mdu W =
4.22
Para um processo de quase equilbrio, no qual pdv m W =
0 pdv du = +
4.23
Investigando o processo adiabtico para um gs ideal com calores especficos constantes.
Para este processo a equao anterior toma a seguinte forma:
0 dv
v
RT
dT c
v
= + rearranjando e integrando, tem-se 4.24
1 k
2
1
c / R
2
1
1
2
v
v
v
v
T
T
v
|
|
\
|
=
|
|
\
|
=
4.25
k
2
1
1
2
k / ) 1 k (
1
2
1
2
v
v
p
p
p
p
T
T
|
|
\
|
=
|
|
\
|
=
4.26
Onde,
) 1 R k/(k c ) 1 R/(k c /c c k
p v v p
= = = 4.27
Finalmente as equaes acima podem ser postas nas formas gerais a seguir para processos
de quase equilbrio adiabtico envolvendo um gs ideal com c
p
e c
v
constantes.
const pv const Tp const Tv
k -k)/k 1 ( 1 k
= = =
4.28
Captulo 4 Primeira Lei da Termodinmica aplicada a sistemas MAQUINAS TRMICAS
4.2.5 O processo politrpico
Uma inspeo cuidadosa dos processos de quase
apresentados nesta seo sugere que cada processo possa ser expresso genericamente por:
V P V P PV
2 2
n
1 1
n
= =
O trabalho ser calculado por:
= =
2
1
V
V
n
1 1
V
V
V P pdV W
Integrando, tem-se
( V V
n 1
V P
W
1
n 1
2
n
1 1
=
( )
n 1
V P V P
W
1 1 2 2
=
( )
n 1
T T mR
W
1 2
=
Quando n=1 deve-se usar a equao 4.1
infinito (processo isomtrico). O calor segue da primeira lei.
Cada processo de quase equilbrio para um gs ideal
n como segue.
Figura 4.2.2- Expoentes politrpicos para vrios processos
Primeira Lei da Termodinmica aplicada a sistemas MAQUINAS TRMICAS
69
4.2.5 O processo politrpico
Uma inspeo cuidadosa dos processos de quase-equilbrio particulares para um gs ideal
apresentados nesta seo sugere que cada processo possa ser expresso genericamente por:
cte
n
2
=
o ser calculado por:
=
2
1
2
1
V
V
n n
1 1
V
V
n
dV V V P
V
dV
)
( )
n 1
V P V P
V
1 1 2 2 n 1
1
se usar a equao 4.14. Note tambm que W=0 quando n igual a
(processo isomtrico). O calor segue da primeira lei.
Cada processo de quase equilbrio para um gs ideal associado a um valor particular para
Isotrmico n=1
Volume constante n =
Presso constante n=0
Adiabtico (Cp cte) n=k
Expoentes politrpicos para vrios processos
Primeira Lei da Termodinmica aplicada a sistemas MAQUINAS TRMICAS - EQM/UNISUL
equilbrio particulares para um gs ideal
apresentados nesta seo sugere que cada processo possa ser expresso genericamente por:
4.29
4.30
4.31
4.32
4.33
. Note tambm que W=0 quando n igual a
associado a um valor particular para
Isotrmico n=1
Volume constante n =
Presso constante n=0
Adiabtico (Cp cte) n=k
Captulo 4 Primeira Lei da Termodinmica aplicada a sistemas MAQUINAS TRMICAS - EQM/UNISUL
70
EXERCCIOS PROPOSTOS:
4.2.1)Um sistema inicialmente em repouso sofre um processo no qual recebe uma quantidade de
trabalho igual a 200 kJ. Durante o processo o sistema transfere para o meio ambiente uma
quantidade de calor igual a 30 kJ. Ao final do processo o sistema tem velocidade de 60 m/s e uma
elevao de 50 m. A massa do sistema de 25 kg, e a acelerao gravitacional local de 9,78
m/s2. Determine a variao de energia interna do sistema durante o processo, em kJ
Resposta: + U=112, 775kJ
4.2.2)Considere 5 kg de vapor de gua contida no interior do conjunto cilindro pisto. O vapor
sofre uma expanso do estado 1 onde P = 5,0 bar e T=240
o
C para o estado 2 onde P=1,5 bar e
T=200
o
C. Durante o processo 80 kJ de calor transferida para o vapor. Uma hlice colocada
no interior do conjunto atravs de um eixo para homogeneizar o vapor, a qual transfere 18,5 kJ
para o sistema. O conjunto cilindro pisto est em repouso. Determinar a quantidade de trabalho
transferido para o pisto durante o processo de expanso.
Resposta: W pistao = + = + = + = + 355,5 kJ
4.2.3) Se 0,03 kg de ar realiza um ciclo como mostrado na Figura abaixo (um dispositivo
cilindro pisto), calcule o trabalho produzido(1,0). Dados para o ar.
kgK / kJ 717 , 0 Cv kgK / kJ 003 , 1 Cp = =
Resposta: W= 4,0 kJ
100 kPa
P em kPa
V em m
3
1
2
3
isotrmico
0,002 0,02
adiabtico
Captulo 4 Primeira Lei da Termodinmica aplicada a sistemas MAQUINAS TRMICAS - EQM/UNISUL
71
4.3 Primeira lei da Termodinmica em termos de fluxo
4.3.1 Formulao Geral para Volumes de Controle
Na aplicao de varias leis, temos nos restringido at aqui a volumes fechados. Nenhuma
massa atravessa os limites de um sistema fechado. Essa restrio aceitvel em muitos exerccios
de interesse e pode, na verdade, ser utilizada no esquema de uma usina termoeltrica, Figura 1.1.
Mas se a primeira lei for aplicada a esse sistema, s se pode alcanar uma anlise incompleta.
Para uma anlise mais completa, devemos relacionar o trabalho e o calor que entra e sai s
variaes de presso e temperatura do fluxo de bomba hidrulica, caldeira, turbina e
condensador, respectivamente. Para fazer isso, devemos considerar cada equipamento da usina
termoeltrica como um volume de controle para o qual e do qual um fluido escoa. Por exemplo,
gua escoa para uma bomba hidrulica a uma presso baixa e sai dessa bomba com uma presso
alta. 0 trabalho realizado nessa bomba obviamente relacionado com o aumento de presso.
Devemos formular equaes que nos permitam fazer os clculos necessrios. Para a maioria das
aplicaes, consideramos o escoamento permanente (as variveis do escoamento em um ponto
do espao no mudam com o tempo) e o escoamento uniforme (a velocidade, a presso e a
densidade so constantes ao longo da rea da seo reta do escoamento).
A Conservao de Massa. Quando se aplica a equao de energia para volumes de
controle, freqentemente necessrio que se aplique o principio de conservao de massa para a
massa enquanto esta se move atravs de um volume no espao. Isso pode nos permitir determinar
as informaes necessrias, como o dimetro de um duto na sada de uma bomba hidrulica ou o
volume de escoamento requerido para uma potencia especifica na sada produzida por uma usina
eltrica.
= |
\
|
s e
vc
m m
dt
dm
& & onde A m v = & 4.34
Captulo 4 Primeira Lei da Termodinmica aplicada a sistemas MAQUINAS TRMICAS - EQM/UNISUL
72
A equao do balano de energia: Considere a seguir, um volume de controle fixo na
Figura 4.3-1, no qual o sistema ocupa o volume 1 mais o volume de controle no tempo t e, mais
tarde, o volume de controle 2 no instante t+t. A linha tracejada delimita o volume de controle.
Figura 4.3-1 O sistema ocupa o volume 1 mais o volume de controle no instante t
Figura 4.3-2 O sistema ocupa o volume de controle mais o volume 2 no instante t+t
A primeira lei para o sistema pode ser estabelecida como:
t t t
E E W Q =
+
4.35
[ ] [ ]
t vc 1 t t vc 2
E E E E W Q + + =
+
4.36
( ) ( ) ( ) ( ) t E t t E t E t t E W Q
vc vc 1 2
+ + + = 4.37
( ) ( ) t E t t E gz
2
1
u t A gz
2
1
u t A W Q
vc vc 1 1 1 1 1 1 2 2 2 2 2 2
+ + |
\
|
+ + |
\
|
+ + = v v v v
r r
4.38
O trabalho W composto de duas partes: o trabalho decorrente da presso necessria para mover
o fluido, algumas vezes chamado de trabalho de escoamento ou trabalho de fluxo, e o que resulta
de algum eixo de rotao, denominado de trabalho de eixo, isto expresso por:
e 1 1 1 2 2 2
W t A p t A p W + = v v
r r
4.39
O sinal negativo surge porque o trabalho realizado sobre o sistema (negativo), quando o fluido
se move para dentro do volume de controle, seguindo convenes pr-estabelecidas.
vc
1
1
1
2
1 1 1 1 1
2
2
2
2
2 2 2 2 2 e
E t
p
gz
2
1
u A t
p
gz
2
1
u A W Q +
|
|
\
|
+ + +
|
|
\
|
+ + + =
v v v v
r r r r
4.40
Captulo 4 Primeira Lei da Termodinmica aplicada a sistemas MAQUINAS TRMICAS - EQM/UNISUL
73
Dividindo por t para obter a equao da energia:
t
E p
gz
2
1
u A
p
gz
2
1
u A
t
W
t
Q
vc
1
1
1
2
1
1 1 1 1
2
2
2
2
2
2 2 2 2
e
+
|
|
\
|
+ + +
|
|
\
|
+ + + =
v v v v
r r r r
4.41
Aplicando a definio de derivada e tomando limite, temos
dt
dE p
gz
2
1
u m
p
gz
2
1
u m W Q
vc
1
1
1
2
1 1 1
2
2
2
2
2 2 2 e
+
|
|
\
|
+ + +
|
|
\
|
+ + + =
v v
r
&
r
&
& &
4.42
Se mais de uma entrada e sadas estiverem presentes, a equao se transforma em:
|
|
\
|
+ + +
|
|
\
|
+ + + + =
entradas 1
1
1
2
1 1 1
saidas 2
2
2
2
2 2 2
vc
e
p
gz
2
1
u m
p
gz
2
1
u m
dt
dE
W Q
v v
r
&
r
&
& &
4.43
Muitas vezes vantajoso usar a primeira lei em termos de fluxo, expressando a taxa mdia
ou instantnea de energia que cruza a fronteira do sistema como calor e trabalho e a taxa de
variao de energia do sistema. Procedendo desse modo estamos nos afastando do ponto de vista
estritamente clssico, pois basicamente a termodinmica clssica cuida de sistemas que esto em
equilbrio e o tempo no um parmetro importante para sistemas que esto em equilbrio.
Entretanto, incluiremos neste texto essas equaes, em termos de fluxo, pois so desenvolvidas a
partir dos conceitos da termodinmica clssica e so usadas em muitas aplicaes. Se o
escoamento for em regime permanente, o que muito encontrado em problemas de volume de
controle em termodinmica, a equao da energia toma a seguinte forma:
( ) ( ) ( )
(
+ + =
2
1
2
2 1 2 1 2 e
2
1
z z g h h m W Q v v
r r
&
& &
4.44
na qual a entalpia pv u h + = onde v / 1 = (v o volume especfico) e considerando-se a
conservao da massa. Algumas vezes as variaes de energia cintica e potencial so
desprezveis. A primeira lei simplificada fica:
( )
1 2 e
h h m W Q = &
& &
ou ( )
1 2 e
h h w q =
e
w
m
W
q
m
Q
= =
&
&
&
&
4.45
Para um volume de controle atravs do qual um fluido escoa, conveniente retomar-mos a
equao 4.42. Para um escoamento permanente, desprezando-se as transmisso de calor e a
energia interna, resulta:
Captulo 4 Primeira Lei da Termodinmica aplicada a sistemas MAQUINAS TRMICAS - EQM/UNISUL
74
( )
|
|
\
|
+
=
1 2
2
1
2
2 1 2
2 e
z z g
2
p p
m W
v v
r r
&
&
4.46
Esta a forma que se usa para bombas e turbinas hidrulicas.
4.3.2 A primeira Lei Aplicada a Volumes de Controle
Como primeiro passo importante identificar o volume de controle selecionado na
soluo dos problemas. A superfcie de controle deve ser escolhida suficientemente longe da
jusante de uma rea abrupta (uma entrada ou uma contrao sbita), de modo que a velocidade e
a presso possam ser aproximadas por distribuies uniformes. Tambm necessrio especificar
o processo sofrido pelas variveis do escoamento. incompressvel?, Isotrmico? A presso
constante? Adiabtico? Um esboo do processo em um diagrama adequado freqentemente til
nos clculos. Em certos casos, a transmisso de calor ou a energia interna no so efeitos
desejados durante o funcionamento de um equipamento, como uma bomba. Para tais situaes, a
transmisso de calor e a variao de energia interna podem ser consideradas juntas como perdas.
Dispositivos de Estrangulamento. Um dispositivo de estrangulamento envolve um
processo adiabtico de escoamento permanente se realizao de trabalho, que envolve queda de
presso sem nenhuma variao significativa na energia potencial ou cintica . O processo ocorre
relativamente rpido, permitindo que se despreze a transmisso de calor. Se a equao da energia
for aplicada a este dispositivo, admitindo processo adiabtico, temos:
1 2
h h = . Na qual a seo 1
est montante e 2 jusante do escoamento. Muitas vlvulas so dispositivos de
estrangulamento. Estes dispositivos tambm so usados em muitas unidades de resfriamento nas
quais uma queda sbita de presso causa uma mudana de fase na substncia de trabalho.
Captulo 4 Primeira Lei da Termodinmica aplicada a sistemas MAQUINAS TRMICAS - EQM/UNISUL
75
(Exemplo 4.1) O vapor entra em uma vlvula de estrangulamento a 8000kPa e 300
O
C e sai
com uma presso de 1600 kPa. Determine a temperatura e o volume especfico do vapor
usando as tabelas de vapor.
Soluo: Escoamento adiabtico, a entalpia na entrada deve se igualar da sada
Entrada Sada
Presso 8000kPa (8MPa ou 80bar) 1600kPa (1,6MPa ou 16bar)
Temperatura 300
O
C (T
sat
=295
O
C) T=201,4
o
C
Entalpia h
1
= 2784,98 kJ/kg (tab 2.4-3)
h
ls
= 859 kJ/kg (tab 2.4-1)
h
vs
= 2794 kJ/kg
Volume
Especfico
v
ls
=0,0012 m
3
/kg
v
vs
=0,1238 m
3
/kg
995 , 0
859 2794
859 98 , 2784
) h h (
h h
x
ls vs
ls 2
=
=
( )
( ) kg / m 1232 , 0 0012 , 0 1238 , 0 995 , 0 0012 , 0 v
v v x v v
3
2
ls 2 vs 2 2 ls 2 2
= + =
+ =
(Exemplo 4.2) Vapor de gua a 0,5 MPa e 200
O
C entra em um bocal termicamente isolado
com uma velocidade de 50 m/s, e sai presso de 0,15 MPa e velocidade de 600 m/s.
Determinar a temperatura final do vapor se ele estiver superaquecido e o ttulo se for
saturado.
Hipteses: Regime permanente (dE
vc
/dt=0), volume de controle isolado (Q=0), do problema
W=0. Do esquema mostrado podemos adotar para os fluxos mssicos que e
P1
=e
P2
. Da primeira
lei da termodinmica, a equao 4.23 resulta
|
\
|
+ = |
\
|
+
1
2
1
2
2 2
h
2
1
2
1
h v v
r r
------------- >
|
|
\
|
+
=
1
2
2
2
1
2
h
2
h
v v
r r
Entrada Sada
Presso 0,5MPa (5bar) 0,15MPa (1,5bar)
Temperatura 200
O
C ?
Entalpia 2855,37 kJ/kg (tab 2.4-3) 2676,62 kJ/kg (calc)
Velocidade 50m/s 600 m/s
Captulo 4 Primeira Lei da Termodinmica aplicada a sistemas MAQUINAS TRMICAS - EQM/UNISUL
76
|
|
\
|
+
|
|
\
|
kg / kJ 37 , 2855
s / m
kg / kJ 10
s / m
2
600 50
h
2 2
3
2 2
2 2
2
kg / kJ 62 , 2676 h
2
=
Voltando s propriedades do vapor superaquecido:
) h h ( x h h
ls vs ls 2
+ =
Do diagrama de Mollier para a gua com P = 0,15 MPa e com h
2
= 2 676,62 kJ,
verificamos que o vapor mido, quase prximo superaquecido (h
vs
=2693,6 kJ/kg). A
entalpia do lquido saturado nesta presso seria (h
ls
= 467,11 kJ/kg) para uma temperatura de
111,4
o
C. O ttulo seria:
99,2% ou x 992 , 0
11 , 467 6 , 2693
11 , 467 62 , 2676
x = =
=
Exemplo 4.3) O fluxo de massa que entra em uma turbina a vapor d'gua de 1,5 kg/s e o
calor transferido da turbina para o meio de 8,5 kW. So conhecidos os seguintes dados
para o vapor de gua que entra e sai da turbina:
Determinar a potncia fornecida pela turbina.
Regime permanente: 0
dt
dE
. : m m m
vc
1 2
= = = & & &
Procedimento: Utilizao das tabelas de vapor e diagramas de Mollier
Anlise: Primeira lei da Termodinmica.
e s
2
s s e
2
e e
W gz
2
1
h m gz
2
1
h m Q
&
& &
&
|
\
|
+ + = |
\
|
+ + + v v
Captulo 4 Primeira Lei da Termodinmica aplicada a sistemas MAQUINAS TRMICAS - EQM/UNISUL
77
Do diagrama de Mollier ou interpolando das tabela de vapor :
Para determinar as propriedades de sada, verificar as propriedades para a presso na condio
de saturao, Figura 2.5-5
Entrada Sada
Presso 2MPa (20bar) 0,1MPa (1bar)
Temperatura 350
O
C (superaquec) ?
Entalpia 3137 kJ/kg (tab 2.4-3) ou fig 2.5-5 2675,5 kJ/kg tab ( 2.4-1) ou fig 2.5-5
Entropia 6,95 kJ/kg (tab 2.4-3) ou fig 2.5-5 7,36 kJ/kg (tab 2.4-1) ou fig 2.5-5
Calculo dos termos de energia cintica e potencial dos fluxos mssicos
kg / kJ 029 , 0
s / m
kg / kJ 10
s / xm 3 x 8066 , 9 gZ ; kg / kJ 0 , 20
s / m
kg / kJ 10
s / m
2
200 x 200
2
1
kg / kJ 059 , 0
s / m
kg / kJ 10
s / xm 6 x 8066 , 9 gZ ; kg / kJ 25 , 1
s / m
kg / kJ 10
s / m
2
50 x 50
2
1
2 2
3
2 2
s
2 2
3
2 2 2
s
2 2
3
2 2
e
2 2
3
2 2 2
e
= = = =
= = = =
v
v
Substituindo os valores numricos na equao temos:
( ) ( )
vc
W 029 , 0 20 5 , 2675 5 , 1 059 , 0 25 , 1 3137 5 , 1 5 , 8
&
+ + + = + + +
kW 7 , 655 4 , 4043 5 , 4707 5 , 8 W W
T vc
= + = =
& &
--------- > Trabalho + realizado pela turbina
Pode-se fazer mais duas observaes em relao a este exemplo. Primeiro, em muitos
problemas de engenharia as variaes de Energia potencial so insignificantes, quando
comparadas com as outras formas de energia. No exemplo acima a variao de energia
potencial no afetou o resultado de modo significativo. Na maioria dos problemas onde a
variao de altura pequena, os termos de energia potencial podem ser desprezados. Segundo,
se as velocidades so pequenas, inferiores a cerca de 20m/s, em muitos casos a variao de
energia cintica, tambm insignificante quando comparado com os demais termos de energia.
Como a variao de energia cintica que importante na equao da 1
a
lei os termos de
energia cintica podem ser comumente desprezados quando no houver grandes diferenas entre
a velocidade de entrada e sada do fluxo mssico no volume de controle. Assim em muitas
aplicaes da 1a lei deve-se julgar quais valores podem ser desprezados.
Captulo 4 Primeira Lei da Termodinmica aplicada a sistemas MAQUINAS TRMICAS - EQM/UNISUL
78
(Exemplo 4.4)Considere uma instalao motora a vapor simples como mostrada na figura
abaixo. Os dados na tabela referem-se a essa instalao.
Determinar as seguintes quantidades , por kg de fluido que escoa atravs da unidade.
1 - Calor trocado na linha de vapor entre o gerador de vapor e a turbina
2 - Trabalho da turbina
3 - Calor trocado no condensador
4 - Calor trocado no gerador de vapor.
4.4 Exerccios com aplicao em sistemas trmicos
4.3.1) Em que fase se encontra a gua, contida em um recipiente de paredes rgidas, em que a
temperatura de 100
o
C e a presso de a) 10 MPa, b) 20 kPa. Obs.: Use a tabela de
Propriedades saturadas para inferir a resposta.
4.3.2)Consideremos um processo der estrangulamento atravs de uma vlvula de expanso, ou
atravs de um tubo capilar, num ciclo de refrigerao por compresso de vapor. Nesse processo a
presso do refrigerante cai da alta presso no condensador para a baixa presso no evaporador e,
durante este processo, uma parte do lquido se vaporiza. Se considerarmos o processo como
adiabtico, o ttulo do refrigerante ao entrar no evaporador pode ser calculado. Seja considerado o
seguinte processo, no qual a amnia o fluido refrigerante. A amnia entra na vlvula de
expanso presso de 12,617 kgf/cm2 e temperatura de 32 OC. Sua presso ao deixar a vlvula
de 1,342 kgf/cm2 Calcular o ttulo da amnia na sada da vlvula de expanso.
4.3.3)Em um sistema de refrigerao, onde o fluido de trabalho o refrigerante, R-134a, este
entra no compressor a 144,54 kPa e -10
o
C e sai com 1 000 kPa e 90
o
C. A vazo de refrigerante
no sistema de 0,013 kg/s, e a potncia consumida pelo compressor de 1,2 kW. O refrigerante
aps sair do compressor entra em um condensador, resfriado com gua, com aproximadamente
1000 kPa e 80
o
C e sai como lquido a 964,14 kPa e 34
o
C. A gua entra no condensador em
contra corrente com o refrigerante, a 28
o
C e sai com 33
o
C . Determinar:
1 - A taxa de calor transferido para o meio pelo compressor.
2 - A vazo de gua de resfriamento atravs do condensador.
Hiptese:
Captulo 4 Primeira Lei da Termodinmica aplicada a sistemas MAQUINAS TRMICAS
1 - O sistema de refrigerao opera em regime
2 - A variao de energia cintica e potencial em
3 - As propriedades do sistema so as do refrigerante
diagrama
4 -Os volumes de controle so os indicados na fi
5.0 SEGUNDA LEI DA TERMODINMICA
TRMICAS
5.1 Conceitos Bsicos
O principal significado da 2a lei da termodinmica que ela estabelece a
ocorre um determinado processo. Alm disso, define o motor
temperatura termodinmica.
troca de calor com o meio ambiente, mas o meio no pode ceder calor para a xcara.
lei, como vimos, no impe a direo do processo, apenas
o calor igual ao trabalho.
Reservatrio Trmico (ou Fonte de Calor)
qualquer sistema que possa fornecer ou receber
oceano, atmosfera, combustveis etc.)
Motor trmico (Mquina trmica)
Seja o sistema constitudo pelo gs, e faamos que este sistema
primeiramente realiza-se trabalho sobre o mesmo
abaixamento do peso e completemos o
Primeira Lei da Termodinmica aplicada a sistemas MAQUINAS TRMICAS
79
O sistema de refrigerao opera em regime permanente, (figura ao lado)
A variao de energia cintica e potencial em cada equipamento do sistema desprezvel
As propriedades do sistema so as do refrigerante 134a - no estado indicado
Os volumes de controle so os indicados na figura, Volumes de controle
SEGUNDA LEI DA TERMODINMICA APLICADA
O principal significado da 2a lei da termodinmica que ela estabelece a
determinado processo. Alm disso, define o motor trmico, o refrigerador e a
temperatura termodinmica. Assim, por exemplo, uma xcara de caf quente esfria em virtude da
de calor com o meio ambiente, mas o meio no pode ceder calor para a xcara.
lei, como vimos, no impe a direo do processo, apenas estabelece que em um processo cclico
Reservatrio Trmico (ou Fonte de Calor) - Chamamos de reservatrio
qualquer sistema que possa fornecer ou receber calor sem alterar sua
oceano, atmosfera, combustveis etc.)
Motor trmico (Mquina trmica) - Consideremos o sistema mostrado na
Seja o sistema constitudo pelo gs, e faamos que este sistema percorra um ciclo no qu
se trabalho sobre o mesmo atravs das ps do agitador, mediante o
abaixamento do peso e completemos o ciclo transferindo calor para o meio ambiente.
Primeira Lei da Termodinmica aplicada a sistemas MAQUINAS TRMICAS - EQM/UNISUL
igura ao lado)
cada equipamento do sistema desprezvel
no estado indicado - tabelas e
de controles 1 e2
APLICADA MQUINAS
O principal significado da 2a lei da termodinmica que ela estabelece a direo na qual
trmico, o refrigerador e a
Assim, por exemplo, uma xcara de caf quente esfria em virtude da
de calor com o meio ambiente, mas o meio no pode ceder calor para a xcara. A primeira
estabelece que em um processo cclico
Chamamos de reservatrio trmico
calor sem alterar sua temperatura. (exemplos;
Consideremos o sistema mostrado na figura 5.1-1.
percorra um ciclo no qual
atravs das ps do agitador, mediante o
ciclo transferindo calor para o meio ambiente.
Captulo 5 Segunda Lei da Termodinmica aplicada maquinas trmicas MAQUINAS TRMICAS - EQM/UNISUL
80
Figura 5.1-1 - sistema mostrando a restrio da segunda lei da termodinmica direo do processo.
Da experincia sabemos que no podemos inverter o ciclo. Isto , fornecer calor ao gs e
fazer com que ele levante o peso. Isto no contraria o primeiro princpio embora no seja
possvel. Essa ilustrao nos leva a considerar a mquina trmica. Com uma mquina trmica (ou
motor trmico) possvel operar em um ciclo termodinmico realizando um trabalho lquido
positivo e recebendo um calor lquido. O conceito de motor trmico corresponde a um sistema ou
instalao que opere segundo um ciclo termodinmico trocando calor com dois reservatrios
trmicos (recebendo calor lquido) e realizando trabalho mecnico. A figura 5.1-2 mostra o
esquema de uma instalao a vapor, que funciona segundo o ciclo da Figura 5.1-1 - sistema
mostrando a restrio da segunda lei da termodinmica direo do processo.
Figura 5.1-2 - Esquema de uma mquina trmica operando em um ciclo
Rankine uma das mquinas trmicas mais importantes do desenvolvimento industrial.
O trabalho til de uma mquina trmica como a da Figura 5.1-2 pode ser obtido aplicando-se a
primeira lei da termodinmica sobre todo o sistema como indicado na figura. A primeira lei da
termodinmica estabelece que, durante um processo cclico qualquer, percorrido por um sistema,
Captulo 5 Segunda Lei da Termodinmica aplicada maquinas trmicas MAQUINAS TRMICAS - EQM/UNISUL
81
a integral cclica (somatrio sobre todo o ciclo), do calor proporcional integral cclica do
trabalho, para o caso acima, temos;
util L H
W Q Q
& & &
= 5.1
onde, trabalho til, a diferena;
B T util
W W W
& & &
= 5.2
Rendimento Trmico - Para uma mquina trmica define-se um parmetro chamado rendimento
trmico, representado pelo smbolo,
T
, como:
H
util
Q
W
sta Energia Ga
til Energia
= = 5.3
Como mostra a Eq. 5.3 o rendimento trmico expressa o aproveitamento da mquina
trmica ao transformar a energia trmica para energia mecnica no eixo da turbina da Fig. 5.1-2.
Na anlise genrica dos motores trmicos faz-se uso do esquema mostrado na Fig 5.1-3. O
esquema da Fig. 5.1-2 especfico para o sistema operando segundo o ciclo de Rankine como
dito anteriormente.
Figura 5.1-3 - Esquema genrico de um motor trmico
Observe-se que ao aplicarmos o balano de energia no sistema definido pela fronteira na
Fig. 5.1-3, obtemos imediatamente o resultado da Eq. 5.1. O motor de combusto interna no
opera segundo um ciclo termodinmico, como j foi dito. Entretanto, os modelos termodinmicos
de motores de combusto interna, com o objetivo de anlise trmica, trabalham com ar em um
Captulo 5 Segunda Lei da Termodinmica aplicada maquinas trmicas MAQUINAS TRMICAS - EQM/UNISUL
82
ciclo termodinmico. A Fig. 5.1-4 mostra o esquema de um ciclo terico padro a ar de motor de
combusto interna.
A Fig.5.1-4a o ciclo terico para o motor por ignio (motor Otto) e a Fig.5.1-4b de
um motor Diesel.
Figura 5.1-4 - Ciclo padro ar Otto e Diesel
Refrigerador ou Bomba de Calor - Consideremos um outro ciclo como mostra a Fig.
5.1-5, o qual sabemos experimentalmente ser impossvel na prtica, embora a 1a lei da
termodinmica no imponha qualquer restrio.
Figura 5.1-5 Esquema da troca espontnea de calor
Para estes dois sistemas o calor pode ser transferido do sistema de alta temperatura para o
de baixa temperatura de forma espontnea, mas o inverso no possvel de ocorrer. Esse sistema
nos leva a considerar uma outra mquina trmica, tambm de grande importncia industrial, O
refrigerador ou a bomba de calor. O refrigerador ou a bomba de calor um sistema (ou
instalao) que opera segundo um ciclo termodinmico recebendo trabalho (potncia) e
transferindo calor da fonte fria (do reservatrio de baixa temperatura) para a fonte quente
Captulo 5 Segunda Lei da Termodinmica aplicada maquinas trmicas MAQUINAS TRMICAS - EQM/UNISUL
83
(reservatrio de alta temperatura). A Fig. 5.1-6 mostra o esquema de um sistema de refrigerao
ou bomba de calor que opera por compresso de vapor (o mesmo sistema ser um refrigerador se
estivermos interessados no calor retirado da fonte fria e ser uma bomba de calor se nosso
interesse for o calor transferido fonte quente). Existem refrigeradores e bombas de calor
operando segundo outro princpio, entretanto nosso interesse aqui mostrar o refrigerador que
recebe potncia e transfere calor da fonte fria para a fonte quente como mostrados no esquema da
Fig 5.1-6.
Fig. 5.1-6 - Esquema de um refrigerador ou bomba de calor por compresso de vapor
Aplicando-se a primeira lei da termodinmica para o sistema demarcado na Fig. 5.1-6, temos;
( )
c H L
W Q Q = + ou
L H c
Q Q W = 5.4
Para um refrigerador ou bomba de calor no se define o parmetro rendimento mas um
outro equivalente chamado de Coeficiente de eficcia, , Coeficiente de desempenho, ou
Coeficiente de Performance, COP, como segue
sta Energia ga
til Energia
COP = = 5.5
a equao 5.5 se aplicada ao refrigerador, fica:
( )
L H
L
c
L
or refrigerad
Q Q
Q
W
Q
COP
= = = 5.6
e para a bomba de calor, resulta
( )
L H
H
c
H
calor de bomba
Q Q
Q
W
Q
COP
= = = 5.7
Pode-se mostrar combinando a Eq. 5.6 com a Eq. 5.7 que:
Captulo 5 Segunda Lei da Termodinmica aplicada maquinas trmicas MAQUINAS TRMICAS - EQM/UNISUL
84
( ) ( ) 1 COP COP
or refrigerad calor bomba de
+ = = = 5.8
5.2 Enunciados da Segunda Lei da Termodinmica
Enunciado de Kelvin e Planck (refere-se ao motor trmico) " impossvel a um motor
trmico operar trocando calor com uma nica fonte de calor". Este enunciado referente mquina
trmica nos diz que impossvel uma mquina trmica com rendimento de 100 %, pois pela
definio de rendimento trmico:
H
L
Q
Q
=1 5.9
O rendimento seria 100% se Q
L
= 0, (apenas uma fonte de calor) ou se Q
H
fosse infinito (o
que no possvel !). Assim, uma mquina trmica tem que operar entre dois reservatrios
trmicos recebendo calor, rejeitando uma parte do calor e realizando trabalho.
Enunciado de Clausius (refere-se ao refrigerador) " impossvel construir um dispositivo
que opere em um ciclo termodinmico e que no produza outros efeitos alm da passagem de
calor da fonte fria para a fonte quente". Este enunciado est relacionado ao refrigerador ou bomba
de calor e estabelece ser impossvel construir um refrigerador que opere sem receber energia
(trabalho). Isto indica ser impossvel um, coeficiente de eficcia (COP) infinito.
Observaes Relativas Segunda Lei da Termodinmica
a) Os dois enunciados so negativos - Assim no possvel uma demonstrao. Estes enunciados
so baseados na observao experimental e no fato de no terem sido refutados at os dias de
hoje.
b) Os dois enunciados so equivalentes
c) A terceira observao que a segunda lei da termodinmica tem sido enunciada como a
impossibilidade de construo de um "Moto-Perptuo de Segunda Espcie".
Moto perptuo de 1
a
espcie - Produziria trabalho do nada ou criaria massa e energia -
violaria a 1
a
lei da termodinmica.
Moto perptuo de 2
a
espcie - Violaria a segunda lei da termodinmica (rendimento 100%
ou COP = )
Captulo 5 Segunda Lei da Termodinmica aplicada maquinas trmicas MAQUINAS TRMICAS - EQM/UNISUL
85
Moto perptuo de 3
a
espcie - Motor sem atrito, conseqentemente se moveria
indefinidamente mas no produziria trabalho
Processo Reversvel - A pergunta que logicamente aparece a seguinte: Sendo impossvel
um motor trmico com rendimento 100% qual o mximo rendimento possvel. O primeiro passo
para responder esta pergunta definir um processo ideal chamado "Processo Reversvel".
Definio - "Processo reversvel para um sistema aquele que tendo ocorrido pode ser invertido
sem deixar vestgios no sistema e no meio". As causas mais comuns da irreversibilidade
(contrrio de reversvel) nos processos reais so: atrito, expanso no resistiva, troca de calor
com diferena finita de temperatura, mistura de substncias diferentes, efeito de histerese, perdas
eltricas, combusto, etc. Assim, para que um processo real se aproxime de um processo IDEAL
REVERSVEL, ele deve ser lento, sofrer transformaes infinitesimais, equilbrio contnuo,
trocar calor com diferenas mnimas de temperatura, mnimo de atrito, etc. Todos os processos
reais so IRREVERSVEIS. Quando todos os processos que compem um ciclo so ditos
reversveis, o ciclo tambm ser reversvel.
5.3 Ciclo de Carnot (Ou Motor de Carnot)
(Engenheiro Francs Nicolas Leonard Sadi Carnot , 1796-1832)
O ciclo de Carnot (ou motor de Carnot) um ciclo ideal reversvel (Motor Trmico Ideal),
composto de dois processos adiabticos reversveis e de dois processos isotrmicos reversveis. O
ciclo de Carnot independe da substncia de trabalho, e qualquer que seja ela, tem sempre os
mesmos quatro processos reversveis. O ciclo de Carnot est mostrado na Fig. 5.3-1.
Figura 5.3-1 - O ciclo de Carnot e o esquema de uma mquina trmica
Existem dois teoremas importantes sobre o rendimento trmico do ciclo de Carnot:
Captulo 5 Segunda Lei da Termodinmica aplicada maquinas trmicas MAQUINAS TRMICAS - EQM/UNISUL
86
1
o
Teorema - " impossvel construir um motor que opere entre dois reservatrios trmicos e
tenha rendimento trmico maior que um motor reversvel (motor de Carnot) operando entre os
mesmos reservatrios".
2
o
Teorema - "Todos os motores que operam segundo um ciclo de Carnot, entre dois
reservatrios mesma temperatura, tm o mesmo rendimento".
Escala Termodinmica de Temperatura - A lei zero da termodinmica fornece a base
para a medida de temperatura, mas tambm que a escala termomtrica deve ser definida em
funo da substncia e do dispositivo usado na medida. O mais conveniente seria uma escala de
temperatura independente de qualquer substncia particular, a qual possa ser chamada de "Escala
Absoluta de Temperatura".
Da segunda lei da termodinmica vimos a definio do ciclo de Carnot, que s depende da
temperatura dos reservatrios trmicos, sendo independente da substncia de trabalho. Assim, o
ciclo de Carnot fornece a base para a escala de temperatura que Chamaremos de "Escala
Termodinmica de Temperatura". Pode-se mostrar que o rendimento trmico do ciclo de Carnot
funo somente da Temperatura. A maquina de Carnot e muito til, j que sua eficincia
estabelece a mxima eficincia possvel de uma maquina real. Se a eficincia de uma maquina
real significativamente menor que a da maquina de Carnot operando entre os mesmos limites,
ento melhoramentos adicionais poderiam ser implementados. O ciclo associado com a maquina
de Carnot e mostrado na Figura 5.3-2, usando-se como exemplo um gs como fluido de trabalho.
Figura 5.3-2 - O ciclo de Carnot
Ele composto pelos quatro processos reversveis seguintes:
Captulo 5 Segunda Lei da Termodinmica aplicada maquinas trmicas MAQUINAS TRMICAS - EQM/UNISUL
87
12 Expanso Isotrmica. O calor fornecido ao fluido de maneira reversvel por um
reservat6rio de alta temperatura a uma temperatura constante Tq. O pisto no cilindro movido e
o volume aumenta.
1
2
V
V
H 2 1 H
V
V
ln mRT pdV W Q
2
1
= = =
5.10
23: Expanso Adiabtica Reversvel. O cilindro completamente isolado, de modo que
nenhuma transmisso de calor ocorra durante esse processo reversvel. 0 pisto continua a ser
movido com o volume aumentando. 0
3 2
=
Q
34: Compresso Isotrmica. O calor e rejeitado pelo fluido de maneira reversvel para um
reservat6rio de temperatura baixa a uma temperatura constante. O pisto comprime o fluido em
questo com diminuio de volume.
3
4
V
V
L 4 3 L
V
V
ln mRT pdV W Q
4
3
= = =
5.11
41: Compresso Adiabtica Reversvel. O cilindro e completamente isolado, no permitindo
nenhuma transmisso de calor durante esse processo reversvel. 0 pisto continua a comprimir o
fluido at que este atinja o volume a temperatura e a presso originais, completando, assim, o
ciclo.
0 Q
1 4
=
5.12
Note que queremos Q
L
como uma quantidade positiva, assim como na relao de eficincia
trmica; logo o sinal negativo.
A eficincia trmica usando a equao 5.3
H
L
H
L H
H
util
Q
Q
1
Q
Q Q
Q
W
sta Energia Ga
til Energia
=
= = = 5.13
|
|
\
|
|
|
\
|
+ = =
1
2
H
3
4
L
H
L
V
V
ln T
V
V
ln T
1
Q
Q
1 5.14
Durante os processos reversveis adiabticos 2-3 e 4-1
Captulo 5 Segunda Lei da Termodinmica aplicada maquinas trmicas MAQUINAS TRMICAS - EQM/UNISUL
88
1 k
3
2
H
L
2
3
V
V
T
T
T
T
|
|
\
|
= = 5.15
1 k
4
1
H
L
1
4
V
V
T
T
T
T
|
|
\
|
= = 5.16
Logo vemos que
4
1
3
2
V
V
V
V
= ou
2
1
3
4
V
V
V
V
=
Substituindo na equao do rendimento, temos que:
H
L
T
T
1 = 5.17
Observe que
H
L
H
L
T
T
Q
Q
= 5.18
Podemos fazer esta substituio para mquinas reversveis ou refrigeradores. Vemos que a
eficincia da mquina de Carnot somente dependente das temperaturas altas e baixas das fontes
quente e fria . O fato de usarmos um gs ideal para fazer o clculo no relevante, uma vez que a
eficincia de Carnot independente da substncia em processo.
O ciclo ideal de Carnot e usado como um modelo com o qual todos os ciclos reais e todos
os outros ciclos ideais so comparados. A eficincia de um ciclo de potncia de Camot a
mxima eficincia possvel para qualquer Ciclo de potencia.
A eficincia aumentada pela elevao da temperatura T
L
na qual o calor fornecido para
o ciclo, ou pela diminuio da temperatura T
H
, em que calor e rejeitado pelo ciclo. Veremos que
isso acontece em ciclos reais. 0 uso das temperaturas mximas mais altas e das temperaturas
mnimas mais baixas maximiza a eficincia do ciclo.
Captulo 5 Segunda Lei da Termodinmica aplicada maquinas trmicas MAQUINAS TRMICAS - EQM/UNISUL
89
Exemplo 5.2-1. Calcular o rendimento trmico de um motor de Carnot que opera entre
500
o
C e 40
o
C.
Soluo:
Como sabemos, o rendimento de um motor de Carnot funo somente de temperatura, ou seja:
H
L
T
T
1 =
K 15 , 313 15 , 273 40 T
K 15 , 7773 15 , 273 500 T
L
H
= + =
= + =
% 5 , 59
595 , 0
15 , 773
15 , 313
1
=
= =
Exemplo 5.3-2. Calcular o coeficiente de eficcia, (ou coeficiente de desempenho ou COP)
de uma bomba de calor de Carnot que opera entre 0
o
C e 45
o
C.
Soluo:
Da definio do coeficiente de eficcia para uma bomba de calor, temos:
Captulo 5 Segunda Lei da Termodinmica aplicada maquinas trmicas MAQUINAS TRMICAS - EQM/UNISUL
90
( )
L H
H
c
H
calor de bomba
Q Q
Q
W
Q
COP
= = =
( )
( )
( )
( ) ( )
07 , 7
15 , 273 15 , 318
15 , 318
15 , 273 0 15 , 273 45
15 , 273 45
COP
T T
T
T
T
1
1
COP
T
T
Q
Q
Q
Q
1
1
Q Q
Q
COP
calor de bomba
L H
H
H
L
calor de bomba
H
L
H
L
H
L
L H
H
calor de bomba
=
=
+ +
+
= =
= =
=
= =
Obs. O valor do coeficiente de eficcia (ou COP) de um refrigerador, (mesmo o sistema real que
funciona por compresso de vapor, a sua geladeira, por exemplo), em geral, maior que 1 (um),
enquanto o rendimento trmico de uma mquina trmica sempre menor que 1 (um)
EXERCCIOS PROPOSTOS:
5.1)Uma bomba trmica fornece 2000 kJ/h para uma casa mantida a 20
o
C. Se o lado de fora est
a -20
o
C, qual a mnima potncia necessria? Resposta: Wu=273kJ/h
5.2)Um refrigerador est resfriando um espao a -5
o
C transferindo calor para a atmosfera que
est a 20
o
C. O objetivo reduzir a temperatura no espao para -25
o
C. Calcule a percentagem
mnima de aumento de trabalho necessrio, assumindo um refrigerador de Carnot, para a mesma
quantidade de calor removido.
5.3)Propem-se aquecer uma residncia durante o inverno usando uma bomba de calor. A
residncia deve ser mantida a 20
O
C. Estima-se que quando a temperatura do meio externo cai a
-10
O
C a taxa de perda de calor da residncia seja de 25 kW. Qual a mnima potncia necessria
para acionar essa unidade de bomba de calor ?
5.4)Um ciclo de refrigerao de Carnot opera em uma sala onde a temperatura 20
O
C.
Necessita-se de uma taxa de transferncia de calor do espao refrigerado de 5 kW para manter a
sua temperatura a -30
O
C Qual a potncia do motor necessria para operar esse refrigerador.
5.5)Prope-se construir um motor trmico para operar no oceano, num local onde a temperatura
na superfcie de 20
O
C e a grande profundidade de 5
O
C. Qual o rendimento trmico mximo
possvel de tal motor .
5.6)Um inventor alega ter desenvolvido uma unidade de refrigerao que mantm o espao
refrigerado a -10 OC, operando numa sala onde a temperatura de 35 OC. e que tem um COP de
8,5. Como voc avalia a alegao de um COP de 8,5 ?
Captulo 5 Segunda Lei da Termodinmica aplicada maquinas trmicas MAQUINAS TRMICAS - EQM/UNISUL
91
5.7)Um determinado coletor solar produz uma temperatura mxima de 100
O
C, a energia coletada
deve ser usada como fonte trmica num motor trmico. Qual o mximo rendimento do motor se
ele opera num meio temperatura de 10
O
C ? O que aconteceria se o coletor fosse projetado para
focalizar e concentrar a energia solar de modo a produzir uma temperatura mxima de 300
O
C.
5.8)Uma bomba de calor deve ser usada para aquecer uma residncia no inverno, e depois
colocada em operao reversa para resfriar a residncia no vero. A temperatura interna deve ser
mantida a 20
o
C no inverno e 25
o
C no vero. A troca de calor, atravs das paredes e do teto,
estimada em 2400 kJ/h K entre o meio interno e externo da residncia.
a) Se a temperatura externa no inverno 0
o
C, qual a mnima potncia necessria para
acionar a bomba de calor?
b)Se a potncia fornecida a mesma da parte a), qual a mxima temperatura externa o
vero para a qual o interior da residncia possa ser mantido a 25
o
C
5.4 Entropia
5.4.1 Entropia para processo Cclico
Para nos permitir aplicar de forma quantitativa a segunda lei da termodinmica para um
processo, identificaremos uma propriedade entropia. Isso estabelece um paralelo com a discusso
da primeira lei. De incio estabeleceremos a primeira lei para um ciclo e, depois, derivamos uma
relao para o processo.
Considere uma mquina de Carnot reversvel operando segundo um ciclo. A quantidade
T
Q
a integral cclica do calor, dividido pela temperatura absoluta na qual a transmisso de
calor ocorre. J que a temperatura T
H
constante durante a transmisso de calor, Q
H
e T
L
constante durante a transmisso de calor Q
L
, a integral dada por:
=
L
L
H
H
T
Q
T
Q
T
Q
5.19
Para um processo adiabtico e reversvel:
= = 0 S dS 5.20
Captulo 5 Segunda Lei da Termodinmica aplicada maquinas trmicas MAQUINAS TRMICAS - EQM/UNISUL
92
na qual o calor que sai da mquina de Carnot, Q
L
considerado positivo. Podemos ver que para o
ciclo de Carnot:
H
L
H
L
T
T
Q
Q
= 5.21
substituindo-se a relao a anterior em 5.19 , resulta:
= 0
T
Q
5.22
Logo, a quantidade expressa pela equao 5.19 um diferencial exato, uma vez que sua integral
cclica zero. Deixemos esta diferencial ser denotado por dS, na qual S representa uma funo
escalar que depende somente do estado do sistema e da quantidade de massa. Isso na verdade,
qualifica S como uma propriedade extensiva do sistema. Chamaremos essa propriedade extensiva
de entropia; seu diferencial ser dado por:
rev
T
Q
dS
=
5.23
na qual o subscrito rev enfatiza a reversibilidade do processo. Isso pode ser integrado ao longo
de um processo para dar:
=
2
1
rev
T
Q
S
5.24
Da equao anterior, podemos ver que a variao de entropia para um processo reversvel
pode ser tanto positiva quanto negativa, dependendo se o calor adicionado ou retirado do
sistema durante o processo. Para um processo adiabtico reversvel (Q=0), a variao de entropia
zero. Se o processo irreversvel e ao mesmo tempo adiabtico, no podemos afirmar que
S=0.
Em geral, esboamos um diagrama de temperatura e entropia para ciclos ou processos de
interesse. O ciclo Carnot tem uma forma simples quando a temperatura x entropia so
representadas graficamente. Isso ilustrado na Figura 5.4-1. A mudana na entropia para o
primeiro processo isotrmico do estado 1 para o estado 2 :
= =
2
1
q
q
1 2
T
Q
T
Q
S S
5.25
Captulo 5 Segunda Lei da Termodinmica aplicada maquinas trmicas MAQUINAS TRMICAS - EQM/UNISUL
93
Figura 5.4-1 - O Ciclo de Carnot TxS
A variao de entropia para um processo adiabtico reversvel do estado 2 para o estado 3
e zero. Para o processo isotrmico do estado 3 para o estado 4, a mudana de entropia e negativa
coma aquela do primeiro processo, do estado 1 para o estado 2. 0 processo do estado 4 para o
estado I tambm e um processo adiabtico reversvel e acompanhado por uma variao nula de
entropia.
O calor durante um processo reversvel pode ser expresso em forma diferencial, como:
TdS Q = 5.26
ou
=
2
1
TdS Q
5.27
Conseqentemente, a rea abaixo da curva no diagrama T-S representa o calor durante
qualquer processo reversvel. A rea retangular na Figura 5.8, ento, representa o calor efetivo
(saldo) durante o ciclo de Carnot. Uma vez que essa quantidade de calor igual ao trabalho
efetivo (util) realizado pelo cic1o, a rea tambm representa o trabalho til do ciclo. Para esse
ciclo de Carnot, Q
u
= W
u
= T. S. Na Figura 5.8, tem-se Qq = Tq S e Q
f
= T
f
S
A primeira lei da termodinmica para uma mudana infinitesimal reversvel (referente a
equao 4.6) torna-se, usando a Equao 5.26
dU W Q = 4.6
dU pdV TdS = 5.28
Captulo 5 Segunda Lei da Termodinmica aplicada maquinas trmicas MAQUINAS TRMICAS - EQM/UNISUL
94
Essa e uma relao importante em nosso estudo de sistemas simples. Chegamos a ela
assumindo um processo reversvel. Todavia, uma vez que somente envolve propriedades de
sistema, e valido para qualquer processo incluindo qualquer sistema irreversvel. Se temos um
processo irreversive1, em geral, pdV W e TdS Q mas a Equao 5.28 ainda se mantm
coma uma relao entre as propriedades, visto que as mudanas nas propriedades no dependem
do processo. Dividindo pela massa, temos:
du pdv Tds = 5.29
Para relacionar a mudana de entropia com a de entalpia, diferenciamos a Equao h=u+pv
e obtemos:
vdp pdv du dh + + = 5.30
Substituindo na equao 5.29, temos:
vdp dh Tds = 5.31
As Equaes 5.29 e 5.31 so usadas para estudo da termodinmica de vrios processos
reversveis e irreversveis.
5.4.2 Variao de Entropia para Substncias nas Fases Vapor, Slido e Lquido
A mudana de entropia foi encontrada para um gs ideal com calores especficos
constantes e para um gs ideal com calores especficos variveis. Para substncias puras, na fase
vapor, a entropia includa como um valor nas tabelas . Na regio bifsica, ela encontrada
usando-se a relao:
( )
ls vs ls
s s x s s + = 5.32
Nota-se que a entropia da gua lquida saturada a 0
o
C arbitrariamente estabelecida como
zero. Somente a variao de entropia de interesse; portanto, esse estado de referncia (zero da
escala) arbitrrio e no tem conseqncia. Na regio de vapor superaquecido, a entropia
tabulada como uma funo da temperatura e da presso com as outras propriedades.
Captulo 5 Segunda Lei da Termodinmica aplicada maquinas trmicas MAQUINAS TRMICA
Figura 5.4-2 Os diagramas Txs e hxs para o vapor
Para um liquido comprimido, o
a tabela de liquido comprimi
mesma temperatura. Para a tabela de
e da tabela de vapor saturado, tabela 2.4
pequena O diagrama de te
esboado durante a soluo
regio bifsica razoavelmente simtrica ao ponto crtico
na regio de liquido comprimido
visualizar um processo em u
relacionadas a irreversibilidade.
de Mollier utilizado na sol
na Figura 5.4-2b. Para a fase s
facilmente se pudermos assum
podemos escrever, considerando que essas fases
especfico for uma funo conhecida da temperatura, a integrao poder ser feita. Calores
especficos de slidos e lquidos podem ser encontrados na literatura.
du Tds =
cdT Tds =
= =
2
1
1
2
ln
T
T
T
T
c cdT s
5.4.3 A desigualdade de Clausius
O ciclo de Carnot um ciclo reversvel e produz trabalho, ao qual nos referimos como
W
rev
. Considere um ciclo irreversvel operando entre dois reservatrios. Obviamente uma vez que
Segunda Lei da Termodinmica aplicada maquinas trmicas MAQUINAS TRMICA
95
Os diagramas Txs e hxs para o vapor
comprimido, o valor da entropia pode ser obtido da Tabe
mido, ou ele pode ser aproximado pelo valor do liquido saturado
temperatura. Para a tabela de lquido comprimido a 10 MPa e 100
tabela de vapor saturado, tabela 2.4-2 a 100
o
C (s
ls
= 1,31 kJ/kg.K. Essa e uma diferen
temperatura e entropia de particular interesse, sendo
o dos problemas. Um diagrama T-s esboa
regio bifsica razoavelmente simtrica ao ponto crtico. Observe que
de liquido comprimido so indistinguveis da linha de liquido sa
processo em um diagrama T-s, uma vez que tal di
relacionadas a irreversibilidade. Alem do diagrama T-s, um diagrama h
utilizado na soluo de problemas. A forma genrica do diagrama h
Para a fase slida ou lquida, a mudana de entropia pode ser encontrada
os assumir o calor especifico como constante. Retornando a Equa
considerando que essas fases so incompressveis, que d
especfico for uma funo conhecida da temperatura, a integrao poder ser feita. Calores
especficos de slidos e lquidos podem ser encontrados na literatura.
cdT
5.4.3 A desigualdade de Clausius
O ciclo de Carnot um ciclo reversvel e produz trabalho, ao qual nos referimos como
. Considere um ciclo irreversvel operando entre dois reservatrios. Obviamente uma vez que
Segunda Lei da Termodinmica aplicada maquinas trmicas MAQUINAS TRMICAS - EQM/UNISUL
valor da entropia pode ser obtido da Tabela 2.4-4 (Parte I),
valor do liquido saturado s
ls
primido a 10 MPa e 100
o
C s = 1,30 kJ/Jkg.K
kg.K. Essa e uma diferena
de particular interesse, sendo frequentemente
ado na Figura 5.4-2. A
ue as linhas de presso alta
de liquido saturado. E sempre til
ma vez que tal diagrama ilustra situaes
diagrama h-s, denominado diagrama
de problemas. A forma genrica do diagrama h-s esta esboado
de entropia pode ser encontrada
constante. Retornando a Equao 5.29,
incompressveis, que dv=0. Se o calor
especfico for uma funo conhecida da temperatura, a integrao poder ser feita. Calores
5.33
5.34
O ciclo de Carnot um ciclo reversvel e produz trabalho, ao qual nos referimos como
. Considere um ciclo irreversvel operando entre dois reservatrios. Obviamente uma vez que
Captulo 5 Segunda Lei da Termodinmica aplicada maquinas trmicas MAQUINAS TRMICAS - EQM/UNISUL
96
o ciclo de Carnot possui a mxima eficincia possvel, a eficincia do ciclo irreversvel deve ser
menor que a eficincia do ciclo de Carnot. Em outras palavras, para a mesma quantidade Q
q
de
calor adicionado, devemos ter:
rev irr
W W <
5.35
Da primeira lei para um ciclo
( ) ( )
irr
L
rev
L
Q Q < 5.36
Isso requer, referindo-se s equaes 5.19 e 5.22, j que a integral anterior para um ciclo
reversvel igual a zero:
< |
\
|
0
irr
T
Q
5.37
Se considerssemos um refrigerador irreversvel em vez de um motor, seria necessrio
maior quantidade de trabalho para a mesma quantidade de calor Q
L.
Para todos os ciclos
podemos escrever.
\
|
0
T
Q
5.38
Esta equao chamada de desigualdade de Clausius, sendo uma conseqncia da
segunda lei da termodinmica e ser usada para estabelecer as relaes entrpicas para os
processos reais.
6.0 CICLOS DE POTNCIA E REFRIGERAO A VAPOR
6.1 Ciclo Rankine
A primeira classe de ciclos de potencia que abordaremos ser a utilizada pela Industria de
gerao de fora eltrica. Esses ciclos de potencia operam de tal maneira que o fluido de trabalho
muda da fase de liquido para a de vapor. O ciclo de potncia a vapor mais simples e chamado
Ciclo Rankine, mostrado esquematicamente na Figura 6.1-1a. Uma caracterstica bem relevante
desse ciclo e que a bomba necessita de pouco trabalho para fornecer gua a alta presso para uma
caldeira, comparativamente ao trabalho desenvolvido pela turbina. Uma possvel desvantagem
que o processo de expanso do vapor em uma turbina normalmente entra na regio bifsica,
resultando em formao de gotculas de liquido que podem danificar as ps da turbina. O ciclo
Captulo 6 Ciclos de Potncia e Refrigerao a Vapor MAQUINAS TRMICAS - EQM/UNISUL
97
Rankine idealizado, no qual as perdas por causa do atrito so ignoradas em cada um dos quatro
componentes. 0 ciclo Rankine composto de quatro processos ideais, mostrados no diagrama T-s
na Figura 6.1-1b
(a) Os componentes principais
(b) O Diagrama Tx s
Figura 6.1-1 O diagrama Txs para o ciclo Rankine a presso constante
12: Compresso isentrpica em uma bomba
23: Fornecimento de calor a presso constante em uma caldeira
34: Expanso isentrpica em uma turbina
4 1: Rejeio de calor a presso constante em um condensador
A bomba usada para aumentar a presso do liquido saturado. Na verdade, os estados 1 e
2 so extremamente prximos, uma vez que as linhas de alta presso esto muito perto da curva
de saturao. A figura esta desenhada fora da escala real para efeito de ilustrao. A caldeira
(tambm chamada gerador de vapor) e o condensador so permutadores de calor que no
requerem nem realizam qualquer trabalho. Se ignorarmos as mudanas de energia cintica e
potencial, o trabalho produzido pelo ciclo a rea do diagrama T-s, representada pela regio 1-2-
3-4-1 da Figura 6.1-1 b, uma vez que a primeira lei requer que Wu = Q. A transmisso de calor
para a substancia de trabalho representada pela rea s
1
-2-3-s
4
-s
1
. Portanto, a eficincia trmica
do ciclo Rankine :
1 4 1
-s -s 3 - 2 - s rea
1 - 4 - 3 - 2 - 1 rea
= 6.1
Captulo 6 Ciclos de Potncia e Refrigerao a Vapor MAQUINAS TRMICAS - EQM/UNISUL
98
Ou seja, a razo entre a sada de energia til e a entrada de energia fornecida (consumida
da fonte). Obviamente, a eficincia trmica pode ser melhorada pelo aumento do numerador ou
pela diminuio do denominador. Isso pode ser feito com o aumento da presso de sada P
2
, com
o aumento da temperatura de sada T
3
ou diminuindo a presso de sada da turbina P
4
(tendo-se
em conta os limites impostos pelas temperaturas das fontes quente e fria externas). Exemplos
sero ilustrados.
Note que a eficincia do ciclo Rankine significativamente menor que a de um ciclo de
Carnot operando entre a temperatura alta T
3
e a temperatura baixa T
1
visto que a transmisso de
calor de uma fonte de temperatura alta geralmente ocorre por grandes diferenas de temperaturas,
nos trocadores de calor. Lembre-se de que quaisquer transmisses de calor por uma diferena
finita de temperatura e irreversvel, ou seja, uma causa de desperdcio energtico.
Vamos agora achar expresses para o trabalho e para o calor nos quatro processos
da Figura 6.1-1. Usando os conceitos da primeira lei referindo-se Figura 6.1-1b, as seguintes
expresses aplicam-se., respectivamente, a bomba, a caldeira, a turbina e ao condensador:
( )
1 1 2
v p p w
B
= ( )
2 3
h h q
V
= ( )
4 3
h h w
T
= ( )
1 4
h h q
C
= 6.2
em que w
B
e q
c
esto expressos em modulo(quantidades positivas). Nos termos anteriores, a
eficincia trmica fica:
V
B T
q
w w
= 6.3
O trabalho da bomba normalmente e muito pequeno, comparado com o trabalho da turbina e,
portanto, e frequentemente ignorado. Com essa aproximao, temos o seguinte resultado:
V
T
q
w
= 6.4
Essa a relao muitas vezes usada para a eficincia trmica do ciclo Rankine.
possvel que a eficincia de certo ciclo Rankine modificado seja igual a eficincia do
ciclo de Carnot, se o ciclo for feito para operar como mostrado na Figura 6.1-2a. Porm, a bomba
necessitaria bombear uma mistura de liquido e vapor, resultando em um consumo de trabalho
consideravelmente grande comparado com aquele para bombear somente liquido puro. Alem
disso, a condensao de gotculas liquidas na turbina resultaria em severos danos. Para evitar os
Captulo 6 Ciclos de Potncia e Refrigerao a Vapor MAQUINAS TRMICAS - EQM/UNISUL
99
danos causados pelas gotculas, algum poderia propor o superaquecimento do vapor a uma
temperatura constante, como mostrado na Figura 6.1-2b. Isso, no entanto, requer que a presso
para esse processo diminua do ponto de vapor saturado para o estado 3. Para atingir tal
decrscimo, o fluxo nos dutos da caldeira teria de ser acelerado, uma tarefa que necessitaria de
tubulaes com dimetros que fossem diminuindo de tamanho. Isso seria complicado e caro, se
fosse tentado. Portanto, no projeto usual, bombeia-se somente o liquido, e P
2
e T
3
so
consideravelmente elevados (T
3
sendo limitada pelas caractersticas de resistncia de temperatura
dos condutos metlicos e das ps nas fileiras dianteiras da turbina, tipicamente por volta de
600 C, embora pesquisas recentes sobre materiais resistentes ao calor vem aumentando esse
limite consideravelmente), como mostrado na Figura 6.1-2c. Tambm se prope que a presso da
sada do condensador seja bastante baixa (pode ficar bem abaixo da atmosfera, prximo ao zero
absoluto). Isso resultaria no estado 4 se localizando na regio bifsica (um ttulo de 90%
considerado baixo), fazendo com que gotculas de gua se formem. Por isto o ciclo de Carnot
para vapor no praticamente vivel.
(a)
(b)
(c)
Figura 6.1-2 Ciclos Rankine modificados em (a) e (b). Ciclo Rankine convencional (c).
Exemplo 6.1 Uma usina a vapor proposta para operar entre as presses de 10kPa e
2MPa com uma temperatura mxima de 400
o
C, como mostrado na figura a seguir.
Determine a eficincia mxima do ciclo de vapor usando as tabelas de vapor.
Captulo 6 Ciclos de Potncia e Refrigerao a Vapor MAQUINAS TRMICAS - EQM/UNISUL
100
6.2 Eficincia do Ciclo Rankine
A eficincia do ciclo Rankine pode ser melhorada com o aumento da presso da caldeira
e, ao mesmo tempo, mantendo-se a temperatura mxima e a presso mnima. O aumento efetivo
na produo de trabalho a rea 1-2-3-4-1 da Figura 6.2-1a, menos a rea 1-2-2-3-4-1 da
Figura 6.2-1b, uma mudana relativamente pequena. O calor, no entanto, diminui pela rea
hachurada da Figura 6.2-1c, essa diminuio significativa leva a um aumento considervel na
eficincia. A desvantagem de aumentar a presso da caldeira que o titulo do vapor saindo da
turbina pode tomar-se muito baixo (menos de 95%), resultando em danos severos nas ps da
turbina e diminuio de sua eficincia em razo das gotculas de gua.
Captulo 6 Ciclos de Potncia e Refrigerao a Vapor MAQUINAS TRMICAS - EQM/UNISUL
101
Figura 6.2-1 Efeito do aumento da presso da caldeira no Ciclo Rankine
Figura 6.2-2a Efeito do aumento da temperatura da caldeira no trabalho lquido
Captulo 6 Ciclos de Potncia e Refrigerao a Vapor MAQUINAS TRMICAS - EQM/UNISUL
102
Figura 6.2-2b Efeito do aumento da temperatura no aumento do calor inserido
Na Figura 6.2-2a o trabalho aumentada pela rea hachurada e o fornecimento de calor
aumentado pela soma da rea hachurada da Figura 6.2-2b (uma porcentagem de aumento menor
que a do trabalho).
inserido calor
lquido trabalho
T
= 6.5
v
liq
V
liq
T
q
w
Q
W
+ = 6.6
Uma vez que o numerador da Equao 6.6 sofre aumento percentual maior que o
denominador, obtem-se acrscimo na eficincia. claro que consideraes metalrgicas limitam
a temperatura mxima que pode ser atingida na caldeira. Temperaturas so limitadas em tomo de
600 C pelas ps da turbina nas seces dianteiras.
Materiais compostos, como cermica com metal, podero permitir temperaturas muito mais altas.
Outra vantagem de elevar a temperatura na caldeira que o titulo do estado 4 obviamente
aumentado. Isso reduz a formao de gotculas de gua na turbina.
Captulo 6 Ciclos de Potncia e Refrigerao a Vapor MAQUINAS TRMICAS - EQM/UNISUL
103
Figura 6.2-2c Aumento do trabalho lquido devido ao efeito da diminuio da presso no condensador
Figura 6.2-2d Resultado do efeito do aumento lquido do trabalho e do calor injetado deido ao efeito da
diminuio da presso no condensador
A diminuio na presso do condensador, ilustrada na Figura 6.2-2c, tambm resulta no
aumento da eficincia do ciclo Rankine. 0 trabalho til vai aumentar significativamente,
conforme representado pela rea hachurada, e o calor fornecido aumentara pouco porque o estado
1 movera para uma entalpia um pouco menor que a do estado 1, o resultado ser um aumento na
eficincia do ciclo Rankine, Figura 6.2-2d. 0 processo de transmisso de calor que ocorre no
condensador limita a presso baixa. O calor rejeitado para a gua ou o ar usados para
resfriamento entrando no condensador a aproximadamente 20C. 0 processo de transmisso de
calor necessita de uma diferena de temperatura entre o fluido de resfriamento e o vapor de pelo
menos 10C. Consequentemente, uma temperatura de pelo menos 30C requerida no condensa-
dor. Isso corresponde a uma presso mnima do condensador (veja as tabelas de vapor) de
Captulo 6 Ciclos de Potncia e Refrigerao a Vapor MAQUINAS TRMICAS - EQM/UNISUL
104
aproximadamente 4 kPa. Isso, obviamente, depende da temperatura da gua ou ar usados para o
resfriamento e da diferena de temperatura requerida no trocador de calor.
Exemplo 6.2 Considere que a presso da cadeira do exemplo 6.1 aumente para 4Mpa,
enquanto se mantm a temperatura mxima e a presso mnima. Despreza o trabalho da
bomba e calcule a percentagem do aumento de eficincia trmica usando as tabelas de
vapor.
Captulo 6 Ciclos de Potncia e Refrigerao a Vapor MAQUINAS TRMICAS - EQM/UNISUL
105
Soluo:
A entalpia h
2
essencialmente igual a h
1
: h
2
=192kJ/kg. A 400
o
C e 4Mpa, a entalpia e entropia
so h
3
=3214 kJ/kg e s
3
=6,7698kJ/kgK. O estado 4 est na regio bifsica. Usando s
4
=s
3
, o ttulo
encontrado como:
8159 , 0
5019 , 7
6491 , 0 7698 , 6
lg
1 4
4
=
=
s
s s
x
ls vs
s s s =
lg
Observe que o contedo de umidade aumentou para 18,4%, um resultado indesejado. A entalpia
do estado 4 vale, ento,
kg kJ x h x h h
l
/ 2144 2392 8159 , 0 192
lg 4 4
= + = + =
ls vs
h h h =
lg
O calor fornecido :
kg kJ h h q
v
/ 3022
4 3
= =
E a sada de trabalho da turbina :
kg kJ h h w
T
/ 1070 2144 3214
4 3
= = =
Finalmente a eficincia da turbina :
3541 , 0
3022
1070
= = =
v
T
q
w
A porcentagem de aumento de eficincia :
% 55 , 9 100
3232 , 0
3232 , 0 3541 , 0
1 . 6
=
= x
Exemplo 6.3 Diminua a presso do condensador do exemplo 6.1 para 4kPa mantendo a
presso da caldeira e a temperatura mxima. Determine a percentagem de aumento na
eficincia trmica usando as tabelas de vapor.
Captulo 6 Ciclos de Potncia e Refrigerao a Vapor MAQUINAS TRMICAS - EQM/UNISUL
106
As entalpia h
2
=192 kJ/kg e h
3
=3248 kJ/kg permanecem como estabelecidas no exemplo 6.1.
Usando s
3
=s
4
=7,1279, como p
4
=4kPa, achamos o ttulo como:
8327 , 0
0529 , 8
4255 , 0 1279 , 7
lg
1 4
4
=
=
s
s s
x
Note que o contedo de umidade de 16,7% maior que o do exemplo 6.1, como esperado. A
entalpia do estado 4 :
kg kJ x h x h h
l
/ 2147 2433 8327 , 0 121
lg 4 4
= + = + =
A eficincia trmica , ento,
3603 , 0 100
192 3248
2147 3248
2 3
4 3
=
= x
h h
h h
% 5 , 11 100
3232 , 0
3232 , 0 3603 , 0
1 . 6
=
= x
Este o maior aumento percentual obtido nos trs exemplos, mostrando por que se procura
empregar a menor presso possvel no condensador
Captulo 6 Ciclos de Potncia e Refrigerao a Vapor MAQUINAS TRMICAS - EQM/UNISUL
107
6.3 Ciclo com Reaquecimento
Ficou claro que, quando se opera um ciclo Rankine com uma caldeira de alta presso ou
um condensador de baixa presso, difcil evitar a formao de gotculas liquidas nas sees de
baixa presso da turbina. Ja que metais no podem resistir as temperaturas acima de 600C, o
ciclo com reaquecimento freqentemente usado para evitar a formao de gotculas liquidas: o
vapor passando atravs da turbina a alguma presso intermediaria reaquecido, aumentando sua
temperatura para o estado 5 no diagrama T-s da Figura 6.3-1. 0 vapor, ento passa atravs de
uma seo da turbina de baixa presso e entra no condensador no estado 6. Isso controla ou elimi-
Figura 6.3-1 Ciclo com reaquecimento
na completamente o problema de umidade na turbina. Frequentemente, a turbina separada em
dois estgios, uma turbina de alta presso e uma turbina de baixa presso. O ciclo com
reaquecimento no influencia significativamente a eficincia trmica do ciclo, mas resulta em um
considervel aumento de trabalho til representado pelas reas 4-5-6-4-4 na figura 6.3-1. O ciclo
com reaquecimento exige um investimento significativo em equipamento adicional, e o uso de
tal equipamento deve ser economicamente justificado, pelo aumento de trabalho gerado. Se o
reaquecimento no usado para evitar a formao de gotculas, a presso do condensador deve
ser bastante alta, prxima do estado 4, na sada do primeiro estgio da turbina, resultando em um
ciclo menos eficiente. Portanto, o reaquecimento permite aumentar a eficincia por meio da
reduo da presso do condensador.
Captulo 6 Ciclos de Potncia e Refrigerao a Vapor MAQUINAS TRMICAS - EQM/UNISUL
108
Exemplo 6.4 Vapor a alta presso entra em uma turbina a 600 psia e a 100F. Ele
reaquecido a uma presso de 40 psia para 600F e ento, expandido para 2 psia. Determine a
eficincia do ciclo usando as tabelas de vapor. Consulte a figura 6.3-1
R:. = 36,5%
Captulo 6 Ciclos de Potncia e Refrigerao a Vapor MAQUINAS TRMICAS - EQM/UNISUL
109
6.4 Efeito de perdas de Eficincia dos Ciclos de Potncia
Nas sees anteriores, lidamos com ciclos ideais, assumindo que no houve nenhuma
queda de presso atravs das tubulaes na caldeira, nenhuma perda enquanto o vapor
superaquecido passa pelas ps da turbina, nenhum sub-resfriamento da linha que sai do
condensador e nenhuma perda na bomba durante o processo de compresso. As perdas no
processo de combusto e as ineficincias na transmisso de calor subseqente para o fluido nos
dutos da caldeira no so includas aqui. Essas perdas, que esto por volta de 15% da energia
contida no carvo ou no leo, estariam includas no total da eficincia da usina real.
H uma perda substancial que deve ser considerada quando calculamos a eficincia real
do ciclo: a perda que ocorre quando o vapor se expande atravs das fileiras de ps da turbina.
Quando o vapor passa por uma p de turbina, h frico viscosa. Alem disso, a transmisso de
calor pode ocorrer para o exterior da turbina, embora ela seja pequena. Essas perdas resultam em
eficincia da turbina de 80% a 89%. A eficincia da turbina e definida como:
s
r
T
w
w
= 6.7
em que w
r
e 0 trabalho real e w
s
o trabalho isentrpico. A definio da eficincia da bomba :
r
s
T
w
w
= 6.8
na qual o trabalho isentrpico obviamente menor que o trabalho real.
H uma perda substancial na presso, provavelmente de 10% a 20%, enquanto o fluido
escoa atravs de muitos metros de duto saindo da bomba, passando pela caldeira, para a entrada
da turbina. A perda pode ser superada simplesmente aumentando-se a presso na sada da bomba.
Isso requer mais trabalho da bomba, mas este menor que 1 % do trabalho da turbina e ,
portanto, desprezado. Consequentemente devemos ignorar as perdas na tubulao da caldeira. 0
condensador pode ser projetado para operar de modo que a gua na sada esteja bem perto da
condio de liquido saturado. Isso vai minimizar as perdas do condensador, de maneira que elas
possam ser ignoradas. O ciclo Rankine real resultante ilustrado no diagrama T-s na Figura
6.4-1. A perda mais significativa a que ocorre na turbina. Observe o aumento na entropia do
estado 4 comparado com o estado 3. Observe, tambm, o efeito desejado de diminuio do
contedo de umidade do estado 4.
Captulo 6 Ciclos de Potncia e Refrigerao a Vapor MAQUINAS TRMICAS
Na verdade, o estado 4 pode ate se mover para a regio de superaquecimento, com
Figura 6.4-1 Ciclo Rankine com perdas na Turbina
Ciclos de Potncia e Refrigerao a Vapor MAQUINAS TRMICAS
110
estado 4 pode ate se mover para a regio de superaquecimento, com
1 Ciclo Rankine com perdas na Turbina
Ciclos de Potncia e Refrigerao a Vapor MAQUINAS TRMICAS - EQM/UNISUL
estado 4 pode ate se mover para a regio de superaquecimento, como mostrado.
Captulo 6 Ciclos de Potncia e Refrigerao a Vapor MAQUINAS TRMICAS - EQM/UNISUL
111
6.5 Ciclo de Refrigerao a Vapor
possvel extrair calor de um espao por meio da operao de um ciclo a vapor, parecido
com o ciclo Rankine, porm funcionando em sentido inverso. A entrada de trabalho ,
obviamente, necessrio,como mostrado na Figura 6.5-1a. 0 trabalho realizado por um
compressor que aumenta a presso e, em conseqncia, a temperatura de um fluido na fase
gasosa por meio de um processo de compresso isentrpico no ciclo ideal. 0 fluido de trabalho
(em geral, R134a) na fase gasosa, comprimida e quente, entra em um condensador no qual calor
extrado, resultando em liquido saturado. A presso desse liquido , reduzida em um processo de
expanso, de modo que o fluido possa ser evaporado por aquecimento pelo calor proveniente do
espao refrigerado. Em seguida, esse vapor segue para o compressor, formando o ciclo
Figura 6.5-1 - Ciclo de refrigerao a Vapor: (a) Os componentes
(b) (c)
Figura 6.5-1 Ciclo de refrigerao a Vapor: (b) Carnot e (c) Refrigerao ideal
Captulo 6 Ciclos de Potncia e Refrigerao a Vapor MAQUINAS TRMICAS - EQM/UNISUL
112
O ciclo mais eficiente, um ciclo de Carnot, mostrado na Figura 6.5-1b. H, no entanto,
duas grandes desvantagens quando uma tentativa e feita para colocar tal ciclo em uma operao
real. Primeiro no aconselhvel comprimir a mistura de liquido e de vapor como representado
pelo estado 1 na Figura 6.5-1b, uma vez que as gotculas de liquido causariam desgaste
excessivo; alem disso, o equilbrio entre a fase lquida e a fase de vapor difcil de ser mantido
em tal processo. Logo, no ciclo de refrigerao ideal, um estado de vapor saturado e assumido no
fim do processo de evaporao. Isso permite o vapor superaquecido existir no compressor, como
mostrado pelo processo 1-2 na Figura 6.5-1c. Segundo, seria bem caro construir um dispositivo
para ser usado no processo de expanso que seria perto de um processo isentrpico (nenhuma
perda permitida). E muito simples reduzir a presso irreversivelmente utilizando uma vlvula
de expanso que realiza um processo de obstruo parcial em que a entalpia permanece
constante, como mostrado pelo processo 3-4 na Figura 6.5-1c. Ainda que esse processo seja
caracterizado por perdas, ele e considerado como parte do ciclo ideal de refrigerao a vapor.
Como o processo de expanso um processo de no - equilbrio, a rea sob o diagrama T-s no
representa o trabalho realizado.
Muitas das dificuldades associadas ao ciclo inverso de Carnot podem ser eliminados pela
vaporizao completa do frigogenio antes de ser comprimido e pela substituio da turbina por
um dispositivo estrangulador, tal como uma vlvula de expanso ou um tubo capilar. O resultado
o ciclo frigorfico ideal por compresso de vapor
Este ciclo o mais utilizado em frigorficos, aparelhos de ar condicionado e bombas de
calor, sendo constitudo por quatro processos:
1-2 Compresso isentrpica num compressor
2-3 Rejeio de calor a presso constante no condensador
3-4 Expanso numa vlvula
4-1 Absoro de calor a presso constante no evaporador
Num ciclo frigorfico ideal por compresso de vapor, o frigorignio:
Estado 1: entra no compressor como vapor saturado, sendo comprimido isentropicamente
at presso do condensador (a temperatura do fluido eleva-se acima do valor do meio
ambiente).
Estado 2: entra no condensador na fase de vapor sobreaquecido
Captulo 6 Ciclos de Potncia e Refrigerao a Vapor MAQUINAS TRMICAS - EQM/UNISUL
113
Estado 3: sai como lquido saturado, resultante da rejeio de calor para a vizinhana. (a
temperatura do fluido ainda superior da vizinhana). O frigorignio estrangulado at
presso do evaporador, devido passagem por uma vlvula de expanso ou tubo capilar. A
temperatura do fluido diminui para um valor inferior ao da temperatura do meio arrefecido.
Estado 4: entra no evaporador como uma mistura saturada com um valor reduzido de
ttulo, sendo totalmente vaporizado, devido absoro de calor do espao refrigerado. O fluido
sai do evaporador como vapor saturado e entra novamente no compressor, completando o ciclo.
Num frigorfico domstico, o compartimento do congelador serve de evaporador, onde
calor absorvido pelo frigorignio. A serpentina localizada na traseira serve de condensador,
onde calor dissipado para o ar exterior.
O desempenho do ciclo de refrigerao, quando empregado com um refrigerador, e
medido por:
COP
=
Q
6.9
quando o ciclo e usado para aquecimento como uma bomba de calor, o desempenho medido
por:
COP
=
Q
6.10
o coeficiente de performance COP pode alcanar valores como 5 para uma bomba de calor
corretamente projetada e 4 para refrigeradores.
As temperaturas de condensao e de evaporao e, portanto, as presses so
estabelecidas pela situao particular que dita o projeto da unidade de refrigerao. Por exemplo,
em um refrigerador caseiro fabricado para resfriar o espao do freezer para -18C (0
o
F),
necessrio projetar o evaporador para operar a aproximadamente -25C para permitir uma
transmisso de calor eficaz entre o freezer e as serpentinas do resfriador. A substancia
refrigerante condensa em decorrncia da transmisso de calor para o ar ambiente, o qual pode
estar cerca de 20C; consequentemente, para permitir uma transmisso de calor eficaz das
Captulo 6 Ciclos de Potncia e Refrigerao a Vapor MAQUINAS TRMICAS
serpentinas que transportam a substncia
a uma temperatura de pelo menos 27C. Isso e mostrado na Figura 6.
Figura 6.5-2 Ciclo de refrigerao mostrando as temperaturas do projeto.
Para conseguir a ref
evaporao seja bastante baixa (em tomo de
como candidata a substancia ref
dia so a amnia (NH
3
) e o
As propriedades do R134 so apresentadas
refrigerante depende da variao das temperaturas altas e baixas.
abaixo de -100C so necessrias para liquefazer muitos gases. Obviamente, nem a amnia nem
R134a podem ser usados a tais baixas temperaturas, visto que eles n
abaixo de -100
o
C. necessrio tambm que se opere u
presso baixa esteja acima da presso atmosfrica, evitando, assim, a contamina
caso de um vazamento. Alm disso
ser no-txica, estvel, no pre
Ciclos de Potncia e Refrigerao a Vapor MAQUINAS TRMICAS
114
entinas que transportam a substncia refrigerante para o meio ambiente, ela deve ser mantida
a temperatura de pelo menos 27C. Isso e mostrado na Figura 6.5-2
Ciclo de refrigerao mostrando as temperaturas do projeto.
Para conseguir a refrigerao na maioria dos espaos, necessrio que a tempera
seja bastante baixa (em tomo de -25C, talvez). Isso, obviamente, d
candidata a substancia refrigerante. Duas substancias refrigerantes comuns usadas hoje em
R134a (CF
3
-CH
2
- F 1, 1, 1,2 - tetrafluoretano).
As propriedades do R134 so apresentadas NA tabela 2.4-9. A seleo de uma substncia
efrigerante depende da variao das temperaturas altas e baixas. Por exemplo, temperaturas bem
necessrias para liquefazer muitos gases. Obviamente, nem a amnia nem
34a podem ser usados a tais baixas temperaturas, visto que eles no existem em forma liquida
necessrio tambm que se opere um ciclo de refrigera
presso baixa esteja acima da presso atmosfrica, evitando, assim, a contamina
lm disso, para a maioria das aplicaes, a substancia refrigerante deve
, no prejudicial ao meio ambiente e relativamente barata.
Ciclos de Potncia e Refrigerao a Vapor MAQUINAS TRMICAS - EQM/UNISUL
meio ambiente, ela deve ser mantida
2.
necessrio que a temperatura de
25C, talvez). Isso, obviamente, descarta a gua
tes comuns usadas hoje em
tetrafluoretano).
9. A seleo de uma substncia
Por exemplo, temperaturas bem
necessrias para liquefazer muitos gases. Obviamente, nem a amnia nem o
o existem em forma liquida
ciclo de refrigerao de modo que a
presso baixa esteja acima da presso atmosfrica, evitando, assim, a contaminao pelo ar no
, a substancia refrigerante deve
judicial ao meio ambiente e relativamente barata.
Captulo 6 Ciclos de Potncia e Refrigerao a Vapor MAQUINAS TRMICAS - EQM/UNISUL
115
EXERCCIOS PROPOSTOS:
6.1)Considere o processo cclico ideal abaixo que usa vapor como fluido de trabalho. Aplicando
o primeiro e segundo princpios e sabendo-se que a vazo de vapor dgua que atravessa a
turbina de 1000kg/s, calcule: (a)O ttulo em 5, (b) Qual a potncia produzida em MW pela
turbina?. Considere o processo adiabtico, (c) Supondo que a gua utilizada para resfriamento no
condensador de um corpo receptor local captada a 25
o
C e lanada a 35
o
C, calcule a vazo
diria de gua do rio necessria. (d) Calcule o trabalho realizado pela bomba em kW, (e) Calcule
o rendimento do ciclo de Rankine, sabendo-se que o trabalho da bomba no desprezvel, (f)
Desenhe o diagrama T X s do ciclo de rankine, inserindo os valores numricos dos pontos no
grfico (1,0)
DADOS: C kg / kJ 17 , 4 Cp
o
= 1Kcal = 4,18kJ 1kgf/cm
2
= 1 bar = 0,1MPa
1kW 1kJ/s kW 1000
s
m
MPa 1
3
= =
6.2) Considere um ciclo ideal de refrigerao que apresenta temperaturas no condensador e no
evaporador, respectivamente, iguais a 45C e -15C. Determine o coeficiente de eficcia para
ciclos que utilizam R-12 como fluido de trabalho.
6.3) O R-134a, por ser menos agressivo ao ambiente, um dos refrigerantes substitutos para o R-
12. Repita o problema anterior utilizando o R-134a como fluido de trabalho.
6.4) Um ciclo de refrigerao, com R-12 como fluido de trabalho, opera numa condio onde a
temperatura mnima -10C e presso mxima 1 MPa. Admita que o ciclo seja ideal.
Determine o coeficiente de eficcia do ciclo.
6.5)Considere um ciclo frigorfico ideal que utiliza R-12 como fluido de trabalho. A temperatura
de refrigerante no evaporador -20C e no condensador 40
o
C Determine o coeficiente de
eficcia do ciclo.
6.6) Considere uma bomba de calor ideal onde a temperatura no condensador e no evaporador
so, respectivamente, iguais a 50 e a OC. Determine o coeficiente de eficcia utilizando R-12
como fluido de trabalho.
6.6) Considere um ciclo ideal de refrigerao do problema 1 que apresenta temperaturas no
condensador e no evaporador, respectivamente, iguais a 45C e -15C. Determine o coeficiente
de eficcia para ciclo que utiliza amnia como fluido de trabalho.
You might also like
- Apostila Tratamento de EfluentesDocument71 pagesApostila Tratamento de EfluentesKleber Ramos100% (1)
- Apostila Tratamento de EfluentesDocument108 pagesApostila Tratamento de EfluentesMarcos Santiago50% (4)
- Mini Caldeiras 2008Document0 pagesMini Caldeiras 2008gustavodm8No ratings yet
- Contaminação Do Solo Por Vazamentos SubterrâneosDocument2 pagesContaminação Do Solo Por Vazamentos SubterrâneosNadjanara EduardoNo ratings yet
- Exp ReynoldsDocument3 pagesExp ReynoldsNadjanara EduardoNo ratings yet
- MECÂNICA DOS SOLOS II: ENSAIO CBRDocument19 pagesMECÂNICA DOS SOLOS II: ENSAIO CBRMarco Antonio VieiraNo ratings yet
- 7 e 8. Escoamento de F. IncompressivéisDocument35 pages7 e 8. Escoamento de F. IncompressivéisAndré AlencarNo ratings yet
- Análise bidimensional de deformação em mecânica aplicadaDocument10 pagesAnálise bidimensional de deformação em mecânica aplicadaZeinadine TaleNo ratings yet
- Considere Que 200 J de Trabalho São Realizados Sobre Um Sistema e 70,0 Cal de Calor SãoDocument1 pageConsidere Que 200 J de Trabalho São Realizados Sobre Um Sistema e 70,0 Cal de Calor SãoRafhael AraújoNo ratings yet
- Fundamentos - Rev 2021 (3606)Document126 pagesFundamentos - Rev 2021 (3606)cosmeticosolucaoNo ratings yet
- Difusão em Ciência dos MateriaisDocument27 pagesDifusão em Ciência dos MateriaisBruno LimaNo ratings yet
- Propriedades térmicas dos alimentosDocument3 pagesPropriedades térmicas dos alimentosandengal799100% (2)
- MECÂNICA DOS FLUIDOS - LISTA DE EXERCÍCIOSDocument2 pagesMECÂNICA DOS FLUIDOS - LISTA DE EXERCÍCIOSRóger Banioli33% (6)
- Experimento 1-Solubilidade e TermodinâmicaDocument6 pagesExperimento 1-Solubilidade e TermodinâmicaJosé GuilhermeNo ratings yet
- Icemec - 2018 - Artigo CorrigidoDocument5 pagesIcemec - 2018 - Artigo CorrigidoFernando JadãoNo ratings yet
- Análise de trocadores de calor em operações unitáriasDocument10 pagesAnálise de trocadores de calor em operações unitáriasKrystel Laís WassmerNo ratings yet
- Projeto de Reatores Não IsotermicosDocument45 pagesProjeto de Reatores Não IsotermicosDionéia BertolettiNo ratings yet
- SFM ProduçãoDocument36 pagesSFM ProduçãoJosé AntonioNo ratings yet
- SINTERIZAÇÃODocument50 pagesSINTERIZAÇÃOCLESIANE DOS SANTOSNo ratings yet
- Teste Energia 7anoDocument6 pagesTeste Energia 7anoElsa Viana Baptista50% (2)
- Termodinâmica - FBDocument4 pagesTermodinâmica - FBNuricel Villalonga AguileraNo ratings yet
- Sistemas Fluidotérmicos - Matéria CompletaDocument32 pagesSistemas Fluidotérmicos - Matéria CompletaJonatan SouzaNo ratings yet
- 002 - Degradação de Chapa de Zinco Numa CoberturaDocument1 page002 - Degradação de Chapa de Zinco Numa CoberturaRichard TeixeiraNo ratings yet
- Ensaios mecânicos introduçãoDocument24 pagesEnsaios mecânicos introduçãoMaria LuziaNo ratings yet
- Edifício Habitação Unifamiliar - Análise Térmica EnvolventeDocument2 pagesEdifício Habitação Unifamiliar - Análise Térmica EnvolventeFotograma StoreNo ratings yet
- Resistência dos materiais: notas de aula sobre reações, esforços, treliças planas e flexão de vigasDocument85 pagesResistência dos materiais: notas de aula sobre reações, esforços, treliças planas e flexão de vigasArmando Belato PereiraNo ratings yet
- Exercicios FQ CEFDocument2 pagesExercicios FQ CEFmarisa_silva_2No ratings yet
- Fenômenos+de+Transporte +seção+4 2+e+4 3Document43 pagesFenômenos+de+Transporte +seção+4 2+e+4 3Hadassah AvrahamNo ratings yet
- Diagramas tensão-deformaçãoDocument6 pagesDiagramas tensão-deformaçãoLucas Santos100% (1)
- Estruturas Metalicas Notas de AulaDocument71 pagesEstruturas Metalicas Notas de AulaEder1000100% (3)
- OUTDOWN 16062009145537matriz Preliminar IndustrialDocument56 pagesOUTDOWN 16062009145537matriz Preliminar IndustrialzedanevesNo ratings yet
- EXERCÍCIOS TERMOQUÍMICADocument2 pagesEXERCÍCIOS TERMOQUÍMICAGeilson SilvaNo ratings yet
- Dados - CalorimetriaDocument2 pagesDados - CalorimetriaMayara OliveiraNo ratings yet
- Evaporador - Catálogo PDFDocument16 pagesEvaporador - Catálogo PDFJasson FuchoNo ratings yet
- 2 Lista QGE2001Document6 pages2 Lista QGE2001Giselaine MedeirosNo ratings yet