Professional Documents
Culture Documents
Solues 120808142105 Phpapp01
Uploaded by
tissiaraujoOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Solues 120808142105 Phpapp01
Uploaded by
tissiaraujoCopyright:
Available Formats
Prof.
EDUARDO CARIELO
QUMICA
2 ANO
SOLUES MISTURAS Quando juntamos duas espcies qumicas diferentes e, no houver reao qumica entre elas, isto , no houver formao de nova(s) espcie(s), teremos uma mistura. Exemplos: Mistura de gua e acar Mistura de gua e leo
SOLUES Quando na disperso o disperso possui tamanho mdio de at 10 7 cm a disperso receber o nome especial de soluo. Nas solues o disperso chama-se soluto e dispergente ser denominado de solvente. Exemplo: Na mistura de gua e acar o soluto o acar e o solvente a gua. COEFICIENTE DE SOLUBILIDADE (CS) a quantidade mxima de uma substncia capaz de se dissolver em uma quantidade fixa de solvente, em certas condies (temperatura e presso).
Quando na mistura tiver apenas uma nica caracterstica em toda a sua extenso teremos uma mistura homognea e, se tiver mais de um aspecto a mistura ser heterognea. Exemplos: gua e acar uma mistura homognea gua e leo uma mistura heterognea Cada aspecto visvel em uma mistura denominado de FASE. Exemplos: Na mistura de gua e leo temos dois aspectos, isto , temos duas fases, ento a mistura bifsica. Na mistura de gua, leo e clorofrmio temos trs aspectos, isto , temos trs fases, ento a mistura trifsica. DISSEMINAO Em uma mistura de duas espcies qumicas diferentes, pode ocorrer a disseminao, sob forma de pequenas partculas, de uma espcie na outra. Neste caso o sistema recebe o nome de disperso. A espcie qumica disseminada na forma de pequenas partculas o disperso e, a outra espcie o dispergente. Exemplo: Na mistura de gua e acar o acar o disperso e a gua o dispergente.
Quando na soluo temos uma quantidade de soluto menor que o mximo permitido pelo coeficiente de solubilidade a soluo ser classificada como soluo insaturada; se a quantidade for igual ao mximo permitido pelo coeficiente de solubilidade ela ser denominada soluo saturada e, se tivermos mais que o permitido pelo coeficiente de solubilidade a soluo ser supersaturada.
Prof. EDUARDO CARIELO
QUMICA
2 ANO
Exerccios: 01) Se dissolvermos totalmente uma certa quantidade de sal em solvente e por qualquer perturbao uma parte do sal se depositar, teremos no final uma soluo: a) saturada com corpo de fundo. b) supersaturada com corpo de fundo. c) insaturada. d) supersaturada sem corpo de fundo. e) saturada sem corpo de fundo. 02) Um determinado sal tem coeficiente de solubilidade igual a 34g/100g de gua, a 20C. Tendo-se 450g de gua a 20 C, a quantidade, em gramas, desse sal, que permite preparar uma soluo saturada, de: a) 484g. b) 450g. c) 340g. d) 216g. e) 153g. 03) A solubilidade do K2Cr2O7, a 20c, de 12g/100g de gua. Sabendo que uma soluo foi preparada dissolvendo-se 20g do sal em 100g de gua a 60c e que depois, sem manter em repouso, ela foi resfriada a 20c, podemos afirmar que: a) todo sal continuou na soluo. b) todo sal passou a formar um corpo de cho. c) 8g de sal foi depositado no fundo do recipiente. d) 12g do sal foi depositado no fundo do recipiente. e) 31g do sal passou a formar um corpo de cho. 04) Aps a evaporao de toda a gua de 25g de uma soluo saturada (sem corpo de fundo) da substncia x, pesou-se o resduo slido, obtendo-se 5g. se, na mesma temperatura do experimento anterior, adicionarmos 80g da substncia x em 300g de gua, teremos uma soluo: a) insaturada. b) saturada sem corpo de fundo. c) saturada com 5g de corpo de fundo. d) saturada com 20g de corpo de fundo. e) supersaturada. c, de 05) A solubilidade do cido brico (H3BO3), a 20 5g em 100g de gua. Adicionando-se 200g de h3bo3 em 1,00 kg de gua, a 20 c, quantos gramas de cido restam na fase slida? a) 50g. b) 75g. c) 100g. d) 150g. e) 175g.
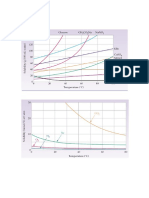
CURVAS DE SOLUBILIDADE Analisando um grfico de solubilidade podemos destacar trs regies.
A temperatura e a presso tm influncia na solubilidade de um slido e de um gs em um lquido. Quando a solubilidade aumenta com o aumento da temperatura, teremos uma solubilidade endotrmica.
Quando a solubilidade diminui com o aumento da temperatura, teremos uma solubilidade exotrmica.
Prof. EDUARDO CARIELO
QUMICA
2 ANO
Algumas solubilidades tm irregularidades, apresentando pontos de inflexo.
ndice 1, para quantidades relativas ao soluto. ndice 2, para quantidades relativas ao solvente. Sem ndice, para quantidades relativas soluo. CONCENTRAO COMUM (C) o quociente entre a massa do soluto (m1), em gramas, e o volume da soluo (v), em litros.
01) (UCSAL-BA) Considere o grfico:
Unidade: g/L Indica a quantidade de soluto em cada litro de soluo.
EXERCCIOS DE APLICAO: 01) Um frasco de laboratrio contm 2,0 litros de uma soluo aquosa de NaCl. A massa do sal dissolvida na soluo de 120 g. que volume deve ser retirado da soluo inicial para que se obtenham 30g de sal dissolvido? a) 1,0 litro. b) 0,5 litro. c) 0,25 litro. d) 1,5 litros. e) 0,75 litro. 02) A concentrao de uma soluo 5,0 g/litro. Dessa soluo 0,5 litro contm: a) 10g de soluto. b) 0,25g de soluto. c) 2,5g de solvente. d) 2,5g de soluto. e) 1,0g de soluto. 03) Uma soluo aquosa com concentrao de 20g/litro apresenta: a) 20 g de soluto dissolvidos em 1 litro de gua. b) 40 g de soluto dissolvidos em 0,5 litro de soluo. c) 10 g de soluto dissolvidos em 0,5 litro de soluo. d) 40 g de soluto dissolvidos em 4,0 litros de soluo. e) 10 g de soluto dissolvidos em 2,0 litros de soluo. 04) Num balo volumtrico de 250 ml adicionam-se 2,0g de sulfato de amnio slido; o volume completado com gua. A concentrao da soluo obtida, em g/litro, : a) 1,00. b) 2,00. c) 3,50. d) 4,00. e) 8,00.
Com base nesse grfico, pode-se concluir que, acrescentando-se 20g de cloreto de potssio em 50g de gua, a 20 c, obtm-se soluo aquosa: a) saturada com corpo de fundo, que insaturada pelo aquecimento. b) saturada com corpo de fundo, que insaturada pelo resfriamento. c) saturada sem corpo de fundo, que insaturada pelo resfriamento. d) insaturada, que pode torna-se aquecimento. e) insaturada, que pode torna-se resfriamento. pode torna-se pode torna-se pode torna-se saturada saturada por por
CONCENTRAO DE UMA SOLUO Chamamos de concentrao de uma soluo a toda forma de expressar a proporo existente entre as quantidades de soluto e solvente ou, ento, as quantidades de soluto e soluo. No estudo das solues usaremos a seguinte conveno:
Prof. EDUARDO CARIELO
QUMICA
2 ANO
DENSIDADE (d) o quociente entre a massa e o volume de um corpo.
e) 1 mol de soluto para cada 1,0 litro de soluo 03)(PUC-SP) No preparo de soluo alvejante de tinturaria, 521,5g de NaClO so dissolvidos em gua suficiente para 10,0 litros de soluo. A concentrao, em mols/litro, da soluo : Dados: massa molar do NaClO = 74,5 g/mol a) 7,0. b) 3,5. c) 0,70. d) 0,35. e) 0,22. 04)a molaridade de uma soluo aquosa contendo 36,5g de cido clordrico dissolvidos em gua at completar 2 litros de soluo : Dados: H = 1 u.m.a; Cl = 35,5 u.m.a. a) 0,5 m. b) 1,0 m. c) 1,5 m. d) 2,0 m. e) 2,5 m. 05) Uma soluo 0,1 molar de um hidrxido alcalino MOH preparada dissolvendo-se 0,8 g de hidrxido MOH em 200 ml de soluo. A frmula do hidrxido : a) CsOH. b) KOH. c) LiOH. d) NaOH. e) RbOH. 06) Em um balo volumtrico de 500 ml colocaram-se 9,6 g de cloreto de magnsio e completou-se o volume com gua destilada. Sabendo-se que o cloreto de magnsio foi totalmente dissolvido, assinale a concentrao aproximada dos ons magnsio nessa soluo: Dados: Mg = 24 u.m.a; Cl = 35,5 u.m.a. a) 0,05 mol/l. b) 0,1 mol/l. c) 0,2 mol/l. d) 0,4 mol/l. e) 3,2 mol/l. 07) (UCS-RS) Uma pessoa usou 34,2g de sacarose (C12H22O11) para adoar seu cafezinho. O volume de cafezinho adoado na xcara foi de 50 mL. A concentrao molar da sacarose no cafezinho foi de: a) 0,5 mol/L. b) 1,0 mol/L. c) 1,5 mol/L. d) 2,0 mol/L. e) 2,5 mol/L.
01) 5,0 litros de uma soluo tem massa de 20g. A densidade dessa soluo : a) 25 g/L. b) 20 g/L. c) 15 g/L. d) 5 g/L. e) 4 g/L.
CONCENTRAO MOLAR (m) o quociente entre o nmero de moles do soluto (n1) e o volume da soluo (v), em litros.
Unidade: mol/L ou molar (M) Como n1 = m1 / M1, teremos:
Onde: m1 a massa do soluto , em gramas. M1 a massa molecular do soluto.
Exerccios: 01) Em 3 litros de uma soluo de NaOH existem dissolvidos 12 mols desta base. a molaridade desta soluo : a) 3 mol/l. b) 4 mol/l. c) 9 mol/l. d) 15 mol/l. e) 36 mol/l. 02) Uma soluo aquosa 2,0 molar de cido clordrico apresenta: a) 2 mols de soluto para cada 2,0 litros de soluo b) 2 mols de soluto para cada 1,0 litro de solvente c) 2 mols de soluto para cada 1,0 litro de soluo d) 1 mol de soluto para cada 2,0 litros de soluo
Prof. EDUARDO CARIELO
QUMICA
2 ANO
08) A massa de hidrxido de sdio dissolvida em 10mL de soluo 0,10 mol/L dessa substncia igual a: Dados: Na = 23 u.; O = 16 u.; H = 1 u. 1 a) 4,0 . 10 g. 2 b) 4,0 . 10 g. 3 c) 4,0 . 10 g. 4 d) 4,0 . 10 g. 5 e) 4,0 . 10 g. 09) Um qumico preparou uma soluo de carbonato de sdio (na2co3) pesando 53g do sal, dissolvendo e completando o volume para 2 litros. A molaridade da soluo preparada foi de: Dados: C = 12 u; O = 16 u; Na = 23 u a) 1,00 mol/L. b) 0,50 mol/L. c) 0,25 mol/L. d) 0,125 mol/L. e) 0,0625 mol/L.
TTULO EM MASSA (T) o quociente entre a massa do soluto (m1) e a massa total da soluo (m), ambas na mesma unidade.
Considerando m = m1 + m2
Podemos relacionar a concentrao molar com a concentrao comum pela expresso:
Exerccios: 01) Uma massa de 40g de NaOH so dissolvidas em 160g de gua. A porcentagem, em massa, de NaOH presente nesta soluo de: a) 20%. b) 40%. c) 10%. d) 80%. e) 100%. 02) O NaCl est presente na gua do mar com 2,5% em massa. Que massa de gua do mar deve ser transferida para uma salina para que, por evaporao da gua, restem 150 g de sal? a) 150g. b) 5850g. c) 6000g. d) 250g. e) 15000g. 03) Uma soluo aquosa de NaCl apresenta porcentagem em massa de 12,5%. Isso significa que, para cada 100g de soluo, teremos ________g de soluto e ________g de solvente. Completa-se corretamente a afirmao acima, respectivamente, com: a) 12,5g e 100 g. b) 12,5g e 87,5g. c) 87,5g e 12,5g. d) 100g e 12,5g. e) 58,5g e 41,5g. 04) Quando se dissolve um certo nmero de gramas de cloreto de clcio, no triplo de gua, a concentrao da soluo resultante (porcentagem em massa) igual a: a) 15%. b) 25%. c) 30%. d) 40%. e) 4%.
EXERCCIOS: 01) A concentrao do cloreto de sdio na gua do mar , em mdia, de 2,95 g/L. assim sendo, a molaridade desse sal na gua do mar aproximadamente : Dados: Na = 23 u.m.a.; Cl= 35,5 u.m.a. a) 0,050 M. b) 0,295 M. c) 2,950 M. d) 5,000 M. e) 5,850 M. 02) Uma soluo 2,5 molar de NaOH apresentar concentrao comum igual a : Dados: H = 1 u.; O = 16 u.; Na = 23 u. a) 10 g/L. b) 100 g/L. c) 25 g/L. d) 2,5 g/L. e) 16 g/L. 03) Temos uma soluo 1,5 mol/L de cido sulfrico (H2SO4). Esta soluo : Dados: H = 1 u.; O = 16 u.; S = 32 u a) 98 g/L. b) 9,8 g/L. c) 1,5 g/L. d) 147 g/L. e) 65,3 g/L.
Prof. EDUARDO CARIELO
QUMICA
2 ANO
05) Quantos gramas de gua so necessrios, a fim de se preparar uma soluo, a 20% em peso, usando 80g de soluto? a) 400g. b) 500g. c) 180g. d) 320g. e) 480g.
05) Qual a molaridade de uma soluo aquosa de etanol, C2H6O, de concentrao igual a 4,6g/l? Dados: H = 1 u.; C = 12 u.; O = 16 u. a) 4,6 m. b) 1,0 m. c) 0,5 m. d) 0,2 m. e) 0,1 m.
Podemos relacionar concentrao comum, concentrao molar e ttulo em massa.
PARTES POR MILHO (ppm) Quando uma soluo bastante diluda, a massa do solvente praticamente igual massa da soluo e, neste caso, a concentrao da soluo expressa em ppm (partes por milho). O ppm indica quantas partes do soluto existem em um milho de partes da soluo (em volume ou em massa).
Exerccios: 01) A molaridade de uma soluo de cido sulfrico a 49% em peso e massa especfica igual a 1,5 g/ml : Dado: massa molar H2SO4 = 98g/mol a) 7,5 molar. b) 1,5 molar. c) 3,75 molar. d) 0,75 molar. e) 15 molar. 02) L-se no rtulo de um frasco: HCl: 40% em peso; densidade: 1,20 g/mL Dados: h = 1 u.; cl = 35,5 u. A molaridade desse cido : a) 10,95 m. b) 26,20 m. c) 13,15 m. d) 12,00 m. e) 0,45 m. 03) O lcool hidratado usado como combustvel tem densidade aproximada de 1 g/ml e apresenta em mdia 3,7% em massa de gua dissolvida em lcool puro. O nmero de mols de etanol (c2h6o) em 1 l dessa soluo de, aproximadamente: Dados : H = 1 u ; C = 12 u ; O = 16 u a) 0,089. b) 0,911. c) 21. d) 37. e) 46. 04) Esta questo relaciona-se com 200g de soluo alcolica de fenolftalena contendo 8,0% em massa de soluto. A massa de fenolftalena, em gramas, contida na soluo e o n de mols do lcool so, respectivamente: Dado: massa molar do etanol = 46 g/litro a) 16,0 e 4,0. b) 8,00 e 4,0. c) 5,00 e 2,5. d) 4,00 e 8,0. e) 2,00 e 3,0.
EXERCCIO: 01) Em uma amostra de 100 L do ar de uma cidade h 8 2 . 10 L do poluente SO2. A quantas ppm, em volume, isso corresponde? 02) (FGV-SP) Dizer que uma soluo desinfetante apresenta 1,5% de cloro ativo equivalente a dizer que a concentrao de cloro ativo nessa soluo : 6 a) 1,5 x 10 ppm. 2 b) 1,5 x 10 ppm. c) 150 ppm. d) 1,5 ppm. e) 15000 ppm
DILUIO DE SOLUES o processo que consiste em adicionar solvente puro a uma soluo, com o objetivo de diminuir sua concentrao.
Prof. EDUARDO CARIELO
QUMICA
2 ANO
Como a massa do soluto no se altera, teremos que:
Levando em considerao que as concentraes das solues estejam em outras unidades teramos as seguintes expresses:
06) Tem-se 400 mL de soluo 0,1 mol/L de carbonato de sdio. Essa soluo evaporada cuidadosamente at seu volume ser reduzido a 320 mL. A molaridade da soluo obtida aps a evaporao : a) 0,125 mol/L. b) 0,250 mol/L. c) 0,500 mol/L. d) 0,150 mol/L. e) 1,235 mol/L. 07) Uma soluo 0,05 mol/L de glicose, contida em um bquer, perde gua por evaporao at restar um volume de 100 mL, passando a concentrao para 0,5 mol/L. O volume de gua evaporada , em torno de: a) 50 mL. b) 100 mL. c) 500 mL. d) 1000 mL. e) 900 mL. 08) Preparam-se 100 mL de uma soluo contendo 1 mol de HCl. Tomaram-se, ento, 50 mL dessa soluo e juntaram-se 450 mL de gua. A molaridade da soluo final ser: a) 0,1 M b) 0,2 M c) 0,5 M d) 1,0 M e) 5,0 M 09) Para preparar 1,2 litros de soluo 0,4 M de HCl, a partir do cido concentrado, 16 M o volume de gua, em litros, a ser utilizado : a) 0,03 litro. b) 0,47 litro. c) 0,74 litro. d) 1,03 litros. e) 1,17 litros.
EXERCCIOS: 01) Se adicionarmos 80 mL de gua a 20 mL de uma soluo 0,20 mol/L de hidrxido de potssio, iremos obter uma soluo de concentrao molar igual a: a) 0,010 mol/L. b) 0,020 mol/L. c) 0,025 mol/L. d) 0,040 mol/L. e) 0,050 mol/L. 02) Adicionou-se gua destilada a 150 mL de soluo 5 m de HNO3 , at que a concentrao fosse de 1,5 M. o volume final obtido foi: a) 750 mL. b) 600 mL. c) 500 mL. d) 350 mL. e) 250 mL. 03) O volume de gua, em ml, que deve ser adicionado a 80 ml de soluo aquosa 0,1 M de uria, para que a soluo resultante seja 0,08 M, deve ser igual a: a) 0,8 Ll. b) 1 mL. c) 20 mL. d) 80 mL. e) 100 mL. 04) Quantos cm3 de H2O temos que adicionar a 0,50 litro de soluo 0,50 mol/L, a fim de torn-la 0,20 mol/L? 3 a) 1500 cm . 3 b) 1250 cm . 3 c) 1000 cm . 3 d) 750 cm . 3 e) 500 cm . 05) Submete-se 3L de uma soluo 1 mol/L de cloreto de clcio evaporao at um volume final de 400mL, sua concentrao molar ser: a) 3,00 mol/L. b) 4,25 mol/L. c) 5,70 mol/L. d) 7,00 mol/L. e) 7,50 mol/L
MISTURA DE SOLUES DE MESMO SOLUTO
Podemos demonstrar que a concentrao final est relacionada com as concentraes das solues misturadas pelas expresses:
Prof. EDUARDO CARIELO
QUMICA
2 ANO
EXERCCIOS: 01) Qual a molaridade de uma soluo de NaOH formada pela mistura de 60 mL de soluo 5M com 300 mL de soluo 2M, da mesma base ? a) 1,5 molar. b) 2,0 molar. c) 2,5 molar. d) 3,5 molar. e) 5,0 molar. 02) O volume de uma soluo de hidrxido de sdio 1,5 mol/L que deve ser misturado a 300 mL de uma soluo 2 mol/L da mesma base, a fim torn-la soluo 1,8 mol/L, : a) 200 mL. b) 20 mL. c) 2000 mL. d) 400 mL. e) 350 mL. 03) Que volumes de solues 0,5mol/L e 1,0mol/L de mesmo soluto deveremos misturar para obter 2,0L de soluo 0,8mol/L, respectivamente? a) 200 mL e 1800 mL. b) 1000 mL e 1000 mL. c) 1200 mL e 800 mL. d) 800 mL e 1200 mL. e) 1800 mL e 200 mL. 04) (UNIV.FED.FLUMINENSE-RJ) A molaridade de uma soluo X de cido ntrico o triplo da molaridade de outra soluo Y de mesmo cido. Ao se misturar 200 ml da soluo X com 600 mL da soluo Y, obtm-se uma soluo 0,3 mol/L do cido. Pode-se afirmar, ento, que as molaridades das solues X e Y so respectivamente: a) 0,60 mol/L e 0,20 mol/L. b) 0,45 mol/L e 0,15 mol/L. c) 0,51 mol/L e 0,17 mol/L. d) 0,75 mol/L e 0,25 mol/L. e) 0,30 mol/L e 0,10 mol/L. 05) Qual a molaridade de uma soluo de cido sulfrico obtida pela mistura de 30 mL do cido 1,3%, densidade de 1,5 g/mL e 20 Ml do mesmo cido 0,5 mol/l ? Dados: H = 1 u.; O = 16 u.; S = 32 u a) 0,64 mol/L. b) 0,32 mol/L. c) 0,48 mol/L. d) 0,10 mol/L. e) 0,50 mol/L.
06) 200 mL de uma soluo aquosa de glicose de concentrao 60g/L foram misturados a 300 mL de uma soluo de glicose de concentrao 120g/L. a concentrao da soluo final, em g/L, ser: a) 96 g/L. b) 9,6 g/L. c) 90 g/L. d) 180 g/L. e) 60 g/L. 07) Duas amostras de solues aquosas de NaOH, uma de volume 200 mL e 0,15 M e a outra de volume 100 mL e 0,30 M, foram misturadas. A molaridade da soluo final ser: a) 0,100 M. b) 0,150 M. c) 0,200 M. d) 0,225 M. e) 0,450 M. 08) 500 mL de uma soluo 1 M de H2SO4 e 1500 mL de uma outra soluo 2 M de H2SO4 foram misturados e volume completado para 2500 mL pela adio de gua. Identifique a alternativa que apresenta corretamente a molaridade da soluo resultante: a) 1,5 M. b) 1,4 M. c) 1,2 M. d) 1,6 M. e) 1,8 M.
FSICO-QUMICA SOLUES 2 ANO
PROF EDUARDO CARIELO
Acesse: equimmica.blogspot.com.br
You might also like
- SOLUÇÕESDocument8 pagesSOLUÇÕESAlineNo ratings yet
- Aula #01 - SoluçõesDocument14 pagesAula #01 - SoluçõesAnna Luiza LopesNo ratings yet
- SOLUCOESDocument4 pagesSOLUCOESjparatyNo ratings yet
- Aula de SoluçõesDocument35 pagesAula de Soluçõesbianca vieiraNo ratings yet
- Apostila de Exercícios Com Gabarito de Soluções - Concentração Comum A Mistura de Soluções de Solutos DiferentesDocument16 pagesApostila de Exercícios Com Gabarito de Soluções - Concentração Comum A Mistura de Soluções de Solutos DiferentesProf. Maych Melo QuímicaNo ratings yet
- Exercícios SoluçõesDocument6 pagesExercícios SoluçõesMirela MottaNo ratings yet
- Concentração de Solução ExerciciosDocument5 pagesConcentração de Solução ExerciciosWesley HenriqueNo ratings yet
- Lista de Exercícios 2 Ano Concentração de SoluçoesDocument1 pageLista de Exercícios 2 Ano Concentração de Soluçoeslopesqui1766No ratings yet
- Atividade Sobre Coeficiente de SolubilidadeDocument13 pagesAtividade Sobre Coeficiente de SolubilidadePedro HélioxNo ratings yet
- 09quimica B - SEMI CrisDocument19 pages09quimica B - SEMI CrisRenata Todeschinni TexeiraNo ratings yet
- SOLUÇÕESDocument8 pagesSOLUÇÕESVitóriaNo ratings yet
- Estudo Das Soluções PDFDocument47 pagesEstudo Das Soluções PDFRenanEQNo ratings yet
- Lista de Exercicios de SolucoesDocument2 pagesLista de Exercicios de SolucoesGraciano ComboioNo ratings yet
- QuimicaDocument4 pagesQuimicaAntonio EduardoNo ratings yet
- BiomedicinaDocument56 pagesBiomedicinaDaniela LealNo ratings yet
- Lista 1 QG 1-19Document6 pagesLista 1 QG 1-19schottbpNo ratings yet
- Quimica - 002 SolucoesDocument5 pagesQuimica - 002 Solucoescon_seguir100% (1)
- 3 - Solucoes AlunoDocument100 pages3 - Solucoes AlunoQuimica Mais FrancisNo ratings yet
- Lista Certa Do RobinhoDocument4 pagesLista Certa Do RobinhogiovanarezendebensiNo ratings yet
- SolucoesDocument75 pagesSolucoesClécio Oliveira SouzaNo ratings yet
- Apostila de Concentração de Soluções - CeseDocument15 pagesApostila de Concentração de Soluções - CeseMarcelo GfteamNo ratings yet
- Valor Nota : 1) Uma Solução Pode Ser Definida ComoDocument4 pagesValor Nota : 1) Uma Solução Pode Ser Definida ComoSuellen CartaxoNo ratings yet
- Soluções e SolubilidadeDocument7 pagesSoluções e SolubilidaderpovilsNo ratings yet
- 1 Lista de Exercicios de Quimica CEIS - 2 UNIDADEDocument5 pages1 Lista de Exercicios de Quimica CEIS - 2 UNIDADEMannulo100% (1)
- 09 Quimica BDocument16 pages09 Quimica Bmoniqueeluiz...No ratings yet
- Trabalho de Quimica 301Document5 pagesTrabalho de Quimica 301GRAZIELLI SILVANo ratings yet
- Arquivo de Soluções Do Prof° VieiraDocument9 pagesArquivo de Soluções Do Prof° VieiravieirasalesNo ratings yet
- Trabalho de Química - Aluna Olga 2 ADocument1 pageTrabalho de Química - Aluna Olga 2 AHaroldo BertrandNo ratings yet
- Exercicios de SolubilidadeDocument6 pagesExercicios de Solubilidadesua mae de 4No ratings yet
- SOLUÇOESDocument37 pagesSOLUÇOESVictória Dutra100% (3)
- Apostila3 2007Document10 pagesApostila3 2007hallexNo ratings yet
- Concentração de SoluçõesDocument2 pagesConcentração de SoluçõesDavid LunaNo ratings yet
- Quim 2Document20 pagesQuim 2Sajin guaxinimNo ratings yet
- Gama - Módulo 19Document23 pagesGama - Módulo 19Koelho CoelhoNo ratings yet
- Revisão Sobre Soluções Químicas para 3ºanos ProfDocument2 pagesRevisão Sobre Soluções Químicas para 3ºanos ProfClebson RamosNo ratings yet
- Lista de Exercícios - Soluções - Documentos GoogleDocument4 pagesLista de Exercícios - Soluções - Documentos GoogleWesley MartinsNo ratings yet
- Resumo - SoluçõesDocument23 pagesResumo - SoluçõesAntony DpbNo ratings yet
- Exercicios de ConcentracaoDocument4 pagesExercicios de Concentracaodkforever0% (1)
- Exercícios Resolvidos - SolubilidadeDocument14 pagesExercícios Resolvidos - SolubilidadeMouraci Santana RibeiroNo ratings yet
- Lista de Exercicio Atualizada SolucoesDocument5 pagesLista de Exercicio Atualizada SolucoesmariomarthinsNo ratings yet
- Capítulo 1 - SoluçõesDocument18 pagesCapítulo 1 - SoluçõesGerson LimaNo ratings yet
- SOLUCOESDocument15 pagesSOLUCOESRaquel Reis Duarte PinheiroNo ratings yet
- Estudodassolucoes 2013Document38 pagesEstudodassolucoes 2013Vanin Silva De SouzaNo ratings yet
- Aula Química - Soluções PDFDocument2 pagesAula Química - Soluções PDF27.marcos9521No ratings yet
- Soluções 2022Document30 pagesSoluções 2022Xavier NetoNo ratings yet
- Breve Listinha de Exercicios Sobre Coeficiente de SolubilidadeDocument6 pagesBreve Listinha de Exercicios Sobre Coeficiente de SolubilidadeÉrica LimaNo ratings yet
- Exercício Soluções Após A 1 AvaliaçãoDocument1 pageExercício Soluções Após A 1 AvaliaçãoZilene AlvesNo ratings yet
- 1 Lista de Exercícios - SoluçõesDocument2 pages1 Lista de Exercícios - SoluçõesAllyf Ferreira100% (1)
- QUiMICA TECNOLoGICA SOLUcoESDocument7 pagesQUiMICA TECNOLoGICA SOLUcoESHugo PerrettNo ratings yet
- Biofísica para ciências biomédicas – 4ª ediçãoFrom EverandBiofísica para ciências biomédicas – 4ª ediçãoNo ratings yet
- 22 Super Benefícios do Bicarbonato de Sódio: O bicarbonato de sódio tem uma variedade de usos domésticos adicionais e benefícios à saúdeFrom Everand22 Super Benefícios do Bicarbonato de Sódio: O bicarbonato de sódio tem uma variedade de usos domésticos adicionais e benefícios à saúdeNo ratings yet
- Apostila Química Orgânica: Carbono, Dienos E AromáticosFrom EverandApostila Química Orgânica: Carbono, Dienos E AromáticosNo ratings yet
- 1 - Compostos I+ - NicosDocument3 pages1 - Compostos I+ - NicostissiaraujoNo ratings yet
- PreparacaoDeSolucoes 1Document9 pagesPreparacaoDeSolucoes 1tissiaraujoNo ratings yet
- Aula 04 Cont. Inflamação.Document18 pagesAula 04 Cont. Inflamação.tissiaraujoNo ratings yet
- Distúrbios Do Desenvolvimento e Crescimento CelularDocument57 pagesDistúrbios Do Desenvolvimento e Crescimento Celulartissiaraujo100% (3)
- Atlas de UrináliseDocument55 pagesAtlas de UrináliseLarissa Beuttenmuller100% (8)
- Preparação Do Cloreto de T-ButilaDocument6 pagesPreparação Do Cloreto de T-Butilavotapsm100% (7)
- Ácidos e Bases 1Document2 pagesÁcidos e Bases 1Priscila Fernanda Pereira BarbosaNo ratings yet
- Polímeros - RelatórioDocument4 pagesPolímeros - RelatórioPedro IgorNo ratings yet
- Miniteste - Ligação QuímicaDocument3 pagesMiniteste - Ligação QuímicaPedro RodriguesNo ratings yet
- Lista 1 Quimica Geral e Tecnologica Eng. CivilDocument3 pagesLista 1 Quimica Geral e Tecnologica Eng. CivilLuciana FernandesNo ratings yet
- Química - Pré-Vestibular Impacto - Estudo Do CarbonoDocument2 pagesQuímica - Pré-Vestibular Impacto - Estudo Do CarbonoQuímica Qui80% (5)
- Relatório de Destilação Por Arraste A Vapor-CanelaDocument9 pagesRelatório de Destilação Por Arraste A Vapor-CanelaGisele Trevisan0% (1)
- Relatorio - AQQT Aula Prática 6 OficialDocument8 pagesRelatorio - AQQT Aula Prática 6 OficialAna LauraNo ratings yet
- Conteudo 1Document6 pagesConteudo 1Eng. Clinica - Agamenon MagalhãesNo ratings yet
- Relatório - ExemploDocument12 pagesRelatório - Exemplomirc_100% (1)
- Vantagens e Desvantagens Da Energia A BiomassaDocument2 pagesVantagens e Desvantagens Da Energia A Biomassabruna_95No ratings yet
- DownloadDocument15 pagesDownloadThiago OliveiraNo ratings yet
- Análise de Benzoato de SódioDocument10 pagesAnálise de Benzoato de SódioNadia100% (1)
- Piramidal Ebook PCDocument15 pagesPiramidal Ebook PCSfmsilva SilviaNo ratings yet
- Ligações IntermolecularesDocument14 pagesLigações IntermolecularesSara Raquel Costa Pinto100% (1)
- Soldagem Oxiacetilênica - Wikipédia, A Enciclopédia LivreDocument3 pagesSoldagem Oxiacetilênica - Wikipédia, A Enciclopédia LivreElijah ShepherdNo ratings yet
- TINTAS Aula UnisinosDocument20 pagesTINTAS Aula UnisinosmateusripolNo ratings yet
- Exercício 3 - Matheus E S GuimarãesDocument2 pagesExercício 3 - Matheus E S GuimarãesMatheus guimarãesNo ratings yet
- Primeira Lista Exercícios Resolvida - BME - 2021-1Document45 pagesPrimeira Lista Exercícios Resolvida - BME - 2021-1Hugo LuizNo ratings yet
- Peso Específico MateriaisDocument6 pagesPeso Específico MateriaisEpi Engenharia Processos Industrias100% (1)
- Leis Ponderais e VolumétricasDocument39 pagesLeis Ponderais e VolumétricasFrancimauroNo ratings yet
- Exercícios Deslocamento de EquilíbrioDocument5 pagesExercícios Deslocamento de EquilíbrioBruna FerreiraNo ratings yet
- Material Informativo BiowareDocument6 pagesMaterial Informativo BiowareJaq Plin PlinNo ratings yet
- Materiais Cerâmicos - Relatório 1 - VFinalDocument17 pagesMateriais Cerâmicos - Relatório 1 - VFinalAlana GabrieliNo ratings yet
- FBF5704 Aula1 PDFDocument111 pagesFBF5704 Aula1 PDFMarli CorreaNo ratings yet
- Prova 11 Engenheiro A J Nior Rea ProcessamentoDocument25 pagesProva 11 Engenheiro A J Nior Rea ProcessamentoPalhaço MalucoNo ratings yet
- Plano de Ensino Química Orgânica Fundamental - Código Iqd0245 TURMA 01, PERÍODO 1º/2023Document3 pagesPlano de Ensino Química Orgânica Fundamental - Código Iqd0245 TURMA 01, PERÍODO 1º/2023Levi AmorimNo ratings yet
- O Que São Os CarboidratosDocument14 pagesO Que São Os CarboidratosGraziele Moraes GraziNo ratings yet
- Flotação No Tratamento de Minério - Baltar (3 de 4) PDFDocument40 pagesFlotação No Tratamento de Minério - Baltar (3 de 4) PDFSamuel HuapallaNo ratings yet
- Aula EletroquimicaDocument65 pagesAula EletroquimicaCarol LimaNo ratings yet