Professional Documents
Culture Documents
Informe Estequiometria
Uploaded by
Xiomara JorgaOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Informe Estequiometria
Uploaded by
Xiomara JorgaCopyright:
Available Formats
METODO DE LA VARIACION CONTINUA DE JOB
MASA - MASA
MASA - VOLUMEN
JUAN CARLOS ROA CARDONA
DINA MARCELA NARANJO HINCAPI
LABORATORIO DE QUMICA GENERAL
Juan Fernando Gil Romero
Qumico
UNIVERSIDAD DE ANTIOQUIA
FACULTAD DE QUMICA FARMACEUTICA
TECNOLOGIA EN REGENCIA DE FARMACIA
MEDELLN
2013
METODO DE LA VARIACION CONTINUA DE JOB
OBJETIVOS:
Determinar la relacin estequiomtrica en la cual se combina los reactivos en una
reaccin, aplicando el mtodo de JOB
Hallar el porcentaje de eficiencia de una reaccin
Identificar en forma experimental, el reactivo lmite de una reaccin.
MARCO TERICO:
Ley de conservacin de la materia:
La ley de conservacin de la masa o ley de Lomonsov-Lavoisier es una de las leyes
fundamentales en todas las ciencias naturales. Se puede enunciar como En una reaccin
qumica ordinaria la masa permanece constante, es decir, la masa consumida de los
reactivos es igual a la masa obtenida de los productos. En el caso de las reacciones
exotrmicas la materia se modifica convirtindose en energa. En este caso la variacin en
la masa no es mesurable.
Estequiometria:
Una reaccin qumica es un proceso por el cual una o ms sustancias se transforma para
dar otra diferente, matemticamente se puede representar mediante una ecuacin, la
cual nos permite visualizar no solamente las clases de sustancias que forman parte en la
reaccin sino determinar la proporcin en que dichas sustancias deben reaccionar.
La estequiometria hace referencia al nmero relativo de tomos de varios elementos
encontrados en una sustancia qumica, es decir, la parte de la qumica que trata sobre las
reacciones cuantitativas entre elementos y compuestos en reacciones qumicas. La
cantidad de tomos presentes se ajusta a las leyes ponderales de la qumica.
Una ecuacin qumica es esencialmente una relacin que muestra las cantidades relativas
de reactivos y productos involucrados en una reaccin qumica. Los clculos
estequiomtricos son aquellos que se realizan para conocer con precisin la cantidad que
se va a obtener de un determinado producto, conocidas las cantidades de los reactivos o,
por el contrario, las cantidades de reactivo que se han de utilizar para obtener una
determinada cantidad de producto. La expresin cantidad estequiomtrica indica la
cantidad exacta que se necesita de una sustancia de acuerdo con una ecuacin qumica.
Reactivo lmite:
Es aquel reactivo que en una reaccin qumica se consume antes determinando la
cantidad de producto o productos obtenidos, por tanto podemos decir que la una
reaccin depende del reactivo limite, ya que cuando este se termine, los dems reactivos
dejan de reaccionar.
MATERIALES:
Equipo:
9 Tubos de ensayo 1 Gradilla
2 Pipetas graduadas 10,0ml Termmetro
Reactivos:
HCl 1M , 2M
NaOH 2M, 3M, 4M
Fenolftalena
PROCEDIMIENTO 7.1 / DETERMINACIN DE RELACION ESTEQUIOMETRICA
DATOS Y CALCULOS:
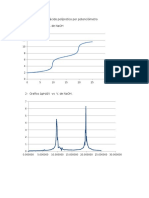
Tubo N NaOH * 4M HCl * 2M T (C)
1 1,0 7,0 31,2
2 2,0 6,0 35,2
3 2,5 5,5 36,9
4 3,0 5,0 39
5 3,5 4,5 37,9
6 4,0 4,0 36,9
7 4,5 3,5 36
Reactivo Concentracin T (C)
NaOH 3,6226 24,5
HCl 1,9768 24,3
Reemplazando:
=
,+,
=
,
= 24,4 C
Rotular 2 beaker
limpios y secos
Adicionar 26-28ml
NaOh, 4M en
beaker #1
Adicionar 42-44ml
HCl 2M el beaker #2
Medir temperatura
inicial NaOH
1M, Registrar dato
Lavar y secar
termometro, dejar
equilibrar
temperatura
Medir temperatura
HCl 2M, Registrar
dato
Promediar
temperatura inicial
Tomar tubo #1 con
1,0ml de NaOH, 4M
Introducir
termometro limpio
y seco
Aadir con pipeta
graduada 7,0ml de
HCl, 2M
Agitar y medir
temperatura
mxima lograda
Repetir proceso en
los tubos restantes
(Segn tabla)
Anotar temperatura
en cada caso
Reactivo /
Tubo
Beaker 1 2 3 4 5 6 7
NaOH
Temperatura
inicial ti
24,5 24,5 24,5 24,5 24,5 24,5 24,5 24,5
HCl
Temperatura
inicial ti
24,3 24,3 24,3 24,3 24,3 24,3 24,3 24,3
Cambio de
temperatura
tf- ti en la
reaccin
entre HCl y
NaOH
31,2 35,2 36,9 39 37,9 36,9 36
Libera calor :
SI, NO
Si Si Si Si Si Si Si
Moles / Tubo 1 2 3 4 5 6 7
Moles NaOH
0,004 0,008 0,01 0,012 0,014 0,016 0,018
Moles HCl
0,014 0,012 0,011 0,01 0,009 0,008 0,007
4
1
1
1000
= 0,004
4
2
1
1000
= 0,008
4
2,5
1
1000
= 0,01
4
3
1
1000
= 0,012
4
3,5
1
1000
= 0,014
4
4
1
1000
= 0,016
4
4,5
1
1000
= 0,018
2
7
1
1000
= 0,014
2
6
1
1000
= 0,012
2
5,5
1
1000
= 0,011
2
5
1
1000
= 0,010
2
4,5
1
1000
= 0,009
2
4
1
1000
= 0,008
2
3,5
1
1000
= 0,007
30
32
34
36
38
40
1
2
3
4
5
6
7
31,2
35,2
36,9
39
37,9
36,9
36
Temperatura Vs Volumen reactivo
PROCEDIMIENTO 7.5 / CALCULO DE LA EFICIENCIA
Tomamos muestra del Tubo N 4.
Detalle Peso g
(M
1
) Masa del tubo vaco ms la base de la probeta: 32,55 g
(M
2
) Masa del tubo con la base de la probeta con 2.0 mL del
tubo de mayor temperatura:
34,72 g
Peso alcuota 2,17 g
Peso residuo 2,03 g
(M
3
) Masa del tubo ms el residuo NaCl: 32,69 g
Masa de NaCl: (M
3
-M
1
) 0,14 g
Adaptar base de la probeta
a un tubo de ensayo y pesar
Tomar alcuota 2,0ml
usando pipeta volumetrica
del tubo con mayor
temperatura final y
adicionar al tubo pesado
Hallar masa de la alcuota
Evaporar a sequedad por
flameado
Dejar enfriar Pesar conjunto nuevamente
Obtener masa de sal de la
alcuota por diferencia de
pesos
PROCEDIMIENTO 7.6 / DETERMINACION REACTIVO LIMITE
DATOS Y RESULTADOS
Formula balanceada: HCl + NaOH --> NaCl + H
2
O
Seleccionamostubo con menor temperatura final
Tubo A. Agregue dos gotas de fenolftalena y observe Color: no se observa cambio de
color
Tubo B. Agregue dos gotas de fenolftalena y observe Color: no se observa cambio de
color
Tubo A. Se agregan 4.0 mL de HCl, temperatura final 27,3C, no hay cambio de color
Tubo B. Se agregan 4.0 mL de NaOH, temperatura final 33,9 C cambia a color morado
Reactivo en exceso: NaOH
Reactivo lmite: HCl
CONCLUSIONES
El mtodo de Job ofrece resultados muy precisos en cuanto a las cantidades en
las que se mezclan dos reactivos para reaccionar, esto es, la relacin
estequiometria adecuada.
Seleccionar tubo de la
reaccion con baja
temperatura final
Marcar como tubo A
y tomar mitad del
volumen (4,0ml)
Marcar como tubo B
el tubo con volumen
restante
Agregar 1-2 gotas
Fenolftaleina
Introducir
termometro en tubo
A
Adicionar 4ml HCl en
tubo A
Medir evolucin de
temperatura por
incremento de
temperatura
Repetir
procedimiento con
tubo B adicionando
4ml de NaOH
Registrar datos -
Temperatura
Deducir reactivo
limite en tubo
seleccionado
Comparar con
metodo
colorimetrico.
El mtodo de Job o de las variaciones continuas resulta ser un mtodo eficaz para
la determinacin de la constante de formacin o estabilidad de un complejo y
adems, la estequiometria que rige a dicho compuesto.
MASA - MASA
OBJETIVOS:
Determinar por mtodos qumicos la composicin de una mezcla de clorato de
potasio y el cloruro de potasio.
Sealar la importancia del tiempo en una reaccin, as como la de la cantidad de
catalizador usada.
MARCO TEORICO:
Propiedades fsicas: Se pueden observar y medir sin que cambie la composicin de la
sustancia. [Color, dureza, densidad, punto de fusin, punto de ebullicin, estado,
conductividad]
Extensivas: Estas dependen de la masa (inercia, peso, rea, volumen, calor ganado o
perdido)
Intensivas: No dependen de la masa [Densidad, Color, olor, sabor, punto de ebullicin,
electronegatividad]
Propiedades qumicas: Son propiedades distintas que se observan cuando se combinan
con otras. [Reactividad, acidez, oxidacin, combustin]
Cloruro de Potasio [KCl]: Es un haluro metlico, en su estado puro es inodoro, cristal
vtreo blanco e incoloro. Se halla como material silvita (Silvinita; Roca sedimentaria salina,
se encuentra en depsitos salinos o fumarolas volcnicas)
Propiedades qumicas: puede reaccionar con un ion cloruro, precipita cloruros insolubles
cuando es agregado a una sal metlica (Ej. AgNO
3)
Se puede extraer de la silvinita y del agua salada y como subproducto de la fabricacin de
cido ntrico.
Clorato de Potasio [KClO
3
]: El clorato de potasio o clorato potsico es una sal formada por
el anin clorato y el catin potasio. En su forma pura forma cristales blancos. Es el clorato
ms comn en la industria, y se encuentra en la mayora de los laboratorios. Se emplea
como oxidante.
Catalizador: Substancia capaz de favorecer o acelerar una reaccin qumica sin intervenir
directamente en ella; al final de la reaccin el catalizador permanece inalterado. Los catalizadores
ms usados son los constituidos por platino, paladio y vanadio o por xidos de cobre y de nquel.
La substancia catalizadora necesita un soporte, constituido generalmente por materias inertes. Se
hace mucho uso de los catalizadores en el campo de las pinturas acrlicas y de los plsticos, para
acelerar el proceso de polimerizacin, o en los silenciadores denominados precisamente
catalticos, para reducir la contaminacin. El empleo de un catalizador en una pintura permite su
endurecimiento en poco tiempo, pero exige tambin una tcnica especial de pulverizacin.
MATERIALES:
Equipo:
Tubo de ensayo Pinza
Mechero Balanza
Reactivos:
Mezcla de KClO3 KCl o NaCLO
3
NaCl
MnO
2
PROCEDIMIENTO
Adaptar base la
probeta a un tubo
de ensayo limpio y
seco
Poner 0,09 a 0,11g
de Mn02 en el
tubo de ensayo
Pesar y agregar al
tubo 1,80 a 2,00g
de la mezcla
cloruro-clorato
Pesar el tubo con
las
sustancias, triturar
y mezclar bien
Retirar base de la
probeta
Calentar
ligeramente al
inicio, luego
incrementar
Asegurar
desprendimiento
del 02
Retirar de la llama
y dejar enfriar
Pesar conjunto
Repetir
procedimiento
hasta obtener peso
constante
Datos obtenidos durante el proceso:
2KClO
3
+ MnO
2
MnO
2
2KCl + 3O
2
Descripcin Masa g
Base + Tubo 29,73 g
Conjunto 31,93 g
KCl + KClO
3
2,09 g
MnO
2
0,11 g
Post_Flameado 31,56 g
O
2
0,37 g
PM NaCl: 58,4 g/mol
PM KClO
3
: 122,4 g/mol
PM KCl: 74,4 g/mol
PM O
2
: 32 g/mol
Gramos de KClO
3
en la mezcla =
0,37
2
245
3
96
2
= 0,94 g
3
Gramos de KCLO
3
=
0,007
3
122,55
3
1
3
= 0,85
3
Gramos de NaCl en la mezcla=
2,09 0,37 = 1,72
Moles de Oxgeno liberado=
0,37
2
1
2
32
2
= 0,011
2
Moles de KClO
3
en la mezcla=
0,011
2
2
3
3
2
= 0,007
3
Se halla el peso del NaCl a partir del O
2
producido:
0.37g O2 x 1 mol O2 x 1 mol NaCl x 58,4g NaCl = 0,22g NaCl
32g O2 3mol O2 1mol NaCl
Masa KClO3= 2,09g Mezcla - 0,22g NaCl 0,37g O2 = 1,5g KClO3
Hallar el porcentaje (%) p/p de KClO
3
y el % p/p NaCl en la mezcla=
%NaCl= 0,22g NaCl x 100 = 10,52% NaCl
2,09g
%KClO3 = 1,5g KClO3 x 100 = 71,77% KClO3
2,09g
8.5.5
1,5g KClO3x 1mol KClO3 x 2mol KCl x 74,4g KCl = 0,91g KCl
122,4g KClO3 2mol KClO3 1 mol KCl
8.5.6
Masa total en el tubo al terminar la reaccin= 31,56g 29,73g= 1,83g
Masa KCl= 1,83g
%KCl = 0,91g KCl x 100% = 49,72%
1,83g
8.6.1
El MnO
2
sirve como catalizador, acelera el proceso de descomposicin del clorato de
potasio ya que de realizarse sin este se tardara mucho ms; entonces podemos
determinar que el MnO
2
afecta directamente el compuesto analizado, activando la
reaccin.
8.6.2
La reaccin inicial fue: NaCl + 2KClO3 NaCl + 2KCl + O2.
Al terminar la reaccin pudimos observar que el cloruro de sodio no resulto afectado en su
composicin; evidenciando que la reaccin qumica expresada en la ecuacin se cumple a
cabalidad.
CONCLUSION
El experimento muestra claramente la importancia de un tiempo adecuado de
calentamiento en la reaccin descrita, pues, un solo minuto de calentamiento no fue
suficiente para descomponer por completo el clorato de potasio siendo necesario
aplicar calor durante algunos minutos ms.
Tericamente deducimos que la falta del catalizador en la reaccin, implica que sta
sea mucho ms lenta, siendo necesario mucho ms tiempo de calentamiento para
alcanzar el nivel de descomposicin esperado.
La masa de oxgeno liberada que se obtuvo en los clculos, coinciden con la masa de
oxgeno obtenida por otro grupo de trabajo, lo que indica que las mediciones de sta
experiencia fueron realizadas con precisin y que los resultados se acercan mucho a
los esperados.
MASA - VOLUMEN
OBJETIVOS:
Determinar relacin masa-volumen en reaccin qumica con produccin de gases.
Aplicar ley de Dalton en resolucin de problemas en que intervienen gases.
MARCO TEORICO:
Ley de Dalton: La presin de una mezcla de gases que no reaccionan qumicamente es
igual a la suma de las presiones parciales que ejercera cada uno de ellos si ocupase todo
el volumen de la mezcla, sin cambiar la temperatura.
Ecuacion de los gases ideales:
= Presin absoluta
= Volumen
= Moles de gas
= Temperatura absoluta
=Constante universal de los gases ideales
0,082 L x atm
Mol x K
MATERIALES:
Equipo:
Eudimetro Vaso precipitado
Regla Soporte metlico
Reactivos:
HCl - 2M
Mg (M) 1 a 1,5 cm menor a 40mg
H
2
O
PROCEDIMIENTO
CALCULOS Y RESULTADOS
Mg
(s)
+2HClMgCl
2
+ H
2
Masa de la lmina de magnesio: 0,0173 g
Volumen del gas recogido en mL: 23 ml
En litros: 0,023L
23
1
1000
= 0,0230
Longitud de la columna de agua en cm 25,3 cm
Agregar 350ml de agua en un
beaker de 400ml.
Llenar eudiometro y tapar con
el indice.
Invertir y sumergir en extremo
inferior a 4cm del nivel del
agua en el beaker.
Evitar que salga aire del
eudiometro y sujetar con
soporte
Colocar 1ml de HCl en tubo de
ensayo con manguera de
desprendimiento y
tapon, evitar mojar las
paredes del tubo.
Introducir extremo de la
manguera en el eudiometro.
Poner lamina de Mg(M) en el
extremo superior del tubo, sin
dejar que se deslice al fondo.
Tapar tubo de ensayo
Poner tubo de ensayo en
posicion horizontal para que
se deslice el Mg(M) al acido y
se efectue la reaccion.
Tomar datos:
- Volumen Hidrogeno
- Temperatura dentro del
beaker
- Presion barometrica
- Longitud columna H2O
En mm 253
25,3
10
1
= 253
Temperatura: 29 C
En kelvin: 302,15
29 + 273,15 = 302,15
Presin baromtrica en la ciudad de Medelln en mm de Hg: 760mmHg
V: 23cm3 x __1L = 0,023L
1000 cm3
T: 29 + 273,15 = 302,15
R: 0,082 L x atm
mol x K
P: 25,3 x 1 = 1,86mmHg
13,6
760mmHg 1,86mmHg 28,6mmHg= 729,54mmHg
729,54mmHg x 1 atm = 0,96 atm
760mmHg
n: PV
RT
n: 0,96atm x 0,023L= 0,02208 = 8,91x10-4mol
0,082 Lxatm x 302,15K 24,77
molxK
8,91x10-4 moles H2 x 2g H2 x 1mol H2 x 1 mol Mg x 24,3g Mg x 1000mgMg= 21,65mgMg
1mol H2 2gH2 1mol H2 1mol Mg 1gMg
Presin H
2
en mmHg:591,99
2
= 760 30,04 1,86 = 727,74
Presin H2 en atmosferas:
727,74
1
760
= 0,96
2
=
0,96 0,023
0,082
302,15
= 8,9110 4
2
Moles de magnesio que reaccionaron=
8,9110 4
2
1
1
2
= 8,9110 4
Explicar que ocurrira con los resultados en caso de que penetre aire al eudimetro.
R- Si ocurriera que en el proceso entre aire, se tomaran mediciones errneas, las
cuales nos variaran los resultados de la presin parcial y el volumen de la
columna de agua.
CONCLUSION
La mayora de las cifras referentes a la cantidad de moles de reactivos y productos son muy
pequeas, por tanto se han expresado en milimoles (mn) que equivalen a una milsima parte
de una mol (1/1000). Adems, se ha hecho uso de hasta 5 cifras significativas, lo que resulta
inusual pero necesario para que los clculos no se alejen de los valores reales.
CIBERGRAFIA
http://es.wikipedia.org/wiki/Clorato_de_potasio
http://diccionario.motorgiga.com/diccionario/catalizador-definicion-significado/gmx-niv15-
con193460.htm
https://es.wikipedia.org/wiki/Ley_de_los_gases_ideales
You might also like
- Enlace QuimicoDocument21 pagesEnlace QuimicoRosely FlorNo ratings yet
- Laboratorio EstequiometriaDocument12 pagesLaboratorio EstequiometriaEdmar Pocco RiverosNo ratings yet
- Informe de EstequiometriaDocument19 pagesInforme de EstequiometriaDAniel Moreno LopezNo ratings yet
- Uni Lab 2Document12 pagesUni Lab 2Yosselyn LeyvaNo ratings yet
- Hidrolisis de SalesDocument9 pagesHidrolisis de SalesRicardo AlcantaraNo ratings yet
- Informe Propiedades de Los Gases Ideales UNALMDocument24 pagesInforme Propiedades de Los Gases Ideales UNALMAndres Atilio Durand CrucesNo ratings yet
- Informe 2 de Quimica (PRIMER GRUPO DE CATIONES)Document16 pagesInforme 2 de Quimica (PRIMER GRUPO DE CATIONES)Anabel Pahuara100% (1)
- Informe #8Document29 pagesInforme #8Mayli Martinez AñancaNo ratings yet
- Ajonjoli ExpoDocument22 pagesAjonjoli ExpoJean Paul Alvarez MartinezNo ratings yet
- Laboratorio N°3 - AnalisisDocument10 pagesLaboratorio N°3 - AnalisisJHONY ANDRES CASTILLA USECHENo ratings yet
- Sílabo de Fisicoquímica I-2018Document6 pagesSílabo de Fisicoquímica I-2018Fatima Leiva ChiribogaNo ratings yet
- Infomorme Lab 5Document10 pagesInfomorme Lab 5Jhosep Palomino BustinzaNo ratings yet
- DiapositivasDocument7 pagesDiapositivasKatherin P. Parra MercadoNo ratings yet
- Ionización Del Agua y Escala de PHDocument12 pagesIonización Del Agua y Escala de PHGina Torres VillanuevaNo ratings yet
- Equilibrio QuimicoDocument36 pagesEquilibrio QuimicoDsam IINo ratings yet
- FISICOQUIMICADocument9 pagesFISICOQUIMICAoilkgas31No ratings yet
- Practica #07Document22 pagesPractica #07Sergio Jonathan100% (1)
- Determinación de Na2CO3Document14 pagesDeterminación de Na2CO3Karina Nadir ʚïɞNo ratings yet
- Informe 2Document16 pagesInforme 2xiomi mazaNo ratings yet
- Biodigestor - MetanogenesisDocument45 pagesBiodigestor - MetanogenesissamallagoNo ratings yet
- Informe Punto de Fusión y EbulliciónDocument5 pagesInforme Punto de Fusión y EbulliciónJuaness MontealegreNo ratings yet
- Pca 7 Mesa 1 Lunes (2-4) PMDocument9 pagesPca 7 Mesa 1 Lunes (2-4) PMSergio Santillan100% (1)
- Espectroscopia y ColorimetriaDocument11 pagesEspectroscopia y ColorimetriaYuriPaolaVallejoNovaNo ratings yet
- 5C Relacion de Estructuras PropiedadesDocument8 pages5C Relacion de Estructuras PropiedadeslujulNo ratings yet
- Determinar La Constante Del Producto de SolubilidadDocument6 pagesDeterminar La Constante Del Producto de SolubilidaddiegoNo ratings yet
- Cinetica Quimica (Ecuaciones Integradas de Velocidad)Document6 pagesCinetica Quimica (Ecuaciones Integradas de Velocidad)Miroslav Alulema CuestaNo ratings yet
- Solubilidad Laboratorio de Química OrgánicaDocument16 pagesSolubilidad Laboratorio de Química OrgánicaJosh Tapia MuciñoNo ratings yet
- Ejercicios Resueltos EstequiometríaDocument11 pagesEjercicios Resueltos EstequiometríaOrii LaraNo ratings yet
- Informe de Química 3 - UnasamDocument21 pagesInforme de Química 3 - UnasamJosé IvañezNo ratings yet
- Informe de Química...Document15 pagesInforme de Química...Katherine Esmeralda Correa MachareNo ratings yet
- Interferometro de MichelsonDocument4 pagesInterferometro de MichelsonFrancisco Tovar CecereNo ratings yet
- Diferencias Orgánicos-InorgánicosDocument6 pagesDiferencias Orgánicos-InorgánicosAlondra AlvirdeNo ratings yet
- Ácidos carboxílicos: nomenclatura, propiedades y reaccionesDocument5 pagesÁcidos carboxílicos: nomenclatura, propiedades y reaccionesAlbert AlberthiñoNo ratings yet
- Hidrocarburos Cíclicos y AromáticosDocument6 pagesHidrocarburos Cíclicos y AromáticosYJPT 111005No ratings yet
- Manual Quimica GeneralDocument94 pagesManual Quimica GeneralEnrique Del Campo Polo100% (1)
- Equilibrio Quimico EjerciciosDocument2 pagesEquilibrio Quimico EjerciciosMarco Antonio Escobedo AguilarNo ratings yet
- Ejercicios Resueltos. Unidad 8 - QuímicaDocument7 pagesEjercicios Resueltos. Unidad 8 - QuímicaMax ChazzNo ratings yet
- Tema 5 - EquilibrioDocument30 pagesTema 5 - Equilibrioandres guerreroNo ratings yet
- Ensayos CarbohidratosDocument2 pagesEnsayos CarbohidratosCorina LópezNo ratings yet
- ESTEQUIOMETRIA InformeDocument28 pagesESTEQUIOMETRIA Informevestkander05 fesdegNo ratings yet
- Informe Destilación (Química Orgánica) - UNALMDocument19 pagesInforme Destilación (Química Orgánica) - UNALMAndres Atilio Durand CrucesNo ratings yet
- Estados de Agregación de La MateriaDocument6 pagesEstados de Agregación de La Materiaasarriac2289100% (3)
- Deshidratacion de AlcoholesDocument5 pagesDeshidratacion de AlcoholesShirley solorzanoNo ratings yet
- GRAVIMETRIADocument37 pagesGRAVIMETRIAChristian SilvaNo ratings yet
- Haluros de AlquiloDocument66 pagesHaluros de AlquiloLuis Alberto MejiaNo ratings yet
- Agentes DesecantesDocument44 pagesAgentes DesecantesRossy Moral100% (1)
- Informe 5. Lab BioqDocument8 pagesInforme 5. Lab BioqKELLY JOHANA CORREA SANTANo ratings yet
- Reconocimiento y Uso de Materiales de Laboratorio y Uso Del Mechero de BunsenDocument4 pagesReconocimiento y Uso de Materiales de Laboratorio y Uso Del Mechero de BunsenSebastian Gomez LopezNo ratings yet
- Qca Bioinorganica 2014Document25 pagesQca Bioinorganica 2014Juan José100% (1)
- Informe de Laboratorio 4Document11 pagesInforme de Laboratorio 4Roberto Ortiz LazarteNo ratings yet
- Obtención Del AcetilenoDocument10 pagesObtención Del AcetilenoMario Rodriguez ParraNo ratings yet
- Guía 4. EstequiometríaDocument9 pagesGuía 4. Estequiometríajesney morenoNo ratings yet
- Informe 4 - Mesa 3Document7 pagesInforme 4 - Mesa 3Jorge Antonio Peche LeivaNo ratings yet
- Labo 9 Solubilidad y Producto de SolubilidadDocument20 pagesLabo 9 Solubilidad y Producto de SolubilidadEricBryanDagninoReyesNo ratings yet
- Reacciones Quimicas Organicas Selectividad PDFDocument12 pagesReacciones Quimicas Organicas Selectividad PDFDaniel GarabitoNo ratings yet
- Informe N15 Catalisis Del Peroxido de HidrogenoDocument33 pagesInforme N15 Catalisis Del Peroxido de HidrogenogersonNo ratings yet
- Trig IntegralesDocument23 pagesTrig Integralesconejo8119No ratings yet
- Metodo de JobDocument9 pagesMetodo de JobDaniela Orozco CardonaNo ratings yet
- P-10 Calculos EstequiometricosDocument7 pagesP-10 Calculos Estequiometricosjose david de arco de avilaNo ratings yet
- 7, 8 y 9 INYECTABLESDocument16 pages7, 8 y 9 INYECTABLESXiomara JorgaNo ratings yet
- Quimica de La CoordinaciónDocument17 pagesQuimica de La CoordinaciónKyra_clik50% (2)
- Triamcinolona TraducidoDocument17 pagesTriamcinolona TraducidoXiomara JorgaNo ratings yet
- Factura 2017-02Document1 pageFactura 2017-02Xiomara JorgaNo ratings yet
- Manual de servicio FZ-16 YamahaDocument267 pagesManual de servicio FZ-16 YamahaJose Gregorio Aponte Perez95% (204)
- Imagenes Expo AnalisisDocument7 pagesImagenes Expo AnalisisXiomara JorgaNo ratings yet
- 19 Oct Actualidad Profesional InvesDocument3 pages19 Oct Actualidad Profesional InvesXiomara JorgaNo ratings yet
- Manual de Laboratorio de FarmacognosiaDocument45 pagesManual de Laboratorio de FarmacognosiaAdolfo Silvera Tomases100% (1)
- Gravimetria No. 1 Q. AnaliticaAADocument4 pagesGravimetria No. 1 Q. AnaliticaAAXiomara JorgaNo ratings yet
- Area SuperficialDocument1 pageArea SuperficialXiomara JorgaNo ratings yet
- 21protocolo para El Manejo Del Asma Potencialmente FatalDocument9 pages21protocolo para El Manejo Del Asma Potencialmente FatalLiv Margunn Gutierrez HuancaNo ratings yet
- Determinación de Un Ácido Políprotico Por PotenciómetroDocument3 pagesDeterminación de Un Ácido Políprotico Por PotenciómetroXiomara JorgaNo ratings yet
- Determinación de Un Ácido Políprotico Por PotenciómetroDocument3 pagesDeterminación de Un Ácido Políprotico Por PotenciómetroXiomara JorgaNo ratings yet
- 4 CyCDocument33 pages4 CyCXiomara JorgaNo ratings yet
- 5 MetabolismobacterianoDocument3 pages5 MetabolismobacterianoXiomara JorgaNo ratings yet
- Estraccion y Solubilidad BuenosDocument9 pagesEstraccion y Solubilidad BuenosXiomara JorgaNo ratings yet
- Taller2. Principios Del Equilibrio Químico 2 QFDocument4 pagesTaller2. Principios Del Equilibrio Químico 2 QFClaudia PadillaNo ratings yet
- Programacion Teusaquillo 4 PDFDocument1 pageProgramacion Teusaquillo 4 PDFsofiaNo ratings yet
- Empresas Calificadoras de RiesgoDocument8 pagesEmpresas Calificadoras de RiesgoCindy ColmenaresNo ratings yet
- Libro Diario y Mayor de Supermercados PeruanosDocument8 pagesLibro Diario y Mayor de Supermercados PeruanosJoel Chanca100% (1)
- Codex Chile PDFDocument5 pagesCodex Chile PDFMartin FigueroaNo ratings yet
- Tesis de Postgrado SISTEMAS DE CALIDAD 2 PDFDocument126 pagesTesis de Postgrado SISTEMAS DE CALIDAD 2 PDFhectwo17No ratings yet
- Caso Andres Thres - MRP - EoqDocument2 pagesCaso Andres Thres - MRP - EoqJoselyn Aquino Mendoza0% (1)
- Capitalismo y NeoliberalismoDocument4 pagesCapitalismo y NeoliberalismoedNo ratings yet
- Reaccion de SaponificacionDocument10 pagesReaccion de SaponificacionWilson WongNo ratings yet
- Extracción de Adn Vegetal - Protocolo Con CtabDocument2 pagesExtracción de Adn Vegetal - Protocolo Con Ctabvalenciabasto100% (1)
- Boletín 6150Document15 pagesBoletín 6150IDELMA YUSELI CASTAÑEDA MEDINANo ratings yet
- N531888Document16 pagesN531888Latipat Biblioteca de GacetasNo ratings yet
- Auditoria de Inventarios 1Document32 pagesAuditoria de Inventarios 1Romeo Morales CárdenasNo ratings yet
- Taller PreciosDocument2 pagesTaller PreciosKATERINE VELEZ GOMEZNo ratings yet
- Taller 1 PDFDocument1 pageTaller 1 PDFMARIA ALEJANDRA OTALORA SANABRIANo ratings yet
- aaa1591d-399c-4e6c-bda2-4dd07091aec3Document1 pageaaa1591d-399c-4e6c-bda2-4dd07091aec3jema4802No ratings yet
- Factura: OriginalDocument3 pagesFactura: OriginalTaz ManiaNo ratings yet
- Reporte Anual 2013 Grupo ModeloDocument213 pagesReporte Anual 2013 Grupo Modelonopalbeat8522100% (2)
- Problemas Motores Electricos2Document4 pagesProblemas Motores Electricos2Joaquim BernadoNo ratings yet
- Operaciones TrenesDocument8 pagesOperaciones TrenesGuillermo García HernándezNo ratings yet
- Niif Pymes Seccion 1 2 3 4 y 35 FinanzasDocument11 pagesNiif Pymes Seccion 1 2 3 4 y 35 FinanzasAsdrubal TuchNo ratings yet
- Agenda de Evento EJEMPLODocument4 pagesAgenda de Evento EJEMPLOyesnoname0% (1)
- TDR Servicio Escaneo y Ploteo de Planos PDFDocument7 pagesTDR Servicio Escaneo y Ploteo de Planos PDFlenaNo ratings yet
- Herramientas Practicas para Innovacion 1.0 Scamper 1Document14 pagesHerramientas Practicas para Innovacion 1.0 Scamper 1monserratNo ratings yet
- Trabajo Práctico Integrador 1 - AgropecuariaDocument5 pagesTrabajo Práctico Integrador 1 - AgropecuariaJuan Esteban NogueraNo ratings yet
- Mi973056751 2Document8 pagesMi973056751 2chito23jNo ratings yet
- Costos ocultos mala calidadDocument3 pagesCostos ocultos mala calidadPriscilla SalazarNo ratings yet
- Colocacion de Canaletas Pluviales y Zingueria Capital Federal para Argentina..20130304.192512Document2 pagesColocacion de Canaletas Pluviales y Zingueria Capital Federal para Argentina..20130304.192512reward0pieNo ratings yet
- Desventajas Del Codigo de ConsumidorDocument12 pagesDesventajas Del Codigo de ConsumidorElizabeth R.No ratings yet
- Resena Historica Del Municipio de QuibdoDocument39 pagesResena Historica Del Municipio de QuibdoYeseniaMosqueraNo ratings yet
- Manual Sopletes y Cortadores en EspañolDocument5 pagesManual Sopletes y Cortadores en EspañolAysmar EsthelaNo ratings yet