Professional Documents
Culture Documents
Resumen Proteinas
Uploaded by
Francisco André Mayorga Yuntul0 ratings0% found this document useful (0 votes)
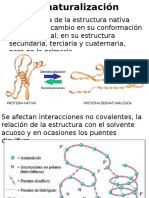
159 views5 pagesLa estructura proteica se estabiliza por uniones químicas como enlaces covalentes, puentes de hidrógeno, puentes salinos y fuerzas de Van der Waals. La estructura proteica incluye la estructura primaria (secuencia de aminoácidos), secundaria (conformaciones como hélice alfa y hoja beta), terciaria (relaciones entre dominios secundarios) y cuaternaria (relaciones entre polipéptidos). Las proteínas pueden desnaturalizarse por cambios de temperatura, pH, urea, detergentes u otros agentes
Original Description:
Original Title
RESUMEN PROTEINAS
Copyright
© © All Rights Reserved
Available Formats
DOCX, PDF, TXT or read online from Scribd
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentLa estructura proteica se estabiliza por uniones químicas como enlaces covalentes, puentes de hidrógeno, puentes salinos y fuerzas de Van der Waals. La estructura proteica incluye la estructura primaria (secuencia de aminoácidos), secundaria (conformaciones como hélice alfa y hoja beta), terciaria (relaciones entre dominios secundarios) y cuaternaria (relaciones entre polipéptidos). Las proteínas pueden desnaturalizarse por cambios de temperatura, pH, urea, detergentes u otros agentes
Copyright:
© All Rights Reserved
Available Formats
Download as DOCX, PDF, TXT or read online from Scribd
0 ratings0% found this document useful (0 votes)
159 views5 pagesResumen Proteinas
Uploaded by
Francisco André Mayorga YuntulLa estructura proteica se estabiliza por uniones químicas como enlaces covalentes, puentes de hidrógeno, puentes salinos y fuerzas de Van der Waals. La estructura proteica incluye la estructura primaria (secuencia de aminoácidos), secundaria (conformaciones como hélice alfa y hoja beta), terciaria (relaciones entre dominios secundarios) y cuaternaria (relaciones entre polipéptidos). Las proteínas pueden desnaturalizarse por cambios de temperatura, pH, urea, detergentes u otros agentes
Copyright:
© All Rights Reserved
Available Formats
Download as DOCX, PDF, TXT or read online from Scribd
You are on page 1of 5
ORGANIZACIN ESTRUCTURA
Estabilidad de la estructura proteica.
Tipos de uniones qumicas.
Enlaces covalentes responsables del enlace peptdico.
Grupos que interaccionan CC, CN, C=O, CH, SS, CNC
Puentes salinos, uniones polares ms fuertes que existen.
Grupos que interaccionan NH3+, COO NH3+
Puentes de hidrgeno presentan la conformacin 3D de una protena.
Grupos que interaccionan
Fuerzas atractivas de Van der Waals
Grupos que interaccionan. Grupos apolares
Estructura
Estructura primaria.
Secuencia de aminocidos
Cambios en la secuencia de aminocidos.
Conservadores. Preservan naturaleza de cadena lateral (cambio
de Asp por Glu, mantienen carga negativa).
No conservadores. (Asp por Ala, por ejemplo) pueden tener
consecuencias ms graves.
Estructura secundaria. Plegado de polipptidos hacia motivos con enlaces
de hidrgeno, como la hlice , la hoja plegada , y asas.
Conformaciones.
Conformacin
Conformacin . (presente en queratina y protenas fibrosas)
Anti paralelas y paralelas.
Estructura terciaria.
Alude a las relaciones entre dominios estructurales secundarios.
Caracterstica de protenas globulares.
Estructura cuaternaria.
Protenas oligomricas se refiere a las relaciones espaciales entre diversos
tipos de poli pptidos.
DESNATURALIZACION.
Anlisis termodinmico de la desnaturalizacin de un sistema protenico se
consideran dos estadios N y D, para la transicin entre las molculas en estado
Nativo (N) y desnaturalizado (D).
Desnaturalizacin trmica.
Desnaturalizacin por cambios de pH.
Modificaciones en su conformacin debido a cambios en la ionizacin de las
cadenas laterales.
Afecta el nmero de puentes salinos que estabilizan la estructura nativa.
Desnaturalizacin por urea y cloruro de guanidinio.
Forma cadenas al azar, que se estabilizan en un nuevo estado desnaturalizado con
puentes de hidrgeno formados con urea.
Desnaturalizacin con detergentes.
Estabilizan forma desplegada del polipptido mediante formacin de micelas
alrededor de las zonas hidrofbicas.
Desnaturalizacin con disolventes orgnicos.
Obedece a la ley de Coulomb: F= (q
1
. q
2
)/er
2
Efectos de las sales en la solubilidad de las protenas.
Concentracin salina fisiolgica.
Interacciones electroestticas de la sales con residuos de aminocidos.
Concentracin salinas altas (IM).
Series liotropicas o caotropicas de Hofmeister.
Estabilidad estructural
Mejoran. Na
2
So
4
y NaF.
Debilitan. NaSCN NaCLO
4
.
Inactivacin mecnica.
Protenas milimricas son fuertemente afectadas por las fuerzas cortantes o por la
agitacin. Se evita con antiespumantes.
Protelisis. rompimiento irreversible de enlaces covalentes de la protena.
MODIFICACION.
Tratamientos trmicos moderados
La desnaturalizacin de las protenas facilita su digestin.
Escaldado inactivar enzimas
Pasteurizacin se desactivan las lipasas de la leche, las toxinas
microbianas
Pirolisis
De acuerdo a la prueba de Ames en el tratamiento trmico de alimentos
(200 C) los aminocidos sufren pirlisis convirtindose en mutgenos.
Entre los ms txicos estn las carbolinas y los imidoaazarenos.
Racemizacin
Es frecuente en los tratamientos alcalinos de acuerdo a la b-eliminacin
(formacin aminocidos raros Ser y fosfoserina).
Entre cruzamientos
interacciones protena-protena (puentes S-S).
Reacciones de las protenas con agentes oxidantes
Los aminocidos lbiles son Met Cys Trp cuando aplican agentes
oxidantes. Inhiben el crecimiento microbiano en procesos de alimentos.
Los lpidos peroxidados provenientes de alimentos en proceso de
enranciamiento.
Reacciones con nitritos
En produccin de embutidos evitan crecimiento de C. botulinum.
Reacciones con sulfitos
Previene el oscurecimiento de Maillard.
Reacciones de carbonil amino
Reaccin de oscurecimiento de Maillard.
Etapa del oscurecimiento.
o Base Shiff. se descompone en Lys y el azcar en el medio cido del
estmago.
o Formacion cetosamina. se forman melanoidinas, compuestos
insolubles indeseables.
Fraccionacion
Se obtienen por tratamientos alcalinos.
PROPIEDADES FUNCIONALES.
Propiedades de hidratacin.
Dependen de las interacciones protenaagua:
Adsorcin de agua.
Humectacin.
Solubilidad.
Retencin de agua.
Dispersabilidad.
Viscosidad
Clasificacin protenas con base solubilidad:
Albuminas. se solubilizan en agua a pH 6.6 (albmina srica, ovoalbmina,
y a-lactoalbmina).
Globulinas. solubles en soluciones salinas diluidas a pH 7.0 (glicinina,
faseolina y b-lactoglobulina).
Glutelinas. solubles en soluciones cidas (pH 2) y alcalinas (pH 12)
(glutelinas de trigo).
Prolaminas. solubles en etanol al 70%
Propiedades de superficie.
Emulsificantes.
Metodos que determinan
Espumantes. Fase continua acuosa y una fase dispersa gaseosa (aire).
Factores
o Ph. PI clara de huevo 4,5.
o Sales. Capacidad espumante aumenta con concentracin NaCl.
o Azucares. Incrementa estabilidad.
o Lpidos. concentracin mayor al 0.5% afectan desfavorablemente
las propiedades espumantes de protenas.
o Temperatura
Viscosidad.
resistencia de una solucin a fluir bajo una fuerza aplicada.
PROPIEDADES NUTRICIONALES.
Evaluacin calidad protenica
Balance de Nitrgeno (NB) evala nitrgeno retenido.
Relacin de la Eficiencia de la Protena (PER) evala ganancia de peso por
gramo de protena consumido
Relacin Neta de la Protena (NPR)
Utilizacin Neta de la Protena (NPU) que evala el nitrgeno corporal en
funcin del ingerido.
You might also like
- 2.1 Proteínas Generalidades AminoácidosDocument54 pages2.1 Proteínas Generalidades AminoácidosArnaldo Ysmael Saffi OviedoNo ratings yet
- Preinformes Bioqiomica 1 2 3 4Document14 pagesPreinformes Bioqiomica 1 2 3 4Edgar PerezNo ratings yet
- Informe de Bioquimica Practica 4Document8 pagesInforme de Bioquimica Practica 4Yesenia CuellarNo ratings yet
- Resu BQ AfDocument324 pagesResu BQ AfFabisol CastilloNo ratings yet
- Guias de Lab de ProteìnasDocument11 pagesGuias de Lab de ProteìnasabdelNo ratings yet
- ResumenDocument75 pagesResumenVera Cabrera Jorge JavierNo ratings yet
- Guía Trabajos Prácticos 2018 BQ AlimentosDocument13 pagesGuía Trabajos Prácticos 2018 BQ AlimentosMaríaJoséCorreaNo ratings yet
- PROTEÍNASDocument5 pagesPROTEÍNASJuliana YagualNo ratings yet
- Propiedades Generales de La ProteínasDocument7 pagesPropiedades Generales de La ProteínasJulian VillanuevaNo ratings yet
- Informe AlimentosDocument9 pagesInforme AlimentosJorgePedrozoCalderonNo ratings yet
- Las Proteínas III NDocument3 pagesLas Proteínas III NJuan GabrielNo ratings yet
- Informe Unidad 1 ProteínasDocument27 pagesInforme Unidad 1 ProteínasMariana MuriaNo ratings yet
- ProteínasDocument11 pagesProteínasEmmanuel CasteloNo ratings yet
- Informe 1Document21 pagesInforme 1Elmer Sanchez RamosNo ratings yet
- Efecto de Los Procesos Tecnológicos en La Estabilidad de Las Proteínas, Lípidos y Carbohidratos Presentes en Los AlimentosDocument67 pagesEfecto de Los Procesos Tecnológicos en La Estabilidad de Las Proteínas, Lípidos y Carbohidratos Presentes en Los Alimentoschaconvill0% (1)
- DesnaturalizaciónDocument28 pagesDesnaturalizaciónErnesto GallegoNo ratings yet
- Desnaturalizacion BromatologiaDocument29 pagesDesnaturalizacion BromatologiaAxel Estrada SalazarNo ratings yet
- Desnaturalizacion de ProteinasDocument7 pagesDesnaturalizacion de ProteinasDario JayaNo ratings yet
- Cuestionario 1Document3 pagesCuestionario 1MaviNo ratings yet
- Identificación de ProteínasDocument12 pagesIdentificación de ProteínasGabys Jary LoveNo ratings yet
- 6 Solubilidad de Las Proteinas II Leche y HuevoDocument16 pages6 Solubilidad de Las Proteinas II Leche y HuevoJuan Steward Flores AmasifuenNo ratings yet
- Bromatología - ProteínasDocument15 pagesBromatología - Proteínasaidenalice4No ratings yet
- Solubilidad Proteinas AlimentosDocument16 pagesSolubilidad Proteinas AlimentosJhoel Daniel Gamboa MejiaNo ratings yet
- Practica n3 Solubilidad de ProteinasDocument12 pagesPractica n3 Solubilidad de ProteinasgustavoNo ratings yet
- Qa Informe 2 FinalDocument21 pagesQa Informe 2 FinalJoselinOreNo ratings yet
- Métodos Analíticos de Solubilidad y Precipitación de Las ProteínasDocument8 pagesMétodos Analíticos de Solubilidad y Precipitación de Las ProteínasAnyi CamilaNo ratings yet
- Estabilidad de Las ProteinasDocument11 pagesEstabilidad de Las ProteinasJim ChNo ratings yet
- PROTEINAS DiapositivasDocument19 pagesPROTEINAS DiapositivasnoebeylinaresNo ratings yet
- TEMA 5. Alteraciones de Las ProteínasDocument16 pagesTEMA 5. Alteraciones de Las ProteínasNicole MastrogiorgioNo ratings yet
- Informe 2 - Química de AlimentosDocument13 pagesInforme 2 - Química de AlimentosDaiana ZumaetaNo ratings yet
- Proteinas ...Document12 pagesProteinas ...Saby ChuanNo ratings yet
- Presentación EnzimasDocument33 pagesPresentación EnzimasAndrea HinestrozaNo ratings yet
- Practica Laboratorio YogurDocument19 pagesPractica Laboratorio YogurAmy mmg14No ratings yet
- Proteinas EnzimasDocument57 pagesProteinas EnzimassarahernandezmgNo ratings yet
- Informe de Laboratorio N. 9Document16 pagesInforme de Laboratorio N. 9Miyey Gutierrez Orduz0% (1)
- TP Nº12. ProteínasDocument4 pagesTP Nº12. ProteínasJana Vecchio RomeroNo ratings yet
- Desnaturalizacion de Proteinas 1Document14 pagesDesnaturalizacion de Proteinas 1Juan Pablo Cruz Sanchez100% (1)
- Práctica N - 2 Solubilidad de ProteínasDocument12 pagesPráctica N - 2 Solubilidad de ProteínasCristian Velásquez0% (1)
- Cuarto InformeDocument13 pagesCuarto InformeJhojan RuizNo ratings yet
- 5 Prop. Físicas y Químicas de ProteínasDocument26 pages5 Prop. Físicas y Químicas de ProteínasBasthean Francisco Pino CabezasNo ratings yet
- DesnaturalizacionDocument9 pagesDesnaturalizacionAlex Apaza MamaniNo ratings yet
- Practica 01Document3 pagesPractica 01Andy Yosifer Chirinos GonzalesNo ratings yet
- Actividad R - ProteínasDocument6 pagesActividad R - ProteínasLuis Pablo ConstantinoNo ratings yet
- Pract 8 - DesnaturalizacionDocument3 pagesPract 8 - Desnaturalizacionadrián párragaNo ratings yet
- Laboratorio N4Document8 pagesLaboratorio N4Neftaly CubiasNo ratings yet
- Química de macrocomponentes de alimentosFrom EverandQuímica de macrocomponentes de alimentosNo ratings yet
- LABORATORIO #03 Solubilidad y Desnaturalización de ProteínasDocument17 pagesLABORATORIO #03 Solubilidad y Desnaturalización de ProteínasAlex Romero SurcoNo ratings yet
- Practica 4 BioquìmicaDocument15 pagesPractica 4 BioquìmicaP Herminio SabinoNo ratings yet
- Practica 4 BioquìmicaDocument15 pagesPractica 4 BioquìmicaBills isuiza leonNo ratings yet
- PROTEINASDocument14 pagesPROTEINASRíos Enríquez Itzel AbigailNo ratings yet
- Proteinas Virtual 2022Document44 pagesProteinas Virtual 2022Nicol LopezNo ratings yet
- Informe 2-Mesa 3Document14 pagesInforme 2-Mesa 3Jose Carlos SanchezNo ratings yet
- Anti Nutrient EsDocument12 pagesAnti Nutrient Esdora yanetNo ratings yet
- Lab 3 - Proteina BrutaDocument14 pagesLab 3 - Proteina BrutaCourtney QuinnNo ratings yet
- Solubilidad de ProteinasDocument12 pagesSolubilidad de ProteinasginoNo ratings yet
- Tarea Proteínas 2 DGS - Docx - Documentos de GoogleDocument3 pagesTarea Proteínas 2 DGS - Docx - Documentos de GoogleDEYANEIRA GUADARRAMA SILVANo ratings yet
- Manual PR Cticas Bioqu MicaDocument37 pagesManual PR Cticas Bioqu Micaoswaldo doria vegaNo ratings yet
- 08.1 Prot 2 Parte 2018-I-Fusionado PDFDocument119 pages08.1 Prot 2 Parte 2018-I-Fusionado PDFJhonatan A OrzNo ratings yet
- Acceso a Universidad para Mayores de 25 años. Biología 2013-2017.: Solucionario Pruebas 2013-2017From EverandAcceso a Universidad para Mayores de 25 años. Biología 2013-2017.: Solucionario Pruebas 2013-2017No ratings yet
- CPPCDocument3 pagesCPPCFrancisco André Mayorga YuntulNo ratings yet
- Manual Adoptantes GatoDocument27 pagesManual Adoptantes GatoRobPNo ratings yet
- Logística FinalDocument21 pagesLogística FinalFrancisco André Mayorga YuntulNo ratings yet
- Pco Sem7Document28 pagesPco Sem7Francisco André Mayorga YuntulNo ratings yet
- Alumnos:: Mayorga Yuntul, Francisco AndréDocument3 pagesAlumnos:: Mayorga Yuntul, Francisco AndréFrancisco André Mayorga YuntulNo ratings yet
- Ejercicio NivelaciónDocument6 pagesEjercicio NivelaciónKevin GuzmanNo ratings yet
- Clase 2 Contaminacion y FuentesDocument24 pagesClase 2 Contaminacion y FuentesFrancisco André Mayorga YuntulNo ratings yet
- CDCDocument221 pagesCDCDavid AlejandroNo ratings yet
- Cinetica de CrecimientoDocument2 pagesCinetica de CrecimientoFrancisco André Mayorga YuntulNo ratings yet
- Inspeccion y MuestroDocument22 pagesInspeccion y MuestroFrancisco André Mayorga YuntulNo ratings yet
- Clase 04 Elementos Teorico-Conceotuales de La InvestigacionDocument16 pagesClase 04 Elementos Teorico-Conceotuales de La InvestigacionEmpeyita Lovely Uriol OlivaresNo ratings yet
- Carátula Examen I UndadDocument1 pageCarátula Examen I UndadFrancisco André Mayorga YuntulNo ratings yet
- Clase 04 Elementos Teorico-Conceotuales de La InvestigacionDocument16 pagesClase 04 Elementos Teorico-Conceotuales de La InvestigacionEmpeyita Lovely Uriol OlivaresNo ratings yet
- TRAZABILIDADDocument24 pagesTRAZABILIDADRosmery Cerna ChavezNo ratings yet
- 1 Laboratorio BCBDocument7 pages1 Laboratorio BCBJeanPiereeTapiaCelisNo ratings yet
- 26 Re Vista JuntosDocument18 pages26 Re Vista JuntosFrancisco André Mayorga YuntulNo ratings yet
- ETAS - Prevencion (Modo de Compatibilidad)Document44 pagesETAS - Prevencion (Modo de Compatibilidad)Ayl Greysi RodriguezNo ratings yet
- Fermín Tacion Alcoho IlicaDocument13 pagesFermín Tacion Alcoho IlicaFrancisco André Mayorga YuntulNo ratings yet
- VU y Microbiología PredictivaDocument22 pagesVU y Microbiología PredictivaLeandro ChilonNo ratings yet
- Gestion Por CompetenDocument23 pagesGestion Por CompetenFrancisco André Mayorga YuntulNo ratings yet
- 2 Biorreactor Columna de BurbujasDocument33 pages2 Biorreactor Columna de BurbujasFrancisco André Mayorga YuntulNo ratings yet
- 1 Biorreactores de Bucle PDFDocument27 pages1 Biorreactores de Bucle PDFSandra BazanNo ratings yet
- Clase 01 2017Document31 pagesClase 01 2017Francisco André Mayorga YuntulNo ratings yet
- FeedbackDocument8 pagesFeedbackFrancisco André Mayorga YuntulNo ratings yet
- Competencias Corporativas BackusDocument19 pagesCompetencias Corporativas BackusJavier ValdiviaNo ratings yet
- 011 PalomarDocument10 pages011 PalomarFrancisco André Mayorga YuntulNo ratings yet
- Efecto de La Dilucion y Concentracion de Carboximetilcelulosa Sodica en La Estabilidad y Aceptacion General de Nectar de MembrilloDocument60 pagesEfecto de La Dilucion y Concentracion de Carboximetilcelulosa Sodica en La Estabilidad y Aceptacion General de Nectar de MembrilloAna Vazquez100% (1)
- Tema 07 Armaduras Entramados y MaquinasDocument64 pagesTema 07 Armaduras Entramados y MaquinasNúñez GeorgeNo ratings yet
- Metodos PcaDocument5 pagesMetodos PcaFrancisco André Mayorga YuntulNo ratings yet
- Pacasmayo Memoria Anual 2013Document83 pagesPacasmayo Memoria Anual 2013Francisco André Mayorga Yuntul100% (1)
- Informe - Informe 3Document9 pagesInforme - Informe 3Diego Cruzado oroscoNo ratings yet
- Los Genes y ProteinasDocument22 pagesLos Genes y ProteinasAshly M Haydar RodriguezNo ratings yet
- Aminoacidos - Bioquima de AlimentosDocument18 pagesAminoacidos - Bioquima de AlimentosAlexis Ancajima SantosNo ratings yet
- Estructura y Funcion de Acidos Nucleicos IDocument34 pagesEstructura y Funcion de Acidos Nucleicos IChristian MartinoniNo ratings yet
- Síntesis de Aminoácidos PDFDocument5 pagesSíntesis de Aminoácidos PDFConstanza Armijo SotoNo ratings yet
- Suplementación Con Omega 3 y Omega6Document8 pagesSuplementación Con Omega 3 y Omega6Simon PedrozoNo ratings yet
- ENZIMASDocument19 pagesENZIMASDaniel LunaNo ratings yet
- ERITROPOYETINADocument4 pagesERITROPOYETINACila Carolina Estrada ArrietaNo ratings yet
- AlitraqDocument1 pageAlitraqAle Michicol GutierrezNo ratings yet
- Oxidaciones BiologicasDocument33 pagesOxidaciones BiologicasFlavioCesarPancayaFloresNo ratings yet
- 2.1. - Lab 2 Dr. Martin Practica LDH - Protocololaboratorio 2 (Autoguardado)Document17 pages2.1. - Lab 2 Dr. Martin Practica LDH - Protocololaboratorio 2 (Autoguardado)JAVIER ANTHONY BUSTOS LOPEZNo ratings yet
- BiomoleculasDocument3 pagesBiomoleculasJosé AbantoNo ratings yet
- Quimiotripsina 1.0Document21 pagesQuimiotripsina 1.0Arantza ChewNo ratings yet
- Laboratorio ProteinasDocument8 pagesLaboratorio ProteinasAngelo Alexander Tapia Huamani100% (1)
- 2 Síntesis de ProteínasDocument161 pages2 Síntesis de ProteínasJosé Luis Maldonado GarcíaNo ratings yet
- Lectura 1. Macromoléculas Biológicas-1-19Document19 pagesLectura 1. Macromoléculas Biológicas-1-19elbertNo ratings yet
- Etiqueta Valor NutricionalDocument3 pagesEtiqueta Valor Nutricionalmaricarmen riosNo ratings yet
- Guía de Laboratorio N°2 - BiocompuestosDocument4 pagesGuía de Laboratorio N°2 - Biocompuestoskemel piñaNo ratings yet
- Metabolismo de b12Document13 pagesMetabolismo de b12Fenella AlejandraNo ratings yet
- Cuestionario de Metabolismo de Lipidos Parte 2Document4 pagesCuestionario de Metabolismo de Lipidos Parte 2sara peresNo ratings yet
- T-21 Degradación de TG y AGDocument24 pagesT-21 Degradación de TG y AGDenis PeraltaNo ratings yet
- Diapositiva BioquimicaDocument4 pagesDiapositiva Bioquimicajackfelin cedeñoNo ratings yet
- Nivelacion 9º IDocument4 pagesNivelacion 9º IJuan Castro33% (3)
- PIRIDOXINADocument10 pagesPIRIDOXINAUno DosNo ratings yet
- Protein AsDocument5 pagesProtein AsManuel AndradeNo ratings yet
- Juego de Power Point-Mayra BrusilDocument42 pagesJuego de Power Point-Mayra Brusilmayra alexandra brusil diasNo ratings yet
- Seccion2 Actividad5Document20 pagesSeccion2 Actividad5Yer Paniora GarciaNo ratings yet
- Sesià N 17-Metabolismo Del Glucogeno 1s2022Document31 pagesSesià N 17-Metabolismo Del Glucogeno 1s2022Luciano Bonilla ReyesNo ratings yet
- Exposicion de MicronutrientesDocument3 pagesExposicion de MicronutrientesNilser CMNo ratings yet
- Catabolismo de Los Esqueletos de CarbonoDocument36 pagesCatabolismo de Los Esqueletos de CarbonoVicThor FernandezNo ratings yet