Professional Documents
Culture Documents
Lista de Exercícios 5 - Volumetria de Precipitação PDF
Uploaded by
André Mauricio De OliveiraOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Lista de Exercícios 5 - Volumetria de Precipitação PDF
Uploaded by
André Mauricio De OliveiraCopyright:
Available Formats
CEFET/MG Campus Timteo Departamento de Metalurgia e Qumica
Disciplina: Qumica Analtica Quantitativa Prof. Andr M. Oliveira
LISTA DE EXERCCIOS:
VOLUMETRIA DE PRECIPITAO
Nome:
Observao:
Todos os clculos e equaes qumicas pertinentes devem ser indicados.
1. Descreva os mtodos argentimtricos de Mohr, Volhard e Fajans, mencionando os indicadores usados e o tipo de interferncia a que cada mtodo est sujeito.
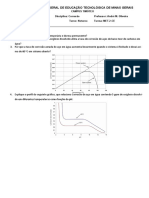
2. Construa as curvas de titulao (em termos de pAg e de pCl em funo do volume
de soluo de AgNO3 ) da titulao de 100 mL de uma soluo 0, 10 Eq/L de cloreto
de sdio com uma soluo 0, 10 Eq/L de nitrato de prata, considerando as seguintes
adies de titulante: 0,00; 25,00; 48,00; 49,00; 49,50; 50,00; 50,50; 51,0; 52,00; 75,00;
100, 00 mL.
3. Refaa as curvas de titulao do item anterior, desta vez considerando solues 0, 005 Eq/L
de cloreto de sdio e nitrato de prata e compare com o resultado ali obtido. Como
explicar esta diferena?
4. Por que o nitrato de prata no pode ser considerado um padro primrio?
5. Por que adicionamos carbonato de clcio ao meio na dosagem de cloreto pelo mtodo
de Mohr?
6. Por que adicionamos nitrobenzeno ou clorofrmio ao meio durante a dosagem de cloreto
pelo mtodo de Volhard? Por que esta medida no necessria na anlise de brometo
e iodeto? (Dados teis: Kps AgCl = 1, 8 1010 ; Kps AgBr = 5, 0 1013 ; Kps AgI =
8, 3 1017 )
7. Por que, na anlise iodeto pelo mtodo de Volhard, devemos adicionar o indicador
somente depois da precipitao do iodeto de prata?
8. 245, 7 mg de cloreto de sdio puro foram dissolvidos em gua e titulados por 41, 50 mL
de uma soluo de nitrato de prata. Calcular a concentrao em Eq/L da soluo
titulante.
Resposta: 0, 1012 Eq/L.
9. 2, 568 g de cloreto de sdio so dissolvidos em gua e o volume completado a 500 mL
em balo volumtrico. 50, 0 mL da soluo resultante necessidade de 47, 80 mL de
uma soluo de nitrato de prata para precipitar completamente o on cloreto, usandose cromato de potssio como indicador. Calcular a normalidade da soluo de nitrato
de prata.
Resposta: 0, 0918 Eq/L.
10. Os ons cloreto de 25, 0 mL de uma soluo de cloreto de sdio necessitaram de 48, 50 mL
de soluo 0, 12 Eq/L de nitrato de prata para completa precipitao. Calcular a concentrao em g/L da soluo titulada.
Resposta: 13, 62 g/L.
11. 100 mL de uma amostra de gua do mar foram transferidos para um balo volumtrico
completado com o volume a exatamente 1, 0 L. Utilizando o mtodo de Mohr, 50, 00 mL
da soluo diluda necessitaram de 27, 20 mL de soluo 0, 20 Eq/L (f = 1, 0200) de
nitrato de prata para a completa precipitao dos haletos sob a forma de haletos de
prata. Calcular a concentrao de haletos na gua do mar expressa em g/L de cloreto
de sdio.
Resposta: 64, 92 g/L.
12. Uma moeda de prata pesando 2, 000 g foi dissolvida em cido ntrico e a soluo resultante diluda em 500 mL em balo volumtrico. 50, 00 mL dessa soluo foram titulados
por 14, 80 mL de soluo 0, 10 Eq/L de tiocianato de potssio. Calcular o teor de prata
na moeda.
Resposta: 79,9 %.
13. 293, 8 mg do cloreto de um metal quadrivalente so dissolvidos em gua. Para precipitar
completamente o on cloreto da soluo resultante, foram consumidos 37, 50 mL de
soluo 0, 12 Eq/L de nitrato de prata. Calcular a massa molar do referido cloreto.
14. 25, 00 mL de uma soluo contendo cloreto de sdio e cido clordrico foram tratados com carbonato de clcio em excesso. A soluo resultante foi ento titulada por
48, 40 mL de soluo 0, 10 Eq/L de nitrato de prata. Outros 50, 00 mL foram completamente neutralizados por 44, 60 mL de soluo 0, 10 Eq/L de hidrxido de sdio.
Calcular a massa de cloreto de sdio e de cido clordrico presente em 1,0\,L de soluo.
2
Resposta: NaCl: 6, 10 g/L; HCl: 3, 25 g/L
15. 204 mg de uma mistura de cloreto de sdio e cloreto de potssio so dissolvidos em gua
e necessitaram de 29, 60 mL de soluo 0, 10 Eq/L de nitrato de prata para completa
precipitao do on cloreto. Calcular o teor de cada sal na mistura analisada.
Resposta: 29,6 % NaCl e 70,4 % de KCl
16. A anlise qualitativa de um produto comercial indicou a formao de um precipitado
branco por tratamento com uma soluo de nitrato de prata em meio ntrico. Por outro
lado, tratando-se 2, 00 g do produto com 100 mL de soluo 0, 10 Eq/L de nitrato de
prata e diluindo-se para 200 mL, observou-se que 100 mL dessa nova soluo reagiram
com 20, 00 mL de uma soluo 0, 10 Eq/L de tiocianato de potssio. Sabendo-se que o
produto analisado tem 5,0 % de umidade, calcule a percentagem de cloreto na amostra
seca.
Resposta: 11,21 % de cloreto
17. A uma amostra de 150 mg de tetracloreto de etileno foi adicionado excesso de sdio metlico, em meio no aquoso, e aquecida sob re uxo por duas horas. Eliminado o excesso
de sdio, acidulou-se a soluo resultante com cido ntrico, adicionou-se 50, 00 mL de
soluo 0, 10 Eq/L de nitrato de prata e diluiu-se para 200 mL. Aps separar o precipitado, titulou-se 100 mL do ltrado com tiocianato de amnio 0, 05 Eq/L em presena de
Fe3+ , gastando-se 24, 80 mL. Calcule o teor de tetracloroetileno na amostra analisada.
Resposta: 69,72 %
18. A Tabela 1 detalha alguns mtodos no argentimtricos de volumetria de precipitao.
Responda ao que se pede:
(a) No preparo da soluo padro de Hg2 (NO3 )2 , dissolve-se o sal comercial Hg2 (NO3 )2 2 H2 O
em cido ntrico e adiciona-se um pouco de mercrio metlico (Hg0 ), devido ao
fato de este sal conter quantidades apreciveis de on mercrico, Hg2+ . Escreva a
reao que ocorre.
(b) Escreva a equao balanceada da precipitao de Zn2+ com ferrocianeto de potssio, K4 [Fe(CN)6 ]2 .
(c) O mtodo ferrocianomtrico se baseia no equilbrio de oxi-reduo entre o ferrocianeto ([Fe(CN)6 ]3 ) e o ferricianeto ([Fe(CN)6 ]4 ), na presena de difenilamina.
Explique como funciona o mtodo.
(d) Todos os indicadores mostrados so indicadores de adsoro. Explique o funcionamento dos mesmos.
Tabela 1: Mtodos no argentimtricos de volumetria de precipitao. Fonte: Ohlweiler
(1976), p. 496.
Referncias
1. Harris, D. C.
Anlise Qumica Quantitativa.
6. Ed. Rio de Janeiro: LTC, 2005.
2. Skoog, D. A.; West, D. M.; Holler, F. J.; Crouch, S. R. Fundamentos
Analtica. 8. Ed. So Paulo: Pioneira Thomson Learning, 2006.
3. Silva, M. P. Anlise Qumica
CEFET-MG, 2004. 143p.
Quantitativa I e II - Terica (Apostila).
de Qumica
Belo Horizonte:
4. Ohlweiler, O. A. Qumica Analtica Quantitativa (2 vol.). 2. Ed. Rio de Janeiro: LTC,
1976.
You might also like
- Lista de Exercícios de Volumetria de PrecipitaçãoDocument6 pagesLista de Exercícios de Volumetria de PrecipitaçãoGeovanna Vilalva FNo ratings yet
- NBR11768-3 - Fls. 1 - 2 - 3 - 4 - 5 - 6 - 7 - 8 - 9 - 10 - 11 - 12 - 13 - 14 - 15 - 16 - 17 - 18 - 19 - 20 - Arquivo para ImpressãoDocument20 pagesNBR11768-3 - Fls. 1 - 2 - 3 - 4 - 5 - 6 - 7 - 8 - 9 - 10 - 11 - 12 - 13 - 14 - 15 - 16 - 17 - 18 - 19 - 20 - Arquivo para ImpressãoAmandarosat100% (1)
- Determinação de Cálcio, Magnésio e Dureza Total Da ÁguaDocument12 pagesDeterminação de Cálcio, Magnésio e Dureza Total Da ÁguaJunior DuarteNo ratings yet
- Determinação de Na+, Cl- e NaCl em sal comercialDocument18 pagesDeterminação de Na+, Cl- e NaCl em sal comercialJúlia MatioliNo ratings yet
- Solução Tampão de Química AnalíticaDocument3 pagesSolução Tampão de Química AnalíticaNeiliane Souza100% (1)
- Determinação de CloretosDocument14 pagesDeterminação de CloretosIldemarFernandesNo ratings yet
- Volumetria de Precipitação Métodos Mohr e VolhardDocument11 pagesVolumetria de Precipitação Métodos Mohr e VolhardVANESSA ZIMERMANN DE OLIVEIRA ILLA FONTNo ratings yet
- 2015 - 04 - 19 REsolucaoDocument20 pages2015 - 04 - 19 REsolucaoMariana SilvaNo ratings yet
- Determinação de SO2 em vinhosDocument4 pagesDeterminação de SO2 em vinhosPablo RobertoNo ratings yet
- Lista de exercícios de volumetria de complexação com EDTADocument4 pagesLista de exercícios de volumetria de complexação com EDTAAndré Mauricio De Oliveira100% (2)
- UEsC Química Nitração BenzoatoDocument7 pagesUEsC Química Nitração BenzoatoGabriel AmaralNo ratings yet
- Haletos orgânicos: nomenclatura e propriedadesDocument13 pagesHaletos orgânicos: nomenclatura e propriedadesAndré Mauricio De Oliveira100% (1)
- Algarismos significativos em análises gravimétricasDocument10 pagesAlgarismos significativos em análises gravimétricasGeiciane MagalhãesNo ratings yet
- 3a Lista de Exercícios de Volumetria de Precip, Complex e Óxido-Redução.Document2 pages3a Lista de Exercícios de Volumetria de Precip, Complex e Óxido-Redução.Pedro Oliveira0% (1)
- Química analítica exercíciosDocument5 pagesQuímica analítica exercíciosEline Picoloto CeronNo ratings yet
- Exercícios Química AnalíticaDocument3 pagesExercícios Química AnalíticajohnnylarahNo ratings yet
- Lista Vol PrecipitacaoDocument2 pagesLista Vol PrecipitacaoWelma LimaNo ratings yet
- Exercícios de VolumetriaDocument1 pageExercícios de VolumetriaFabiano VitorNo ratings yet
- Titulação de complexos com EDTADocument2 pagesTitulação de complexos com EDTARenato Miani Gonçalves100% (2)
- Volumetria precipitação química exercíciosDocument1 pageVolumetria precipitação química exercíciosVictor CarvalhoNo ratings yet
- Química Analítica Quantitativa: Lista de Exercícios Volumetria PrecipitaçãoDocument4 pagesQuímica Analítica Quantitativa: Lista de Exercícios Volumetria PrecipitaçãoAndressa BarcellosNo ratings yet
- Volumetria de complexação com EDTA para determinação de concentrações de soluçõesDocument18 pagesVolumetria de complexação com EDTA para determinação de concentrações de soluçõesPaulo Victor Souza100% (1)
- Padronização de NH4SCNDocument4 pagesPadronização de NH4SCNjapinhaquimicaNo ratings yet
- Relatório 04 - Volumetria Por PrecipitaçãoDocument9 pagesRelatório 04 - Volumetria Por PrecipitaçãoLucas ManuelNo ratings yet
- 2a Lista QAGDocument5 pages2a Lista QAGTata VieiraNo ratings yet
- Volumetria de Precipitação: Cálculos de Solubilidade e Titulação com PrataDocument5 pagesVolumetria de Precipitação: Cálculos de Solubilidade e Titulação com PrataDaniel FreitasNo ratings yet
- Lista VolumetriadeoxidacaoreducaoDocument3 pagesLista VolumetriadeoxidacaoreducaoMateus SantosNo ratings yet
- 1538812-Lista de GravimetriaDocument2 pages1538812-Lista de GravimetriaMax HolandaNo ratings yet
- Cap Exercicios NeutralizacaoDocument10 pagesCap Exercicios NeutralizacaoAngelique ViannyNo ratings yet
- Exercícios Tampão e Titulação Ácido-BaseDocument2 pagesExercícios Tampão e Titulação Ácido-BaseSilvio MarinhoNo ratings yet
- 5 Lista de Exercícios QA IIDocument2 pages5 Lista de Exercícios QA IIliviasavignonNo ratings yet
- Lista de Volumetria de Oxi - SkoogDocument1 pageLista de Volumetria de Oxi - SkoogShâmara Stéfany Guimarães100% (2)
- Determinação de cloreto em soro fisiológicoDocument7 pagesDeterminação de cloreto em soro fisiológicoFlavio SousaNo ratings yet
- Titulações Complexométricas com EDTADocument3 pagesTitulações Complexométricas com EDTADiogo FevereiroNo ratings yet
- Lista de Exercicios - Volumetria Precipitacao GABARITODocument4 pagesLista de Exercicios - Volumetria Precipitacao GABARITOVitorNoviicNo ratings yet
- Prática - 06 - QUI137 - Síntese - e - Caracterização - de - (Cu (NH3) 4) SO4.H2ODocument3 pagesPrática - 06 - QUI137 - Síntese - e - Caracterização - de - (Cu (NH3) 4) SO4.H2OajrbaptistaNo ratings yet
- Determinação do teor de NaClO e cloro ativo em água sanitária por iodometriaDocument6 pagesDeterminação do teor de NaClO e cloro ativo em água sanitária por iodometriaSamuel AguiarNo ratings yet
- Aula 7 Volumetria de Complexação 2012.2Document38 pagesAula 7 Volumetria de Complexação 2012.2Robson RaduanNo ratings yet
- Determinação de Cloreto de Sódio em Soro FisiológicoDocument18 pagesDeterminação de Cloreto de Sódio em Soro FisiológicoEvelynSchweitzerNo ratings yet
- Lista Complexação 2017-02Document2 pagesLista Complexação 2017-02jnfjjunior0% (1)
- listaQAII exerIVDocument2 pageslistaQAII exerIVFelipe Felix100% (1)
- Padronização de soluções de NaOH e HCl por titulaçãoDocument11 pagesPadronização de soluções de NaOH e HCl por titulaçãodailtonddNo ratings yet
- Determinação de ácido ascórbico e cobre por iodometriaDocument2 pagesDeterminação de ácido ascórbico e cobre por iodometriaRaiana Canzian LimaNo ratings yet
- Lista Métodos Gravimétricos de AnáliseDocument2 pagesLista Métodos Gravimétricos de AnáliseRodrigo Siqueira Melo50% (2)
- Determinação de cloreto em soro fisiológico por titulação argênticaDocument5 pagesDeterminação de cloreto em soro fisiológico por titulação argênticadaniNo ratings yet
- Relatório 3 - Marcha AnalíticaDocument8 pagesRelatório 3 - Marcha AnalíticaLailaFerreiraNo ratings yet
- Volumetria de Precipitação - Método de Mohr (Relatório) 2.0Document5 pagesVolumetria de Precipitação - Método de Mohr (Relatório) 2.0Victor CarvalhoNo ratings yet
- Diacetato de Hidroquinona.Document8 pagesDiacetato de Hidroquinona.Guilherme Zulim0% (1)
- Relatório - Volumetria de ComplexaçãoDocument5 pagesRelatório - Volumetria de ComplexaçãoliancarlaNo ratings yet
- Determinação de concentração por titulaçãoDocument7 pagesDeterminação de concentração por titulaçãoNatália RodriguesNo ratings yet
- Determinação de cloreto de sódio por métodos volumetricosDocument2 pagesDeterminação de cloreto de sódio por métodos volumetricosJuliane Froncheti de MouraNo ratings yet
- Dosagem de Amônia em Um Sal de AmônioDocument13 pagesDosagem de Amônia em Um Sal de AmônioMariNo ratings yet
- Reações do alumínio com ácidos e basesDocument3 pagesReações do alumínio com ácidos e basesCamila Nascimento100% (1)
- 2011 Roteiro de Estudos 05 - OxidoreduçãoDocument7 pages2011 Roteiro de Estudos 05 - OxidoreduçãoVanessa SantosNo ratings yet
- Dureza Da Água e Padronização de EDTADocument5 pagesDureza Da Água e Padronização de EDTAJean MarcioliNo ratings yet
- 4a ListaDocument4 pages4a ListaVictor DiasNo ratings yet
- Determinação de Nitrito em Água da UNOESTEDocument14 pagesDeterminação de Nitrito em Água da UNOESTEJulianoNo ratings yet
- Modelo de Relatório Volumetria de NeutralizaçãoDocument6 pagesModelo de Relatório Volumetria de NeutralizaçãoRonaldo Guilherme100% (1)
- Determinação do teor de ácido acético do vinagreDocument8 pagesDeterminação do teor de ácido acético do vinagrethalita santos alvesNo ratings yet
- Obtenção de cloreto de terc-butila por SN1Document7 pagesObtenção de cloreto de terc-butila por SN1Aline Ornelas100% (1)
- 06a QUESTÕES E PROBLEMASDocument3 pages06a QUESTÕES E PROBLEMASThaís AraújoNo ratings yet
- Determinação Do Teor de Carbonato e Hidróxido em Uma Amostra de Soda CáusticaDocument7 pagesDeterminação Do Teor de Carbonato e Hidróxido em Uma Amostra de Soda CáusticaEmílioDosSantos0% (1)
- 2016-Exercícios de OxiDocument4 pages2016-Exercícios de OxiAugusto TanamatiNo ratings yet
- Reações Orgânicas de Oxidação e Redução - SLIDESDocument36 pagesReações Orgânicas de Oxidação e Redução - SLIDESAndré Mauricio De Oliveira100% (1)
- Reações de Substituição - 2 Parte - SLIDESDocument25 pagesReações de Substituição - 2 Parte - SLIDESAndré Mauricio De OliveiraNo ratings yet
- Isomeria Geométrica - SLIDESDocument14 pagesIsomeria Geométrica - SLIDESAndré Mauricio De OliveiraNo ratings yet
- Aminas, Amidas e Nitrocompostos - SLIDESDocument22 pagesAminas, Amidas e Nitrocompostos - SLIDESAndré Mauricio De OliveiraNo ratings yet
- Reações de Adição QuímicaDocument15 pagesReações de Adição QuímicaAndré Mauricio De OliveiraNo ratings yet
- Aldeídos e Cetonas - SLIDESDocument18 pagesAldeídos e Cetonas - SLIDESAndré Mauricio De OliveiraNo ratings yet
- Introdução Às Reações Orgânicas - SLIDESDocument15 pagesIntrodução Às Reações Orgânicas - SLIDESAndré Mauricio De OliveiraNo ratings yet
- Reações de Substituição - 1 Parte - SLIDESDocument16 pagesReações de Substituição - 1 Parte - SLIDESAndré Mauricio De OliveiraNo ratings yet
- Reações de Adição - 2 Parte - SLIDESDocument12 pagesReações de Adição - 2 Parte - SLIDESAndré Mauricio De OliveiraNo ratings yet
- Isomeria Ótica - SLIDESDocument20 pagesIsomeria Ótica - SLIDESAndré Mauricio De OliveiraNo ratings yet
- Isomeria plana: tipos e exemplosDocument21 pagesIsomeria plana: tipos e exemplosAndré Mauricio De OliveiraNo ratings yet
- Álcoois, Éteres e Fenóis - SLIDESDocument19 pagesÁlcoois, Éteres e Fenóis - SLIDESAndré Mauricio De OliveiraNo ratings yet
- Ácidos carboxílicos, sais e ésteres: nomenclatura e propriedadesDocument20 pagesÁcidos carboxílicos, sais e ésteres: nomenclatura e propriedadesAndré Mauricio De OliveiraNo ratings yet
- Identificação de Funções Orgânicas - SLIDEDocument20 pagesIdentificação de Funções Orgânicas - SLIDEAndré Mauricio De Oliveira100% (1)
- Alcanos, Cicloalcanos, Alcenos e Alcinos - SLIDESDocument29 pagesAlcanos, Cicloalcanos, Alcenos e Alcinos - SLIDESAndré Mauricio De OliveiraNo ratings yet
- Classificação de Cadeias Carbônicas - SLIDEDocument24 pagesClassificação de Cadeias Carbônicas - SLIDEAndré Mauricio De OliveiraNo ratings yet
- Hidrocarbonetos Aromáticos - SLIDESDocument14 pagesHidrocarbonetos Aromáticos - SLIDESAndré Mauricio De OliveiraNo ratings yet
- Introdução à Química OrgânicaDocument25 pagesIntrodução à Química OrgânicaAndré Mauricio De OliveiraNo ratings yet
- Arrumação PDFDocument2 pagesArrumação PDFAndré Mauricio De OliveiraNo ratings yet
- Introdução aos processos químicos industriaisDocument42 pagesIntrodução aos processos químicos industriaisAndré Mauricio De OliveiraNo ratings yet
- Exercicios Eletroquimica - Sem GabaritoDocument10 pagesExercicios Eletroquimica - Sem GabaritoAndré Mauricio De OliveiraNo ratings yet
- Partitura Tira Poeira Satyro Bilhar 46 PDFDocument2 pagesPartitura Tira Poeira Satyro Bilhar 46 PDFAndré Mauricio De OliveiraNo ratings yet
- Lista de Exercícios 3 - Produção Da AguardenteDocument1 pageLista de Exercícios 3 - Produção Da AguardenteAndré Mauricio De OliveiraNo ratings yet
- Estudo #1 - 2018Document1 pageEstudo #1 - 2018André Mauricio De OliveiraNo ratings yet
- Lei de Beer em CrCl3Document4 pagesLei de Beer em CrCl3André Mauricio De OliveiraNo ratings yet
- Herois (Partitura)Document1 pageHerois (Partitura)André Mauricio De OliveiraNo ratings yet
- CEFET-MG Lista de Exercícios de CorrosãoDocument2 pagesCEFET-MG Lista de Exercícios de CorrosãoAndré Mauricio De OliveiraNo ratings yet
- Solubilidade e Produto de SolubilidadeDocument5 pagesSolubilidade e Produto de SolubilidadeAndré Mauricio De OliveiraNo ratings yet
- Cinética de Corrosão, Polarização e PassivaçãoDocument3 pagesCinética de Corrosão, Polarização e PassivaçãoAndré Mauricio De OliveiraNo ratings yet
- Hist da Quím Anal desde Antigüid até HojeDocument3 pagesHist da Quím Anal desde Antigüid até HojeIzabelleNo ratings yet
- Aula21 Quimica1 Exercícios PDFDocument4 pagesAula21 Quimica1 Exercícios PDFBRAZILIAN JOKERNo ratings yet
- Relatorio de Química Geral - Preparo de Soluções e Determinação de PH Qualitativo e Quantitativo (Titulação)Document5 pagesRelatorio de Química Geral - Preparo de Soluções e Determinação de PH Qualitativo e Quantitativo (Titulação)Danielle CristineNo ratings yet
- MetodologiaDocument5 pagesMetodologiaThalita SantosNo ratings yet
- História das Teorias Ácido-Base no Século XXDocument3 pagesHistória das Teorias Ácido-Base no Século XXWesley OliveiraNo ratings yet
- Aula Prática de Funções Inorgânicas: Caráter Ácido e BásicoDocument6 pagesAula Prática de Funções Inorgânicas: Caráter Ácido e BásicoMarcus TolentinoNo ratings yet
- Determinação do teor de vitamina C em comprimidosDocument6 pagesDeterminação do teor de vitamina C em comprimidosVinicius SimaoNo ratings yet
- Activi 5 Q A I Gravimetria e TitulacaoDocument8 pagesActivi 5 Q A I Gravimetria e TitulacaoNell's BalateNo ratings yet
- Equilíbrio Químico - Brasil EscolaDocument31 pagesEquilíbrio Químico - Brasil EscolaRodrigo Silva e SilvaNo ratings yet
- Lista de Exercicios - Volumetria PrecipitacaoDocument3 pagesLista de Exercicios - Volumetria PrecipitacaoVitorNoviicNo ratings yet
- Novo 11Q NL (Teste2 CC) Abr.2019Document3 pagesNovo 11Q NL (Teste2 CC) Abr.2019Rui SantosNo ratings yet
- Prática 9 - Reações de Precipitação, Complexação e OxirreduçãoDocument3 pagesPrática 9 - Reações de Precipitação, Complexação e OxirreduçãoKelle GomesNo ratings yet
- Volumetria - NeutralizaçãoDocument5 pagesVolumetria - NeutralizaçãoRita de CassiaNo ratings yet
- Exercícios Química SoluçõesDocument9 pagesExercícios Química Soluçõesgilliane santosNo ratings yet
- pH de Soluções AquosasDocument34 pagespH de Soluções AquosasEcas UnicornNo ratings yet
- Relatório 5 PDFDocument13 pagesRelatório 5 PDFNielsen FonsecaNo ratings yet
- Titulação de aminoácido tripróticoDocument3 pagesTitulação de aminoácido tripróticoJunior CastagnolliNo ratings yet
- Equilíbrio Químico Lista ExercíciosDocument3 pagesEquilíbrio Químico Lista ExercíciosCarlos HenriqueNo ratings yet
- Apostila - IQA243Document50 pagesApostila - IQA243maria beatrizNo ratings yet
- Soluções tampão: relação A/D, quantidade e diluiçãoDocument4 pagesSoluções tampão: relação A/D, quantidade e diluiçãoKenia Lutiele MirandaNo ratings yet
- Lista de ExercíciosDocument3 pagesLista de ExercíciosThalita AzevedoNo ratings yet
- AAS Por Eletroforese Capilar - CEDocument7 pagesAAS Por Eletroforese Capilar - CEJessica ReimbergNo ratings yet
- Relatório Bioquímica - Neutralização Da GlicinaDocument5 pagesRelatório Bioquímica - Neutralização Da GlicinaDébora Raíssa Marçal100% (1)
- Determinação da dureza da águaDocument2 pagesDeterminação da dureza da águaRaony FonsecaNo ratings yet
- 3 Lista de Exercícios QAMinDocument2 pages3 Lista de Exercícios QAMinCarlosHerlânioNo ratings yet
- Ácidos e Bases Química GeralDocument18 pagesÁcidos e Bases Química GeralTi FerpNo ratings yet
- Resultados e DiscussõesDocument2 pagesResultados e DiscussõesValentina CodognotoNo ratings yet