Professional Documents
Culture Documents
Balance Termico y Entropia Informe
Uploaded by
trementineroCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Balance Termico y Entropia Informe
Uploaded by
trementineroCopyright:
Available Formats
BALANCE TRMICO Y ENTROPA
Isaac David Campuzano, Estefany Daz, Mara Florencia Martnez, yeseris
villa lpez.
Universidad De Crdoba.
Facultad de ingenieras.
Programa De Ingeniera De Alimentos.
RESUMEN.
Todos los procesos reales son irreversibles. Se producen a una velocidad
con diferencias finitas de temperatura y de presin entre las diferentes
partes de un sistema o entre un sistema y el medio ambiente. En mecnica
se introducen los conceptos de energa, cantidad de movimiento y otros
porque se conservan. La entropa no se conserva, sin embargo, excepto en
los procesos reversibles y esta propiedad no familiar, o falta de propiedad
de la funcin entropa, es una razn del porque existe cierto misterio sobre
el concepto de entropa. Cuando se mezcla un vaso de agua caliente con uno
de agua fra, el calor entregado por el agua caliente es igual al recibido por
el agua fra, sin embargo la entropa del agua caliente disminuye y la del
agua fra aumenta; pero el aumento es mayor que la disminucin por lo que la
entropa total del sistema aumenta.
ABSTRAB.
All real processes are irreversible. Occurs at a speed of finite differences
in temperature and pressure between the different parts of a system or
between the system and the environment. In mechanics introduces the
concepts of energy, momentum and others because they are preserved.
Entropy is not conserved, however, except for reversible processes and
this property is not familiar, or lack of ownership of the entropy function,
is one reason why there is some mystery about the concept of entropy.
When mixed hot water glass with one of cold water, the heat delivered by
the hot water is equal to that received by the cold water, but hot water
entropy decreases and increases cold water, but the increase is greater
the decrease so the total entropy of the system increases.
INTRODUCCIN
La importancia de la tercera ley es
evidente. Suministra una base para
el clculo de las entropas
absolutas de las sustancias, las
cuales pueden utilizarse en las
ecuaciones apropiadas para
determinar la direccin de las
reacciones qumicas.
La ley cero estableci lo que fue la
temperatura del sistema, la
primera ley de la energa y la
segunda ley de la entropa.
La entropa est relacionada con la
aleatoriedad del movimiento
molecular (energa trmica), por
esto, la entropa de un sistema no
decrece si no hay cierta
interaccin externa. Ocurre que la
nica manera que el hombre
conoce de reducir la energa
trmica es transferirla en forma
de calor a otro cuerpo,
aumentando as la energa trmica
del segundo cuerpo y por ende su
entropa.
La entropa es entonces una
caracterstica de una propiedad de
estado que la suma de los cambios
de esa propiedad en un ciclo es
cero. Es decir, la entropa es una
magnitud fsica que mide la parte
de la energa que no puede
utilizarse para producir trabajo.
La entropa, como todas las
variables de estado, depende slo
de los estados del sistema, y
debemos estar preparados para
calcular el cambio en la entropa
de procesos irreversibles,
conociendo slo los estados de
principio y al fin.
En la siguiente prctica
aplicaremos los conceptos ya
conocidos para calcular la entropa
a distintas sustancias como la
leche y el agua, de igual forma
calcular la entropa total del
sistema.
OBJETIVOS
Comprender el concepto de
entropa
Relacionar ciertas leyes
termodinmicas con sistemas
reales
Determinar la variacin de
entropa en un proceso
reversible.
MATERIALES Y REACTIVOS
Calormetro.
Balanza Analtica.
Agitador.
Termmetro.
Beakers.
Probeta.
Estufa.
Nctar.
Agua Destilada.
PROCEDIMIENTO
Medir 100ml de agua
destilada.
Adicionar en el calormetro.
Medir la temperatura
inicial del agua.
Medir otros 100ml de agua.
Calentar el agua durante un
tiempo moderado hasta
80C sin permitir que llegue
a la temperatura de
ebullicin.
Medir la temperatura del
agua caliente.
Retirar la tapa del
calormetro y verter el agua
caliente sobre el agua fra.
Colocar la tapa tan rpido
como sea posible y realizar
las lecturas de temperatura
cada 30 segundos hasta que
sea constante.
Calibrar el calormetro.
Medir 100ml de agua
destilada.
Adicionar en el calormetro.
Medir la temperatura
inicial del agua.
Pesar 80g de nctar.
Calentar el nctar durante
un tiempo moderado hasta
80C sin permitir que llegue
a la temperatura de
ebullicin.
Medir la temperatura del
nctar caliente.
Retirar la tapa del
calormetro y verter el
nctar sobre el agua fra.
Colocar la tapa tan rpido
como sea posible y realizar
las lecturas de temperatura
cada 30 segundos hasta que
sea constante.
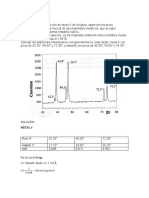
RESULTADOS
Calibracin del calormetro
Clculo de entropa
NOTA:
CALCULO DE LA ENTROPA
( ) (
) (
)
() (
) (
)
La entropa calculada de manera
experimental nos da a pensar que
el material o dispositivo en el cual
se realiz la mezcla era
totalmente aislado debido a que el
valor de la entropa arrojo un valor
mayor o igual a cero, lo que quiere
decir que la entropa de los
alrededores no tuvo mayor efecto
en la entropa del sistema.
Para determinar la temperatura de
equilibrio.
( ) (
) () () (
) ()
() (
) ( ) (
ANLISIS DE RESULTADOS
A partir de los resultados
obtenidos en esa prctica podemos
decir que si dos sistemas poseen
distintas temperaturas, el flujo de
calor se presenta de mayor a
menor temperatura. Los sistemas
se pueden interpretar como
fuente de calor balance trmico
exigen que el calor que se pierde
ser igual al que se gana. Para un
proceso en donde la presin es
constante (isobrico), el calor
transferido durante el cambio de
estado es equivalente al cambio de
entalpa; teniendo en cuenta que el
cambio de entalpa est
relacionado con el cambio de la
temperatura.
La entropa, como todas las
variables de estado, dependen
nicamente de los estados del
sistema, y por ello debimos usar en
la practica un sistema isobrico, y
de esta manera buenos resultados
al calcular el cambio en la entropa
de procesos.
CUESTIONARIO
1. Compare el valor de la
temperatura de equilibrio
despejado de la ecuacin (1)
con el obtenido
experimentalmente y seale
sus conclusiones.
(
(
)
(
( )
)
Lo cual indica que no hubo mucha
diferencia entre la temperatura
hallada por la ecuacin y la
temperatura experimental por lo
que el margen de y en este caso
las condiciones del error es
mnimo.
2. Por qu no es posible calcular
le entropa mxima de un
sistema?
Se dice que un sistema
altamente distribuido al azar
tiene alta entropa. Puesto que
un sistema en una condicin
improbable tendr una
tendencia natural a
reorganizarse a una condicin
ms probable (similar a una
distribucin al azar), esta
reorganizacin resultar en un
aumento de la entropa. La
entropa alcanzar un mximo
cuando el sistema se acerque al
equilibrio, alcanzndose la
configuracin de mayor
probabilidad.
Cuando la entropa es mxima,
esto es, que existe un equilibrio
entre todas las temperaturas y
presiones, es decir que habr
una muerte trmica del sistema
(enunciado por Clausius). Toda
la energa se encontrar en
forma de calor y no podrn
darse transformaciones
energticas; es por esto que no
es posible encontrar la entropa
mxima de un sistema.
3. Consulte si existe un
instrumento para medir la
variacin de entropa de un
sistema e indique como
funciona.
Para poder conocer ms sobre
el concepto de entropa se
necesita un instrumento de
medida, ste existe y se
conoce con el nombre de
entropmetro.
Se llamar entropmetro al
aparato que consta de una
sonda que se introduce a una
muestra y un indicador que
entrega una lectura en una
escala, como si se tratara de un
termmetro. El interior de un
entropmetro es ms
complicado que el de un simple
termmetro de mercurio. La
sonda consta de un calentador
(controlado por el mismo
aparato) y un termmetro (que
tambin est controlado). El
microprocesador est
programado para calcular la
dependencia entre la
temperatura de la muestra y la
energa por el mecanismo calor
cedida por el calentador. La
lectura que aparece en el
indicador es el cambio de
entropa de la muestra entre la
temperatura inicial y la
temperatura final.
4. Investigue la aplicacin de le
entropa en la ingeniera de
alimentos.
La entropa es necesaria en
muchos campos de la ciencia,
pero en la ingeniera de
alimentos cumple un papel muy
importante ya que para que un
proceso como los que se llevan
a cabo en la industria de
alimentos sea eficaz sta debe
estar en proporciones mnimas
y de esta manera hacer que el
proceso sea ms productivo en
cuanto a que la energa que no
realiza trabajo va a ser mnima.
5. Calcule la entropa con la
temperatura de equilibrio por
formula y halle el margen de
error.
R/ la Te hallado por formula es:
46C (mirar los clculos).
Te=46+273,15= 319,15K
() (
) (
)
() (
) (
)
%Error=( (0,98+(-1,84))/0,98)*100
%Error= -87,7%
CONCLUSIONES
Una vez realizada la prctica de
entropa podemos concluir que
Es posible calcular la entropa de
un sistema a nivel de laboratorio,
pero hay que tener cuidado a la
hora de escoger el calormetro y
en la manipulacin de este, ya que
al estar este mal manipulado
afecta drsticamente el resultado
obtenido como es el caso de
nuestro resultado.
En esta prctica observamos la
relacin del balance trmico en la
mezcla de dos sistemas que se
encuentran a distintas
temperaturas que nos ayudaron a
determinar el cambio de entropa.
BIBLIOGRAFA
VAN NESS SMITH, Abbot.
Introduccin a la termodinmica
en la ingeniera qumica. Mxico.
Mc Graw Hill, 1997.
Cengel, y; Boles, M.A.(1996)
termodinmica, Tomo I segunda
edicin. Mc Graw Hill
interamericana de Mxico, S.A. de
Mxico.
You might also like
- Informe 7 BALANCE TÉRMICO Y ENTROPÍADocument14 pagesInforme 7 BALANCE TÉRMICO Y ENTROPÍASergio Luis Rivero TrujilloNo ratings yet
- Informe 2Document14 pagesInforme 2adelina hernandezNo ratings yet
- Propiedades y compuestos del grupo 15Document37 pagesPropiedades y compuestos del grupo 15ErikaRubioloNo ratings yet
- Balance Termico y Entropia#8Document13 pagesBalance Termico y Entropia#8Ceballos Peña KlarenaNo ratings yet
- Termodinamica 3Document8 pagesTermodinamica 3luis kun100% (1)
- Labo 2 QMC 1400 A PDFDocument21 pagesLabo 2 QMC 1400 A PDFHarold Cesar Gabriel Herrera100% (1)
- Capitulo Xi RefractometriaDocument18 pagesCapitulo Xi RefractometriaJosé Enrique Jurado MenesesNo ratings yet
- Determinación de Hidrógeno Sustituible en Un ÁcidoDocument14 pagesDeterminación de Hidrógeno Sustituible en Un ÁcidoJavier Mercado DiazNo ratings yet
- TAREA 6 CinéticaDocument14 pagesTAREA 6 CinéticaManuel CortezNo ratings yet
- (QO2) Práctica 2 - Síntesis de Anaranjado de MetiloDocument5 pages(QO2) Práctica 2 - Síntesis de Anaranjado de MetiloYomara CollaguazoNo ratings yet
- Esta Di SticaDocument3 pagesEsta Di SticaRafael Angel Mamani DiazNo ratings yet
- Serie 3 Equilibrio Quimico 4540Document2 pagesSerie 3 Equilibrio Quimico 4540Yassel4No ratings yet
- Texto3 EstDescDocument17 pagesTexto3 EstDescGustavo Manosalva HornaNo ratings yet
- Practica #5Document4 pagesPractica #5Niel MaldonadoNo ratings yet
- 8 - IR - FundamentosDocument21 pages8 - IR - Fundamentosdavid barretoNo ratings yet
- Lab#3, QMC 1400, Ninatito, ReizaDocument8 pagesLab#3, QMC 1400, Ninatito, ReizaMâśüļ Řêîżâ Ńìńà ŤìťôNo ratings yet
- Practica 7 Lab de FisicoquimicaDocument19 pagesPractica 7 Lab de FisicoquimicaWendy Guaman MendozaNo ratings yet
- Justificación Del 3 ParcialDocument3 pagesJustificación Del 3 Parcialfrancy riveraNo ratings yet
- Informe 2 Fisico Quimica Unmsm TermoquimicaDocument16 pagesInforme 2 Fisico Quimica Unmsm TermoquimicaTony ChavezNo ratings yet
- Parcial 2Document2 pagesParcial 2Ricardo Castro0% (1)
- Problemario #2 GVDMDocument9 pagesProblemario #2 GVDMMonse González ValenciaNo ratings yet
- Practica 10 QuimicaDocument7 pagesPractica 10 QuimicaedwinNo ratings yet
- Guia de Lab SolucionesDocument7 pagesGuia de Lab SolucionesSofia UrregoNo ratings yet
- Informe Analitica de Hierro en FertilizanteDocument6 pagesInforme Analitica de Hierro en FertilizanteDani BerrioNo ratings yet
- Verificación experimental de la Ley de OhmDocument12 pagesVerificación experimental de la Ley de OhmEduardo Sejas O.No ratings yet
- PRACTICA No 2 QuimiometriaDocument15 pagesPRACTICA No 2 QuimiometriaDANIELA NERI FABIANI CONTRERAS100% (1)
- Practica 1. LTEFDocument17 pagesPractica 1. LTEFFernanda ToscanoNo ratings yet
- Determinacion Del Coeficiente de Solubilidad de Una Sal AnhidraDocument5 pagesDeterminacion Del Coeficiente de Solubilidad de Una Sal AnhidraCarlosSusulPeñaMaGañaNo ratings yet
- Presentacion TermoquimicaDocument49 pagesPresentacion TermoquimicaAlfredo Sánchez100% (1)
- Solucion Problemas Tema 2Document25 pagesSolucion Problemas Tema 2Futsal RealityNo ratings yet
- Momento1 Grupo 12Document25 pagesMomento1 Grupo 12TCOAndres15 xNo ratings yet
- El método del árbol de síntesis para el diseño de rutas sintéticasDocument68 pagesEl método del árbol de síntesis para el diseño de rutas sintéticasGarcía Nuñez SergioNo ratings yet
- Taller Ternodinamica TERMINADODocument11 pagesTaller Ternodinamica TERMINADOyublian orozcoNo ratings yet
- Espectroscopiaelectronica 11898Document67 pagesEspectroscopiaelectronica 11898anon_285163627No ratings yet
- Calorimetria AleDocument16 pagesCalorimetria Aleale maldonadoNo ratings yet
- Elementos de transición externos: características y usosDocument14 pagesElementos de transición externos: características y usosMauricio Albert Cortez ZelayaNo ratings yet
- Balance de masa en química generalDocument15 pagesBalance de masa en química generalEdith RamosNo ratings yet
- Examen Quimica AnaliticaDocument7 pagesExamen Quimica AnaliticaDaniela OrtegaNo ratings yet
- Volumetría RedoxDocument21 pagesVolumetría RedoxMelanie De los RíosNo ratings yet
- Tarea de Rayos XDocument2 pagesTarea de Rayos XGRANDEZ WONG FRANKNo ratings yet
- HISTORIA de Las Propiedades DielectricasDocument2 pagesHISTORIA de Las Propiedades DielectricasJose Carlos SanchezNo ratings yet
- CRISTALOGRAFIADocument3 pagesCRISTALOGRAFIAGloria SolarteNo ratings yet
- Calidad de Un Transformador PDFDocument1 pageCalidad de Un Transformador PDFJose Armando MartinezNo ratings yet
- INFORME PRÁCTICA 5 Sulfatos (Autoguardado)Document8 pagesINFORME PRÁCTICA 5 Sulfatos (Autoguardado)Jeremy HernandezNo ratings yet
- Cuestionario 2C, GCDocument1 pageCuestionario 2C, GCOmar Sanchez SantosNo ratings yet
- Ejerc. de Aplic. I. FQ. IDocument2 pagesEjerc. de Aplic. I. FQ. IKarol Lancheros CondeNo ratings yet
- Compuestos de Coordinacion.2022-1Document72 pagesCompuestos de Coordinacion.2022-1Jhon Fuentes GallegoNo ratings yet
- Problemas Resueltos para El Segundo ParcialDocument8 pagesProblemas Resueltos para El Segundo ParcialJohann Navarro LópezNo ratings yet
- Termodinamica (Temperatura de Llama)Document25 pagesTermodinamica (Temperatura de Llama)Ronald Cristhian Mamani CopaNo ratings yet
- Actividad y Coeficiente de Actividad de ElectrolitosDocument17 pagesActividad y Coeficiente de Actividad de ElectrolitosDary Man PelaezNo ratings yet
- Efectos fotoeléctrico y ComptonDocument4 pagesEfectos fotoeléctrico y ComptonGUSTAVO ADOLFO ULCHUR SANCHEZNo ratings yet
- INFORME 9 - Elementos P, AS, SB, BiDocument14 pagesINFORME 9 - Elementos P, AS, SB, BiDavid Francisco Benites MillanNo ratings yet
- Respuestas Cap. 20 QuimicaDocument2 pagesRespuestas Cap. 20 QuimicaManuel Alejandro Jojoa BucheliNo ratings yet
- Seminario de FisicoquimicaDocument29 pagesSeminario de FisicoquimicaJosèSebastianZkrasGlindoNo ratings yet
- Problemas de FasesDocument7 pagesProblemas de FasesIván0% (1)
- Practica 1Document4 pagesPractica 1Noemi JhoanNo ratings yet
- Trabajo en Grupo 1Document6 pagesTrabajo en Grupo 1Jennifer BenavidesNo ratings yet
- Entropia (Carlos Córdova y Ricardo Hinrichsen)Document4 pagesEntropia (Carlos Córdova y Ricardo Hinrichsen)aishiteru89No ratings yet
- TERMODINAMICADocument11 pagesTERMODINAMICAelisa butoNo ratings yet
- Unidad 5 TermodinamicaDocument28 pagesUnidad 5 TermodinamicaOswald Higuera FuentesNo ratings yet
- Trabajo CalidadDocument12 pagesTrabajo CalidadtrementineroNo ratings yet
- Lab de BiotecnologiaDocument1 pageLab de BiotecnologiatrementineroNo ratings yet
- Estructura Del Plan de NegociosDocument39 pagesEstructura Del Plan de NegociostrementineroNo ratings yet
- Taller Bacillius CereusDocument3 pagesTaller Bacillius CereustrementineroNo ratings yet
- M. TeoricoDocument2 pagesM. TeoricotrementineroNo ratings yet
- Historia Del BocadilloDocument4 pagesHistoria Del Bocadillotrementinero50% (2)
- Embutidos EscaldadosDocument12 pagesEmbutidos EscaldadosLourdes Jave90% (10)
- AreasDocument8 pagesAreastrementineroNo ratings yet
- Calculo de AreasDocument3 pagesCalculo de AreastrementineroNo ratings yet
- Historia Del BocadilloDocument4 pagesHistoria Del Bocadillotrementinero50% (2)
- Cebada TraducidoDocument6 pagesCebada TraducidotrementineroNo ratings yet
- QDA Traduccion 2Document27 pagesQDA Traduccion 2trementineroNo ratings yet
- MonodDocument28 pagesMonodtrementineroNo ratings yet
- Alimentos TransgénicosDocument3 pagesAlimentos TransgénicostrementineroNo ratings yet
- Info SensorialDocument7 pagesInfo SensorialtrementineroNo ratings yet
- EtnolDocument3 pagesEtnoltrementineroNo ratings yet
- Parte 3Document3 pagesParte 3trementineroNo ratings yet
- Evaporadores Conservacion IDocument12 pagesEvaporadores Conservacion ItrementineroNo ratings yet
- EVAPORADORESDocument9 pagesEVAPORADOREStrementineroNo ratings yet
- Informe de Laboratorio Tamizado de Una Muestra de Arroz PartidoDocument6 pagesInforme de Laboratorio Tamizado de Una Muestra de Arroz PartidotrementineroNo ratings yet
- Alimentos TransgénicosDocument3 pagesAlimentos TransgénicostrementineroNo ratings yet
- Posco Sec HaDocument46 pagesPosco Sec HatrementineroNo ratings yet
- Sacha InchiDocument1 pageSacha InchitrementineroNo ratings yet
- Lab. SedimetnacionDocument7 pagesLab. SedimetnaciontrementineroNo ratings yet
- Rendimiento de Prensado en Frio Soya PDFDocument9 pagesRendimiento de Prensado en Frio Soya PDFNeo GCNo ratings yet
- Rendimiento de Prensado en Frio Soya PDFDocument9 pagesRendimiento de Prensado en Frio Soya PDFNeo GCNo ratings yet
- Taller Original TranfeDocument11 pagesTaller Original TranfetrementineroNo ratings yet
- Conceptos de Higiene Y Seguridad IndustrialDocument14 pagesConceptos de Higiene Y Seguridad Industrialrichilv82% (38)
- 1.1 - Agroindustria ColombianaDocument30 pages1.1 - Agroindustria ColombianatrementineroNo ratings yet
- Tarea N°04 Briones Prado Albert JeremyDocument6 pagesTarea N°04 Briones Prado Albert JeremyALBERT JEREMY BRIONES PRADONo ratings yet
- 9 TermodinámicaDocument6 pages9 TermodinámicaSantiago PetrizzoNo ratings yet
- Calentamiento transitorio de placa de aceroDocument8 pagesCalentamiento transitorio de placa de aceroLui Gonzalo Quipe RodríguezNo ratings yet
- Resumen Corte de Gas 1Document44 pagesResumen Corte de Gas 1Vanesa LunaNo ratings yet
- Saladillo H3Document44 pagesSaladillo H3jsilva69No ratings yet
- 8° Prueba InstruimosDocument32 pages8° Prueba InstruimosHanna CortesNo ratings yet
- Estudio experimental de la transferencia de calor y caída de presión de un nanofluido de cobre-agua en un intercambiador de calor de doble tubo horizontalDocument6 pagesEstudio experimental de la transferencia de calor y caída de presión de un nanofluido de cobre-agua en un intercambiador de calor de doble tubo horizontalJason SanchezNo ratings yet
- Esterilización mediante calor y vaporDocument8 pagesEsterilización mediante calor y vaporJinel MendozaNo ratings yet
- bdc6l La Manual PDFDocument15 pagesbdc6l La Manual PDFVitorio AmoresanoNo ratings yet
- Acertijo PDFDocument182 pagesAcertijo PDFAngie Bordoli50% (2)
- Primer Segundo PrincioDocument2 pagesPrimer Segundo PrincioPablo BARANNo ratings yet
- SEMANA 1 EjerciciosDocument11 pagesSEMANA 1 EjerciciosJesus SNo ratings yet
- Calorimetria I TrabajoDocument7 pagesCalorimetria I TrabajoCrystell CoropunaNo ratings yet
- Investigacion de Ciclos TermodinamicosDocument24 pagesInvestigacion de Ciclos TermodinamicosDaniel adair Perez muñozNo ratings yet
- Termodinámica Gases IdealesDocument45 pagesTermodinámica Gases IdealesGoenyi GoenyiNo ratings yet
- Analisis DimensionalDocument2 pagesAnalisis DimensionalshirleyNo ratings yet
- Practica 3 Condiciones Físicas y Ergonomicas en Una PymeDocument71 pagesPractica 3 Condiciones Físicas y Ergonomicas en Una PymeCynthia K. Díaz de LeónNo ratings yet
- Arquitectura BioclimáticaDocument64 pagesArquitectura Bioclimáticaleo3001No ratings yet
- Ensayos de LaboratorioDocument8 pagesEnsayos de LaboratorioAlexSuntaxiNo ratings yet
- Propiedadesquimicas en MinaDocument47 pagesPropiedadesquimicas en MinaCintia GonzálesNo ratings yet
- Análisis dimensionalDocument24 pagesAnálisis dimensionalYuri Cristian Rios Pio75% (8)
- Partes Constituidas de La CalderaDocument10 pagesPartes Constituidas de La CalderaMarcos CarloNo ratings yet
- Vapor sobrecalentado: teoría básica y cálculo de desobrecalentamientoDocument5 pagesVapor sobrecalentado: teoría básica y cálculo de desobrecalentamientoYoissNo ratings yet
- Certificados y propiedades del PP-R para sistemas de tuberíasDocument36 pagesCertificados y propiedades del PP-R para sistemas de tuberíasIván López PavezNo ratings yet
- Energía Geotérmica: Una Fuente Renovable InteriorDocument58 pagesEnergía Geotérmica: Una Fuente Renovable Interiorgeologia1976No ratings yet
- Fundamentos de Transferencia de CalorDocument10 pagesFundamentos de Transferencia de CalorisabellaNo ratings yet
- Taller Final Cinética QuímicaDocument91 pagesTaller Final Cinética QuímicaCRISTANCHO TORRES AURA CAMILANo ratings yet
- Preguntas Fomento EspanolDocument17 pagesPreguntas Fomento Espanoljab_vegaNo ratings yet
- Anestesia en Cirugia de Control de DañosDocument45 pagesAnestesia en Cirugia de Control de DañosFilippo Chimento VilaróNo ratings yet