Professional Documents
Culture Documents
Titulometria Acido Base PDF
Uploaded by
RafaelAmorimOriginal Description:
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Titulometria Acido Base PDF
Uploaded by
RafaelAmorimCopyright:
Available Formats
06/10/2014
Qumica Analtica
Titulometria cido-base
Prof. Dr. Andr Gustavo Ribeiro Mendona
Qumica Analtica
Equilbrio cido-base: reviso
Calcular o pH das solues:
i) cido clordrico 0,10 mol L-1
ii) cido actico 0,10 mol L-1
iii) Amnia 0,10 mol L-1
iv) Acetato de sdio 0,15 mol L-1
v) cido actico 0,10 mol L-1 + acetato de sdio 0,15 mol L-1
Dados: Ka cido actico = 1,8 x 10-5
Kb amnia = 1,8 x 10-5
06/10/2014
Equilbrio cido-base: reviso
Calcular o pH das solues:
i) cido clordrico 0,10 mol L-1
ii) cido actico 0,10 mol L-1
iii) Amnia 0,10 mol L-1
cido forte (1,00)
cido fraco (2,87)
base fraca (11,13)
iv) Acetato de sdio 0,15 mol L-1
sal bsico (hidrlise!) (8,96)
v) cido actico 0,10 mol L-1 + acetato de sdio 0,15 mol L-1
tampo (4,92)
Titulometria cido-base: indicadores
Utilizao: deteco do ponto final das titulaes
Indicadores cido-base: so cidos ou bases
orgnicas
fracas,
que
possuem
coloraes
diferentes dependendo da forma (cida ou bsica).
Indicadores cidos:
HIn
(forma cida: cor A)
H+ + In(forma bsica: cor B)
06/10/2014
Titulometria cido-base: indicadores
...se a reao mostrada de um cido fraco, temos
um K associado:
Ka
H 3O In
HIn
H 3O
Ka
HIn
In
Indicadores cido-base: O olho humano no muito
sensvel diferena de cores em uma soluo contendo
uma mistura de HIn e In- quando a razo [HIn]/[In-] for
maior que 10 e menor que 0,1.
Titulometria cido-base: indicadores
Dessa forma, temos os limiares de uso dos indicadores:
Cor cida
HIn 10
[ In ]
Cor bsica
HIn
[ In ]
1
10
Substituindo as razes entre [HIn] / [In-] na expresso
da constante de equilbrio do indicador, temos:
Para um indicador, intervalo de pH = pK 1;
06/10/2014
Titulometria cido-base: indicadores
Por exemplo: indicador com Ka = 1
10-5 (pKa = 5),
possui alterao de cor quando o pH da soluo na qual
estiver dissolvido mudar de 4 para 6.
No entanto, a expresso do intervalo de pH = pK 1
um pouco relativa! Depende do tipo de indicador e do
analista (algumas mudanas de cores so mais
facilmente identificveis).
Titulometria cido-base: indicadores
Dependendo da mudana de pH no PONTO DE
EQUIVALNCIA, o extrato de repolho roxo pode no ser
um bom indicador!
06/10/2014
Titulometria cido-base
Qual o pH no PONTO DE EQUIVALNCIA
das titulaes?
Depende das substncias usadas na titulao:
- cido forte com base forte;
- cido fraco com base forte;
- Base fraca com cido forte.
Titulometria cido-base
pH e curvas de titulao
variao do pH com a adio do titulante
Para construirmos curvas de titulao:
pH antes do pto equivalncia
3 regies de interesse
pH ponto de equivalncia
pH aps o pto equivalncia
06/10/2014
Titulometria cido-base
Curvas de titulao: cido forte com base forte
Ponto de equivalncia pH SEMPRE 7,00
NaOH
Inicialmente: calcular o volume necessrio para
atingir o ponto de equivalncia!
HCl
Titulao de 100,00mL de soluo de cido clordrico 0,100mol L-1
com soluo de NaOH 0,100mol L-1
Qual o volume de NaOH adicionado quando atingir pto
equivalncia?
Titulometria cido-base
Curvas de titulao: cido forte com base forte
HCl (aq) NaOH (aq)
H 2 O (l ) NaCl (aq)
Titulao de 100,00 mL de soluo de cido clordrico 0,100 mol L-1
com soluo de NaOH 0,100 mol L-1
a)
Sem adio de base (Vbase = 0mL)
HCl (aq) H 2 O(l )
0,100mol L-1
H 3O (aq) Cl (aq)
0,100mol L-1
NaOH
0,100mol L-1
pH log[ H 3 O ] log 0 ,100 1 ,00
b)
Volume de NaOH = 10,00mL
[ H 3O ]
[ H 3O ]
excesso HCl (C a Va ) (C b Vb )
Volume Total
Va Vb
( 0 ,100 100 ,00 ) ( 0 ,100 10 ,00 )
8 ,18 10 2 mol L-1
100 ,00 10 ,00
pH log[ H 3 O ] log 8 ,18 10 2 1 ,09
HCl
0,100mol L-1
100,00mL
06/10/2014
Curvas de titulao: cido forte com base forte
c)
Volume de NaOH = 50,00mL
[ H 3O ]
excesso HCl (C a Va ) (Cb Vb )
Volume Total
Va Vb
[ H 3O ]
( 0 ,100 100 ,00 ) ( 0 ,100 50 ,00 )
3 ,33 10 2 mol L-1
100 ,00 50 ,00
pH log[ H 3O ] log 3 ,33 10 1 ,48
d)
NaOH
0,100mol L-1
Volume de NaOH = 99,00mL
[ H 3O ]
( 0 ,100 100 ,00 ) ( 0 ,100 99 ,00 )
5 ,03 10 4 mol L-1
100 ,00 99 ,00
pH log[ H 3O ] log 5 ,03 10 4 3 ,30
HCl
0,100mol L-1
100,00mL
Curvas de titulao: cido forte com base forte
d)
Volume de NaOH = 99,90mL (0,1% antes do ponto de equivalncia 2
gotas)
[ H 3O ]
( 0 ,100 100 ,00 ) ( 0 ,100 99 ,90 )
5 ,00 10 5 mol L-1
100 ,00 99 ,90
pH log[ H 3O ] log 5 ,00 10 4 ,30
e)
Volume de NaOH
EQUIVALNCIA)
100,00mL
H 3O (aq) OH (aq)
NaOH
0,100mol L-1
(PONTO
2H 2 O(l )
HCl
0,100mol L-1
100,00mL
pH log[ H 3O ] log 1 ,00 10 7 7 ,00
06/10/2014
Curvas de titulao: cido forte com base forte
f)
Volume de NaOH = 100,10mL (0,1% aps o ponto de equivalncia 2
gotas)
[OH ]
[ OH ]
excesso NaOH (Cb Vb ) (C a Va )
Volume Total
Va Vb
NaOH
0,100mol L-1
( 0 ,100 100 ,10 ) ( 0 ,100 100 ,00 )
5 ,00 10 5 mol L-1
100 ,00 100 ,10
pOH log[ OH ] log 5 ,00 10 5 4 ,30
pH 14 pOH 14 4 ,30 9 ,70
HCl
0,100mol L-1
100,00mL
Curvas de titulao: cido forte com base forte
g)
Volume de NaOH = 101,00mL
[ OH ]
( 0 ,100 101 ,00 ) ( 0 ,100 100 ,00 )
4 ,98 10 4 mol L-1
100 ,00 101 ,00
NaOH
0,100mol L-1
pOH log[ OH ] log 4 ,98 10 4 3 ,30
pH 14 pOH 14 3 ,30 10 ,70
HCl
0,100mol L-1
100,00mL
06/10/2014
Curvas de titulao: cido forte com base forte
VNaOH
(mL)
pH(a)
pH(b)
pH(c)
0,00
50,00
75,00
90,00
98,00
99,00
99,50
99,80
99,90
100,00
100,10
100,20
100,50
101,00
102,00
110,00
125,00
150,00
200,00
0,00
0,50
0,80
1,30
2,00
2,30
2,60
3,00
3,30
7,00
10,70
11,00
11,40
11,70
12,00
12,70
13,00
13,30
13,50
1,00
1,48
1,80
2,30
3,00
3,30
3,60
4,00
4,30
7,00
9,70
10,00
10,40
10,70
11,00
11,70
12,00
12,30
12,50
2,00
2,50
2,80
3,30
4,00
4,30
4,60
5,00
5,30
7,00
8,70
9,00
9,40
9,70
10,00
10,70
11,00
11,30
11,50
pH
Efeito da concentrao no perfil das curvas
14
14
12
12
10
10
4
HCl 1 mol L
-1
HCl 0,1 mol L
-1
HCl 0,01 mol L
0
0
50
100
150
-1
0
200
Volume de NaOH/mL
(a)
100,00mL de HCl 1,00mol L-1 com NaOH 1,00mol L-1
(b)
100,00mL de HCl 0,100mol L-1 com NaOH 0,100mol L-1
(c)
100,00mL de HCl 0,0100mol L-1 com NaOH 0,0100mol L-1
Curvas de titulao: cido forte com base forte
Curvas de titulao para NaOH com HCl
Curva A: 50,00 mL de NaOH 0,0500 mol L-1 com HCl 0,1000 mol L-1.
Curva B: 50,00 mL de NaOH 0,00500 mol L-1 com HCl 0,0100 mol L-1.
06/10/2014
Curvas de titulao: cido forte com base forte
Efeito da concentrao e a escolha do indicador
12
Curva de titulao de HCl com NaOH
10
Faixa de transio da fenolftaleina
pH
Faixa de transio do azul de bromotimol
6
Faixa de transio do verde de bromocresol
2
-1
-1
50,00 mL HCl 0,0500 mol L com NaOH 0,1000 mol L
-1
-1
50,00 mL HCl 0,000500 mol L com NaOH 0,001000 mol L
0
0
10
15
20
25
30
Volume de NaOH (mL)
Curva de titulao de HCl com NaOH para diferentes concentraes.
Curvas de titulao: cido forte com base forte
Efeito da concentrao e a escolha do indicador
O melhor indicador para uma
titulao aquele que a transio
de cor esteja mais prxima do
ponto de equivalncia, ou seja,
esteja no intervalo perpendicular
da curva de titulao. Assim, a
transio de cor ocorrer de forma
rpida e abrupta...
...do contrrio, a mudana de cor
muito gradual, dificultando a
definio do ponto de viragem!
;;
Consequncia: erro
de titulao
10
06/10/2014
Curvas de titulao: cido forte com base forte
Titulao de 40,00 mL de
HCl 0,100 mol L-1 com
fenolftaleina
NaOH 0,100 mol L-1
pH
Qual indicador escolher?
vermelho de metila
Entre vermelho de metila e
fenolftalena: INDIFERENTE!
Volume de NaOH/mL
Titulometria cido-base
Para as titulaes envolvendo:
- cido fraco com base forte;
- Base fraca com cido forte.
No incio da reao de neutralizao, temos apenas o
titulante e titulado separados fisicamente.
HA(aq) + H2O
BOH(aq) + H2O
A-
(aq)
+ H3O+(aq)
B+ (aq) + OH-(aq)
11
06/10/2014
Titulometria cido-base
Com o avano da reao, a quantidade de titulado vai
diminuindo e seu par conjugado aumentando.
Qual a consequncia
- cido fraco com base forte:
desse avano da reao?
OH-
A-
HA(aq) + H2O
(aq)
Formao de um tampo!
- Base fraca com cido forte:
H+
+ H3O+(aq)
B+ (aq) + OH-(aq)
BOH(aq) + H2O
Titulometria cido-base
...relembrando para que um tampo seja efetivo, a relao
entre as concentraes do cido fraco:base conjugada (ou
da base fraca:cido conjugado) deve ser:
mnimo
1:10
mximo
10:1
Dessa forma, temos determinados intervalos
de atuao do sistema tampo!!!
12
06/10/2014
Equao de Henderson-Hasselbach
Para uma soluo tampo contendo um cido fraco:
pH = pKa + log
[A-]
[HA]
Para uma soluo tampo contendo uma base fraca:
pOH = pKb + log
[HB+]
[B]
Curvas de titulao: base fraca com cido forte
NH 4 OH (aq) HCl(aq)
H 2 O(l ) NH 4Cl (aq)
Titulao de 100,00 mL de soluo de amnia aquosa 0,100 mol L-1
com soluo de HCl 0,100 mol L-1
a)
Sem adio de cido (Vcido = 0mL)
NH 3 (aq) H 2 O(l )
0,100mol L-1 - x
Kb
NH 4 (aq) OH (aq)
x
x
HCl
0,100mol L-1
[ OH ][ NH 4 ]
x x
1 ,76 10 5
[ NH 3 ]
0 ,100 x 0
x 2 K b [ NH 3 ]
x [ OH ] ( 1,76 10 5 ) 0 ,100 1,33 10 3 mol L-1
pOH log[ OH ] log 1 ,33 10 2 ,88
NH4OH
0,100mol L-1
100,00mL
pH 14 pOH 14 2 ,88 11 ,12
13
06/10/2014
Curvas de titulao: base fraca com cido forte
b)
Volume de HCl = 50,00mL
NH 4 (aq) OH (aq)
NH 3 (aq) H 2 O(l )
0,100 mol
H 2 O( l )
NH3 NH4+ TAMPO
HCl ( aq ) H ( aq ) Cl ( aq )
0,100 mol L-1
V = 50,00mL
pH 14 pK b log
[ base ]
[ cido conjugado]
[ base]
Agente Titulante
( C b Vb ) ( C a Va )
Vb Va
( 0 ,100 100 ,00 ) ( 0 ,100 50 ,00 )
3 ,33 10 2 mol L-1
100 ,00 50 ,00
( C a Va ) [ cido conjugada ] ( 0 ,100 50 ,00 ) 3 ,33 10 2 mol L-1
[ cido conjugado ]
100 ,00 50 ,00
V V
[ base ]
pH 14 pK b log
[ cido conjugado]
3 ,33 10 2
14 4 ,75 log
9 ,25
[ base]
3 ,33 10 2
Curvas de titulao: base fraca com cido forte
c)
Volume de HCl = 99,90mL (0,1% antes do ponto de equivalncia)
NH 3 (aq) H 2 O(l )
NH 4 (aq) OH (aq)
0,100 mol
pH 14 pK b log
[ base ]
[ cido conjugado]
[ base]
[ base ]
( C b Vb ) ( C a Va )
Vb Va
( 0 ,100 100 ,00 ) ( 0 ,100 99 ,90 )
5 ,00 10 5 mol L-1
100 ,00 99 ,90
[ cido conjugado ]
[ cido conjugado ]
( C a Va )
Vb Va
Temos um tampo?
( 0 ,100 99 ,90 )
5 ,00 10 2 mol L-1
100 ,00 99 ,90
pH 14 pK b log
[ cido conjugado]
5 ,00 10 2
14 4 ,75 log
6 ,25
[ base]
5 ,00 10 5
14
06/10/2014
Curvas de titulao: base fraca com cido forte
d)
Volume de HCl = 100,00mL (PONTO DE EQUIVALNCIA)
NH 4 OH (aq) HCl(aq)
H 2 O(l ) NH 4 Cl (aq)
NH4 Cl ( aq ) NH4 ( aq ) Cl ( aq )
NH 4 ( aq ) H 2 O ( l ) NH 4 OH ( aq ) H 3 O ( aq )
[ C sal ]
( C a Va )
Va Vb
[ C sal ]
( 0 ,100 100 ,00 )
5 ,00 10 2 mol L-1
100 ,00 100 ,00
(hidrlise cida)
pH 5,28
Curvas de titulao: base fraca com cido forte
e)
Volume de HCl = 100,10mL (0,1% aps o ponto de equivalncia)
[ H 3O ]
[ excesso de HCl] ( Ca Va ) ( Cb Vb )
Volume Total
Vb Va
[ H 3O ]
( 0 ,100 100 ,10 ) ( 0 ,100 100 ,00 )
5 ,00 10 5 mol L-1
100 ,00 100 ,10
pH log[ H 3 O ] log 5 ,00 10 5 4 ,30
f)
Volume de HCl = 101,00mL
[ H 3O ]
[ excesso de HCl] ( Ca Va ) ( Cb Vb )
Volume Total
Vb Va
[ H 3O ]
( 0 ,100 101 ,00 ) ( 0 ,100 100 ,00 )
4 ,98 10 4 mol L-1
100 ,00 101 ,00
pH log[ H 3 O ] log 4 ,98 10 4 3 ,30
15
06/10/2014
Curvas de titulao: base fraca com cido forte
VHCl
(mL)
14
pH(a)
pH(b)
pH(c)
-5
NH3 aquosa, Kb = 1,76 x 10
12
0,00
11,12
12,00
10,00
10,00
10,20
11,95
8,00
50,00
9,25
11,00
7,00
90,00
8,30
10,05
6,10
99,00
7,25
9,01
5,00
99,80
6,55
8,30
4,70
-3
base, Kb = 1 x 10
-7
99,90
6,25
8,00
4,43
100,00
5,28
6,15
4,37
100,10
4,30
4,30
4,30
100,20
4,00
4,00
4,00
101,00
3,30
3,30
3,30
105,00
2,61
2,61
2,61
base, Kb = 1 x 10
10
pH
abc
6
4
2
0
0
20
40
60
80
100
120
140
160
110,00
2,32
2,32
2,32
Volume de HCl/mL
125,00
1,95
1,95
1,95
150,00
1,70
2008
200,00
1,48
1,70
1,70
Efeito da fora da base no
1,48
1,48
180
200
perfil das curvas
cidos poliprticos
...relembrando como calcular o pH do cido fosfrico
(H3PO4)?
H3PO4
H+ + H2PO4-
Ka1 = 7,52 x 10-3
H2PO4-
H+ + HPO42-
Ka2 = 6,23 x 10-8
HPO42-
H+ + PO43-
Ka3 = 4,80 x 10-13
Devemos considerar apenas a [H+] do primeiro equilbrio!
Solues de cidos poliprticos comportam-se como
solues de um cido monoprtico, onde Ka = Ka1
16
06/10/2014
cidos poliprticos
Antes do primeiro ponto de equivalncia: calcular o pH da
soluo de H3PO4 aps reagir com determinada quantidade
de NaOH (equilbrio do cido fraco!)
No primeiro ponto de equivalncia: quais so as espcies em
soluo?
H3PO4 + OH-
H2O + H2PO4-
H2PO4- : uma espcie cida ou bsica?
uma espcie ANFTERA (ou anfiprtica, ou anflita)!
cidos poliprticos
No primeiro ponto de equivalncia:
- H2PO4- reagindo como cido:
H2PO4-
H+ + HPO42-
Ka2 = 6,23 x 10-8
- H2PO4- reagindo como base:
H2PO4- + H2O
H3PO4 + OH-
Kb = ???
Kb = Kw / Ka1
Kb = 1,32 x 10-12
Carter cido ou bsico neste primeiro ponto de equivalncia?
Ka > Kb carter CIDO!
17
06/10/2014
cidos poliprticos
No primeiro ponto de equivalncia: calcular o pH da soluo
pela equao
pH = (pKa1 + pKa2)
pH = (2,12 + 7,21)
pH = 4,66
cidos poliprticos
Antes do SEGUNDO ponto de equivalncia: calcular o pH da
soluo de H2PO4- aps reagir com determinada quantidade
de NaOH (equilbrio do cido fraco!)
No SEGUNDO ponto de equivalncia: quais so as espcies
em soluo?
H2PO4- + OH-
H2O + HPO42-
HPO42- : uma ANFTERA
18
06/10/2014
cidos poliprticos
No SEGUNDO ponto de equivalncia:
- HPO42- reagindo como cido:
HPO42-
H+ + PO43-
Ka3 = 4,80 x 10-13
- HPO42- reagindo como base:
HPO42- + H2O
H2PO4- + OH- Kb = ???
Kb = Kw / Ka2
Kb = 1,61 x 10-7
Carter cido ou bsico neste segundo ponto de equivalncia?
Kb > Ka carter BSICO!
cidos poliprticos
No SEGUNDO ponto de equivalncia: calcular o pH da
soluo pela equao
pH = (pKa2 + pKa3)
pH = (7,21 + 12,68)
pH = 9,94
Aps o SEGUNDO ponto de equivalncia: calcular o pH da
soluo de HPO42- aps reagir com determinada quantidade
de NaOH (equilbrio do cido fraco!)
19
06/10/2014
cidos poliprticos
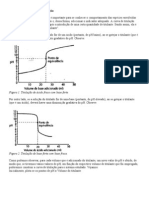
Curva de titulao do cido
fosfrico com base forte
Intervalo do tampo 3
Intervalo do tampo 2
Intervalo do tampo 1
Intervalo tamponante: pH = pKa 1
Bons
estudos!!
20
You might also like
- E-Book AfundoDocument15 pagesE-Book AfundoIrene SantiagoNo ratings yet
- Metrologia - Telecurso 2000Document151 pagesMetrologia - Telecurso 2000Leandro Ricardo100% (2)
- Aula 14 Centrifugacao MCDocument19 pagesAula 14 Centrifugacao MCpamelajessica100% (1)
- Operações Com Soluções TitulaçãoDocument22 pagesOperações Com Soluções TitulaçãoGleison100% (1)
- Exercicios ResolvidosDocument6 pagesExercicios ResolvidosBruno Paccola Meirelles80% (5)
- Razão e ProporçãoDocument5 pagesRazão e ProporçãoPablo MendonçaNo ratings yet
- Manual - Draft SurveyDocument76 pagesManual - Draft SurveyPaulo Ricardo88% (8)
- FPS 30 - Organização Do Estaleiro Ed02Document3 pagesFPS 30 - Organização Do Estaleiro Ed02cegoliveira100% (1)
- Aula 3 PeneiramentoDocument26 pagesAula 3 Peneiramentobarbosera100% (1)
- Memorial Descritivo Das Medidas de Segurança Contra Incêndio e PânicoDocument9 pagesMemorial Descritivo Das Medidas de Segurança Contra Incêndio e PânicoAlexandre OliveiraNo ratings yet
- Aula 3 Volumetria de Neutralização Parte II 2012Document35 pagesAula 3 Volumetria de Neutralização Parte II 2012Jhamine CarolineNo ratings yet
- Semana 4.4 TitulaçãoDocument34 pagesSemana 4.4 TitulaçãoCanal ParronNo ratings yet
- Leitura DinâmicaDocument14 pagesLeitura DinâmicaBianca Carolina100% (1)
- Aula 4 - Titulação Ácido-BaseDocument23 pagesAula 4 - Titulação Ácido-BasePassei Direto PDNo ratings yet
- Hinário Mestre Irineu O Cruzeiro - Partituras PDFDocument167 pagesHinário Mestre Irineu O Cruzeiro - Partituras PDFLelo Jobim Carvalho Sasso100% (6)
- Manual CV 3000 II Cosco DorelDocument16 pagesManual CV 3000 II Cosco DorelAlessandro Vasconcelos67% (3)
- Aula Volumetria de NeutralizaçãoDocument33 pagesAula Volumetria de NeutralizaçãoLudmila CaitanoNo ratings yet
- Actividade - Áreas e VolumesDocument25 pagesActividade - Áreas e VolumesSonia Coelho0% (1)
- Ficha de Trabalho Teorema de PitagorasDocument15 pagesFicha de Trabalho Teorema de PitagorasFilipa LunaNo ratings yet
- Volumetria Acido BaseDocument11 pagesVolumetria Acido BaseLourdes NascimentoNo ratings yet
- Quimica Analitica - Exercicios 1° ProvaDocument2 pagesQuimica Analitica - Exercicios 1° ProvaIgor Rafael de OliveiraNo ratings yet
- Lista1 Exercicios ADocument4 pagesLista1 Exercicios ALucas TestaNo ratings yet
- Lista 1Document3 pagesLista 1rodolfoceiNo ratings yet
- Lista 2 de Quimica Analitica Quantitativa I Quimica - Equilibrios e Titulacao de Neutralizacao 2023Document3 pagesLista 2 de Quimica Analitica Quantitativa I Quimica - Equilibrios e Titulacao de Neutralizacao 2023paranziniNo ratings yet
- Exercicios Primeira ProvaDocument5 pagesExercicios Primeira ProvaTiago Franco EANo ratings yet
- Aula 5 Volumetria de Neutralização 1Document45 pagesAula 5 Volumetria de Neutralização 1Sergio navarro HenriqueNo ratings yet
- Aula 2 Titulação Ácido BaseDocument54 pagesAula 2 Titulação Ácido BaseGabi PessoaNo ratings yet
- Lista de QuimicaDocument5 pagesLista de QuimicaLinniker Godoi0% (1)
- Lista de Exercício de Química AnalíticaDocument4 pagesLista de Exercício de Química AnalíticaLuisa Gardênia FariasNo ratings yet
- Aula Solução TampãoDocument19 pagesAula Solução TampãoClaudia MachadoNo ratings yet
- Lista de Exercicios Volumetria Neutralizacao FINALDocument6 pagesLista de Exercicios Volumetria Neutralizacao FINALgabihsabaNo ratings yet
- Efeito Íon ComumDocument25 pagesEfeito Íon ComumAlessandrafsaNo ratings yet
- Volumetria de Neutralização 2011Document58 pagesVolumetria de Neutralização 2011Lucas0% (1)
- Polígrafo - Equilibrio Acido - Base - ExercíciosDocument4 pagesPolígrafo - Equilibrio Acido - Base - ExercíciosAna Carolina Falcão SchiavoNo ratings yet
- 4 Aula PraticaDocument17 pages4 Aula PraticaLígia Rodrigues SampaioNo ratings yet
- Lista de Exercícios - Equilíbrio Ácido-BaseDocument4 pagesLista de Exercícios - Equilíbrio Ácido-BaseThaís AndradeNo ratings yet
- Cálculo Do PHDocument12 pagesCálculo Do PHJANAÍNA DOS SANTOSNo ratings yet
- Construção de Curvas de TitulaçãoDocument19 pagesConstrução de Curvas de TitulaçãoEliana AlvarengaNo ratings yet
- Titulações Ácido-Base Texto 2023Document14 pagesTitulações Ácido-Base Texto 2023Vinicius NogueiraNo ratings yet
- Aula - Titulações de NeutralizaçãoDocument15 pagesAula - Titulações de NeutralizaçãoLucas do Carmo100% (1)
- 4 Equilibrio Acido BaseDocument3 pages4 Equilibrio Acido BaseGabriella GamaNo ratings yet
- Acido BaseDocument3 pagesAcido BaseLuiza PolitanoNo ratings yet
- 2 - Lista - de - Exercicios QUIMICA PDFDocument5 pages2 - Lista - de - Exercicios QUIMICA PDFElaine FerreiraNo ratings yet
- Volumetria Acido-Base 16-04-2022Document18 pagesVolumetria Acido-Base 16-04-2022Isadora Lima SilvaNo ratings yet
- 8 Lista de Exercícios Ácidos e Bases 2010. 2Document1 page8 Lista de Exercícios Ácidos e Bases 2010. 2Rafael GomesNo ratings yet
- IC 607 1a. Lista de Exercicios Prof Otavioic607Document5 pagesIC 607 1a. Lista de Exercicios Prof Otavioic607Toni EltonNo ratings yet
- Equilibrio Acido BaseDocument7 pagesEquilibrio Acido BaseSílvio Gualter Manuel Filipe0% (1)
- Go Quimica Ita 5ef4f625c80a3Document10 pagesGo Quimica Ita 5ef4f625c80a3PAOLA LORRAYNE DA SILVANo ratings yet
- Gama - Módulo 27 PDFDocument22 pagesGama - Módulo 27 PDFThiago Magno Tavares MachadoNo ratings yet
- Exercícios4 CQ120Document2 pagesExercícios4 CQ120Rogério Da Silva SouzaNo ratings yet
- Lista Com GabaritoDocument3 pagesLista Com GabaritoKety CostaNo ratings yet
- Exercico de Quimica 03..07........Document9 pagesExercico de Quimica 03..07........samila magalhaes100% (1)
- Aula 2 Titulação Ácido BaseDocument41 pagesAula 2 Titulação Ácido BaseAdriano RafaelNo ratings yet
- Atencao Plena - Mark WilliamsDocument20 pagesAtencao Plena - Mark WilliamsMargarida MachadoNo ratings yet
- Lista Equilà Brio à Cido-Base 13 03 2023 - RevisadoDocument5 pagesLista Equilà Brio à Cido-Base 13 03 2023 - Revisadolarinha40037No ratings yet
- Cap Exercicios NeutralizacaoDocument10 pagesCap Exercicios NeutralizacaoAngelique ViannyNo ratings yet
- Volumetria de Neutralizacao Parte IIDocument28 pagesVolumetria de Neutralizacao Parte IIElyakyn GuimarãesNo ratings yet
- Lista de Exercà - Cios Volum ácido Base PDFDocument6 pagesLista de Exercà - Cios Volum ácido Base PDFLaila QuaresmaNo ratings yet
- 21 titulacoesABDocument2 pages21 titulacoesABCarolina RodriguesNo ratings yet
- Volumetria de NeutralizaoDocument33 pagesVolumetria de NeutralizaoAnne TelesNo ratings yet
- Curvas de PH e Determinação Do Ponto de NeutralizaçãoDocument15 pagesCurvas de PH e Determinação Do Ponto de NeutralizaçãoBruno ThomaziniNo ratings yet
- Exercicio de TampaoDocument2 pagesExercicio de TampaoRaquel Bezerra SNo ratings yet
- Exercicios Quimica VDocument7 pagesExercicios Quimica VflaviaapmoreiraNo ratings yet
- Lista de Exercícios - Análise Volumétrica - Farmácia (2017)Document7 pagesLista de Exercícios - Análise Volumétrica - Farmácia (2017)Vitor ViegasNo ratings yet
- Resumo Capitulo 3 Volumetria de NeutralizaçãoDocument5 pagesResumo Capitulo 3 Volumetria de NeutralizaçãoLudmila CaitanoNo ratings yet
- Enviando A Medição De Ph Para Monitoramento No Vb Com A Stm8 Programada Em ArduinoFrom EverandEnviando A Medição De Ph Para Monitoramento No Vb Com A Stm8 Programada Em ArduinoNo ratings yet
- Enviando A Medição De Ph Para Monitoramento No Vc# Com A Stm8 Programada Em ArduinoFrom EverandEnviando A Medição De Ph Para Monitoramento No Vc# Com A Stm8 Programada Em ArduinoNo ratings yet
- Apostila Química Orgânica: Terpenos E Rotas De SínteseFrom EverandApostila Química Orgânica: Terpenos E Rotas De SínteseNo ratings yet
- Manual Proesp BR 2015Document20 pagesManual Proesp BR 2015Cleber PereiraNo ratings yet
- Regulador Não-Balanceado - EsquemaDocument2 pagesRegulador Não-Balanceado - Esquemacarlosbarbosa.df8598No ratings yet
- Aplicações Diversas Das Derivadas Parciais AlunosDocument4 pagesAplicações Diversas Das Derivadas Parciais AlunosJanilson Loterio100% (1)
- Plano de Aula FuncionalDocument2 pagesPlano de Aula Funcionalms67335No ratings yet
- Trabalho Escrito AlongamentoDocument12 pagesTrabalho Escrito AlongamentoSilvio_IkegamiNo ratings yet
- Abordagem Tecnica Do PAIS ATP - Glossario de Exercicios 1 2Document74 pagesAbordagem Tecnica Do PAIS ATP - Glossario de Exercicios 1 2Maria DielmaNo ratings yet
- Manual GaussianDocument60 pagesManual GaussianLuan Feitoza100% (1)
- Níveis de Tensão - Abradee - Associação Brasileira de Distribuidores de Energia ElétricaDocument6 pagesNíveis de Tensão - Abradee - Associação Brasileira de Distribuidores de Energia ElétricaRonilson Di SouzaNo ratings yet
- Planilha Academia Intermediaria 3bDocument5 pagesPlanilha Academia Intermediaria 3bCamila Torres RodriguesNo ratings yet
- Manual Estacao300m PDFDocument24 pagesManual Estacao300m PDFCarlos de Caprio100% (1)
- Corrida Com Musculação Prof Fábio GianollaDocument5 pagesCorrida Com Musculação Prof Fábio GianollaFelipe Silveira100% (1)
- Calculos para Redutor de Velocidade Tentativa 2Document1,128 pagesCalculos para Redutor de Velocidade Tentativa 2Carlos ManiezoNo ratings yet
- 1 Lista Exercícios Química GeralDocument2 pages1 Lista Exercícios Química GeralPaulo EricoNo ratings yet
- Manual Do Usuário - Secador de Cabelos Cadence Florea Sec401Document4 pagesManual Do Usuário - Secador de Cabelos Cadence Florea Sec401Saulo Cunha CamposNo ratings yet
- Determinação Do Ácido Acético em VinagreDocument8 pagesDeterminação Do Ácido Acético em Vinagredhenrique_60No ratings yet
- Caderno1 Fis 203 207 Movimento CircularDocument5 pagesCaderno1 Fis 203 207 Movimento CircularDiomerson DalloNo ratings yet
- Modelo PlanilhaDocument2 pagesModelo PlanilhaLucas AlvesNo ratings yet