Professional Documents
Culture Documents
Preinforme Coeficiente de Transferenciafinal
Uploaded by
Hernann von HelmholtzCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Preinforme Coeficiente de Transferenciafinal
Uploaded by
Hernann von HelmholtzCopyright:
Available Formats
Universidad Nacional de Colombia. Delgadillo, Vega, Villamil.
Coeficiente de difusividad
Informe prctica: Coeficiente de difusividad
Camila Delgadillo, Marcela Vega, Felipe Villamil
cdelgadilloc@unal.edu.co, jmvegah@unal.edu.co, favillamilq@unal.edu.co
Universidad Nacional de Colombia
Facultad de Ingeniera-Departamento de Ingeniera Qumica y Ambiental
1. OBJETIVOS
General:
Determinar la difusividad de la acetona en fase gas
con aire
Especficos:
Utilizar una celda de arnold para calcular la
difusividad acetona-aire por medio de varios
mtodos
Calcular la difusividad por medio de las
correlaciones recomendadas en la literatura
Comparar los datos obtenidos con lo
presentado en la literatura
2. FUNDAMENTO TERICO
A. Transferencia de masa
La transferencia de masa es un fenmeno que se
genera cuando en una fase hay dos lugares con
concentraciones distintas de un soluto, entonces
segn la segunda ley, el flujo natural tendera a
mover dichas molculas e igualar las
concentraciones en dichos dos lugares, con el fin de
aumentar la entropa total del sistema. Esta
transferencia de masa se lleva a cabo en una o
varias fases con el fin de aumentar la entropa del
sistema, pero en sistemas multifasicos se bbusca la
igualdad de fugasidades para dicha sustancia.
La transferencia de masa se puede dar segn dos
contribuciones, una contribucin difusiva o de
movimiento molecular y una contribucin de
transporte o movimiento global de sustancia:
CA n
D ABdC A
N A = N i
(1)
C
dz
i
Esquemticamente, la velocidad sde flujo tiene dos
contribucuiones, la velocidad a la que se desplazan
todas las partculas, ayudadas unas a otras
(sumatoria de N) y la velocidad a la que la partcula
como tal se desplaza entre las dems (diferencial de
concentracin)
A partir de la ecuacion 1 se pueden hacer varias
simplificaciones que dependenden de la situaciomn
y de la naturaleza de las molculas, pues el termino
que se simplifica es el termino de sumatorias para
expresar el flujo de las dems sustancias en funcin
de el flujo de nuestra sustancia de inters.
B. Coeficiente de difusividad
El coeficiente de difusividad es una cantidad que
relaciona la facilidad del movimiento de una
molecula entre otras molculas; este coeficiente
depende de la temperatura, presin, identidad de las
molculas, concentraciones, tamaos moleculares y
presencia de otras molculas; para los gases, este
coeficiente es independiente de las concentraciones
a diferencia de liquidos y solidos. Depende de la
presin en la medida que la presin demuestra
unin entre las molculas, a mayor unin se
generara mayos hacinamiento y menor facilidad de
movimiento; para la temperatura, la dufision
aumenta al aumentar la temperatura ya que se le
brinda mayor energa de movimiento a las
molculas.
C. Celda de arnold
La celda de arnold es un dispositivo usado para
determinar el coeficiente de difusividad bajo unas
condiciones especiales que permiten su correcta y
fcil medicin
Universidad Nacional de Colombia. Delgadillo, Vega, Villamil. Coeficiente de difusividad
liq
dV liq
mol perdida MArea
N A=
=
(4 )
areatiempo
dT
V liq =Harea(5)
dV liq areadH dz
=
=
area(6)
dT
dT
dT
Asi igualando las ecuaciones 3, 4 y 6 se obtiene
El dispositivo consiste en un tubo capilar inmerso
en un bao termosttico, el tubo capilar tiene un
liquido puro en el fondo y esta conectado a un tubo
donde el aire fluye en rgimen laminar. La
concentracin en z=z1 es la presin de saturacin
del liquido a la temperatura del bao y la
concentracin en z=z2 es de 0, ya que el flujo de
aire arrastra todas las molculas de soluto y limpia
ese lugar.
Este experimento se hace con aire o con cualquier
gas, y se da un caso de flujo en un medio estatico,
pues aunque haya un gradiente de concentracin de
las molculas de aire, estas no se mueven desntro
del liquido, no se genera una acumulacin de aire en
ningn lugar
Para este experimento se integra la ecuacion1 dando
lugar a la expresin
NA
NA
D ABC
Y 2
N
N
N A=
ln
(2)
Z
NA
Y
N 1
( )
Como el aire no se difunde, los trminos de
sumatoria se vuelven la unidad y la concentracin
se relaciona con la ley de gases ideales
N A=
D ABP
1Y 2
ln
(3)
ZRT
1Y 1
Por otra parte la prdida de moles o sea el flujo N se
relaciona con la variacin del volumen del capilar
liq
dz
D ABP
1Y 2
M
ln
=
(7)
ZRT
1Y 1
dT
Que reacomodando se obtiene
T=Tf
T =0
1Y 2
P
D AB
ln
RT
1Y 1
liq
M
Z=ZF
)( )
dT =
Z dZ (8)
Z=Zi
Vemos que la integral del lado izquierdo es una
constante para el experimento y se conoce
exactamente por tanto
Z
( f Zi )(9)
2 T =
De esta manera si se grafica el tiempo transcurrido
respecto a una variacin al cuadrado de las aluras se
obtendr una lnea recta en cuya pendiente se puede
despejar la difusividad.
Se utiliza un flujo de aire laminar para eliminar las
molculas en el tubo, si se utiliza flujo turbulento el
aire podra mesclarse dentro del tubo y eliminar el
gradiente de concentracin., se recomienda un
Reynolds menor que 2100 para garantizar flujo
laminar, esto se logra aproximadamente con
caudales de 4.6E-4 m3/s.
El coeficiente de difusin puede despejarse de
varias maneras aparte de calcular una lnea recta
entre el tiempo transcurrido y la distancia cuadrada
Universidad Nacional de Colombia. Delgadillo, Vega, Villamil. Coeficiente de difusividad
o Zf Zo, las cuales son la distancia del tubo llena
de gas
Esta ecuacin se obtiene resolviendo la segunda ley
de Fick despreciando el termino de arrastre (caso de
a en b estancado o contradifusion). As para obtener
el 95% del flujo estable se reemplaza el nmero de
Fourier en la ecuacin y se resuelve para el tiempo,
generalmente este tiempo es del orden de un minuto
El mtodo de winkelmann implica contruir una
grafica de t/zf zo) vs zf-zo, obtenindose
una grafica recta en cuya pendiente esta la
difusividad respecto a la siguiente ecuacion
( Zf Zo )R T PBML liq
RT P BML liq Zo
t
D. Correlaciones para calcular la
=
+
(10)
Zf Zo 2 D AB P M A ( P AsupP Agas ) D AB P M A ( P Asup P Agas )
difusividad de gases
Para determinr la difusividad se ha propuesto la
siguiente correlacion segn la teora de gases
ideales por champman y enskog
Donde Pbml es la diferencia de presin logartmica
dada por
P P Bsup
PBML = Bgas
(11)
PBgas
ln
PBsup
D AB=
( )
1
2
AB
(10)
2
AB
PM D
Donde T esta en grados K
P en bares
en amstrong y se calcula como el promedio de los
radios atomicos de las moleculas
es la integral de colisin
1
1
1
M AB=2
+
(11)
M A MB
El siguiente mtodo es el de wilke lee que
transforma la ecuacin de otra manera
1 Zf 1
1
=
+
(12)
Da
D AB Zf D AB
Da=
0.00266T
3
2
R T P BML liq ( Z f 2Z o 2)
( 13 )
2 tP M A ( P AsupP Agas )
es una ponderacin de los pesos moleculares
Para calculas la integral de colisin se requieren de
las energas de choque de las molculas
1
AB =( A B ) 2 (12)
El mtodo anteriormente determinado establece que
todo lo calculado se da en estado estable, pero al
inicio el experimento es no estacionario y debe
pasar algn tiempo hasta que se determine
completamente el perfil de concentraciones
Asi este tiempo se debe calcular segn la siguiente
ecuacin
N At =t
=12 e1
N A t=inf
2
Fo
+2 e2
Fo
2 e3
Donde se utiliza el nmero de Fourier
D
Fo= AB2 t (15)
Zf
Fo
+2 e4
AB =
T=
Fo
A + B
(13)
2
kT
(14)
AB
2
5 Fo
G)
2 eDT
E .(14
e
+ FT + ( H T ) (15)
e
e
A C
D= B +
T
A=1.06036
B=0.15610
C=0.193
Universidad Nacional de Colombia. Delgadillo, Vega, Villamil. Coeficiente de difusividad
D=0.47635
E=1.03587
F=1.52996
G=1.76474
H=3.89411
Va
=1.9410
2p 1
( 17)
Vb Tb
1.585 V b 3
=
(18)
1+1.3 2
(1/ 2)
( A B ) (19)
ab=
1
1
2
AB =( A B ) (21)
Otra ecuacin emprica dada por wilke y lee es la
siguiente
( )}
3.03
0.98
103 T 2
2
M AB
PM 2AB 2ABD
+ }
1
PM 2AB{
{0.00143T 1.75 }
D AB=
Las sumatorias se calculan tanto para aire como
para la acetona, los parmetros asi como la revisin
de las ecuaciones esta dada por reid et all
E. Materiales y reactivos
1.
2.
3.
4.
5.
6.
7.
8.
Aire
Acetona Liquida Pura
Celda De Arnold
Bao Termostatico
Termmetro
Catetmetro
Deshumidificador De Aire
Dos jeringas graduadas
El catetmetro es un instrumento que sirve para
medir distancias en longitudes muy pequeas.
AB A B 2
=
(20)
k
k k
( )
1
3 2
3. Procedimiento
Donde miu es el momento dipolar en debyes
Vb es el volumen molar del liquido en el punto de
ebullicin
Tb es la temperatura de ebullicin a 1 atmosfera
=1.18 ( 1+1.3 ) T b (17)
k
D AB=
1
3
VB
As se calcula primero la energa de activacin, con
ella se calcula la integral de colisin y despus se
calcula la difucion
La ecuacion anterior se usa cuando los gases son no
polares
0.19 2AB
Dcorregido= D +
(16)
T
{{
(22)
Otra ecuacin modificada implica las sumas de los
volmenes de los atomos que componen las
molculas
Para el experimento se debe medir la velocidad del
aire, por tanto lo que se puede hacer es utilizar una
solucin jabonosa, la cual se introduce en una pera
exprimida la cual se conecta a una bureta rota y a la
tubera de gas, de esta forma se mide la velocidad
del gas a patir de la velocidad a la que las busbujas
de jabon acienden
Universidad Nacional de Colombia. Delgadillo, Vega, Villamil. Coeficiente de difusividad
Conectar todo el equipo al compresor
con ayuda de abrazaderas o de un
adhesivo industrial.
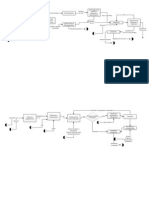
Diagrama 1. Procedimiento Experimental
I.
llenar una jeringa con la muestra a
tratar y ponerla por encima de otra en
un tubo donde circulara el flujo de aire.
Encender la resistencia y preparar el
bao trmico. Con apoyo de un
termmetro hay que asegurarse que
tenga la temperatura adecuada.
Poner en marcha el compresor. Fijarse que
no haya fugas y medir la presin a la que se
trabaja con la ayuda del manmetro.
Una vez establecido la temperatura y
presin adecuadas se inyecta la muestra en
la jeringa inferior.
esperar la estabilizacion del equipo
Cada vez que vaya disminuyendo una
cantidad conocida de la muestra se toma su
tiempo. Al final se debe de tomar un tiempo
promedio.
[1] treybal
[2] welty
[3] otro doc
REFERENCIAS
You might also like
- EntregafinalDocument23 pagesEntregafinalHernann von HelmholtzNo ratings yet
- Formato Inscripcion TGDocument2 pagesFormato Inscripcion TGHernann von HelmholtzNo ratings yet
- COPERT CompiladoDocument28 pagesCOPERT CompiladoHernann von HelmholtzNo ratings yet
- E MisionesDocument6 pagesE MisionesHernann von HelmholtzNo ratings yet
- Adhesivos de Contacto en MosqueraDocument5 pagesAdhesivos de Contacto en MosqueraHernann von HelmholtzNo ratings yet
- Tarea EmisionesDocument3 pagesTarea EmisionesHernann von HelmholtzNo ratings yet
- Ciclo de Vida PeganteDocument25 pagesCiclo de Vida PeganteHernann von HelmholtzNo ratings yet
- Aca Dice Que Hhay Secadores Rotatorios de Mas de 3 Metros de DiametroDocument6 pagesAca Dice Que Hhay Secadores Rotatorios de Mas de 3 Metros de DiametroHernann von HelmholtzNo ratings yet
- Detergent EsDocument2 pagesDetergent EsHernann von HelmholtzNo ratings yet
- Adsorción INFORMEDocument11 pagesAdsorción INFORMEHernann von HelmholtzNo ratings yet
- Tarea Del Reactor de EstirenoDocument6 pagesTarea Del Reactor de EstirenoHernann von HelmholtzNo ratings yet
- Combustión y Su TecnologíaDocument1 pageCombustión y Su TecnologíaHernann von HelmholtzNo ratings yet
- Analisis de ReultadosDocument2 pagesAnalisis de ReultadosHernann von HelmholtzNo ratings yet
- Ruta Quifmica de N PropanolDocument3 pagesRuta Quifmica de N PropanolHernann von HelmholtzNo ratings yet
- INFORME FINAL EsterificacionDocument13 pagesINFORME FINAL EsterificacionHernann von HelmholtzNo ratings yet
- Ruta Quimica de GN PropanolDocument3 pagesRuta Quimica de GN PropanolHernann von HelmholtzNo ratings yet
- Taller 3 DiseñoDocument5 pagesTaller 3 DiseñoHernann von HelmholtzNo ratings yet
- PDF Taller 1Document2 pagesPDF Taller 1Hernann von HelmholtzNo ratings yet
- Taller 3 DiseñoDocument12 pagesTaller 3 DiseñoHernann von HelmholtzNo ratings yet
- Contextualizacion IndustrialDocument3 pagesContextualizacion IndustrialHernann von HelmholtzNo ratings yet
- Producción de Propanol Iso RutasDocument12 pagesProducción de Propanol Iso RutasHernann von HelmholtzNo ratings yet
- Ruta Quimica de N PropanolDocument2 pagesRuta Quimica de N PropanolHernann von HelmholtzNo ratings yet
- ControlDocument8 pagesControlHernann von HelmholtzNo ratings yet
- ACTA No TalesDocument3 pagesACTA No TalesHernann von HelmholtzNo ratings yet
- Plantilla de CalculoDocument262 pagesPlantilla de CalculoHernann von HelmholtzNo ratings yet
- Sostenibilidad en Matriales UN Agosto 13 2015Document1 pageSostenibilidad en Matriales UN Agosto 13 2015Hernann von HelmholtzNo ratings yet
- Plantilla de CalculoDocument262 pagesPlantilla de CalculoHernann von HelmholtzNo ratings yet
- Preinforme de La Practica de SolubilidadDocument9 pagesPreinforme de La Practica de SolubilidadHernann von HelmholtzNo ratings yet
- Proyecto Termodinamica TerminadoDocument8 pagesProyecto Termodinamica TerminadoHernann von HelmholtzNo ratings yet
- Procesos y Técnicas Aplicados en La Producción de PolietilenoDocument25 pagesProcesos y Técnicas Aplicados en La Producción de PolietilenoAlberto PrietoNo ratings yet
- Antecedentes de Presa Blanca y Procedimiento de ColiformesDocument14 pagesAntecedentes de Presa Blanca y Procedimiento de ColiformesViridiana TorresNo ratings yet
- Analisis Al JabonDocument5 pagesAnalisis Al Jabonyoona3No ratings yet
- Qui MicaDocument7 pagesQui MicaHades DHNo ratings yet
- Analisis Fisicoquimico de Concentrado de MaracuyaDocument15 pagesAnalisis Fisicoquimico de Concentrado de MaracuyaMaricruz M. AdrianzénNo ratings yet
- Titulacion Acido Base y Determinacion de PH de Una Muestra ComercialDocument13 pagesTitulacion Acido Base y Determinacion de PH de Una Muestra ComercialFelipe VilchesNo ratings yet
- Informe Química 18.04Document16 pagesInforme Química 18.04Sofía SorianoNo ratings yet
- Solucionario Disoluciones Quimicas ViDocument7 pagesSolucionario Disoluciones Quimicas ViPROBNo ratings yet
- Tema 1 SedimentaciónDocument27 pagesTema 1 Sedimentacióndani100% (4)
- Instructivo Metodo 3550 (Extracción Ultrasonica)Document19 pagesInstructivo Metodo 3550 (Extracción Ultrasonica)Olivier Rojas UlateNo ratings yet
- Problemas Con El Agua OxigenadaDocument3 pagesProblemas Con El Agua OxigenadaFini SabinNo ratings yet
- SolucionesDocument15 pagesSolucionesBelén Ornelas100% (1)
- Conceptos de Fugacidad y ActividadDocument3 pagesConceptos de Fugacidad y ActividadBrayan GamezNo ratings yet
- Serie IDocument2 pagesSerie IAbril SosaNo ratings yet
- Preguntas de Repaso Informes 6 Al 10 (Química General A1)Document8 pagesPreguntas de Repaso Informes 6 Al 10 (Química General A1)Andres Arturo Lee Sanchez CastilloNo ratings yet
- Xantato Amilico de PotasioDocument5 pagesXantato Amilico de PotasioJuan Carlos Orozco100% (3)
- Reacciones de Transferencia de ProtonesDocument18 pagesReacciones de Transferencia de ProtonesMIldre666100% (2)
- KlaDocument10 pagesKlaGaby RamirezNo ratings yet
- Syllabu QuimicaDocument4 pagesSyllabu QuimicaOscarín Julinho Gallardo PeñaNo ratings yet
- GUÍA DE LABORATORIO N°1 - EncurtidosDocument4 pagesGUÍA DE LABORATORIO N°1 - EncurtidosVasterMereelNo ratings yet
- Guía Dipol Emergencias y DesastresDocument60 pagesGuía Dipol Emergencias y DesastresPedro Contador SanNo ratings yet
- FQ1 - Relación General de Problemas - 2014!09!09Document25 pagesFQ1 - Relación General de Problemas - 2014!09!09scrjonNo ratings yet
- Trabajo de Investigacion 8 Quimica GeneralDocument5 pagesTrabajo de Investigacion 8 Quimica GeneralYamila PerezNo ratings yet
- Soluciones y Curvas de TitulacionDocument14 pagesSoluciones y Curvas de TitulacionMarcos Geronimo MoralesNo ratings yet
- RefractometríaDocument6 pagesRefractometríaJose Antonio Vargas GonzalezNo ratings yet
- Medidas de Asociación NominalDocument11 pagesMedidas de Asociación NominalAlonzo Manrique CristobalNo ratings yet
- Protocolo de Analisis de Furfural en Bebidas AlcoholicasDocument5 pagesProtocolo de Analisis de Furfural en Bebidas AlcoholicasJefersson AcevedoNo ratings yet
- Guide ABC of Easy Titration ES LOWDocument40 pagesGuide ABC of Easy Titration ES LOWMiguel Angel Lupaca BernalesNo ratings yet
- 1 IntroduccionDocument16 pages1 IntroduccionesajuaniNo ratings yet
- Ejercicios de Equilibrio QuímicoDocument5 pagesEjercicios de Equilibrio QuímicoKevinAmayaNo ratings yet