Professional Documents
Culture Documents
Proteínas 2014
Uploaded by
LaraBen79Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Proteínas 2014
Uploaded by
LaraBen79Copyright:
Available Formats
08/06/2014
Protenas Funciones y roles biolgicos
Estructura de las protenas: Existen 4 niveles de organizacin en la estructura de
las protenas (100 aminocidos o ms)
Catlisis enzimtica: catalizan (aumentan las veloc.) casi todas las reacciones biolgicas, reacciones
de distinta complejidad (hidrlisis vs replicacin de un cromosoma completo). Esas reacciones no
ocurren en ausencia de las enzimas.
Transporte y almacenamiento: Ej. O2 transportado por hemoglobina en sangre y por mioglobina en
msculo.
Movimiento coordinado: macroscpico (msculo, deslizamiento de 2 filamentos proteicos) o
Estructura primaria: est dada por la secuencia de
aminocidos y los puentes disulfuro.
Estructura secundaria: Est determinada por las
disposiciones regulares de aminocidos cercanos
en una cadena peptdica. Ciertas conformaciones
de pptidos son ms estables que otras.
microscpicos (cromosomas en la mitosis, propulsin del esperma por medio de flagelos)
Soporte mecnico: piel, huesos. Soportan tensin
Proteccin inmune: anticuerpos (protenas especficas que reconocen y se combinan c/ sustancias
extraas tales como virus, bacterias y clulas de otros organismos. Distinguir lo propio de lo ajeno
Generacin y transmisin de impulsos nerviosos: La respuesta de las clulas nerviosas a
estmulos especficos depende de la presencia de receptores proteicos. Ej: rodopsina es el receptor en
los bastoncitos del a retina.
Estructura terciaria: Originada por plegamientos
adicionales, enrollamientos y otras formas de
agregacin que se dan como consecuencia de la
relacin espacial entre aminocidos situados muy
distantes en la secuencia.
Estructura cuaternaria: determinada por la
asociacin de dos o ms cadenas proteicas que
originan un multmero de orden superior
Control del crecimiento y diferenciacin: mensajeros qumicos y hormonas
08/06/2014
Estructura secundaria
Est determinada por las disposiciones regulares de aminocidos cercanos en una
cadena peptdica. Ciertas conformaciones de pptidos son ms estables que otras.
HLICES ALFA
a-queratina (lana)
LMINAS BETA
Los electrones se
encuentran en un nico
orbital hbrido
Fibrona de seda (15 aa
diferentes, 46 % Gli, 38 % Ala
CH3 y Ser CH2OH)
VUELTAS INVERSAS
(o GIROS INVERSOS)
Todas estas conformaciones son mantenidas por enlaces hidrgeno entre residuos
que se encuentran prximos en la cadena
08/06/2014
Estructura secundaria de las protenas
Hlices
Hlices
La hlice alfa est estabilizada por
puentes de hidrgeno entre los grupos
amino y carbonilo del esqueleto del
polipptido. El grupo carbonilo de cada
residuo forma un puente de hidrgeno
con el grupo amino del aminocido
situado cuatro residuos ms adelante.
Es una hlice derecha!
08/06/2014
Hlices
Hlices
En teora, sentido de la hlice puede ser
dextrgira, en sentido de giro igual al de las
agujas del reloj, o levgira, sentido contrario al de
las agujas del reloj. Pero en la hlice levgira los
oxgenos de los grupos carbonilos y las cadenas
laterales de los residuos desestabilizan la hlice
por impedimentos estricos. Esto se debe a que
los aminocidos de las protenas son de la serie L-.
Como se aprecia en la figura las cadenas laterales
de cada residuo estn aproximadamente en
posicin trans respecto al oxgeno del carbonilo
adyacente. Si el aminocido fuese de la serie D-,
estos residuos estaran en conformacin cis, con
mayores posibilidades de conflictos estricos
dependiendo del tipo de cadena lateral.
Tambin puede pensarse la hlice
como una cadena enrollada alrededor
del eje longitudinal de la molcula.
Los grupos R sobresalen del esqueleto
helicoidal
Hlice a vista desde arriba
Las protenas que forman los
msculos (miosina) y la lana (
queratina) son hlices .
08/06/2014
Aminocidos incompatibles o que desestabilizan las hlices a:
Hay aminocidos incompatibles con esta estructura debido a las
propiedades de su cadena lateral.
-El asprtico tiene la cadena lateral cargada por lo que si hay
muchos juntos se repelen desestabilizando la molcula. Slo son
estables si no estn disociados.
- Hay aminocidos que son muy voluminosos en su carbono b
porque estn sustituidos y el residuo no puede extenderse. Son
la treonina y la isoleucina.
Hay otro aminocido que rompe la a-hlice: prolina. Como el
enlace no puede girar, la cadena da la vuelta. Ya que tiene el
grupo a-amino sustituido no puede formas puentes de hidrgeno.
Se puede tener a-hlice antes y despus de la prolina.
Lminas
Antiparalela
O
H2N CHC OH
CH 2
C O
OH
O
H2N CHC OH
CHOH
CH3
O
H2N CHC OH
CH CH 3
CH 2
CH 3
H
N
C
OH
-La glicina desestabiliza las estructuras en hlice alfa porque es
demasiado flexible.
Una protena puede tener a-hlice a lo largo de una porcin
porque los aminocidos son compatibles. La cadena se puede
estirar rompiendo puentes de hidrgeno y el lmite est en la
cadena polipeptdica.
O
H2N CH2C OH
En la hebra beta, la cadena polipeptdica
est generalmente estirada. Todos los
residuos presentan una rotacin de 180
respecto a los precedentes. La distancia
entre dos aminocidos adyacentes es de
0.35 nm, en lugar de los 0.15 nm de la
hlice alfa. La estructura se estabiliza
mediante la asociacin de hebras para
formar una lmina u hoja beta. Estos se
disponen casi perpendiculares a la
cadena polipeptdica extendida. La hoja
beta est estabilizada por puentes de
hidrgeno entre el grupo amida y el
grupo carboxilo de un filamento
adyacente. Los radicales se disponen
alternativamente a uno y otro lado de la
cadena polipetdica.
08/06/2014
Lminas
Lminas
Paralela
Estructura secundaria mantenida por puentes de hidrgeno entre elementos de la
cadena peptdica. Aspecto laminar.
Las cadenas adyacentes de una hoja beta
pueden orientarse en la misma direccin
(hojas beta paralelas), o en direcciones
opuestas (hojas beta antiparalelas). Cuando
la hojas beta son antiparalelas los puentes
de hidrgeno que estabilizan la estructura
son prcticamente perpendiculares a las
cadenas polipeptdicas y los grupos
carbonilo y amino de dos residuos forman
puentes de hidrgeno entre s. Esto no
ocurre en las hojas beta paralelas, donde los
puentes de hidrgeno no son
perpendiculares al esqueleto polipeptdico y
los grupos carbonilo y amino de un residuo
forman puentes de hidrgeno con dos
residuos diferentes.
Son ricas en aminocidos pequeos (gly, ala,
ser)
Diferencias con hlice a:
- La cadena polipeptdica est lo ms extendida posible.
- Distancia entre aminocidos: 3.5 angstroms.
- Estructura mantenida por puentes de hidrgeno, pero en lugar de formar puentes
entre elementos de la misma cadena es con elementos de cadenas distintas (o de la
misma que da la vuelta). Los puentes de hidrgeno se establecen perpendiculares al
eje de la lmina. Todos los carbonilo forman puentes de hidrgeno con los amino, por
lo que es igual de estable que la a-hlice.
Existen 2 arreglos posibles de lminas b:
- Si los 2 segmentos tienen direcciones distintas la hoja plegada es antiparalela. Como los
puentes de hidrgeno son enlaces direccionales es ms estable.
- Si los 2 segmentos tienen direcciones iguales la hoja plegada es paralela.
Las cadenas laterales van por encima y por debajo alternativamente porque la
configuracin del enlace es trans.
- Las cadenas laterales estn ms prximas que en la a-hlice, por lo que slo es
compatible con aminocidos de cadena lateral muy corta: glicina, alanina y serina (son los
ms pequeos). Los otros aminocidos sufren repulsiones de tipo estrico.
08/06/2014
Giros, vueltas , vueltas inversas, o giros reversos
Formado por 4 aminocidos, el
primero forma un enlace H con el
cuarto.
La fibrona de la seda es casi totalmente una lmina plegada y ms del 80%
de su estructura repite el motivo gly-ser-gly-ala-gly-ala
Lo esencial de este giro en horquilla
es que el carbonilo de un residuo n
se enlaza con el grupo amino del
residuo n+3. En consecuencia la
cadena puede cambiar bruscamente
de direccin.
Se conocen varios tipos de giros. En
los giros tipo I, podemos encontrar
cualquier tipo de residuos con
excepcin de la prolina en posicin
3. En los giros tipo II, la glicina debe
estar en posicin 2 y casi siempre
aparece una prolina en posicin 3.
Los giros tipo III no tienen
restricciones en cuanto a la
identidad de sus componentes.
A veces puede conseguirse un giro
completo de la cadena polipeptdica
con tan solo dos residuos como es el
caso de los giros tipo . En estos
residuo n debe ser una prolina.
08/06/2014
Giros, vueltas , vueltas inversas, o giros reversos
Estructura terciaria
Originada por plegamientos adicionales, enrollamientos y otras formas de
agregacin. Son consecuencia de la interaccin de aminocidos situados muy
distantes en la secuencia. Muy importantes para el mantenimiento de la estructura
terciaria son los puentes disulfuro entre residuos de cistena distantes.
En general conectan sucesivamente lminas antiparalelas.
Cambian la direccin de la cadena, contribuyen a su forma compacta.
Generalmente en la superficie de la protena y poseen residuos cargados.
Estn formados por 4 aminocidos.
En la tabla aparecen las principales interacciones no covalentes que son importantes en el
mantenimiento de la estructura de las protenas.
La menor energa de estas interacciones las hacen importantes dado que pueden
romperse y volverse a formar durante las interacciones moleculares. Las interacciones
moleculares dependen de un rpido recambio de parejas moleculares que podra no
producirse si las interacciones fuesen ms fuertes.
Adems estas interacciones tambin estabilizan la estructura cuaternaria de las protenas,
nivel de organizacin que aparece en las protenas compuestas por ms de una cadena
polipeptdica.
La estructura cuaternaria se refiere a como las distintas cadenas polipeptdicas se asocian
entre s y se disponen espacialmente.
08/06/2014
Tipos de enlace que estabilizan la estructura terciaria de una protena
08/06/2014
Clasificacin de protenas de acuerdo a su
estructura terciaria
Protenas fibrosas
Haces de filamentos alargados
Resultan insolubles en agua
Fibrosas:
Adoptan una conformacin lineal con mltiples puntos de interaccin
entre las diferentes cadenas.
Interactan poco con los solventes, siendo insolubles en agua
Estn vinculadas a funciones estructurales, como la fibrona de la seda (bqueratina), las a-queratinas en uas, pelo, cuerno, piel y plumas y el
colgeno, en tejido conectivo.
Espiral enrollada formada por 2 hlices
Globulares:
Las cadenas estn enrolladas en el espacio (pte. disulfuro)
Adoptan formas esfricas o elipsoidales, colocando los grupos
hidrofbicos hacia su interior
A pH fisiolgico y por lo tanto son solubles en agua.
Asociadas a funciones biolgicas (transporte, defensa, enzimtica, etc).
Protofilamentos: formado por
2 espirales enrolladas
4 Protofilamentos
forman un filamento
10
08/06/2014
Protenas fibrosas la queratina
Protenas fibrosas la queratina
Las queratinas son las protenas ms
abundantes del pelo y las uas y forman
parte de la piel de los animales. Las alfaqueratinas son miembros de las
protenas filalentosas intermedias, que
realizan un funcin estructural muy
importante en el ncleo, citoplasma y
superficie de muchos tipos celulares. La
estructura tpica de las queratinas es la
siguiente: las molculas individuales
poseen largos fragmentos (aprox. 300
residuos) estructurados en forma de
alfa-hlice. Un par de hlices se
enrollan entre si para formar la
estructura de ovillo enrollado a
izquierdas; dos ovillos enrollados
vuelven a unirse para formar una
protofibrilla de cuatro molculas;
finalmente, ocho protofibrillas se unen
para formar una microfibrilla, que es la
base de la estructura del pelo. Las
microfibrillas son elsticas y flexibles.
Las alfa-queratinas presentan un mayor porcentaje de cistenas que otras protenas, con
lo que se pueden establecer puentes disulfuros entre las distintas estructuras
helicoidales, lo que da mayor rigidez a las microfibrillas.
Mediante la aplicacin de agentes reductores y de calor hmedo se puede cambiar el
patrn de enlaces disulfuro entre las distintas cadenas polipeptdicas. Aplicando agentes
oxidantes, una vez que el cabello se ha moldeado segn la forma deseada, se consigue
que se establezca un patrn de puentes disulfuro diferente y el cabello queda ondulado
de modo "permanente".
11
08/06/2014
Algunas protenas globulares
Mioglobina: nica
cadena de 153
residuos. 8 segmentos
rectos e hlice a
conectados por giros o
lazos. 70% de los
residuos en regiones
helicoidales
Citocromo c: nica
cadena de 100
residuos. 40% de los
residuos en regiones
helicoidales. El resto en
lazos, giros y
segmentos extendidos.
Lisozima: nica cadena
de 120 residuos. 40%
de los residuos en
regiones helicoidales
pero en distinta
distribucin. Tambin
posee conformacin b.
Algunas protenas globulares
Las protenas fibrosas tienen misiones estructurales en los organismos y por tanto son muy abundantes y
esenciales para el mismo. Sin embargo, la gran mayora de las funciones celulares las llevan a cabo protenas
globulares. Su nombre se debe a que sus cadenas polipptdicas se pliegan sobre si misma de manera
compacta. La gran variedad de plegamientos diferentes que encontramos en las protenas globulares refleja
la variedad de funciones que realizan estas protenas. A pesar de esta enorme variedad de plegamientos
podemos encontrar una serie de motivos y principios comunes.
La estructura terciaria de una protena es el modo en el cual se pliega la cadena polipetdica. La complejidad
que presenta la estructura terciaria de las protenas hace que se distingan subestructuras dentro de sta. En
la imagen vemos diferentes representaciones de la estructura terciaria de la mioglobina.
12
08/06/2014
Estructura cuaternaria de las protenas
Disposicin de protenas y subunidades proteicas en complejos tridimensionales.
Subunidades diferentes pueden llevar a cabo funciones separadas y las
interacciones entre subunidades pueden modificar la actividad enzimtica.
Conjugacin con grupos prostticos, cofactores, coenzimas, iones inorgnicos,
mollucas simples (H. de C), etc.
Grupo Hemo
(grupo prosttico)
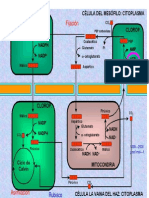
Hemoglobina: Transporta el O2 en la sangre de los pulmones a las clulas. 4 grupos prostticos
hemo y 4 cadenas polipeptdicas.
- Proteica (globina): 2 cadenas a (141 residuos c/u) y 2 cadenas b (146 residuos c/u).
- Las cadenas a y b contienen varios segmentos de hlice a separados por lazos peptdicos.
- Cada cadena tiene un grupo hemo.
-Anemia falciforme: reemplazo del aa146 (Val por Glu) de la cadena b.
-Anemias: desplazamiento del Fe2+ por H2O
13
08/06/2014
La triple hlice del colgeno
resiste la tensin y el
estiramiento
Cuando el colgeno se
desnaturaliza (pierde su estructura
terciaria/cuaternaria), se
transforma en gelatina: las hebras
se separan en cadenas pseudo
globulares irregulares
Gly X- Y muy frecuentemente Gly Pro Hpro
Cadenas que forman hlices izquierdas!
La Hpro no est codificada
por el ADN y se biosintetiza
por hidroxilacin de la Pro.
El alto contenido de Pro e Hpro trae como
consecuencia la formacin de hlices izquierdas de
manera espontnea
3 cadenas de colgeno se asocian entre s y forman un
arreglo que determina su estructura cuaternaria
El colgeno es una protena fibrosa componente de la piel, los huesos, los tendones y los dientes. La
unidad bsica de la fibra de colgeno es una triple hlice denominada tropocolgeno. Cada cadena del
tropocolgeno, de unos 1000 residuos de longitud, est formado por una hlice a izquierda con 3,3
residuos por vuelta y 0,29 nm de elevacin. Las tres cadenas que forman el tropocolgeno se enrollan
entre s a derechas. La secuencia de aminocidos del colgeno es extraordinariamente regular.
Prcticamente cada tres residuos contiene una glicina, tambin presenta una mayor proporcion de
prolina que el resto de las protenas. Otra caracterstica es la presencia de residuos de 4-hidroxiprolina,
aminocidos que raramente se encuentra en otras protenas. Los residuos de glicina se sitan en la zona
del tropocolgeno donde las tres hlices se encuentran ms cerca, lo que hace que sea este aminocido
el nico que no presente impedimentos estricos en dicha posicin.
14
08/06/2014
Factores que modifican la estructura de las
protenas. Desnaturalizacin
La desnaturalizacin es la prdida de la estructura terciaria de la
protena, de forma reversible o irreversible. La protena cambia sus
propiedades fsicas y suele perder o cambiar su actividad biolgica.
pH
Temperatura
Fuerza inica
Complejacin con metales
Oxidacin o reduccin (formacin o ruptura de
puentes disulfuro)
15
You might also like
- Guia ValidacionDocument55 pagesGuia ValidacionFender Strat100% (1)
- Validación limpieza farmacéuticaDocument16 pagesValidación limpieza farmacéuticaMayrascencio94% (16)
- Reglamento de Buenas Practicas de ManufacturaDocument50 pagesReglamento de Buenas Practicas de Manufacturaspeaker31No ratings yet
- Daughter of No Worlds by Carissa Broadbent (009-020) (1) .En - EsDocument12 pagesDaughter of No Worlds by Carissa Broadbent (009-020) (1) .En - EsJemerling RondónNo ratings yet
- Ejmeplo de Plan Maestro de Validaciones EjemploDocument24 pagesEjmeplo de Plan Maestro de Validaciones EjemploEugenio Rangel León88% (8)
- Ciclo CelularDocument23 pagesCiclo CelularDiego Girón100% (2)
- Cunicultura. SenaDocument21 pagesCunicultura. Senadianyvgn100% (3)
- Anatomia Dentaria PDFDocument49 pagesAnatomia Dentaria PDFEMMA ALISON ANINIR NEYEZNo ratings yet
- Evaluación animales invertebradosDocument9 pagesEvaluación animales invertebradosDaniella HerreraNo ratings yet
- Anatomia Región OcciptofrontalDocument4 pagesAnatomia Región OcciptofrontalThiago Ribeiro da Silva100% (1)
- Libro GeneticaDocument203 pagesLibro GeneticaLaraBen79No ratings yet
- Rtas. Esperadas - Parcial Practico IBMC 2015Document6 pagesRtas. Esperadas - Parcial Practico IBMC 2015LaraBen79No ratings yet
- Primer Parcial IBMC-2015Document4 pagesPrimer Parcial IBMC-2015LaraBen79100% (1)
- 2do Parcial Teorico IBMC 2015 Rtas. EsperadasDocument3 pages2do Parcial Teorico IBMC 2015 Rtas. EsperadasLaraBen79No ratings yet
- 1er Parcial IBMC 2015 - Respuestas EsperadasDocument3 pages1er Parcial IBMC 2015 - Respuestas EsperadasLaraBen79No ratings yet
- Algas 2Document42 pagesAlgas 2LaraBen79No ratings yet
- AminoácidosDocument20 pagesAminoácidosLaraBen79No ratings yet
- Pequeñas Estafas PedagógicasDocument26 pagesPequeñas Estafas PedagógicasAnabel BlancoNo ratings yet
- FotosintesisDocument21 pagesFotosintesisLaraBen79No ratings yet
- GP02Document13 pagesGP02LaraBen79No ratings yet
- Procedimiento de Auditoria InternaDocument8 pagesProcedimiento de Auditoria InternajumancesuNo ratings yet
- Algas - Primera ParteDocument51 pagesAlgas - Primera ParteLaraBen79No ratings yet
- Técnicas EspectroscópicasDocument21 pagesTécnicas EspectroscópicasSérgio MateusNo ratings yet
- Tema 10 QODocument44 pagesTema 10 QOYamilito GarnicaNo ratings yet
- Peptidos y ProteinasDocument13 pagesPeptidos y ProteinasLaraBen79No ratings yet
- AAVV - Evolución - La Base de La BiologíaDocument535 pagesAAVV - Evolución - La Base de La BiologíaPaul Dante Carranco Blanquet100% (2)
- Am in AsDocument23 pagesAm in AsLaraBen79No ratings yet
- RMN 2014Document10 pagesRMN 2014LaraBen79No ratings yet
- Lípidos 2014Document18 pagesLípidos 2014LaraBen79No ratings yet
- Acidos CarboxílicosDocument30 pagesAcidos CarboxílicosLaraBen79No ratings yet
- AlquenosDocument41 pagesAlquenosLaraBen79No ratings yet
- Buenas Practicas ManufacturaDocument74 pagesBuenas Practicas ManufacturalargoxxxNo ratings yet
- Grupos Protectores en Química OrgánicaDocument40 pagesGrupos Protectores en Química Orgánicafernandopessoa25No ratings yet
- AlcoholesDocument24 pagesAlcoholesMadeley VilchezNo ratings yet
- Expo SuturasDocument100 pagesExpo SuturasAngel A. Gutierrez Jimenez100% (1)
- 2017.1. Practica OpalinidosDocument3 pages2017.1. Practica OpalinidosDanielIsaabNo ratings yet
- Glosario Entomologia GeneralDocument18 pagesGlosario Entomologia GeneralGeovanny Cepeda100% (1)
- Filariasis PDFDocument27 pagesFilariasis PDFJenniffers TorresNo ratings yet
- Que Forma A Un LeónDocument6 pagesQue Forma A Un LeónEstefanía ReyNo ratings yet
- Crotalus CatalalinensisDocument2 pagesCrotalus CatalalinensisAntonioNo ratings yet
- Los Principios de La Evolución BiológicaDocument12 pagesLos Principios de La Evolución BiológicaAnonymous fUZQVBW0No ratings yet
- Morfogénesis de las plantas: desarrollo de tejidos y órganosDocument15 pagesMorfogénesis de las plantas: desarrollo de tejidos y órganosAntonio OmogrossoNo ratings yet
- Contrucción de CladorgramasDocument4 pagesContrucción de CladorgramasCatalino Miauw MiawNo ratings yet
- Caracterización morfológica de PoríferosDocument17 pagesCaracterización morfológica de Poríferosmarix644No ratings yet
- Iberomyrmex 5Document56 pagesIberomyrmex 5francispereaNo ratings yet
- Ejercicio 1 EcuacionesDocument2 pagesEjercicio 1 EcuacionesANDRES ROJASSNo ratings yet
- Proceso de HumanizacionDocument11 pagesProceso de HumanizacionCarlos Alberto Ardila RuizNo ratings yet
- Neuroanatomia - CerebeloDocument6 pagesNeuroanatomia - CerebeloJuan Diego Mosquera RodriguezNo ratings yet
- Biología y alimentación de los CoccinellidaeDocument7 pagesBiología y alimentación de los Coccinellidaejesusrondinel6966No ratings yet
- Anatomía dental y columna vertebral en animalesDocument13 pagesAnatomía dental y columna vertebral en animalesJennifer ChicaizaNo ratings yet
- Hueso TemporalDocument26 pagesHueso TemporalNazarena Cerrato0% (1)
- Determinación del mercado potencial y meta para productos en La MolinaDocument20 pagesDeterminación del mercado potencial y meta para productos en La MolinaBayona Mendoza DavidNo ratings yet
- CARATULASDocument5 pagesCARATULASMaritza Elizabeth SNo ratings yet
- Las Grullas CantorasDocument2 pagesLas Grullas CantorasÓscar EdutecaNo ratings yet
- Anatomía de los AnélidosDocument4 pagesAnatomía de los AnélidosCheril MejíaNo ratings yet
- 01 Correa Et Al 2011 6Document21 pages01 Correa Et Al 2011 6Helen Diaz-PaezNo ratings yet
- Adaptacion y SeleccionDocument34 pagesAdaptacion y SeleccionDavid Vidal Núñez100% (1)
- Guía para El Autoexamen de MamasDocument3 pagesGuía para El Autoexamen de MamasAdrian Carbo TapiaNo ratings yet