Professional Documents
Culture Documents
INFORME FINAL Esterificacion
Uploaded by
Hernann von HelmholtzCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
INFORME FINAL Esterificacion
Uploaded by
Hernann von HelmholtzCopyright:
Available Formats
Universidad Nacional de Colombia 2015
FACULTAD DE INGENIERA
REA DE INGENIERA QUMICA Y AMBIENTAL
LABORATORIO DE OPERACIONES DE SEPARACIN, REACCIN Y CONTROL
Informe final No 2: Obtencin de acetato de isoamilo por esterificacin de cido actico con
alcohol isoamlico catalizada por cido sulfrico
Profesor: Ing. Germn Andrs Cabrera Rojas
Estudiantes:
Jacobo Alberto Benavides Blanco
Erika Tatiana Fajardo Ariza
William Fernando Sotelo Bernal
Felipe Andrs Villamil Quintero
Cdigo: 245562
Cdigo: 244784
Cdigo: 245306
Cdigo: 245590
INFORME FINAL
1. Resumen
El proceso de esterificacin de alcohol isoamlico y cido actico para producir acetato de
isoamilo fue estudiado en un reactor batch a escala de laboratorio para evaluar los parmetros
cinticos del proceso anteriormente mencionado. Se estudi la influencia de la concentracin de
las especies reaccionantes y la influencia de la temperatura sobre los parmetros de la cintica de
la reaccin. Los ensayos se llevaron a cabo para dos temperaturas distintas (65C y 75C) y con
concentraciones en distintas proporciones molares de los reactantes. Se determinaron los
parmetros de molecularidad de la reaccin anteriormente mencionada y la constante k en
funcin de la temperatura. Los resultados obtenidos son acordes a lo supuesto desde la ruta
qumica de la reaccin.
Esterificacin
Jacobo Benavides, Erika Fajardo, William Sotelo, Felipe Villamil
Universidad Nacional de Colombia 2015
2. Introduccin
El problema de la cintica qumica est relacionado con la velocidad de reaccin, e
industrialmente este parmetro o conjunto de caractersticas de una reaccin definen varios
aspectos importantes de un proceso: factibilidad econmica, tamao de equipos, flujos de
reactante y proporciones, tiempo de operacin y temperatura de mejor conversin.
La reaccin se puede llevar a cabo en un reactor batch, que tendr un determinado tiempo para
lograr cierta conversin; o en un reactor empacado que tendr una determinada longitud para
lograr a la salida una conversin deseada; tambin un reactor continuo de mezcla perfecta que
tendr un tamao determinado para una conversin deseada. A lo largo de estos procesos la
concentracin de reactantes va cambiando y esta concentracin es la directamente relacionada
con la velocidad, pues a mayor concentracin la posibilidad de choque ser mayor y se efectuar
ms rpido la reaccin.
Por otro lado, surge la incgnita de cmo se ve ese cambio, si es un cambio grande, pequeo, y
en qu medidas; adems de cul es la temperatura optima de la reaccin, si es mejor en fro o en
caliente, qu tan fro o caliente. Todo lo anterior lleva a la necesidad de caracterizar la
dependencia de la velocidad de reaccin respecto a la concentracin de reactivos y respecto a la
temperatura; adems de otras condiciones de reaccin que son importantes como el catalizador,
su naturaleza y su concentracin.
Ahora, segn la necesidad de caracterizar la velocidad, la forma ms fcil de hacerlo es medir
concentracin en funcin del tiempo para una temperatura dada, de forma que por regresin
lineal se pueda determinar la dependencia de la velocidad respecto a cada parmetro y haciendo
el ensayo a distintas temperaturas y concentraciones de catalizador para determinar la
dependencia con la temperatura y el catalizador. Ahora bien, existe el problema de la
termodinmica de la reaccin, pues muchas veces las reacciones llegan a un equilibrio en una
mezcla de reactivos y productos, sugiriendo que la reaccin no se lleva a cabo completamente
sino que parcialmente, por lo cual en el diseo de reactores debe tenerse en cuenta la cintica
reversa y la constante de equilibrio.
Esterificacin
Jacobo Benavides, Erika Fajardo, William Sotelo, Felipe Villamil
Universidad Nacional de Colombia 2015
3. Metodologa empleada
3.1. Materiales y reactivos empleados
Para realizar los ensayos se utilizaron los reactivos de inters anteriormente mencionados;
Alcohol isoamlico, cido actico glacial, cido sulfrico como catalizador, hidrxido de
potasio como titulante para la neutralizacin, biftalato de potasio como sustancia estndar y
agua destilada para disolver el hidrxido de potasio.
Reactivos
300 ml cido actico glacial
300 ml Alcohol isoamlico
99%
300 ml Acetato de isoamilo
99%
25 ml cido sulfrico
concentrado
40 g KOH en lentejas
4 g Biftalato de potasio
Agua destilada
Fenolftaleina
Materiales utilizados
Erlenmeyer
Vasos de precipitado
Termmetro
Reactor enchaquetado
Agitador de vidrio
Balones aforados de 100 y 200
ml
Montaje de titulacin
Balanza analtica
3.2. Descripcin del equipo
El equipo con el que se cuenta es un reactor enchaquetado con un sistema de bombeo de
lquido calefactor, de forma que el mismo reactor permanece isotrmico durante el curso se
la reaccin; el reactor cuenta con una columna de condensacin que se encarga de devolver
a la mezcla los productos volatilizados. El reactor tambin cuenta con un mezclado
mecnico o magntico y una apertura en la tapa para pipetear las cantidades necesarias de
muestra a titular y medirles el valor acido. La capacidad mxima del reactor es de 500 ml y
puede usarse para temperaturas de hasta 100 grados Celsius pues cuenta con un calefactor
de aceite trmico. De igual manera se necesitan buretas y vasos de precipitado para titular la
muestra y pipetas para obtener la muestra de reaccin, mediante un montaje de titulacin
cido-base, como se muestran en las figuras 1 y 2.
Figura 1. Esquema del reactor enchaquetado usado1
1
Elaboracin propia
Esterificacin
Jacobo Benavides, Erika Fajardo, William Sotelo, Felipe Villamil
Universidad Nacional de Colombia 2015
3.3. Descripcin del procedimiento
Se midieron distintas cantidades de los reactivos iniciales, los cuales fueron cargados dentro
del reactor fro. Posteriormente la mezcla fue calentada hasta la temperatura de inters (es de
notar que durante este lapso de tiempo la reaccin no sucede pues no est catalizada y para
que se autocatalice se requiere de un tiempo muy prolongado). Una vez los reactivos estn a
la temperatura deseada se procede a agregar tres mililitros de acido sulfrico y en el momento
de adicionarlos empieza a medirse el tiempo. Durante este tiempo se pipetean varias muestras
de la mezcla reaccionante, se enfra la muestra y procede a titularse con KOH estandarizado,
para determinar el grado de acidez de la mezcla y con ello determinar la concentracin de
cido actico e indirectamente la de alcohol isoamlico. Con estos datos se puede relacionar la
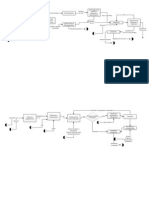
velocidad de reaccin. El procedimiento se esquematiza en la figura 3.
Figura 2. Esquema del montaje de titulacin usado2
3.4. Diagrama de flujo del procedimiento
Figura 3. Diagrama de bloques de proceso de medicin de la cintica de la esterificacin
2
Tomado de http://amqsena1003km.blogspot.com/2014/07/titulacion-acido-base.html
Esterificacin
Jacobo Benavides, Erika Fajardo, William Sotelo, Felipe Villamil
Universidad Nacional de Colombia 2015
3.5. Diagrama de flujo del proceso
Figura 4. Diagrama de proceso de medicin de la cintica de la esterificacin
4. Tablas de datos
Tabla 1. Datos iniciales recolectados en el experimento
Muestra
1
2
3
Ensayo 1
T C
Vol. KOH (mL)
4.3
7.45
7.3
Cantidades iniciales (mL)
Muestra
1
2
3
5
Ensayo 2
T C
Vol. KOH (mL)
25.8
23
22.5
75
t(min)
0
7
11
Alcohol
Acido actico
cido Sulfrico
Vol. muestra (ml)
2
5
5
38
20
3.2
75
t(min)
0
5
10
Vol. muestra (ml)
5
5
4.9
Esterificacin
Jacobo Benavides, Erika Fajardo, William Sotelo, Felipe Villamil
Universidad Nacional de Colombia 2015
Tabla 1. Datos iniciales recolectados en el experimento (continuacin)
Cantidades iniciales (mL)
Muestra
1
2
3
Ensayo 3
T C
Vol. KOH (mL)
6.75
5.35
5.1
Cantidades iniciales (mL)
Muestra
1
2
3
Ensayo 4
T C
Vol. KOH (mL)
15.6
13
9.25
Cantidades iniciales (mL)
Alcohol
Acido actico
cido Sulfrico
22
34
3
75
t(min)
0
5
10
Alcohol
cido actico
cido Sulfrico
Vol. muestra (mL)
4.9
5
5
48
8
3
65
t(min)
0
5
10
Alcohol
cido actico
cido Sulfrico
Vol. muestra (mL)
5
5
5
38
20
3
Ensayo 5
T C
Vol. KOH (mL)
21.5
20.95
20.2
75
Muestra
t(min)
Vol. muestra (mL)
1
0
4.9
2
5
5
3
11
4.9
Acetato de isoamilo
30
Agua
3.6
Cantidades iniciales (mL)
cido actico
24
Sulfrico
3
Estandarizacin KOH
Biftalato de potasio (g) 2.054
Volumen KOH (mL)
4.9
[M] KOH
2.012
Tabla 2. Datos iniciales estandarizacin de hidrxido de potasio
6
Esterificacin
Jacobo Benavides, Erika Fajardo, William Sotelo, Felipe Villamil
Universidad Nacional de Colombia 2015
5. Tablas de resultados
V. inicial
(mL)
Tabla 3. Ensayo 1, concentraciones equimolares de cido actico y alcohol isoamlico a 75C, 5% v/v de H2SO4.
1
2
3
Alcohol I.
cido A.
A.Sulfrico
Vol. KOH
(mL)
4,3
7,45
7,3
38
20
3,2
t(min)
0
7
11
Vol. muestra
(mL)
2
5
5
Moles KOH
0,0086
0,0150
0,0147
Concentracin
cido actico (M)
4,325
2,997
2,937
V. inicial
(mL)
Tabla 4. Ensayo 2, concentraciones 75-25% molar de cido y alcohol respectivamente, a 75C, 5% v/v de H2SO4.
1
2
3
Alcohol I.
cido A.
A.Sulfrico
Vol. KOH
(mL)
25,8
23
22,5
22
34
3
t(min)
0
5
10
Vol. muestra
(mL)
5
5
4,9
Moles KOH
0,0520
0,0463
0,0453
Concentracin
cido actico (M)
10,380
9,253
9,237
Tabla 5. Ensayo 3, concentraciones 25-75% molar de cido actico y alcohol isoamlico respectivamente, a 75C,
V. inicial
(mL)
5% v/v de H2SO4
1
2
3
Alcohol I.
cido A.
A.Sulfrico
Vol. KOH
(mL)
6,75
5,35
5,1
48
8
3
t(min)
0
5
10
Vol. muestra
(mL)
4,9
5
5
Moles KOH
0,0136
0,0108
0,01026
Concentracin
cido actico (M)
2,771
2,152
2,052
Esterificacin
Jacobo Benavides, Erika Fajardo, William Sotelo, Felipe Villamil
Universidad Nacional de Colombia 2015
Tabla 6. Ensayo 4, concentraciones equimolares de cido actico y alcohol isoamlico respectivamente, a 65C, 5%
V. inicial
(mL)
v/v de H2SO4
1
2
3
Alcohol I.
cido A.
A.Sulfrico
Vol. KOH
(mL)
15,6
13
9,25
38
20
3
t(min)
0
5
10
Vol. muestra
(mL)
5
5
5
Moles KOH
0,031380276
0,02615023
0,018606895
Concentracin
cido actico (M)
6,276055235
5,230046029
3,721378905
Tabla 7. Ensayo 5, concentraciones equimolares de acetato de isoamilo y agua con cido actico como inerte a 75C,
V. inicial
(mL)
5% v/v de H2SO4
1
2
3
Acetato de
isoamilo
Agua
cido actico
cido Sulfrico
Vol. KOH t(mi Vol. muestra
(mL)
n)
(mL)
21,5
0
4,9
20,95
5
5
20,2
11
4,9
Moles
KOH
0,043
0,042
0,041
Concentracin cido
actico (M)
8,823
8,428
8,292
30
3,6
24
3
6. Muestra de clculo
Durante la experimentacin en el ensayo para la reaccin reversa de la esterificacin, se
presentaron dos fases lquidas, lo que imposibilit la adecuada medicin del valor cido, por ello
los clculos se desarrollan con los primeros 4 ensayos, que corresponden a la reaccin de
esterificacin.
Clculo de la velocidad inicial:
Se realiz regresin polinmica a cada conjunto de datos, para obtener una expresin que
represente adecuadamente la relacin tiempo-concentracin acido. El ajuste polinmico y las
expresiones obtenidas, se muestran en la figura 5.
8
Esterificacin
Jacobo Benavides, Erika Fajardo, William Sotelo, Felipe Villamil
Universidad Nacional de Colombia 2015
Concentracin de cido respecto al tiempo
12
y = 0,0222x2 - 0,3363x + 10,38
Concentracin acido (M)
10
8
y = -0,0093x2 - 0,1629x + 6,2761
6
y = 0,0159x2 - 0,3008x + 4,3248
4
y = 0,0104x2 - 0,1755x + 2,771
2
0
0
10
Tiempo (min)
Equimolar a 75C
75% Acido - 25% Alcohol a 75C
75% Alcohol - 25% Acido a 75C
Figura 5. Perfiles de concentracin para diferentes concentraciones iniciales de cido actico y alcohol isoamlico.
Con estos ajustes polinmicos se calcul la velocidad de reaccin inicial (derivada en tiempo 0).
Los resultados se muestran en la tabla 8.
Tabla 8. Velocidades iniciales calculadas
ra (mol/min)C. cido (M) C. Alcohol (M)
Ensayo 1 Equimolar 75
Ensayo 2Exceso de Acido
Ensayo 3 Exceso de alcohol
Ensayo 4 Equimolar 65
-0,3008
-0,3363
-0,1755
-0,1629
5,708
10,066
2,369
5,708
5,684
3,414
7,448
5,684
Con estos datos se procedi a calcular por regresin de mnimos los rdenes de reaccin y la
energa de activacin (el ensayo 4 fue realizado a una temperatura diferente que los precedentes).
Los resultados de la regresin se muestran en la tabla 9.
Esterificacin
Jacobo Benavides, Erika Fajardo, William Sotelo, Felipe Villamil
Universidad Nacional de Colombia 2015
Tabla 1. Parmetros obtenidos por el ajuste de mnimos cuadrados.
Parmetro
Valor ajustado
Orden de reaccin acido actico
0.9124
Orden de reaccin alcohol isoamlico
0.9310
2
Constante cintica k (L /mol.min)
0.012582
Energa de activacin (J/mol)
89934.28
De la regresin se deduce que la expresin para la reaccin hacia la derecha (cido y alcohol
como reactivos) es:
= 0.9124 0.9310
Donde, Ca y Cb representan las concentraciones molares de cido actico y alcohol isoamlico
respectivamente.
La reaccin reversible se obtuvo por medio de un anlisis de consistencia termodinmica,
teniendo por lo que los rdenes del agua y del acetato de isoamilo son:
:
:
Donde, alfa y beta representan el orden de reaccin para el agua y el acetato respectivamente en
la reaccin hacia la derecha (cido y alcohol como reactivos), m y n representan el coeficiente
estequiomtrico del agua y el acetato respectivamente.
Tal como reporta la bibliografa (Osorio, 2012), esta reaccin presenta un calor de reaccin
estadsticamente comparable a cero, por lo que no se espera cambios significativos en la
conversin de equilibrio e implcitamente en el valor de la constante de equilibrio. Lo anterior
permite fijar la constante de equilibrio como una constante en la expresin cintica. Del anlisis
termodinmico de la reaccin, se encuentra que:
= 14.92 /
= 2.70303
De lo anterior se encuentra que la reaccin cintica para la esterificacin entre cido actico y
alcohol isoamlico es:
= () ( 0.9124 0.9310
10
1
)
2.70303
Esterificacin
Jacobo Benavides, Erika Fajardo, William Sotelo, Felipe Villamil
Universidad Nacional de Colombia 2015
Donde la dependencia de k con la temperatura, viene dada por:
() = 0.012582 (
89934.28 1
1
(
))
8.314
348.15
2
[
]
.
T en kelvin.
Ca, Cb, Cc y Cd son concentraciones molares del cido actico, alcohol isoamlico, agua y acetato
de isoamilo respectivamente.
7. Anlisis de resultados
Los resultados obtenidos se lograron a partir una reaccin de esterificacin del alcohol isoamlico
con el cido actico para formar acetato de isoamilo. Dicha reaccin se llev a cabo en un reactor
tipo batch con agitacin constante (mediante agitador magntico), bajo distintas condiciones en
varios ensayos. En el primer ensayo la reaccin llevada a cabo agregando composiciones
cantidades volumtricas de ambos reactivos (Alcohol y cido) en las cantidades necesarias para
tener una relacin estequiometria (1 a 1 dada la reaccin), esta reaccin se llev a cabo a 75 C y
en presencia de catalizador homogneo (cido sulfrico) y se siguieron las concentraciones
iniciales y a tiempos de 5 y 10 min, para posteriormente aplicar la derivada de tres puntos y
determinar el cambio diferencial de la concentracin con el tiempo (dCa/dt) requerido para
poder aplicar el mtodo de velocidades iniciales. Luego se llevaron a cabo los ensayos 2 y 3 a la
misma temperatura pero con excesos de alcohol en uno y de cido en el otro, para as poder
determinar los rdenes de reaccin en la ecuacin cintica. Se propuso hacer el mismo mtodo
con la fase reaccin reversa partiendo de los productos que son acetato de isoamilo y agua, pero
al invertirse la reaccin la formacin de los reactivos y las concentraciones en el reactor
propiciaron la formacin de dos fases que dificultaron la determinacin del valor cido, y
produciendo errores significativos que podran alterar los resultados, por lo cual al no tener
valores adecuados en estos ensayos se dejaron por fuera de la determinacin de la cintica.
De los resultados presentados en la tabla 9 se obtuvieron los rdenes de reaccin hacia la derecha
y luego por consistencia termodinmica se obtuvieron los rdenes de la reaccin reversa,
obteniendo as la ecuacin
= () ( 0.9124 0.9310
1
)
2.70303
Para continuar con la descripcin de fenmenos cinticos que ocurren en la esterificacin, se ha
calculado la energa caracterstica de la activacin para la reaccin y el factor pre exponencial
determinado por la ecuacin de Arrhenius como parmetros caractersticos de la constante
cintica. Estos valores se calculan a partir de los resultados encontrados por el mtodo de
velocidades iniciales aplicado en el ensayo 4 que se llev a cabo a una temperatura de 65 C con
11
Esterificacin
Jacobo Benavides, Erika Fajardo, William Sotelo, Felipe Villamil
Universidad Nacional de Colombia 2015
el fin de describir el efecto de la temperatura en la reaccin, estos parmetros slo se pueden
encontrar cuando se comparan diferente cintica a distintas temperaturas. Con este valor es
posible determinar la dependencia de la cintica con la temperatura para hacerla aplicable en un
rango de temperaturas ms amplio.
Esta cintica se compar con la cintica de esta reaccin propuesta por Osorio en su tesis
(Osorio, 2002)
= 1 (
1
)
()
Donde llevando a cabo un desarrollo matemtico riguroso determinar que los modelos apunta a
un valor del de 0, con lo cual la cintica toma la forma de
= 1 (
1
)
()
Y que adems encontr que la constante de equilibrio (Keq) tiene una dependencia con la
temperatura dbil, por lo cual en intervalos de temperatura de 290 a 360 K se puede considerar
como un valor constante, razn por la cual el valor presentado en la cintica es presentado como
una constante y no como un valor dependiente de la temperatura.
De esta manera se logra ver una consistencia entre los valores obtenidos y los reportados en la
literatura. Los valores obtenidos en la prctica luego de los ajustes arrojaron valores cercanos a
1, entre las razones por las cuales se presentan estas desviaciones se asocian que: los reactivos no
son 100 % puros y pueden contener trazas de otros compuestos. La valoracin se llev a cabo
tan inmediatamente se extrae la muestra del reactor pero sin embargo la reaccin segua
llevndose a cabo dentro de la muestra cambiando el valor cido de la muestra; los tiempos
exactos de toma de muestras pueden tener errores debido al tiempo que toma extraer la muestra,
durante la reaccin se dio cambio de fase debido a que muchas molculas obtenan energa
suficiente para cambiar de estado, y dado que era un reactor abierto a la atmsfera, no era posible
retener estos vapores durante el experimento. Todos estos fenmenos conllevaron por tanto a
una serie de acumulacin de error que terminan arrojando un valor ligeramente alejado del valor
esperado.
Condiciones optimas de operacin
Con los resultados obtenidos es posible determinar que las condiciones ptimas para la una alta
conversin es llevar a cabo la reaccin en un reactor que garantice la fase liquida, llevar la
temperatura hasta la mxima posible que garantice el estado lquido de los componentes. Y para
mejorar la conversin al estar limitada por el equilibrio, se recomienda retirar el agua para poder
desplazar la reaccin y as beneficiar la formacin de ms acetato de isoamilo.
12
Esterificacin
Jacobo Benavides, Erika Fajardo, William Sotelo, Felipe Villamil
Universidad Nacional de Colombia 2015
8. Conclusiones
8.1. Se determin la cintica de la reaccin de esterificacin para la obtencin de acetato de
isoamilo.
8.2. Se establecieron las mejores condiciones de operacin para el proceso de esterificacin.
8.3. Se obtuvo informacin cintica experimental similar a la reportada por literatura.
9. Sugerencias y recomendaciones
9.1. Realizar un montaje de equipos tal que permita retirar agua condensada para evitar que
ocurra la reaccin reversa a la esterificacin
9.2. Reducir el tiempo de toma de muestras y la valoracin para evitar variaciones significativas
en el avance de la reaccin
9.3. Fijar siempre la temperatura de reaccin dentro del contenido del reactor antes de adicionar
el catalizador
9.4. Iniciar con los ensayos a menor temperatura y luego realizar incrementos de la misma por
funcionamiento del equipo: toma ms tiempo reducir la temperatura del aceite de la
chaqueta que incrementarla.
10. Referencias
Fogler, H. S. (1999). Elements of chemical reaction engineering.
Narvez Rincn, P. (2004). Diseo conceptual de procesos qumicos. Metodologa con
aplicaciones en esterificacin. Bogot, Cundinamarca: Universidad Nacional de Colombia.
Wilmar, O. (2014). Desarrollo de un proceso intensificado para la produccin de acetato de isoamilo mediante
tecnologa de membranas. Bogota: Universidad Nacional de Colombia.
13
Esterificacin
Jacobo Benavides, Erika Fajardo, William Sotelo, Felipe Villamil
You might also like
- NTP 400.012 GranulometríaDocument18 pagesNTP 400.012 GranulometríaCesar Stevens Melgarejo Serna100% (7)
- Visita A Estación MeteorológicaDocument28 pagesVisita A Estación MeteorológicaStephanie MéndezNo ratings yet
- Curso de Bovinos de Carne Paty IIDocument23 pagesCurso de Bovinos de Carne Paty IIRobert Ayala HerreraNo ratings yet
- U1-Conducción en Estado EstableDocument20 pagesU1-Conducción en Estado EstableAlex MeloNo ratings yet
- Manual - Berço Aquecido AMPLA 2085 - ESPANHOL - UnlockedDocument101 pagesManual - Berço Aquecido AMPLA 2085 - ESPANHOL - UnlockedOvidio Cabezas TorrezNo ratings yet
- Desarrolo Final APMFIDocument296 pagesDesarrolo Final APMFImasdel012486% (14)
- Un Problema para Cada Día 3ºDocument149 pagesUn Problema para Cada Día 3ºValesca Varela AburtoNo ratings yet
- E MisionesDocument6 pagesE MisionesHernann von HelmholtzNo ratings yet
- Analisis de ReultadosDocument2 pagesAnalisis de ReultadosHernann von HelmholtzNo ratings yet
- EntregafinalDocument23 pagesEntregafinalHernann von HelmholtzNo ratings yet
- COPERT CompiladoDocument28 pagesCOPERT CompiladoHernann von HelmholtzNo ratings yet
- Taller 3 DiseñoDocument12 pagesTaller 3 DiseñoHernann von HelmholtzNo ratings yet
- Tarea Del Reactor de EstirenoDocument6 pagesTarea Del Reactor de EstirenoHernann von HelmholtzNo ratings yet
- Adhesivos de Contacto en MosqueraDocument5 pagesAdhesivos de Contacto en MosqueraHernann von HelmholtzNo ratings yet
- Prevención contaminación cementos contactoDocument25 pagesPrevención contaminación cementos contactoHernann von HelmholtzNo ratings yet
- Tarea EmisionesDocument3 pagesTarea EmisionesHernann von HelmholtzNo ratings yet
- Adsorción INFORMEDocument11 pagesAdsorción INFORMEHernann von HelmholtzNo ratings yet
- Aca Dice Que Hhay Secadores Rotatorios de Mas de 3 Metros de DiametroDocument6 pagesAca Dice Que Hhay Secadores Rotatorios de Mas de 3 Metros de DiametroHernann von HelmholtzNo ratings yet
- Taller 3 DiseñoDocument5 pagesTaller 3 DiseñoHernann von HelmholtzNo ratings yet
- Formato Inscripcion TGDocument2 pagesFormato Inscripcion TGHernann von HelmholtzNo ratings yet
- Combustión y Su TecnologíaDocument1 pageCombustión y Su TecnologíaHernann von HelmholtzNo ratings yet
- Detergent EsDocument2 pagesDetergent EsHernann von HelmholtzNo ratings yet
- Ruta Quifmica de N PropanolDocument3 pagesRuta Quifmica de N PropanolHernann von HelmholtzNo ratings yet
- ControlDocument8 pagesControlHernann von HelmholtzNo ratings yet
- Contextualizacion IndustrialDocument3 pagesContextualizacion IndustrialHernann von HelmholtzNo ratings yet
- Ruta química de n-propanol: Hidroformilación e hidrogenaciónDocument2 pagesRuta química de n-propanol: Hidroformilación e hidrogenaciónHernann von HelmholtzNo ratings yet
- Producción de Propanol Iso RutasDocument12 pagesProducción de Propanol Iso RutasHernann von HelmholtzNo ratings yet
- PDF Taller 1Document2 pagesPDF Taller 1Hernann von HelmholtzNo ratings yet
- Ruta Quimica de GN PropanolDocument3 pagesRuta Quimica de GN PropanolHernann von HelmholtzNo ratings yet
- Sostenibilidad en Matriales UN Agosto 13 2015Document1 pageSostenibilidad en Matriales UN Agosto 13 2015Hernann von HelmholtzNo ratings yet
- Preinforme Coeficiente de TransferenciafinalDocument5 pagesPreinforme Coeficiente de TransferenciafinalHernann von HelmholtzNo ratings yet
- ACTA No TalesDocument3 pagesACTA No TalesHernann von HelmholtzNo ratings yet
- Plantilla de CalculoDocument262 pagesPlantilla de CalculoHernann von HelmholtzNo ratings yet
- Plantilla de CalculoDocument262 pagesPlantilla de CalculoHernann von HelmholtzNo ratings yet
- Proyecto Termodinamica TerminadoDocument8 pagesProyecto Termodinamica TerminadoHernann von HelmholtzNo ratings yet
- Preinforme de La Practica de SolubilidadDocument9 pagesPreinforme de La Practica de SolubilidadHernann von HelmholtzNo ratings yet
- Tipo de PeinesDocument4 pagesTipo de PeinesPettherTorresNo ratings yet
- DuctilidadDocument8 pagesDuctilidad'Yaahiir CruzNo ratings yet
- Lección 4Document5 pagesLección 4Monica PatiñoNo ratings yet
- KCT2010 Manual Usuario - ES PDFDocument21 pagesKCT2010 Manual Usuario - ES PDFcandywoman2No ratings yet
- Física TareaDocument3 pagesFísica TareaHector TrianaNo ratings yet
- Flujo HorizontalDocument7 pagesFlujo HorizontalAlan Cristian Espinoza AguilarNo ratings yet
- Reporte No.2 - CristalizacionDocument13 pagesReporte No.2 - CristalizacionMarian Jiménez100% (1)
- Capacidad Calorifica de LíquidosDocument4 pagesCapacidad Calorifica de LíquidosFranz Aleman SanchezNo ratings yet
- Kestrel 400 Manual en EspañolDocument5 pagesKestrel 400 Manual en EspañolSaray Landeros GarcíaNo ratings yet
- Resistencia Del Acero Al Fuego y Altas TemperaturasDocument6 pagesResistencia Del Acero Al Fuego y Altas TemperaturasTP Luis AlbertoNo ratings yet
- Curso de LadrillosDocument25 pagesCurso de LadrillosVanesa CcoyccosiNo ratings yet
- Operacion y Funcionamiento de Tanques de AlmacenamientoDocument7 pagesOperacion y Funcionamiento de Tanques de AlmacenamientoValeria BenalcazarNo ratings yet
- Informe MonograficoDocument43 pagesInforme MonograficoalbertoclintonNo ratings yet
- Deber AnetaDocument11 pagesDeber AnetaAngeles EnriquezNo ratings yet
- Sustancias Puras y Gases IdealesDocument17 pagesSustancias Puras y Gases IdealesCarlos De Pietro PozNo ratings yet
- Visita Centro Meteorológico CuscoDocument8 pagesVisita Centro Meteorológico CuscoWilliamGayonaGalindoNo ratings yet
- Lectura 8 - FÍSICA (José Carlos QUIÑONES PUMA)Document2 pagesLectura 8 - FÍSICA (José Carlos QUIÑONES PUMA)Mas Chap LibreNo ratings yet
- Lab Oratorio de Equilibrio y Cinetica Practica 1Document3 pagesLab Oratorio de Equilibrio y Cinetica Practica 1tania_mccartney_1No ratings yet
- Operaciones UnitariasDocument30 pagesOperaciones UnitariasM Eduardo Vega CNo ratings yet
- Concepto de IQBDocument2 pagesConcepto de IQBEver Hernández OlivasNo ratings yet
- Biodetergentes Se Prefieren Sobre Los Detergentes Sintéticos Convencionales en Vista de Su Mejor LimpiezaDocument9 pagesBiodetergentes Se Prefieren Sobre Los Detergentes Sintéticos Convencionales en Vista de Su Mejor LimpiezaJorge Carlos Vazquez SanchezNo ratings yet
- Marco Teorico Contenido de HumedadDocument10 pagesMarco Teorico Contenido de HumedadLuCa S. C. B.No ratings yet
- Autoclaves de LaboratorioDocument22 pagesAutoclaves de LaboratorioAlfredo Capo PfmNo ratings yet