Professional Documents
Culture Documents
07 (185-214) Nervi Cranici
Uploaded by
Michele Scilla FresielloCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
07 (185-214) Nervi Cranici
Uploaded by
Michele Scilla FresielloCopyright:
Available Formats
Funzioni dei nervi cranici e dei nervi spinali
185
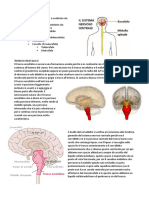
7. Funzioni dei nervi cranici e dei nervi spinali
C. Loeb
Nervi cranici
GENERALIT
I nervi cranici sono 12, anche se il primo
(nervo olfattorio) ed il secondo (nervo ottico)
non possono essere considerati propriamente
nervi, ma sono piuttosto estroflessioni cerebrali. Mentre nel midollo spinale esistono quattro
categorie di fibre: le fibre efferenti distinte in somatiche e viscerali, le fibre afferenti distinte in
somatiche e viscerali, le fibre dei nervi cranici
presentano qualche ulteriore particolarit. I nuclei e le fibre efferenti che si distribuiscono ai
muscoli striati sono indicate come fibre e nuclei
somatici efferenti generali (nuclei del III, IV, VI,
XI, XII nervo cranico). Le cellule di questi nuclei sono morfologicamente analoghe alle cellule delle corna anteriori del midollo.
Lateralmente ai nuclei somatici efferenti generali si trovano altre due categorie di nuclei
efferenti.
Le fibre dei nuclei che si trovano nella colonna mediale si distribuiscono a muscoli striati
sviluppati dagli archi branchiali e cio muscoli
masticatori e in pi ventre anteriore del digastrico e miloioideo (primo arco branchiale); muscoli mimici e in pi ventre posteriore del digastrico e stiloioideo (secondo arco branchiale); muscoli del faringe e del laringe (terzo e quarto
arco branchiale). I nuclei sono quelli del V, VII
paio dei nervi cranici e il nucleo ambiguo, e
forse lXI. Questi nuclei e fibre costituiscono la
porzione somatica efferente speciale.
Le fibre che nascono dalla colonna grigia situata pi lateralmente alla precedente, rappre-
sentano le vie efferenti viscerali generali. Si tratta del n. di Edinger Westphal del III, del n. salivatorio superiore (VII paio) e salivatorio inferiore (IX paio) e del n. motore dorsale del vago
(X paio): innervano muscoli lisci e ghiandole
(lacrimali e salivari).
Le vie afferenti che raggiungono la colonna
grigia, lateralmente al solco limitante interno,
sono definite viscerali generali afferenti. Tale
colonna grigia il nucleo del tratto solitario, che
si estende lungo tutto il bulbo e che riceve fibre
che passano attraverso il n. intermediario, il IX,
il X. Le fibre che convogliano stimoli gustativi
sono indicate come afferenti viscerali speciali,
altre che convogliano impulsi viscerali sono indicate come viscerali afferenti generali.
I nuclei che ricevono vie afferenti somatiche
generali si trovano nella porzione pi laterale
del tegmento e si riferiscono a fibre che trasportano la sensibilit cutanea superficiale (e forse
profonda) e giungono ai nuclei sensitivi del V
paio.
I nuclei che ricevono vie vestibolari e cocleari
sono indicati come nuclei e fibre somatiche afferenti speciali.
Riassumendo si pu quindi osservare che i
nuclei motori (efferenti) sono disposti medialmente, mentre i nuclei sensitivi (afferenti) sono
localizzati lateralmente (Fig. 7.1). In senso medio-laterale, avremo perci:
A. Nuclei e vie efferenti
1. Somatiche generali
per i muscoli striati (III-IV-VI-XI - branca
spinale - XII paio di nervi cranici)
186
Elementi di fisiopatologia e semeiologia
2. Viscerali
SPECIALI, per i muscoli derivati da:
1 arco branchiale (muscoli masticatori; ventre anteriore digastrico; miloioideo) (V paio)
2 arco branchiale (muscoli mimici; ventre
posteriore vie efferenti digastrico; stiloioideo)
(VII paio)
3- 4 arco branchiale (muscoli del faringe e
laringe) (IX-X-XI paio di nervi cranici nucleo ambiguo)
GENERALI, per muscoli lisci e ghiandole (lacrimali e salivari) (III, nucleo di Edinger
Westphal; VII, nucleo salivatorio superiore;
XI, nucleo salivatorio inferiore; X, nucleo
motore dorsale).
B. Nuclei e vie afferenti
1. Viscerali
SPECIALI: convogliano stimoli gustativi (VIIIX-X paio)
GENERALI: convogliano stimoli dalla porzione posteriore della lingua (IX), dal faringe, laringe, trachea, esofago, visceri toracici e addominali (IX paio; X paio)
2. Somatiche
SPECIALI: convogliano stimoli acustici e dai
canali semicircolari (VIII paio)
GENERALI: convogliano stimoli dalla cute e
dalle mucose a livello del capo (V-VII paio
e in parte IX e X) (e per stimoli propriocettivi III- IV-V paio)
Il capitolo sui nervi cranici stato organizzato tenendo contro di un criterio eminentemente funzionale. Comprende quindi 1) le funzioni e le alterazioni dellolfatto e del gusto
che coinvolgono il primo nervo cranico o nervo olfattorio e parzialmente i nervi cranici V,
VII, X e XI; 2) la neuroftalmologia in cui vengono descritte la funzione visiva e loculomozione (nervi cranici II, III, IV, VI); 3) la neurotologia che descrive i sistemi uditivo e vestibolare (VIII nervo cranico); 4) la descrizione sistematica delle funzioni dei nervi cranici
V, VII, X, XI e XII; 6) le lesioni combinate
dei nervi cranici.
I Sensi Chimici: Olfatto e Gusto
A. Seitun
Olfatto e gusto sono accomunati da qualit
uniche nellambito dei sistemi sensoriali delluomo. Entrambi i sensi permettono di avvertire e riconoscere la presenza di esigue tracce di
molecole volatili (cavit nasale odori) o in
soluzione (cavit orale sapori) attraverso sen-
Fig. 7.1 - Rappresentazione schematica dei nuclei di origine dei nervi cranici sulla faccia dorsale (A) e laterale (B) del
tronco cerebrale (da C. Loeb, Trattato Italiano di Medicina Interna, USES, Firenze, 1974).
Funzioni dei nervi cranici e dei nervi spinali
sibilissimi chemorecettori di cellule altamente
specializzate, ma a ciclo vitale paradossalmente effimero (olfattive: 30-60 giorni; gustative: 10
giorni), in palese contrasto con il principio di
perennit di ogni altra cellula nervosa.
Lopportunit di accomunare olfatto e gusto
in un unico capitolo non dettata solo da questioni di affinit neurobiologica, piuttosto dal
fatto che questi sensi armonicamente regolano
le scelte edoniche oro-alimentari, le pulsioni ed
il comportamento, preparano lapparato digerente alla digestione dei cibi, e permettono anche lunica possibile difesa da sostanze tossiche
(veleni alimentari o ambientali) o pericoli imminenti (odore di fumo) altrimenti non percepibili.
Lo strategico posizionamento di olfatto e
gusto in sedi anatomiche molto vicine, strettamente connesse per via aerea (rinofaringe cavit nasali) ed accomunate da una ricca innervazione sensitiva mucosa (trigeminale), non
sembra affatto casuale, poich permette di fondere aromi, sapori e sensazioni tattili e termiche
in ununica esperienza percettiva impregnata di
significati emozionali e di ricordi, che globalmente ed impropriamente siamo abituati a
definire gusto dei cibi.
Il significato e lulteriore elaborazione fantastico-rievocativa di questa esperienza pu essere
straordinariamente variabile, ed stato finora
una specie di leit-motif di molta grande letteratura. Lincredibile dipanarsi dei ricordi nella A
la recherche du temp perdu di Proust, innescato dalla semplice degustazione di un cucchiaino di th con una briciola di madeleine (Du
ct de chez Swann, 1913), pi che sufficiente a giustificare laffermazione che nulla
pu far rivivere il passato meglio degli odori
(Vladimir Nabokov). altres vero che nella nostra vita quotidiana, sempre pi cerebrale poich basata su vista ed udito, le sensazioni olfattive e gustative spesso si fermano a semplici
impressioni di gradevolezza o sgradevolezza (o meglio, disgusto). Il modo con cui si per-
187
cepiscono gli odori ed i sapori, cos come il
significato estetico e di piacere o dispiacere che
viene loro attribuito, dipende molto anche dal
contesto sociale ed intellettuale nel quale si
cresciuti (Jha, 1999), e ci sta alla base di molte curiose differenze etniche, tipicamente espresse nelluso - o rifiuto - gastronomico di
aromi, spezie, variet di cibo1 .
Limpatto di questi sensi sulla vita istintivo-affettiva
noto fin dallantichit, ma stato portato agli estremi
letterari solo recentemente (Colui che domina gli odori
domina il cuore degli uomini, Sskind 1985). Curiosamente trascurata invece limpenetrabilit delle memorie olfattive e gustative come tali agli sforzi del nostro
ricordo (la memoria pu riportare in vita qualunque
tipo di ricordo, salvo quello degli odori, Vladimir
Nabokov). La spiegazione di questi e molti altri aspetti
soggettivi della nostra esperienza chemio-sensoriale
stata finora alquanto elusiva, non andando oltre alla constatazione che olfatto e gusto hanno come principale
epicentro anatomo-funzionale lallocortex (o archicortex) del sistema limbico anzich la neocorteccia.
Lintegrarsi e fondersi delle due sensazioni in
ununica complessa esperienza sensoriale si pu
perdere anche per isolate disfunzioni olfattive o
del gustative, che difficilmente sono riconosciute come tali da chi per la prima volta le esperimenta, e che non sono nemmeno facilmente
quantificabili in maniera obbiettiva. In questi
casi, non vi da sorprendersi se il disturbo pi
comunemente riferito consiste in una perdita di
appetibilit dei cibi (diventati privi di gusto)
o in una generale disappetenza, di per s piuttosto aspecifica se non corredata di ulteriori, pi
precise informazioni.
Il neurologo raramente interpellato per primo per disturbi dellolfatto o del gusto, poich
i malati, attraverso il medico di famiglia o direttamente, quasi sempre si rivolgono e rimangono in carico allotorinolaringoiatra. La mancanza di sollecitazioni ha condizionato nel tempo una diffusa mancanza dinteresse e di cultu1
In Cina, ad esempio, si pensa che bere latte faccia emanare odori
sgradevoli, ed forse per questo motivo che nella sterminata
gastronomia cinese non viene proposto alcun latticino.
188
Elementi di fisiopatologia e semeiologia
ra della comunit neurologica verso questi disturbi, rafforzando lopinione che spetti ad altri occuparsene. appena il caso di sottolineare che i disturbi chemopercettivi non sono dissimili da quelli visuo- ed audiopercettivi (vedi
Neurooftalmologia e Neurootologia), ed implicano altrettante competenze specialistiche multisciplinari, nellottica di risolvere nella maniera
cooperativa pi colta, efficiente e rapida i problemi chemosensoriali che possono affliggere
un soggetto altrimenti sano.
Olfatto (I - Nervo olfattivo - Sistema
Vomero-Nasale - Nervo Cranico 0)
In media, una persona impiega 5 secondi per
respirare, 2 secondi per inspirare e 3 per espirare. In un anno, respiriamo mediamente 6.307.200
volte, e ad ogni respiro, siamo in grado di avvertire migliaia di odori, e di distinguerne fino a
5000 differenti tipi (Buck, 2000a,b). Lolfatto
10 volte pi sensibile del gusto, ma nonostante
sia un senso incredibilmente preciso, non permette di comunicare tutte le varie sfumature di un
odore a chi non labbia gi provato2.
A parte i gemelli monozigoti, ciascuno di noi
ha anche un proprio odore impalpabile unico,
geneticamente codificato e simile ad una vera
e propria impronta digitale da noi stessi riconoscibile (Lord e Kasprzak, 1989) e capace di attivare nellaltro sesso specifiche aree cerebrali,
come stato recentemente dimostrato mediante la PET (Savic et al., 2001b; Sobel e Brown,
2001). Tale propriet, ben sviluppata nel mondo animale macrosmatico e globalmente riferibile a specifiche miscele di feromoni (cfr.
Weller, 1998) nelluomo sembra essere correlata al biotipo MHC-HLA, ed avere specularmente, in altre persone della stessa specie, ma
di sesso opposto, un corrispettivo corredo di
recettori olfattivi per il suo riconoscimento.
2
La scarsit del vocabolario odoroso dipende dalla difficolt a
rievocare la sensazione di un odore dal suo eventuale nome.
Quindi, lolfatto ingloba un sesto senso inconscio, che nella specie umana appare in qualche
modo coinvolto in preferenze e selezioni biosessuali sottilmente finalizzate alla scelta di idonei istotipi (Jacob et al., 2002). Il corrispettivo
sistema anatomico utilizza una via olfattiva accessoria, costituita dal sistema dellorgano
vomero-nasale (VNO) (Keverne, 1999) e dal
sistema di rilascio gonadotropinico GnRH (o
LHRH) costituito dal nervus terminalis, detto
anche Nervo Cranico 0 (zero).
Storicamente, il sistema olfattivo si prestato pi dogni altro allo studio neuromorfologico
mediante metodi di impregnazione argentica,
grazie alla sua citoarchitettonica laminare abbastanza semplice ed alla presenza di tipi neuronali ben distinguibili fra loro, contribuendo in
maniera fondamentale allelaborazione della
classica dottrina del neurone (Cajal, 1911,
1955).
Questo periodo di grande interesse, compreso nel periodo fra fine dell800 e primo 900, fu
seguito da un periodo di relativo silenzio fino
agli anni 50-60, quando la moderna neurofisiologia e la microscopia elettronica permisero
di intuire che la semplicit strutturale del sistema olfattivo era solo apparente, e che la sua organizzazione funzionale andava ben oltre lo
schema della dottrina del neurone come era stata
formulata in semplici termini di modello motoneuronale (Shepherd, 1974).
Nel ventennio successivo, evidenze ultrastrutturali, neuroanatomiche, elettrofisiologiche
e neurochimiche contribuirono a rafforzare ulteriormente questo sospetto, senza permettere,
tuttavia, di formulare ipotesi attendibili su come
riusciamo a percepire e distinguere migliaia di
differenti odori.
Complessivamente, non v dubbio che il sistema olfattivo sia stato il sistema sensoriale pi
a lungo negletto, sia sul piano sperimentale che
clinico, e che i suoi segreti abbiano dovuto attendere fino al 1991 per cominciare ad essere
tumultuosamente svelati.
Funzioni dei nervi cranici e dei nervi spinali
189
Infatti, solo a partire dallidentificazione
della grande famiglia multigenica dei recettori
olfattivi (siglati OR) avvenuta circa dieci anni
fa (Buck e Axel, 1991; Buck, 1996, 2000a,b;
Mombaerts, 1999a,b,c, 2001; Zoxulya et al.,
2001; Zhang e Firestein, 2002)3 che si rapidamente attivata in questo senso la ricerca
multidisciplinare di base coinvolgendo anche il
gusto, per cui questi due sensi chimici, olfatto
e gusto, trovano finalmente adeguata collocazione nellambito delle Neuroscienze.
Aspetti neuroanatomici
1. MUCOSA OLFATTIVA E PROIEZIONI DI 1 ORDINE
a) Sistema olfattivo propriamente detto. La via olfattiva nasce da specifici neuroni bipolari chemosensibili situati nella mucosa olfattiva della porzione supero-posteriore della cavit nasale, ove essa si estende in senso medio-laterale dal terzo superiore della mucosa del setto nasale fino alla superficie del turbinato superiore (Fig. 7.2).
Fig. 7.3 - Distribuzione dellepitelio olfattorio nella parete laterale (A) e nella parete mediale (B) delle fosse nasali.
Fig. 7.2 - Localizzazione della mucosa olfattiva nella cavit nasale. VNO= organo vomero-nasale.
Il neuroepitelio olfattivo4 occupa circa 5 cm2 della
mucosa nasale, distinguendosi visivamente dalla mucosa respiratoria (rossastra) per un tipico colore giallastro
causato da un particolare pigmento, la cui assenza si
correla allanosmia che accompagna lalbinismo (Fig.
7.3). In esso si riconoscono tre differenti tipi cellulari: a)
Vedi database on-line dello Human Brain Project USA al sito
http://senselab.med.yale.edu/senselab/ORDB/default.asp
4
Verr usato arbitrariamente solo il termine olfattivo, anzich
olfattorio (usato nella lingua anglosassone).
neuroni sensoriali olfattivi (da 6 a 20 milioni per lato),
b) cellule di supporto simil-gliali frammiste ad esse, principalmente deputate a mantenere lomeostasi del [K+]e
e c) cellule staminali basali, deputate alla rigenerazione
dei neuroni sensoriali olfattivi perduti per apoptosi.
Le terminazioni trigeminali diffuse, in buona parte
chemocettive, contribuiscono alla percezione chemoestesica di esili tracce di molecole volatili irritanti, a cui
rispondono rilasciando localmente neuropeptidi (ad
esempio SP) responsabili di immediata irritazione locale (ipersecrezione mucosa, edema) e, per via riflessa, di
starnuto.
Il numero totale dei neuroni sensoriali olfattivi varia
ampiamente in rapporto alla sensibilit olfattiva di ciascuna specie: da 40 milioni delluomo si sale a 100 milioni del coniglio ed a un miliardo del cane.
I neuroni olfattivi (neuroni di 1 ordine) sono esili
cellule bipolari con soma di 40-50 m di diametro, che
perifericamente si estende in un dendrita periferico (diametro 1m) dotato allestremit di 5-20 delicate ciglia
immobili protrudenti per 100-150 m nel muco superficiale, e centralmente in un prolungamento assonale
centripeto amielinico molto sottile (0,1-0,2 ) che converge con altri in piccoli fascicoli (fila olfactoria) avvolti da particolari cellule gliali di rivestimento mielinico, simili alle cellule di Schwann, ma a differenza di
190
Elementi di fisiopatologia e semeiologia
esse penetranti nel SNC ed esprimenti marcata azione
neurotrofica.
Lestrema compattezza delle varie fibre allinterno dei
fascicoli, costituenti nel loro insieme il I nervo cranico,
ha permesso recentemente di postulare lesistenza di interazioni efaptiche fra gli assoni di I ordine quale peculiare modalit fisiologica di modulazione dei segnali olfattivi (Bokil et al, 2001).
Dopo avere attraversato la dura madre di cui rivestita la lamina cribrosa delletmoide, i fascicoli provenienti dalla mucosa olfattiva raggiungono la porzione
orbitaria del bulbo olfattivo, organo pari adagiato sulla
lamina cribrosa, penetrano nel suo strato pi superficiale (1 strato delle fibre olfattive) e terminano nello strato
immediatamente sottostante in corrispondenza di glomeruli sinaptici (2 strato glomerulare) (Fig. 7.4).
b) Sistema Vomero-Nasale. Istologicamente simile,
anche se per vari aspetti differente, appare la mucosa
dellorgano vomero-nasale di Jakobson (VNO), struttura tubulare contenente muco situata su entrambi i lati
della porzione antero-inferiore del setto nasale (Fig.
7.2), deputata esclusivamente alla trasduzione dei segnali sessuali portati dai cosiddetti feromoni, steroidi
volatili ad azione attrattiva specifica solo per laltro sesso (vedi oltre).
Ben sviluppato nei vertebrati macrosmatici, il VNO
rinoscopicamente dimostrabile uni- o bilateralmente
nel 73% almeno degli esseri umani (Trotier et al., 2000),
sotto forma di un abbozzo rudimentale tubuliforme di
lunghezza variabile da 3 a 23 mm (media 7 mm) e diametro di 1 mm, lievemente obliquo verso il basso, aprentesi in una piccola cavit anteriore non sempre facilmente
riconoscibile in vivo (Abolmaali et al., 2001). La sua posizione assai variabile, ma pi frequentemente si trova
alla base della porzione pi anteriore del setto nasale,
aggettante al di sopra del cercine corrispondente alla cartilagine vomero-nasale (anteriormente ed obliquamente
frapposta fra cartilagine del setto e vomere sottostante)
(Fig. 7.2). La mucosa del VNO formata da un epitelio
pseudo-stratificato, in cui si aprono in prossimit del
lume ghiandole mucipare settali (Bhatnagar e Smith,
2001; Smith et al., 2001).
Lesistenza del VNO nelluomo stata a lungo messa in discussione, anche perch si tratta di una piccola
struttura soggetta a modificazioni di volume tali da impedirne molto spesso la dimostrazione in un singolo esame (Trotier et al., 2000; Abolmaali et al., 2001), e limportanza del suo ruolo modulatorio neuroendocrino
ancora dibattuta (cfr. Buck, 2000b; Trotier et al., 2000;
Doty, 2001; Meredith, 2001).
Il neuroepitelio del VNO dotato superficialmente di
microvilli, anzich di ciglia; i suoi fini assoni si raccolgono in fascicoli che raggiungono il bulbo olfattivo, per
terminare nella sua porzione dorso-posteriore o bulbo
olfattivo accessorio, struttura ben evidente nei vertebrati
macrosmatici ma alquanto discussa nelluomo.
c) Sistema del Nervo Terminale(NT) o Nervo Cranico
0. un sistema assai poco noto, descritto un secolo fa
nello squalo come nervo isolato, ma presente nella mucosa olfattiva di tutti i vertebrati ed anche nelluomo
(Fuller e Burger, 1990; Wirsig-Wiechmann, 2001).
costituito da cellule della porzione pi rostrale della cresta neurale, originariamente adiacenti ai progenitori
delle cellule dellipofisi anteriore, in parte rimaste in sede
nella cavit nasale, in parte migrate nel telencefalo basale attraverso il nervo terminale. Questultimo formato
da una catena di somi ganglionari contenenti ormone rilasciante gonadotropine (GnRH) frammisti a processi
distali e prossimali, dotati di varicosit che indicano capacit di rilascio e trasmissione di volume. Nei mammiferi, tali catene neuronali si trovano prefernzialmente
associate ai fascicoli nervosi del sistema VNO (WirsigWiechmann, 2001).
Nelluomo, il sistema NT bilateralmente presente
sotto forma di un microscopico plesso di fascicoli nervosi periferici amielinici subaracnoidei ricoprenti il giro
retto della superficie orbitaria dei lobi frontali. Il plesso
si forma a livello della lamina cribriforme delletmoide
e si estende posteriormente in prossimit del trigono
olfattivo, del giro olfattivo mediale e della lamina terminale (Fuller e Burger, 1990).
La funzione del sistema NT non chemosensoriale,
bens modulatoria della chemorecezione, conscia ed inconscia.
d) Connessioni nel bulbo olfattivo e proiezioni di 2
ordine (Fig. 7.4). Gli assoni olfattivi e vomero-nasali terminano con digitazioni sinaptiche nei glomeruli, formati dalle arborizzazioni dendritiche di tre singoli diversi tipi
di neuroni: cellule a pennacchio (3 strato plessiforme
esterno), cellule mitrali (4 strato delle cellule mitrali di
Golgi) ed interneuroni periglomerulari. Questultimi
formano localmente sinapsi asso-dendritiche con gli
assoni olfattivi afferenti di 1 ordine e sinapsi dendrodendritiche sui dendriti mitrali, ed inviano un corto assone ai glomeruli adiacenti per formare sinapsi inibitorie GABAergiche asso-dendritiche sui rispettivi dendriti
mitrali. Negli stessi strati terminano anche assoni ascendenti diretti, provenienti dal nucleo olfattivo anteriore e
dal nucleo del braccio orizzontale della banda diagonale di Broca ipsilaterali, ed assoni crociati, provenienti via
commissura anteriore dal nucleo olfattivo anteriore dellaltro lato (Fig. 7.4 e 7.5).
Le cellule mitrali sono grandi neuroni a morfologia
piramidale dotati di un dendrita apicale principale a decorso radiale (400-600 m) che si arborizza e termina
Funzioni dei nervi cranici e dei nervi spinali
191
Fig. 7.4 - Schema semplificato dellorganizzazione neuronale e delle connessioni sinaptiche nel bulbo olfattivo. Notare la
convergenza di pi assoni olfattivi di 1 ordine della stessa classe (nero, grigio, bianco), provenienti da da aree lontane,
sullo stesso glomerulo sinaptico, ove esse innervano, assieme alle terminazioni assonali dei neuroni periglomerulari inibitori,
i dendriti apicali delle cellule mitrali ed a pennacchio. Non sono riportate le cellule gliali della mucosa olfattiva e linnervazione
afferente extra-mucosa.
nello strato dei glomeruli, e di estesi dendriti basali secondari, poco ramificati, che si estendono trasversalmente per circa 600 m nello strato plessiforme esterno.
Lelaborazione dei segnali olfattivi avviene nelle cellule
mitrali ed a pennacchio (neuroni di proiezione molto simili e definite anche cellule mitrali in miniatura) ed
utilizza, oltre agli interneuroni periglomerulari superficiali ad assone corto, anche i granuli, il cui soma situato nel 5 e penultimo strato granulare, essendo il 6
strato costituito da glia limitante ed ependima. Ci vale
anche per la porzione dorsale, occupata dal bulbo olfattivo accessorio.
I granuli sono elementi cellulari del tutto unici, poich mancano di un vero e proprio assone, ed inoltre, in
analogia ai neuroni sensoriali di I ordine, hanno un ciclo vitale analogo e scompaiono per apoptosi. Ma ci non
tutto. Il loro rinnovamento, infatti, reso possibile da
progenitori staminali indifferenziati non locali, ma situati
nella zona sub-ventricolare anteriore, capaci di migrare
rostralmente fino al bulbo olfattivo ed a rimpiazzare con
esattezza gli elementi mancanti (Gheusi et al., 2000). Lo
stesso fenomeno, presente anche nella specie umana
(Bernier, 2000), vede coinvolti anche gli interneuroni
periglomerulari, ed accomuna i granuli del sistema olfattivo ai granuli del giro dentato ippocampale, appartenente
allinterconnesso sistema limbico.
Funzionalmente, i granuli sono cellule GABAergiche
inserite in un circuito a feed-back negativo: sono eccitati sia dalle cellule mitrali, attraverso loro collaterali
assoniche ricorrenti e sinapsi dendro-dendritiche, che dai
vari tipi di assoni ascendenti sopra descritti, ed inibiscono non solo la stessa cellula mitrale da cui sono innervati,
ma anche quelle circostanti con cui formano sinapsi dendro-dendritiche. La peculiarit delle interazioni dendrodendritiche multiple e bidirezionali del bulbo olfattivo,
gi osservata 30 anni fa (Shepherd, 1974-1998), emerge anche da una serie di recenti evidenze sulle particolari caratteristiche dei meccanismi di trasmissione localmente presenti, GABAergici (Isaacson, 2001) glutamatergici e nitrossido-dipendenti, la cui descrizione dettagliata esula da questa trattazione5.
possibile comunque intuire il ruolo di potenziamento reciproco dei due bulbi olfattivi nella prima elaborazione dei segnali sensoriali in arrivo (attraverso una vera
e propria scultura funzionale delle zone attive omologhe), ed anche il ruolo modulante dei segnali afferenti al
bulbo olfattivo dal telencefalo basale, capace di enfatizzare - o mitigare - gli odori in rapporto alle necessit istintuali-comportamentali del momento.
5
Molto utile al riguardo il database on-line dello Human Brain
Project USA al sito: http://senselab.med.yale.edu/senselab/
192
Elementi di fisiopatologia e semeiologia
Le proiezioni efferenti di 2 ordine sono rappresentate dagli assoni delle cellule a pennacchio e dalle cellule mitrali che si raccolgono nel tratto olfattivo, prolungamento a sezione prismatica (30-35 mm), adagiato sul
corrispondente solco della faccia orbitale del lobo frontale (Fig. 7.5).
In sintesi, il bulbo olfattivo presenta unorganizzazione simil-corticale piuttosto complessa, ma molto pi rudimentale e filogeneticamente pi antica rispetto ad ogni
altro tipo di corteccia, per cui pu essere giustamente
considerato come una protrusione estrema di archicortex
(allocortex) dal SNC.
A questo proposito, il paragone che viene fatto con
la retina, anchessa unestroflessione periferica del SNC,
piuttosto grossolano ed improprio poich la retina non
ha alcuna organizzazione corticale. Il paragone, quindi,
vale solo limitatamente al fatto che i somi dei neuroni
sensoriali di 2 ordine presenti in entrambe le strutture
(rispettivamente cellule ganglionari della retina e cellule
mitrali), in tutti gli altri sistemi sensoriali e sensitivi sono
situati allinterno del SNC.
e) Aree olfattive primarie. Lavamposto rostrale estremo rappresentato dal nucleo olfattivo anteriore, contenuto allinterno del tratto olfattivo (Fig. 7.5). Esso
innervato dalla maggior parte degli assoni delle cellule
a pennacchio, ed a sua volta proietta assoni che contribuiscono a formare la radice mediale del tratto. Questo
contingente di fibre si incrocia ad ansa nella commissura
anteriore formando una specie di chiasma (chiasma
olfattivo), e decorre nel tratto olfattivo dellaltro lato per
raggiungere infine il bulbo controlaterale.
Allestremit posteriore del solco, il tratto olfattivo si
appiattisce e si divide in due strie olfattive, una mediale
e laltra, pi voluminosa, laterale. Esse delimitano uno
spazio triangolare o trigono olfattivo, la cui base si estende nel tubercolo olfattivo, che nelluomo corrisponde alla
sostanza perforata anteriore (corteccia orbito-frontale).
Il tubercolo olfattivo rappresenta il secondo avamposto delle aree olfattive primarie: infatti, contiene un nucleo (nucleo del tubercolo olfattivo) che riceve proiezioni
dalle cellule mitrali (ma anche dalle cellule a pennacchio), ed a sua volta proietta, attraverso la stria laterale,
alle aree olfattive secondarie, ed attraverso la stria mediale, ai nuclei del setto pellucido e, molto probabilmente,
anche ai nuclei dellabenula (via stria midollare).
Infine, il principale contingente delle proiezioni olfattive di 2 ordine, proveniente essenzialmente dalle cellule mitrali e decorrenti nella stria laterale (ed in minor
misura, mediale), si distribuisce a tre vicine aree temporali archicorticali di transizione costituenti il lobulo
piriforme: corteccia prepiriforme, corteccia peri-amigdaloidea o nucleo cortico-mediale dellamigdala (settore antero-superiore delluncus dellippocampo, ed allarea entorinale (area 28 di Brodman), situata nella parte
anteriore del giro paraippocampale (Brodal, 1981).
f) Aree olfattive secondarie. Le proiezioni efferenti
dalle cinque aree olfattive primarie convergono in parte
su comuni aree secondarie, rappresentate dal nucleo dorsale mediale del talamo e dalla corteccia prefrontale, in
parte raggiungono aree specifiche: dal nucleo corticomediale dellamigdala nucleo baso-laterale dellamigdala
ipotalamo e bulbo olfattivo; dalla corteccia entorinale
Fig. 7.5 - Schema semplificato delle principali proiezioni di 2 ordine dal bulbo olfattivo alle aree olfattive primarie, e da
queste alle aree olfattive secondarie (frecce).
Funzioni dei nervi cranici e dei nervi spinali
(area 28) uncus dellippocampo, amigdala e probabilmente anche circonvoluzioni dellinsula. Le connessioni di queste aree con altre o con il bulbo olfattivo sono
illustrate in Fig. 7.5. Ulteriori dettagli sullorganizzazione
funzionale di queste strutture limbiche sono forniti a pag.
534)
Un recente studio PET non ha dimostrato alcuna differenza anatomo-funzionale olfattiva fra maschio e femmina, essendo in entrambi attivate bilateralmente corteccia piriforme, amigdala ed insula (Bengtsonn et al., 2001).
g) Sistema Vomero-Nasale (VNO). Le proiezioni mitrali del sistema VNO provenienti dal bulbo olfattivo accessorio raggiungono quasi esclusivamente lipotalamo,
sia direttamente (Firestein, 2001) che attraverso la mediazione dei nuclei amigdaloidei proiettanti principalmente su di esso. Un recente studio funzionale nelluomo ha dimostrato nella femmina olfattivamente stimolata
con derivati androgenici unattivazione ipotalamica con
epicentro nei nuclei preottico e ventromediale, e nel
maschio stimolato con composti estrogenici, unanaloga attivazione nei nuclei paraventricolare e dorso-mediale (Savic et al., 2001b). Esistono inoltre retro-proiezioni
dallamigdala al bulbo olfattivo accessorio.
Ci saccorda con un coinvolgimento del sistema
VNO nella biologia comportamentale dellattaccamento (infantile ed adulto) e della riproduzione attraverso
comunicazioni feromonali volatili, sessualmente orientate e specifiche, ma inodori ed inconscie.
Aspetti neurofisiologici e neurobiologici
1. Muco olfattivo. La mucosa olfattiva contiene particolari ghiandole tubulari o tubuloalveolari (g. di Bowmann), deputate alla produzione di uno speciale muco
contenente lattoferrina e particolari lipocaline, glicoproteine specificamente deputate a catturare e trasportare in fase acquosa molecole idrofobiche di vario tipo. In
particolare, le lipocaline espresse nella sfera orale delluomo6 (mucosa olfattiva, apparato salivare, polmoni)
corrispondono alle odorant binding proteins (OBP-IIa)
(Lacazette et al., 2000), che facilitano il trasporto e la presentazione delle molecole odorose ai recettori delle ciglia olfattive e fungono anche da tampone in caso di loro
eccesso, evitando la saturazione dei recettori. Il muco
anche ricco di IgA-IgM e lisozima per bloccare i germi
patogeni allesterno del cranio. Nel sistema VNO esistono analoghe lipocaline per la veicolazione dei feromoni
o vomeromoduline (afrodisina nel criceto, Briand et
al., 2000).
Un secondo gruppo di lipocaline (OBP-IIb), espresso dalla
sfera genitale (specie prostata e mammella)
193
2. Recettori olfattivi (OR). Lusuale risposta dei neuroni sensoriali ad un odore consiste in una depolarizzazione apicale che si traduce in una generazione di potenziali dazione in corrispondenza del cono demergenza
dellassone. La depolarizzazione pu essere elettrofisologicamente registrata anche nelluomo mediante elettrodi di superficie (elettro-olfattogramma), ma la tecnica
complessa e rimane di appannaggio prettamente sperimentale. Il numero di neuroni attivati proporzionale alla
concentrazione delle molecole odorose: ma ci si traduce
in sensazioni pi intense solo fino ad un certo punto, oltre
il quale la sensazione si pu modificare anche drasticamente sul piano qualitativo7. Complessivamente, in molti
eucarioti i geni che codificano per le proteine OR costituiscono il 4% del rispettivo genoma (Firestein, 2001).
I recettori olfattivi sono proteine etero-trimeriche dotate di sette domini transmembrana, sito di riconoscimento esterno, e sito di accoppiamento interno a G-proteine
(Buck e Axel, 1991; Dryer e Berghard, 1999; Mombarts,
1999c). A differenza del sistema visivo, ove sono sufficienti tre sole classi di fotorecettori (per il blu, il verde e
per il rosso), il sistema olfattivo utilizza un elevato numero di recettori olfattivi (OR) codificati da altrettanti
geni appartenenti a 228 famiglie, distribuiti in 27 gruppi
su quasi tutti i cromosomi, specie l11 (il 20 e lY ne sono
apparentemente privi). Il numero degli OR identificati
salito rapidamente fino ad oggi: da una stima nei roditori (macrosmatici) di almeno 1000 OR, e nelluomo (microsmatico) di 500-750 OR (Mombaerts, 1999b), si
giunti fino a stimarne 1296 sia nel topo che nelluomo
(Zhang e Firestein, 2002). Nelluomo, tuttavia, solo il 3035% dei geni OR capace di esprimersi, essendo i due
terzi degli OR umani pseudo-geni formati dalla fusione
di due geni o da sequenze nucleotidiche inattive (Mombaerts, 1999b; Glusman et al., 2001; Zozulya et al., 2001;
Crasto C. et al., 2002; Zhang e Firestein, 2002)8. Sebbene il quadro generale sia piuttosto intricato e suscettibile di ulteriori precisazioni, si pu ritenere pari a 347 il
numero dei geni OR umani pienamente funzionanti (Zozulya et al., 2001).
La trasduzione del segnale chimico comporta un distacco della G-proteina dal recettore interazione della G-proteina con la limitrofa adenilil-ciclasi III produzione di cAMP attivazione di canali cationici (Na+Ca2+) depolarizzazione generazione di potenziali
noto che odori ripugnanti possono trasformarsi in fragranze
quando siano opportunamente diluiti nellaria: il muschio, ad
esempio, la cui soglia percettiva (fragranza gradevole) corrisponde a 410-5mgl-1 (aria).
8
Al sito: http://senselab.med.yale.edu/senselab/ORDB/default.asp disponibile il database completo delle sequenze delle proteine OR.
194
Elementi di fisiopatologia e semeiologia
dazione assonici. Coesistono altri meccanismi di trasduzione in cascata, basati sulla formazione di inositolo(1,4,5)-trifosfato (IP3), cGMP e monossido di carbonio
(CO). I neuroni olfattivi sono caratterizzati da adattamento rapido, dipendente da una desensitizzazione del
recettore per fosforilazione, e da aggiustamento della
sensibilit dei canali cationici ai livelli medi di cAMP
sub-membrana.
3. Recettori feromonali del VNO. Nel ratto, il sistema VNO dotato di due famiglie recettoriali, V1R e V2R,
ciascuna comprendente approssimativamente 100 geni
espressi su una vasta gamma di cromosomi, e nelluomo del solo V1R, ma solo con il 52-59% di identit e con
unalta percentuale di sequenze inattive (pseudogeni)
(Giorgi et al., 2000). I recettori VR hanno sequenze non
correlate con quelle OR, solo raramente espresse dai neuroni di 1 ordine VNO, ma sono costituiti da proteine dotate di sette domini transmembrana accoppiate a due differenti G-proteine. La distribuzione spaziale dei V1RV2R differisce da quella degli OR, poich nella mucosa
del VNO i neuroni sensoriali si dispongono in due pseudo-strati paralleli, esprimenti quello superficiale la proteina Gi2, quello profondo la proteina Go.
Nelluomo, i ligandi putativi di questi recettori sono
probabilmente molteplici, e principalmente prodotti da
particolari zone del corpo maschile (ascelle: androstadienone) o femminile (vagina: copuline o derivati
estro-progestinici). anche probabile che esistano proiezioni differenziate dal sistema VNO allamigdala ed
allipotalamo in funzione delle differenti classi recettoriali, come suggerito dalle differenti risposte osservate in
seguito a stimolazione feromonale (Monti-Bloch et al.,
1998; Grosser et al., 2000; Savic et al., 2001b).
4. Recettori GnRH. Sono presenti sia nel neuroepitelio olfattivo propriamente detto che feromonale, e sono
attivati dal GnRH secreto dal sistema NT, ove la trasduzione del segnale avviene in cascata tramite G-proteine
transmembrana, attivazione di fosfolipasi C e formazione di IP3 quale secondo messaggero. Nel sistema NT, lesocitosi di GnRH si traduce in una modulazione autocrina
dellattivit pace-maker della stessa cellula e paracrina
dellattivit delle cellule circostanti secondo un meccanismo bifasico (transitoria inibizione seguita da prolungato aumento di scarica) (Abe e Oka, 2000). Lattivit
spontanea dei neuroni NT inoltre modulata dal numerose proiezioni centrali e periferiche, anche trigeminali
(Yamamoto e Ito, 2000).
Nella femmina, lattivazione del sistema NT allinizio della fase luteale (ovulazione) comporta non solo un
potenziamento dellacuit olfattiva, ma anche una maggior gradevolezza dei messaggi feromonali maschili, inducendo risveglio sessuale finalizzato ad un comporta-
mento copulatorio centrato sul momento pi favorevole
per la fecondazione (Wirsig-Wiechmann, 2001). Ci
probabile che avvenga anche nella specie umana, ove
sono state documentate variazioni della sensibilit olfattiva correlate al ciclo mestruale (con maggior sensibilit
nella fase luteale: Pause et al, 1996) ed in gravidanza, ove
laumento dellacuit olfattiva garantirebbe nel primo
trimestre risposte avversive nei confronti di sostanze
potenzialmente dannose per la gestazione ed il feto
(Kolble et al., 2001).
Ogni gene olfattivo attivo si esprime solo nello 0,1%
delle cellule neuroepiteliali olfattive, per cui si pu concludere che ognuna di esse dotata di un solo tipo di
proteina recettoriale. Dato il breve ciclo vitale di queste
cellule (come gi stato detto, destinate a scomparire per
apoptosi), il posto lasciato vuoto viene colmato da una
nuova: questultima non solo riesce ad esprimere la stessa
proteina, ma nellinviare il proprio assone al bulbo olfattivo, riesce addirittura a connettersi con il glomerulo sinaptico lasciato vacante. Come ci possa avvenire resta tuttora un affascinante mistero.
Spazialmente, i neuroni dotati dello stesso OR sono
segregati in una sola zona della mucosa olfattiva, ove
sono intercalati a neuroni dotati di altri OR: esistono almeno quattro grossolane aree neuroepiteliali che proiettano a differenti aree del bulbo olfattivo, garantendo con
questo tipo di arrangiamento altamente distribuito una
conservazione dellolfatto anche in caso di lesioni di buona parte del neuroepitelio sensoriale.
In ciascun glomerulo, 200-500 assoni provenienti da
vaste aree della mucosa olfattiva convergono su 20-50
dendriti di neuroni di proiezione di 2 ordine (cellule a
pennacchio e mitrali): ci permette una drastica riduzione (circa 100 volte) del numero dei neuroni deputati alla
trasmissione del segnale, e garantisce nel contempo la
loro attivazione da parte di stimoli odorosi applicati su
disparati punti della mucosa.
I meccanismi di identificazione di una molecola odorosa sono piuttosto intricati e di non facile comprensione.
a) Ogni singolo OR riconosce molecole odorose multiple di massa superiore a 500, ed ogni molecola riconosciuto da OR multipli, per cui differenti molecole sono
riconosciute da differenti combinazioni di OR. Il sistema olfattivo, quindi, usa uno schema di codifica recettoriale di tipo combinatorio per identificare ogni tipo di odore. Ci spiega perch il codice e quindi lodore
di una molecola odorosa possano modificarsi in rapporto a minime variazioni della sua struttura chimica o, alternativamente, in rapporto a variazioni della sua concentrazione nellaria (Malnic et al., 1999). A seconda della
propria dotazione di differenti OR, ogni cellula neurosen-
Funzioni dei nervi cranici e dei nervi spinali
soriale olfattiva risponde con elevata specificit e sensibilit a precisi gruppi funzionali di un certo composto
odoroso, ma presenta anche unelevata tolleranza e capacit di risposta anche per gruppi chimici di altro tipo,
caratteristici di altri composti: tale strategia permette allapparato olfattivo di essere altamente discriminativo e,
nello stesso tempo, capace di riconoscere alcune migliaia
di differenti odori (Araneda et al., 2000).
Lidentit di una molecola odorosa implica quindi una
codifica multipla di certi suoi epitopi da parte di un certo numero di classi recettoriali, permettendo cos di raggiungere elevatissimi gradi di discriminazione molecolare, fino al limite estremo del riconoscimento degli
enantiomeri di una stessa molecola. Nelluomo, tale capacit consente di distinguere lisomero (R) dallisomero
(L) di almeno 100 coppie di essenze chirali, in base a
sottili differenze della qualit o dellintensit dellodore
percepito (Ohloff, 1994), ma nei mammiferi inferiori si
estende ulteriormente a molti altri enantiomeri che luomo non riesce a distinguere (optical imaging: Xu,
2001; Rubin e Katz, 2001)9 .
b) Gli assoni dei neuroni sensoriali sensibili ad uno
stesso stimolo convergono su pochi glomeruli, che nel
bulbo olfattivo curiosamente conservano la stessa posizione in differenti specie animali, e selettivamente si attivano ogni volta per lo stesso stimolo odoroso, come
stato possibile dimostrare nel ratto stimolato con isoamilacetato e limonene anche mediante fMRI (Xu et al,
2000).
Come corollario di questa disposizione somatotopica,
se uno stimolo odoroso riesce ad attivare molti glomeruli,
esso necessariamente deve avere attivato molti differenti tipi di neuroni sensoriali.
Se invece il singolo glomerulo ad essere attivato da
differenti stimoli odorosi, questi devono necessariamente
essere stati riconosciuti dallo stesso neurone sensoriale
olfattivo.
In termini pi semplici e sintetici, ciascun recettore
olfattivo fornisce un tassello di quel codice ultimo che,
come unimpronta digitale, contraddistingue una grande variet di molecole odorose. Ne consegue che il bulbo olfattivo cablato secondo unorganizzazione parallela non tanto in funzione degli odori (che sono soltanto sensazioni olfattive finali), quanto in funzione delle caratteristiche chimico-steriche comuni a molecole
odorose anche fortemente eterogenee fra loro.
La successiva elaborazione centrale, come dimostrato mediante la PET, avviene attraverso lattivazione di
Per ulteriori informazioni a riguardo:
http://www.leffingwell.com/chirality/chirality.htm
195
aree primarie, secondarie e di associazione secondo
unorganizzazione anche gerarchica, sensibilmente
variabile a seconda del compito olfattivo assegnato (Savic
et al., 2000; Savic, 2001a).
Esame della funzione olfattiva
La ricchezza di informazioni di base emergente dalle premesse di cui sopra contrasta in
maniera stridente con la relativa povert di mezzi clinico-strumentali concretamente utilizzabili
in ambiente neurologico per esplorare la funzione olfattiva.
La semplice olfattometria qualitativa, ovvero
il riconoscimento di aromi gi conosciuti tramite inalazione in una narice per volta (ad esempio,
il caff, la menta, la canfora, il petrolio, il muschio artificiale) serve assai poco, e pressoch
solo a confermare senza pretese di vera obbiettivit ci che gi ovvio o al massimo ad escludere grossolane simulazioni (alternando essenze
aromatiche a sostanze irritanti come lammoniaca o laceto). Lelettro-olfattografia ed i potenziali evocati olfattivi sono rimasti confinati alla
ricerca sperimentale di pochi laboratori e non
hanno avuto, n in Italia n altrove, il successo e
la popolarit dellelettro-retinografia e dei potenziali evocati visivi. La ultradecennale arretratezza delle conoscenze di base sul sistema olfattivo,
e la povert di ricerche cliniche in tema, tumultuosamente corrette solo in questultimo decennio, hanno condizionato un atteggiamento di vero
e proprio neglect neurologico diffuso, che solo
a partire dal 1984 si progressivamente corretto, dal Nord America allEuropa, grazie allintroduzione ed alla disponibilit di nuovi metodi
olfattometrici standardizzati, primo dei quali
lUPSIT (University of Pennsylvania Smell
Identification Test) (Doty et al., 1984). In accordo, nel 1999 stato proposto alla comunit medica italiana un accurato protocollo standard per
lesame dellolfatto, del quale vengono di seguito
riportati i parametri essenziali (Parola e Liberini,
1999).
196
Elementi di fisiopatologia e semeiologia
Tabella 7.1 Intervista strutturata per la valutazione dellolfatto.
Dati personali
Stile di vita
Anamnesi
Disturbi olfattivi
Disturbi gustativi
Genere (sesso)
Fumo
M. naso
M. seni paranasali
Modalit dinsorgenza
Modalit dinsorgenza
Et
Sostanze dabuso
M. neurologiche
Durata
Durata
Cultura etnica
Esposizione a
tossici ambientali
Disturbi psichiatrici
Andamento temporale
Andamento temporale
Livello deducazione
Uso di profumi
Disturbi metabolici
Sensibilit agli odori
Sensibilit ai gusti:
salato-acido
dolce-amaro
Preferenza manuale
Assunzione di farmaci
Intervista anamnestica
Precede lesame olfattometrico vero e proprio, e viene condotta secondo quanto riportato nella tabella 7.1.
cos possibile tener conto dei fattori che
pi influenzano lolfatto, quali sesso, et, professione e fumo, ed inoltre di accertare le modalit dinsorgenza, di evoluzione e durata del
disturbo olfattivo, la concomitanza con traumi
cranici, lavvio di terapie o le esposizioni accidentali o professionali ad inalanti esogeni, e
leventuale coesistenza di disturbi neuro-psichiatrici, di affezioni locali o generali e di disturbi gustativi.
Successivamente viene effettuata lindagine
olfattometrica vera e propria, che si struttura secondo paradigmi di complessit crescente in
rapporto alle particolari necessit di ogni singolo paziente.
Valutazione olfattometrica
MODALIT DI STIMOLAZIONE. La stimolazione
comporta lannusamento del vapore emanato da
soluzioni con concentrazioni scalari di una sostanza odorosa attraverso entrambe le narici, o
attraverso una narice per volta (essendo laltra
otturata mediante nastro adesivo). Il secondo
metodo (unirinale) molto pi lento ma anche
Perversioni olfattive
Perversioni gustative
Odore avvertito
Effetto dellammoniaca
Gusto avvertito
pi preciso, e comunque indispensabile per localizzare un deficit olfattivo unilaterale.
IDENTIFICAZIONE DELLA SOGLIA OLFATTIVA. La soglia definita dalla concentrazione molare minima di sostanza odorosa (o odorante) cui corrisponde, per inalazione dei vapori, una percezione
del rispettivo aroma, ed un indice convenzionale dellacuit olfattiva. Leventualit di una coattivazione trigeminale pu essere esclusa impiegando un odorante puro quale lalcool fenil-etilico10 . Lodorante diluito in acqua bidistillata, o
meglio ultrapura (Millipore-Q) in 14 concentrazioni 0,5 log scalari comprese fra 1 10-7 M, e la soluzione posta in flaconi con apertura di 2,5 cm di
diametro. In ogni prova, il soggetto deve annusare ad occhi bendati due flaconi, uno dei quali contenente solo il solvente (acqua), e dire quale dei
due evoca in lui la sensazione pi forte.
Lidentificazione della soglia chemopercettiva
trigeminale (ammoniaca, acido formico) pu essere utile in caso di iposmia post-traumatica per
documentare la frequente coesistenza di un deficit trigeminale, generalmente assente o molto
modesto nella patologia rino-sinusitica (Gudziol
et al., 2001): perci, limpiego di irritanti trigeminali a scopo medico-legale (per documentare
10
Phenylethyl alcohol, PEA (Carlo Erba o Sigma-Aldrich-Fluka).
Funzioni dei nervi cranici e dei nervi spinali
197
Tabella 7.2 Punteggi di identificazione olfattiva nel test del CA-SIT nella popolazione italiana.
Probabile
simulazione
Anosmia
totale
Microsmia
grave
Microsmia
moderata
Microsmia
lieve
Normosmia
00 04
05 15
16 19
20 23
24 27
28 34
Anosmia: perdita completa della capacit a percepire le sensazioni qualitative degli odori.
Microsmia: perdita parziale della capacit a percepire le sensazioni qualitative degli odori.
Tabella 7.3 Coppie di aromi consigliati per il test di discriminazione olfattiva.
Paia simili
Paia dissimili
-dodecalattone Aldeide C-14
Citronellil acetato Citronellil butirrato
Cinnamil propionato Cinnamil butirrato
Estratto di limone Citral rettificato
Anetolo Benzil butirrato
Fenetil alcool Eptanolo
Olio di garofano Solfuro dallile
Acido butirrico Eugenolo
eventuali tentativi di frode) perde molto del suo
significato in caso di trauma cranico.
dall80% dei soggetti normali. I relativi punteggi tarati sono espressi in Tab. 7.2.
IDENTIFICAZIONE DEGLI ODORI. Comporta una
stimolazione olfattiva soprasogliare e tre possibili tipi di risposte: denominazione dellodore,
risposta s-no circa il nome suggerito, e risposta a scelta multipla, con scelta di un nome fra
quelli elencati per ciascun odore.
LUPSIT (Sensonics, Haddon Heights, N.J.,
USA) appartiene a questultima categoria, implicando la scelta forzata di un nome fra quattro suggeriti per ciascun stimolo olfattivo (il
soggetto deve rispondere comunque, anche se
non avverte odore), ed basato sullannusamento di 40 aromi microincapsulati e stampati
a 10 per volta su quattro differenti foglietti secondo una tecnica definibile come gratta-eannusa11 . Poich sei di questi 40 aromi sono
relativamente sconosciuti Italia, nel nostro paese da usarsi il test culturalmente adattato CASIT, che comprende 34 aromi riconoscibili
DISCRIMINAZIONE DEGLI ODORI. La capacit di
decidere se due odori sono gli stessi o differiscono fra loro si esplora per ogni narice con 16
coppie di odori, di cui 8 paia simili e 8 dissimili, presentati nellambito di ciascun paio in rapida successione mediante un piccolo tampone
imbevuto di essenza, con intervallo di almeno
20 secondi fra differenti paia. Il soggetto deve
annusare una sola volta e rispondere se i due
odori sono identici o differiscono fra loro, o alternativamente, qualora si trovi incerto, indovinare. In base alle risposte ottenute, si calcola il
rapporto percentuale di quelle corrette su quelle errate. Le sostanze che si impiegano in questo test sono riportate in Tab. 7.3.
11
Analoga a quella ben nota del gratta-e-vinci. In versioni pi
ridotte, stato proposto in passato come auto-test di svago perfino da riviste femminili a larga tiratura.
MEMORIA DEGLI ODORI. La capacit mnesica
per gli odori condivide con la memoria visiva e
verbale lo stesso utilizzo di parole (codici verbali) ogniqualvolta un odore abbia una chiara
denominazione (ad esempio odore di menta),
ma ci non essenziale quando si tratta di dimostrare di avere gi avvertito un odore inusuale privo di un nome preciso (ad esempio lepta-
198
Elementi di fisiopatologia e semeiologia
nolo). Viene testata chiedendo al soggetto di
annusare con entrambe le narici 10 aromi differenti per 5 secondi, con intervallo di presentazione di 20 secondi. A distanza di tempo (minuti, ore o giorni dopo), il soggetto deve analogamente annusare 5 degli aromi precedenti intercalati a caso fra 5 nuovi, e identificare quali
egli ricorda di avere gi percepito. Il punteggio
corrisponde alla differenza fra risposte corrette
ed errate e varia da 10 a 10. Lo studio della memoria olfattiva, verbale e non verbale, richiede
limpiego di sostanze odoranti riconoscibili in
base ad un nome chiaro e ben identificabile nel
linguaggio corrente (quasi sempre riferito alloggetto in cui sono contenute), e di sostanze
sprovviste di tale nome (e quindi identificabili
solo in funzione di un astratto nome chimico,
ma prive di correlati con oggetti del mondo circostante).
In ogni caso, linterpretazione dei risultati
ottenuti con questi tipi di test dovrebbe sempre
avvenire nellambito di uno studio neuropsicologico pi o meno allargato e mirato sui problemi posti da ciascun paziente.
In linea generale, la misura dellacuit olfattiva (soglia) rappresenta il parametro di base per
ogni tipo di disturbo dellolfatto, a cui associare gli altri test isolatamente o in associazione fra
loro a seconda che si tratti di patologia neurodegenerativa (demenze, m. di Parkinson, etc.),
neurologica focale (traumatica, neoplastica,
epilessia del lobo temporale), psichiatrica (schizofrenia, parafrenia), periferica (nasale/paranasale) o di problematiche medico-legali (Parola
e Liberini, 1999).
A questo riguardo, vale la spesa sottolineare
che lenigma dellasserita maggior sensibilit
olfattiva femminile non sembra giustificato da
una pi bassa soglia agli odori, poich questa
non differisce significativamente fra i due sessi; piuttosto, sembra dipendere da una maggior
capacit di identificazione e discriminazione
olfattiva indipendente dal livello di intelligenza (Segal et al., 1995; Brand e Millot, 2001).
ALTRI TEST OLFATTOMETRICI
Recentemente diventata disponibile una versione ridotta dellUPSIT a validit multi-culturale (12 aromi, CC-SIT) (Doty et al., 1996), che
permette di effettuare il test di identificazione
olfattiva in meno di 6 minuti, ed anche una miniversione tascabile a 3 odori per lesame neurologico di routine (PST). Test simili al CC-SIT, altamente concordanti con lUPSIT o il CC-SIT ed
adattati per lEuropa, si basano sullimpiego di
kit portatili relativamente poco costosi quali la
batteria Sniffin Sticks, costituito da 7 pennarelli con differenti odori che permettono la
valutazione della soglia olfattiva e leffettuazione dei test di identificazione e discriminazione
(Kobal et al., 1996; Wolfensberger et al., 2000),
e Le Nez du Vin, kit analogo alla batteria precedente, formato da sei differenti aromi, originariamente progettato per gli allievi sommeliers
(McMahon e Scadding, 1996).
INDAGINI ELETTROFISIOLOGICHE. Sono rappresentate dallelettro-olfattogramma e dai potenziali
chemiosensoriali eventocorrelati (CSERP), entrambi tipi dindagine praticabili solo in alcuni laboratori specializzati, e finora utilizzati quasi
esclusivamente a scopo sperimentale (Pause et
al., 1996; Pause e Krauel, 2000).
Disturbi dellOlfatto
La loro prevalenza molto pi alta di quanto si possa immaginare: in Italia, circa 500.000
persone (0,87% dellintera popolazione) sono
colpite da disturbi olfattivi (Parola e Liberini,
1999).
In accordo a Victor (2001), si possono suddividere in quattro categorie: a) disturbi quantitativi, sotto forma di deficit (completo: anosmia;
parziale: iposmia o microsmia) o, assai pi raramente, di aumento dellacuit olfattiva; b) disturbi qualitativi, sotto forma di distorsioni o perversioni (disosmia) o di illusioni olfattive (paro-
Funzioni dei nervi cranici e dei nervi spinali
smia); c) disturbi psico-olfattivi, sotto forma di
allucinazioni o deliri a contenuto olfattivo; d)
disturbi simbolici (agnosia olfattiva).
Disturbi quantitativi
IPOSMIA (MICROSMIA) ED ANOSMIA. Indicano
una diminuzione o perdita dellolfatto12 . Sono
i disturbi pi frequenti, che possono passare
inosservati se unilaterali, ed invece essere vissuti come perdita congiunta dellolfatto e del
gusto quando sono bilaterali.
Sul piano patogenetico possono riconoscersi tre principali cause di ipo- anosmia: patologia primitiva del neuroepitelio olfattivo, patologia centrale (dei sistemi di conduzione) e
patologia geneticamente determinata (Tab.
7.4).
Come si pu osservare, il primo gruppo ingloba la patologia locale dellapparato nasale
e paranasale responsabile di deficit olfattivi
tradizionalmente attribuiti ad un ostacolato afflusso di aria alla mucosa olfattiva (dogma ostruttivo). A parte la comune constatazione
che liposmia causata dal semplice raffreddore poco sensibile alle usuali terapie disostruenti locali o generali (vasocostrittori, FANS,
mucolitici) che ripristinano la perviet aerea
dellintera cavit nasale, levidenza di un frequente, incompleto recupero olfattivo dopo
guarigione da affezioni rino-sinusitiche trova
spiegazione nellevidenza istologica di un danno neuro-olfattivo pi o meno rilevante o anche permanente, qualora vi sia stata perdita
delle cellule staminali basali (Doty e Mishra,
2001). Perci, il fattore ostruttivo va considerato un fattore di aggravamento importante ma
secondario.
Una delle pi vaste casistiche esistenti sullargomento ha dimostrato che nei due terzi
dei casi di ipo- anosmia il disturbo dipende da
12
Non esistono finora dati riguardanti possibili deficit della sensibilit olfattiva ai feromoni nelluomo.
199
una patologia nasale e paranasale (infezioni
virali incluse) o da trauma cranico (Hendriks,
1988).
In particolare, la prevalenza del disturbo
olfattivo appare correlata allentit del trauma
subito: 0% (traumi minori senza disturbo di coscienza), 5% (traumi minori con disturbo di
coscienza < 1 ora), 15-19% (traumi moderati
con disturbo di coscienza da 1 a 24 ore), 2430% (traumi maggiori con disturbo di coscienza > 24 ore) (v. pag. 000). Nel 66,8% dei casi
si tratta di unanosmia permanente, che in massima parte (87,3%) fa seguito a traumi cranici
maggiori causati da impatto occipitale o anche
temporo-parietale, sedi particolarmente rischiose per lesioni da contraccolpo in fossa cranica
anteriore (Doty et al., 1997; Biacabe et al.,
2000). Lipo- anosmia pu dipendere sia da lesioni dei filamenti olfattivi nel loro passaggio
attraverso la lamina cribrosa delletmoide, sia
da contusioni dei bulbi o tratti olfattivi, o del
trigono olfattivo, o delle regioni orbito-frontali. Ci spiega la frequente associazione fra
anosmia post-traumatica e problematiche sociolavorative importanti, connesse non solo ad
esclusioni professionali specifiche (profumieri,
cuochi, sommeliers, ecc.), ma spesso anche
a perdite motivazionali sul lavoro inquadrabili
nellambito di una sindrome orbito-frontale
(Varney, 1988) (v. pag. 523).
Una riduzione bilaterale dellolfatto si instaura nella settima decade di vita in entrambi
i sessi, ma si accentua progressivamente soprattutto nel maschio: lo stesso periodo det coincide con una maggior incidenza di varie forme
di patologia neurodegenerativa, molte delle quali caratterizzate da marcata e precoce iposmia
(ad esempio malattia di Alzheimer e di Parkinson), a genesi non chiara, ma potenzialmente
attribuibile al progressivo depauperamento neuronale delle aree olfattive primarie o delle rispettive aree di proiezione associative.
Al contrario, i vari parametri olfattivi risultano normali nellanoressia nervosa, ove lav-
200
Elementi di fisiopatologia e semeiologia
Tabella 7.4 Cause di ipo anosmia.
Patologia neuroepiteliale
Patologia centrale (o di conduzione)
Patologia genetica
Riniti e rinosinusiti
allergiche e vasomotorie
batteriche
virali
adeno-rinovirus, influenza,
HSV1, epatite
Poliposi nasale
Abuso di vasocostrittori
Rinite cronica atrofica
Fumo di tabacco (intenso)
Radioterapia locale
Da tossici esogeni
solventi organici (benzene)
metalli
polveri industriali contenenti metalli:
Al, As, Bi, Cd, Co, Cr, Hg,
Mn, Ni, Zn (Sunderman, 2001)
cocaina
oppiacei
corticosteroidi *
immunosoppressori
antiblastici
aminoglicosidi
tetracicline
L-DOPA
Carenziale
Ipovitaminosi A
Ipovitaminosi B1
(S. di WernickeKorsakoff)
Ipocorticosurrenalismo
Ipotiroidismo
Insufficienza epatica
Insufficienza renale
Estesioneuroblastoma (estremamente
raro)
Traumi cranici
Frattura lamina cribrosa
Da trazione contusione
Masse occupanti spazio
Meningiomi
della doccia olfattiva
soprasellari
della piccola ala dello sfenoide
Gliomi
orbitofrontali
del chiasma e n. ottico
temporobasali mediali
Osteomi del tetto orbitario
Ascessi del lobo frontale
Neoplasie ipofisarie
Aneurismi
a. cerebrale anteriore
a. comunicante anteriore
Meningoencefalocele anteriore
M. neurodegenerative
m. di Alzheimer
m. di Pick
demenza a corpi di Lewy
s. di Down (fase tardiva)
m. di Parkinson (idiopatica)
m. di Parkinson (famigliare)
corea di Huntington
Parkinson-Dementia complex (Guam)
SLA-Dementia complex (Guam)
SLA
Sclerosi Multipla
Emorragia subaracnoidea
Meningiti croniche
Interventi neurochirurgici
Tumori
Epilessia temporale
Sindrome di Kallman
(anosmia congenita per agenesia del neuro-epitelio e dei
bulbi olfattivi con ipogonadismo ipo-gonadotropo)
Sindrome di Turner
Albinismo
Anosmia specifica
* Solo labuso cronico, poich una breve terapia corticosteroidea locale utile e consigliabile nelliposmia rinogenica
(Golding-Wood et al., 1996).
versione verso i cibi potrebbe indurre a sospettare un deficit olfattivo primitivo o anche secondario, causato cio da grave carenza alimentare (Kopala et al., 1995).
Un particolare, piuttosto infrequente tipo di
deficit olfattivo rappresentato dalla cosiddetta anosmia specifica, cio una selettiva mancanza di olfatto per una sostanza o unintera
Funzioni dei nervi cranici e dei nervi spinali
classe di sostanze odorose con olfatto altrimenti normale (Amoore, 1967). Paragonabile alla
cecit per i colori, il disturbo ha base genetica, derivando dalla mancanza di recettori olfattivi specifici per una certa sostanza volatile
(Griff e Reed, 1995). Secondo alcuni (Moller et
al., 1999), il disturbo sembrerebbe curabile
mediante ripetute esposizioni allodore non
percepito.
Una riduzione unilaterale dellolfatto pu
riscontrarsi tipicamente nella patologia espansiva della fossa cranica anteriore (neoplasie,
aneurismi della. carotide interna), ove pu
occasionalmente arricchire una sindrome di
Foster-Kennedy (v. pag. 525), e nellepilessia
temporale, in cui liposmia pu dipendere da
unestensione del focolaio lesionale alle aree
olfattive, o rappresentare lesito di un intervento neurochirurgico di exeresi. In questi casi, la
presenza di uniposmia unilaterale pu essere riconosciuta solo effettuanto i vari test olfattometrici per via monorinale.
IPEROSMIA. Indica un abnorme aumento della
percezione olfattiva verso gli odori in genere.
Contraddistingue essenzialmente le crisi pi
violente di emicrania (ove si associa a nausea
ed a vomito) e le meningiti acute, ove costituisce un segno irritativo di significato analogo
alliper- disestesia superficiale ed alla foto- e
fonofobia spesso coesistenti.
Disturbi qualitativi
DISOSMIE. Sono distorsioni percettive a carattere fastidioso o sgradevole che si manifestano
in presenza di comuni stimoli odorosi.
Tipicamente riguardano lodore dei cibi, olfattivamente percepiti come disgustosi o nauseabondi, e possono configurare in casi estremi
una globale cacosmia, spesso associata ad
unanaloga modificazione della percezione
gustativa (cacogeusia).
201
In certe forme particolari di patologia rinosinusitica (ozena, empiema dei seni paranasali)
con produzione locale di secreti ad odore particolarmente sgradevole, probabile che le disosmie o la cacosmia dipendano da un danno delle
ciglia olfattive o da una saturazione dei rispettivi recettori.
Manifestazioni disosmiche possono insorgere anche per lesioni incomplete del bulbo
olfattivo, causate da traumi, compressioni o esposizione a vapori o assunzione di sostanze tossiche.
Esistono infine casi a genesi oscura, che riguardano persone anziane (ed in cui, a parte
let, non si trovano altre possibili cause), o che
si associano ad una evidente sintomatologia
ansioso-depressiva: in questo caso, il disturbo
spesso recede spontaneamente a distanza di
tempo, senza che siano emerse motivazioni
plausibili del disturbo (quali ipovitaminosi, uso
di alcuni farmaci, patologia dentaria, abuso di
fumo etc.).
P AROSMIE . Sono percezioni spontanee di
odori inusuali, non riferibili ad alcun odore
noto, che compaiono in assenza di stimoli
odorosi.
Consistono nella percezione, spesso a carattere accessuale e di breve durata, di odori forti,
sgradevoli e mal definibili a parole dal paziente, quali ad esempio odore di cavolo o uovo
marcio, di zolfo, di copertone dauto o rifiuti
incendiati, etc. Queste manifestazioni dispercettive, talora associate o seguite da una breve,
parziale compromissione della coscienza, configurano le cosiddette crisi epilettiche olfattive o uncinate del lobo temporale, in quanto
prodotte dallattivazione della corteccia olfattiva
primaria (corteccia prepiriforme ed uncus dellippocampo) (v. pag. 537).
Disturbi psico-olfattivi
Sono costituiti dalle allucinazioni olfattive,
percezioni spontanee altamente realistiche di
202
Elementi di fisiopatologia e semeiologia
odori esistenti ben noti, contraddistinte dallassenza di una stimolazione odorosa.
Possono avere genesi epilettica e, come le
parosmie, dipendere dallattivazione di aree
corticali olfattive quali corteccia prepiriforme
ed uncus dellippocampo.
Alternativamente, possono rappresentare
frammenti psicosensoriali proiettati dal paziente
su s stesso o allesterno, nellambito di un delirio di riferimento sensitivo o di una psicosi
dissociativa (parafrenia tardiva e schizofrenia).
Nel primo caso, di solito il paziente avverte
odori emananti dal proprio corpo che nessun
altro percepisce, ma che egli ritiene tali da pregiudicare ogni rapporto con gli altri, per cui
spinto ad interminabili lavacri e ad esagerato o
abnorme uso di detergenti. Coesiste quasi sempre una condizione depressiva che peggiora una
struttura di personalit ossessivo-fobica.
Nel secondo caso, il paziente avverte odori
particolari provenienti da una sorgente esterna,
quali esalazioni di gas, solventi o fumi industriali, che ritiene appositamente procurati da altri a
suo esclusivo dispetto o danno. Come in ogni
altro delirio, anche in queste circostanze esiste
unincrollabile certezza sulla realt dei fenomeni percettivi allucinatori e sul significato soggettivo del loro vissuto, bench non esistano prove a sostegno.
Non chiaro se vi sia una base biologica delle allucinazioni olfattive, anche se ci probabile, almeno limitatamente nella schizofrenia.
Infatti, in una vasta casistica (Kopala et al.,
1994) allucinazioni olfattive erano presenti nel
34,6% dei soggetti schizofrenici, nel 19% dei
soggetti affetti da depressione maggiore e nel
29% dei soggetti con disturbi del comportamento oro-alimentare, ma solo nel gruppo degli
schizofrenici si poteva dimostrare la coesistenza
di un generico disturbo dellidentificazione
olfattiva.
Linquadramento ed il trattamento di queste
forme di competenza psichiatrica, e contempla limpiego di terapie mirate principalmen-
te sui sintomi distimici (antidepressivi-ansiolitici) o deliranti-allucinatori (neurolettici maggiori).
Occasionali allucinazioni olfattive sono eccezionalmente riferite anche nelle fasi evolutive della m. di Alzheimer e nella sindrome
da astinenza alcoolica (entrambe condizioni
che contemplano riduzione dellacuit olfattiva).
Disturbi simbolici
Analogamente agli altri sistemi sensoriali,
anche lolfatto soggiace alla possibilit di
unerrata elaborazione simbolica dei segnali da
parte delle aree corticali deputate allattribuzione ed alla rievocazione dei nomi o al riconoscimento del significato simbolico dei messaggi in arrivo. La dimostrazione di unagnosia
agli odori, ovvero incapacit ad identificare o
denominare correttamente dati aromi pu essere sospettata in base ai risultati del test
UPSIT (test di identificazione degli odori).
Conviene precisare, peraltro, che questo test
risente particolarmente delle capacit lessicali
e verbali del soggetto, e pu risultare alterato
non tanto per un disturbo della sfera olfattiva,
quanto per la coesistenza di un disturbo fasico,
quale ad esempio lanomia che frequentemente
contraddistingue lesordio di una demenza. In
questi casi, lUPSIT dovrebbe essere sostituito da un test analogo basato sullidentificazione di figure (PIT): ad esempio di frutti (arancio, banana), cibi (pizza, cioccolata), solventi
(benzina, trementina).
Analogamente, i test di discriminazione e di
memoria degli odori risentono notevolmente
delle capacit attentivo-mnesiche di cui ciascun
soggetto dispone, per cui, come concetto di
base, la valutazione psicometrica olfattiva dovrebbe avvenire nellambito pi generale di un
bilancio neuropsicologico completo (v. pag.
000).
Funzioni dei nervi cranici e dei nervi spinali
Gusto (V - Nervo linguale; VII - Nervo intermediario; IX - Nervo glossofaringeo; X - Nervo vago)
Il senso del gusto principalmente deputato
ad identificare la qualit degli alimenti da ingerire. Per quanto possa essere aiutata da olfatto
e vista, la ricognizione e selezione finale del
cibo si affida alla trasduzione chemocettiva
intraorale, che ha principalmente sede nellapparato gustativo della lingua, e, in misura del
tutto accessoria, del palato, della faringe e dellepiglottide. Poich il transito di un alimento
dal cavo orale alla porzione superiore dellesofago piuttosto veloce, specie per i cibi liquidi
ed a nutrizione gi avviata, il rischio che parti
di cibo invisibilmente avariate e possibilmente
tossiche siano per sbaglio ingerite pu essere
minimizzato solo attraverso un controllo gustativo continuo, inserito in un circuito riflesso a
velocit dintervento sufficientemente rapida.
Nelle decisioni gustative, implicanti un significato di vita o di morte, luomo risulta circa tre
volte pi veloce del topo, impiegando solo 50
msec per bloccare la deglutizione di un alimento
dal gusto sospetto (Delconte et al., 1992).
Il gusto, quindi, costituisce in primo luogo un
apparato di difesa, inducendo risposte di avversione per quei cibi che visualmente ed olfattivamente appaiono seducenti, ma che alla scansione chimica si rivelano veri e propri trojans13 : il troppo salato o acido evocano immagini di composti avariati e dannosi, mentre
lamaro indispensabile per riconoscere ed evitare alcaloidi vegetali ed altre tossine ambientali potenzialmente mortali.
Per contro, labilit ad identificare sostanze
alimentari dolci particolarmente importante
nella ricerca di cibi ricchi di carboidrati con alto
valore nutritivo (Margolskee, 2002). In tal
modo, il gusto diventa anche fonte di ineguagliabile piacere, fondamentale per motivare
dopo la nascita lattaccamento al seno materno
(Steiner et al., 2001), e successivamente garantire la qualit della vita (Lindemann, 2001), non
solo in termini puramente edonici, ma anche
sociali, permettendo quella speciale convivialit
orale essenziale per ogni genuino rapporto dintimit, sia nei primati che nelluomo. Antropologicamente, esistono evidenze circa unevoluzione parallela dellacuit gustativa per due raggruppamenti di gusti primari: per le sostanze
vegetali dolci (gradevoli) e per quelle amare o
ricche di tannini (sgradevoli). Lapprezzamento del gusto salato, e la corrispettiva minor acuit, sarebbe invece una risposta culturalmente acquisita in tempi recenti (Hladik et al, 2002).
Lapparato gustativo, a differenza di quello
olfattivo, non risponde alle molecole volatili, ma
alle molecole in soluzione, fenomeno che fisiologicamente garantito dalla continua produzione di saliva; inoltre, perifericamente distribuito su una superficie molto pi estesa.
La differenza pi evidente fra i due apparati
sta per nella rispettiva sensibilit agli stimoli
chimici, straordinariamente superiore per quelli
olfattivi (molti dei quali capaci di farsi percepire persino a diluizioni di 1109 di fronte ad un
massimo di 3,376103 per lamaro della chinina
solfato) e nel numero di sostanze riconosciute:
migliaia di odori contro solo sei gusti di base,
di cui quattro classici (il dolce, lamaro, il salato e lacido), e due di recente inclusione, rispettivamente lumami14 o gusto di l-glutammato monosodico (il sapido del piatto giapponese dashi, degli intingoli e salse cinesi e
dei brodi concentrati di carne) (Faurion, 1991;
Lindemann, 2000; Yamaguchi e Ninomiya,
2000), ed il grasso (Margolskee, 2002).
14
13
Cavalli di Troia, termine informatico usato per definire piccoli programmi nocivi mascherati sotto nomi allettanti.
203
Dispiace che la patria di Brillat-Savarin, del consomm e di
salse haute cuisine ed anche il famoso estratto di carne
deutsche non abbiano avuto la bench minima considerazione nel mondo scientifico anglosassone.
204
Elementi di fisiopatologia e semeiologia
Fig. 7.6 - Aree gustative della lingua, territori dinnervazione, papille e calici gustativi e zone di maggior sensibilit per i
gusti di base.
Esistono spiegazioni di ordine anatomico: di
fronte a 40 milioni di cellule olfattive, esprimenti complessivamente molte centinaia di differenti classi recettoriali, vi sono solo 5-10 milioni
di equivalenti cellule gustative, dotate di pochissime classi recettoriali.
Fortunatamente, le combinazioni gustative
possibili risultano in realt pi numerose di
quanto ci si potrebbe attendere da cos pochi
gustibase: il problema principale, quindi, di
natura eminentemente lessicale, essendo il vocabolario occidentale particolarmente povero di
parole atte a descrivere lintera gamma dei sapori che a tavola siamo in grado di percepire.
Aspetti neuroanatomici
1. Mucosa, calici e cellule gustative. La via gustativa nasce da specifiche cellule recettoriali che complessivamente formano lorgano del gusto, rappresentato dai
calici o gemme o bottoni gustativi (Fig. 7.6).
Descritti da Loven e Schwalbe nel 1868, i calici sono
microscopiche formazioni sferiche o ovoidali morfologicamente paragonabili a palloncini o meglio, a minuscole bottiglie rigonfie annidate nello spessore dellepitelio
(altezza 70-80 m, larghezza 35-50 m), con base appoggiata al derma e collo terminante alla superficie libera
della mucosa con un piccolo poro gustativo (diametro 3-4 m).
Su un totale di circa 10.000 calici, 9000 si concentrano
sul dorso della lingua in corrispondenza delle papille
gustative, ed in particolare: a) in numero scarso (da 1 a
5) nelle papille fungiformi, piccole escrescenze protrudenti dalla mucosa dei 2/3 laterali e punta della lingua
(dominio del nervo intermediario, VII); b) in numero
molto pi alto (centinaia: 150 o pi) nelle papille foliate,
invaginate nella mucosa e disposte in fila lungo i bordi
laterali del 1/3 posteriore della lingua; c) nelle grandi
papille circumvallate (o vallate), invaginate e circondate da un vallo pi profondo, situate nel 1/3 posteriore
della lingua e costituenti la V linguale (dominio del nervo glossofaringeo, IX) (Fig. 7.6).
I restanti calici (circa 1.000) si distribuiscono al palato
molle attorno allugola, agli archi palatini, alla faringe (dominio dei nervi glossofaringeo e vago, IX-X). Una piccola quota di essi, priva di rilievo funzionale anche perch
destinata a scomparire nella prima infanzia, si ritrova sulla faccia laringea (o posteriore) dellepiglottide e sulle pieghe ariteno-epiglottiche (nervo vago, X).
Ghiandole sierose annesse alle papille contribuiscono
alla formazione di saliva allinterno del vallo peripapillare.
I calici sono cos costituiti (Fig. 7.6): a) allesterno,
da cellule epiteliali di sostegno, allungate ed a faccia concavo-convessa, che delimitano il poro gustativo; b) allinterno, da cellule neuro-epiteliali fusiformi disposte a
doga di botte, alquanto ispessite in corrispondenza del
nucleo ed interconnesse da giunzioni serrate16 , che ter-
16
Tali giunzioni ostacolano la diffusione passiva dei sali alle regioni basali, in proporzione al loro peso ed ingombro sterico.
Funzioni dei nervi cranici e dei nervi spinali
minano perifericamente con microvilli simili a ciglia protrudenti nel poro gustativo; c) al confine dermico, da piccole cellule basali rotondeggianti indifferenziate daspetto staminale (precursori), che incessantemente generano nuovi elementi neuro-epiteliali. Il neuro-epitelio, infatti, ha un ciclo vitale piuttosto breve (attorno ai 10 giorni), ed istologicamente risulta formato da una minoranza di cellule scure, iperdense (probabilmente in fase
degenerativa per apoptosi) alternate ad una maggioranza di cellule chiare o intermedie.
Le cellule neuro-epiteliali non sono neuroni, poich
mancano di dendriti e di assone, ed avendo vita effimera, devono essere continuamente rinnovati. Analogamente al neuro-epitelio olfattivo, ogni nuova cellula esprime
il corredo recettoriale e si connette con le stesse terminazioni assoniche di quella scomparsa che va a sostituire (Ganchrow, 2000). Le cellule gustative, tuttavia,
sono capaci di generare potenziali dazione come i
neuroni, ed inoltre formano, in corrispondenza di accumuli di vescicole di aspetto presinaptico situati al loro
polo baso-laterale, numerosi contatti presinaptici con
espansioni dei rami centrifughi di neuroni ganglionari a
T gustativi, del tutto analoghi a quelli sensitivi di 1 ordine dei gangli dorsali.
Ogni cellula neuro-epiteliale presinaptica non solo
rispetto a molte terminazioni di una stessa fibra ganglionare, ma in parte anche alle diramazioni collaterali di altre
fibre ganglionari preferenzialmente terminanti su altri
elementi.
2. Proiezioni gustative di 1 ordine. Il decorso centripeto fino al soma delle fibre gustative provenienti dai due
terzi anteriori della lingua anatomicamente complicato
ed ancor oggi poco chiaro nelluomo, non solo per limpossibilit ad identificare quali siano i contingenti di fibre
che decorrono nei rami anastomotici, ma anche per le variazione anatomiche esistenti fra persona e persona.
diffusamente accettato, comunque, che i due terzi
anteriori antistanti la V linguale (papille fungiformi)
siano principalmente innervati da fibre afferenti al SNC
che ascendono nella corda del timpano, raggiungono il
rispettivo soma nel ganglio genicolato e da qui entrano a far parte del tratto prossimale del nervo intermediario di Wrisberg (nervo intermedio-facciale, VII) per penetrare nel solco bolbo-pontino in corrispondenza dellala cinerea (tratto o fascicolo solitario) e terminare
infine nellarea gustativa bulbare, o porzione rostrale del
nucleo del tratto solitario, aggettante lateralmente sul
pavimento del IV ventricolo (tuber cinereum) (Fig. 7.7,
7.8, 7.9).
possibile che un certo contingente raggiunga il
ganglio genicolato tramite unanastomosi fra corda del
205
timpano e nervo grande petroso superficiale, ed un altro contingente ascenda inizialmente nel nervo linguale
(ramo del nervo mandibolare, III branca del trigemino,V)
e solo successivamente, tramite un ramo anastomotico,
raggiunga la corda del timpano. Simile destino hanno le
fibre che innervano il palato molle, ascendenti attraverso il nervo grande petroso superficiale al ganglio genicolato (VII).
Al contrario, il terzo posteriore della lingua (papille
foliate e circumvallate) innervato da fibre gustative
ganglionari centrifughe che, ascendendo nella branca
linguale del nervo glossofaringeo (IX) raggiungono i rispettivi somi nel ganglio petroso (Andersch, 1791) e decorrendo come rami centripeti nella radice del IX nervo,
poi si distaccano per entrare nellarea gustativa bulbare
(Bradley et al., 1996) (Fig. 7.8 e 7.9).
Le restanti regioni retro-linguali sono innervate nella
faringe dai nervi IX e X (vago) attraverso il plesso
faringeo, e nella laringe, dal nervo laringeo superiore (X
nervo): le fibre gustative ganglionari centrifughe, dopo
aver raggiunto i rispettivi somi, situati rispettivamente nel
ganglio petroso (IX nervo) e nel ganglio nodoso (X nervo), si estendono in rami centripeti lungo le radici di questi nervi per terminare anchesse nellarea gustativa bulbare (Fig. 7.8 e 7.9).
3. Proiezioni gustative di 2 e 3 ordine. Le vie centrali del gusto sono ancor oggi poco conosciute nelluomo (Brodal, 1981; Norgren, 1990), e ci che la recente
letteratura riporta al riguardo basato sullo studio
anatomo-funzionale in RM di singoli casi con lesioni
focali del tronco, del talamo o della corteccia (SanchezJuan e Combarros, 2001).
Le proiezioni di 2 ordine dei neuroni dellarea gustativa bulbo-pontina (nucleo del tratto solitario) ascendono ipsilateralmente nel tratto tegmentale centrale bulbopontino, posto dorsalmente al lemnisco mediale, e sono
di tre tipi: segmentali, solitario-talamiche e solitarioparabrachiali.
a) Le proiezioni segmentali innervano vari nuclei del
tronco encefalico: nucleo dorsale motore del X, nucleo
ambiguo, nuclei salivatori, nuclei del V e del VII, e rappresentano larco afferente di vari meccanismi vegetativi e motori riflessi, quali ad esempio, salivazione, masticazione, deglutizione e vomito.
b) Le proiezioni solitario-talamiche risalgono ipsilateralmente fino al ponte-mesencefalo, quindi in gran parte si incrociano in un tratto compreso fra mesencefalo e
parte mediale del VPM (Onoda e Ikeda, 1999), e terminano controlateralmente nella porzione pi mediale
206
Elementi di fisiopatologia e semeiologia
Fig. 7.7 - Schema della distribuzione delle vie vasodilatatorie, secretrici ghiandolari e delle vie gustative del n. intermediario di Wrisberg.
(parvicellulare) del nucleo talamico VPM (Fig. 7.9). Le
proiezioni di 3 ordine di questo subnucleo raggiungono la corteccia gustativa primaria corrispondente, situata
nel territorio di confine fra porzione anteriore dellinsula
ed opercolo parietale.
Non chiaro se esistano contingenti che seguono il
decorso del lemnisco mediale (Fig. 7.11) e contingenti
che non sincrociano: tali possibilit, suggerite soprattutto
in passato, oggi sembrano assai remote.
Pertanto, lageusia di unintera emilingua (emiageusia) pu dipendere: i) da una lesione focale ipsilaterale del tronco encefalico, oppure ii) da una lesione
focale controlaterale del talamo, delladiacente capsula
interna o della corteccia gustativa primaria opercolo-insulare.
c) Le proiezioni solitario-parabrachiali terminano
nella porzione mediale del nucleo parabrachiale pontomesencefalico, disposto ventralmente attorno al braccio
congiuntivo di ogni lato. Il nucleo parabrachiale invia
proiezioni rostro-ventrali di 3 ordine sia allipotalamo,
deputate alla regolazione di funzioni vegetative quali ad
esempio lappetito e la sete, sia alle regioni olfattive del
sistema limbico (area prepiriforme, uncus dellippocampo). In tali sedi avviene quella speciale integrazione degli odori e dei sapori che permette di apprezzare il gusto dei cibi sotto il profilo edonico e contemporaneamente di impedire lingestione di sostanze tossiche
(Reilly, 1999).
Aspetti neurofisiologici e neurobiologici
1. Recettori e meccanismi di trasduzione
degli stimoli gustativi.
Le quattro qualit gustative basali (salato,
dolce, amaro, acido) sono percepite ubiquitariamente sulla lingua, ma con maggior facilit
in corrispondenza di specifiche regioni, ove
ogni unit sensitiva reagisce a tutti e quattro gli
stimoli, ma con soglia particolarmente bassa per
uno stimolo specifico: apice della lingua (dol-
Funzioni dei nervi cranici e dei nervi spinali
207
Fig. 7.8 - Via gustativa: fibre a partenza dal terzo posteriore della lingua (n. glosso-faringeo) e fibre a partenza dai due
terzi anteriori della lingua, ove tre possibili vie A, B, C, sono indicate. A) Attraverso la corda del timpano, il ganglio genicolato e lintermediario di Wrisberg si raggiunge il n. del fascicolo solitario; B) attraverso la corda del timpano, il ganglio genicolato, il n. grande petroso superficiale, il ganglio sfenopalatino, il ganglio di Gasser, il V paio, si raggiunge il n. del fascicolo solitario; C) attraverso il n. linguale, il ganglio di Gasser, il V paio si raggiunge il n. del fascicolo solitario. V-VII-IX-X:
nervi cranici. 1, 2, 3: branche del trigemino.
Fig. 7.9 - Schema delle vie gustative centrali.
208
Elementi di fisiopatologia e semeiologia
ce), V-linguale (amaro), bordi laterali anteriori
(salato), bordi laterali posteriori (acido).
Per ogni tipo di stimolo gustativo esiste uno
specifico meccanismo di trasduzione, ma la
stessa sensazione pu essere evocata da due differenti stimoli (ad esempio, il gusto acido prodotto da protoni [H+] pu essere potenziato da
anioni organici, quali lattato o meglio ancora,
citrato). Inoltre, i meccanismi trasduttivi per la
stessa sostanza stimolante possono sensibilmente differire fra le diverse specie di vertebrati.
In accordo a Buck (2000b) e Margolskee
(2002), i meccanismi molecolari responsabili
dei gusti base seguono questa sequenza generale: interazione delle sostanze stimolanti con
recettori situati sulla superficie apicale (microvilli) depolarizzazione generazione di
potenziali dazione ingresso (o liberazione
intracellulare) di Ca2+ rilascio di neurotrasmettitori dalla superficie basale attivazione
sinaptica delle fibre di 1 ordine.
Sia i recettori gustativi con relative G-proteine, che i meccanismi di trasduzione intracellulare
del segnale chimico attraverso secondi e terzi
messaggeri, tentativamente sintetizzata in Tab.
7.5, rappresentano argomenti molto complessi e
non ancora completamente conosciuti (Kinnamon, 2000; Margolskee, 2002).
Come possibile osservare, esistono due classi multigeniche di recettori accoppiati a differenti G-proteine
(gustducine, molto simili alla transducina dei coni retinici), T1R per il gusto dolce e T2R (o TRB) per il gusto
amaro. In particolare:
a) la prima classe caratterizzata da tre tipi di recettore, T1R (1-3), di cui la forma T1R3, corrispondente al
locus Sac sul cromosoma 4, la principale responsabile
per la sensibilit ai dolcificanti naturali ed artificiali, quali
la saccarina (Sainz et al. 2001), ed espressa sulle papille
fungiformi, ed anche sulle papille circumvallate e foliate.
La formazione di eterodimeri (T1R1/T1R2, T1R2/T1R3)
e lassociazione a isoforme di gustducina sarebbero responsabili della differente sensibilit finale ai differenti
dolcificanti.
Sorprendentemente, oltre a permettere il riconoscimento delle sostanze dolci, letero-dimero T1R1/T1R3
permetterebbe anche quello del gusto umami, cio del lglutammato ed l-aspartato. Recenti evidenze di non age-
vole comprensione, infatti, dimostrano che questi l-aminoacidi producono una selettiva attivazione, nettamente potenziata da 5'-ribonucleotidi (IMP-GMP), delleterodimero formato dal recettore T1R1 (dotato di sequenze
identiche a quelle del recettore metabotropico per il lglutammato (mGluR1) e dal recettore T1R3, qualora
entrambi siano espressi in cellule dotate di particolari Gproteine, quali ad esempio G15 (Li et al., 2002).
Ma ci non tutto (Nelson et al., 2002): letero-dimero
T1R1/T1R3 funzionerebbe non tanto come recettore specifico per l-glutammato/l-aspartato (con relativo gusto
umami), ma come generico sensore della maggior parte di
altri 20 l-aminoacidi dotati di sapore piacevole (dolce o
umami-simile). Sequenze aminoacidiche di T1R1/T1R3,
differenti da specie a specie, spiegherebbero le preferenze di gusto nellambito di queste molecole, essenziali sia
come precursori biosintetici, che come fonte denergia.
Questa selettivit del senso del gusto probabilmente comporta rilevanti implicazioni di carattere evoluzionistico. Rigorosamente stereospecifica ed assente per i d-isomeri,
essa tuttavia differisce da quella olfattiva, capace di distinguere gli isomeri chirali della stessa molecola in base ad
una differente intensit o qualit percettiva.
Il gusto umami, inoltre, garantito anche da un secondo meccansimo di trasduzione, basato sullattivazione di
recettori metabotropici per il glutammato/aspartato di
tipo mGlu-R4 (sensibili a l-2-amino-4-fosfono-butirrato
o L-AP4), cui fa seguito in cascata una riduzione del cAMP submembrana (Chaudhari e Roper, 1998; Chaudari
et al., 2000) ed una facilitata apertura dei canali Na+ e
Ca2+ c-AMP-dipendenti.
b) La seconda classe T2R/TRB (amaro) comprende
una famiglia di 40-80 recettori associati ad a-gustducina
o anche ad altre sue isoforme, espresse nel 15-20% delle cellule neuro-epiteliali delle papille circumvallate e
foliate e del palato, ma soltanto in pochissime cellule
delle papille fungiformi (Adler et al., 2000). Poich un
largo repertorio di questi recettori espresso nella stessa cellula, diventa facile spiegarsi perch un uniforme
gusto amaro sia prodotto da cos tante sostanze tossiche
strutturalmente eterogenee, ed anche prive di correlato fra
loro (Chandrashekar et al., 2000).
2. Saliva ed apparato gustativo.
La funzione salivare strettamente legata a
quella gustativa, e le rispettive interazioni, non
ancora completamente conosciute, possono essere cos riassunte (Spielman, 1990):
a) Interazioni salivastimoli gustativi. La dotazione
ionica della saliva critica per la trasduzione dei segnali
fisiologici: la presenza di bicarbonati, infatti, attenua il
Funzioni dei nervi cranici e dei nervi spinali
209
Tabella 7.5 Principali meccanismi recettoriali e di trasduzione intracellulare degli stimoli gustativi (aggiornati al 2002).
Recettori
Salato
Acido
Dolce
Stimolo
Eventi molecolari intracellulari
NaCl
canali Na+ ingresso Na+ (apicale/ basale) depolarizzazione esocitosi
KCl
canali K+ ingresso K+ (apicale) depolarizzazione basale esocitosi
HCl
canali Na+ (amiloride sensibili) ingresso H+ depolarizzazione esocitosi
Citrato
canali K+ (apicali) blocco depolarizzazione esocitosi
T1R1-T1R2 Zucchero
attivazione adenilil-ciclasi aumento cAMP fosforilazione (PKA) ed inibizione
T1R2-T1R3
dei canali basolaterali K+ depolarizzazione ingresso di Ca2+
esocitosi
T1R3
Amaro T2R/TRB
Dolcificanti
attivazione fosfolipasi PLC IP3/DAG rilascio di Ca2+
Denatonio
gustducina (G attivazione di fosfodiesterasi (PDE1A) riduzione cAMP
Propiltiouracile disinibizione canali (Ca2+, K+) cAMP dipendenti ingresso di Ca2+
esocitosi
gustducina (G3, G13) PLC2 IP3/DAG rilascio di Ca2+
Chinina
Umami mGLU-R4
blocco di canali K+ apicali e relativa corrente duscita depolarizzazione esocitosi
GLU/ASP
gustducina (?) attivazione di fosfodiesterasi riduzione cAMP
c-AMP/IP3
disinibizione canali (Ca2+, K+) cAMP dipendenti (?) ingresso di Ca2+
esocitosi
T1R1-T1R3 idem + L-AP4 gustducina (G15) attivazione fosfolipasi IP3/DAG rilascio di Ca2+
(mGLU-R1)
gusto acido, mentre quella di glutammato tende a potenziare il gusto sapido (umami); inoltre, il contenuto in Na+
della saliva, normalmente privo di correlato gustativo, a
determinare la soglia per lapprezzamento del salato.
Analogamente, ogni sostanza escreta nella saliva o
trasportata in essa dallapparato dentale (ad esempio farmaci, ioni metallici, derivati della degradazione di residui alimentari, etc.) teoricamente in grado di modificare in maniera anche sostanziale la soglia percettiva per
uno o pi gusti base, o di creare distorsioni percettive
(disgeusia).
La presenza nella saliva di lipocaline quali le hOBPIIa (componenti del muco olfattivo gi descritte a pag.
000) permette inoltre la solubilizzazione e presentazione ai recettori gustativi di molecole idrofobiche grasse,
responsabili di quellattraente ed indefinibile sapore
aggiuntivo che caratterizza ogni alimento ricco in lipidi.
b) Interazioni stimoli gustativisaliva. La produzione e la composizione della saliva sono influenzate dal tipo
degli stimoli gustativi. Generalmente, il massimo flusso
con pi elevata concentrazione di Na+ prodotto dagli
acidi organici (da acido citrico o acetico), mentre la pi
alta concentrazione di proteine e Ca2+ prodotta dal sale
comune e dal l-glutammato monosodico (Horio e Kawamura, 1989) La relativa proporzione delle varie proteine
salivari, comunque, rimane fisiologicamente invariata ed
indipendente dal tipo di stimolo.
3. Apprendimento e modulazione dei gusti.
La diffusa accettazione dei quattro gusti di
base nasce dalla certezza, mai contestata, che
possono essere percepiti da tutti, sia pure con
modeste variazioni interindividuali. I nuovi due
gusti, lumami ed il grasso, sono ancor oggi
accettati con riserva, anche da chi vi crede.
Molto probabilmente, il motivo sta nel fatto che
sono entrambi molto allettanti e piacevoli, ma
210
Elementi di fisiopatologia e semeiologia
poco nettamente delineati da un punto di vista
qualitativo, e che non tutte le cucine ne fanno
lo stesso uso.
Il fatto che solo il 73% delle persone riesca a distinguere il gusto umami dal gusto salato, suggerendo che
le altre abbiano unageusia specifica per il glutammato
(Lugaz et al., 2002), sembra piuttosto ridimensionato
dalla dimostrazione che tale deficit selettivo scompare facilmente, solo che si assaggi dadi al l-glutammato per un
po di giorni (Kobayashi e Kennedy, 2002). Ci va pienamente daccordo con la dimostrazione neurofisiologica
nel primate di un epicentro corticale per il gusto umami
differente da quello dei gusti classici, essendo situato in
unarea gustativa secondaria della corteccia orbito-frontale, area in cui possibile un netto potenziamento da
parte di altri specifici gusti (5'-inosina monofosfato) o
odori (aglio), cos come una loro marcata attenuazione
a saziet raggiunta (Rolls, 2000).
In conclusione, cos come per gli odori, anche per i sapori ed i gusti non tanto lattrezzatura che sembra difettare, quanto labitudine
ad usarla.
4. Elaborazione del codice neurale.
Il paradigma dei quattro gusti di base indurrebbe a pensare che vi siano linee privilegiate
per ciascuno di essi (teoria quadripartita delle
labelled-lines). Linsieme delle evidenze
psicofisiche ed elettrofisiologiche finora raccolte depone piuttosto per lesistenza di qualit
gustative che vanno ben al di l di una scarsa
manciata di gusti. Lattivazione iniziale di un
vasto numero di differenti recettori, canali ionici
e secondi messaggeri, comporterebbe piuttosto
linsorgenza di specifici, differenti pattern di
scarica attraverso lintera matrice neuronale del
sistema gustativo (teoria across-fiber). In altre parole, i neuroni non sarebbero programmati
per elaborare una particolare sensazione, ma per
operare in rete con gli altri nella codifica dei vari
sapori (Schiffman, 2000).
5. Interazioni fra sistema gustativo e sistema
trigeminale somestesico endo-orale.
La densa innervazione tattile, termica, dolorifica e vegetativa (eccitosecretiva e vasomotoria)
delle mucose chemosensoriali da parte del nervo trigemino permette di modulare finemente la
sensibilit agli stimoli olfattivi e gustativi attraverso un controllo locale delle secrezioni mucose e del flusso arteriolo-capillare.
Stimoli sensitivi endo-nasali ed endo-orali,
inoltre, accompagnano costantemente quelli
sensoriali nella loro elaborazione ad ogni livello
del SNC. Limitatamente allaspetto puramente
percettivo (e tralasciando quindi le attivit riflesse
quali ad esempio la congestione nasale riflessa,
lo starnuto, la nausea ed il vomito), lesperienza
finale olfattiva e gustativa risulta sempre arricchita di qualit non sensoriali, come per esempio il
caldo, il freddo, la consistenza o la fluidit, e non
ultimo, anche le propriet irritanti dei cibi, erroneamente attribuite al senso del gusto.
La diffusa abitudine, specie nei climi caldi,
di condire gli alimenti con paprika piccante o
con spezie analoghe, quali ad esempio lo zenzero, di per s essenzialmente prive di odore e
sapore, basterebbe da sola ad attestare lesistenza - o una forte necessit - di unelaborazione
sensitivo-sensoriale centrale congiunta17 .
Vi sono peraltro sufficienti evidenze neuroanatomiche che sostengono questidea, almeno
limitatamente al gusto, poich lapprodo finale
dei messaggi talamo-corticali termici e dolorifici avviene, vedi caso, in unarea insulare immediatamente retrostante a quella che riceve i
messaggi gustativi (porzione anteriore dellinsula) (v. pag. 542).
ESAME DELLA FUNZIONE GUSTATIVA
Prevede leffettuazione di unintervista anamnestica come per lolfatto (v. pag. 196) seguita da prove di semplice identificazione dello stimolo gustativo. Sfortunatamente mancano
ancora metodi standardizzati analoghi a quelli
olfattometrici precedentemente esposti per
quantificare la soglia e le capacit di discrimi17
Analogamente alla consonanza son et lumire, direbbero i
sacerdoti del culto della temperatura di vini.
Funzioni dei nervi cranici e dei nervi spinali
nazione e di memorizzazione degli stimoli gustativi, e, come per lolfatto, limpiego di tecniche elettrofisiologiche rimane essenzialmente sperimentale e confinato allambito di pochi
laboratori specializzati.
Diversi fattori possono interferire con lesame del gusto: unadeguata collaborazione da
parte del paziente, la progressiva riduzione con
let delle cellule e delle papille gustative, il
differente apprezzamento simbolico dei sapori
in rapporto alle abitudini ed alla cultura etnica.
Lesame si effettua stimolando vari punti dei
due terzi anteriori e del terzo posteriore della
lingua, sia a sinistra che a destra.
Poich gli stimoli chimici sotto forma liquida tendono a diffondere rapidamente, preferibile utilizzare sostanze chimiche solide in
minima quantit, tali da formare una soluzione
concentrata pressoch solo nel punto di contatto, applicate mediante un piccolo tampone leggermente inumidito.
Alternativamente, possono essere applicati,
con una sottile pinza, piccoli dischi di carta da
filtro imbevuti di soluzioni concentrate, oppure,
qualora si voglia testare la soglia gustativa, di
soluzioni a concentrazioni log-scalari (NaCl: 2,57,5-15%; acido citrico: 1,5-5-10%; glucosio: 110-40%; chinina-HCl: 0,035-0,075-0,5%).
Il soggetto non deve parlare, essere in grado di mantenere la lingua protrusa immobile, appoggiata su una garza, e di indicare, sulle figure o sui nomi rappresentativi di
ciascun gusto che gli vengono mostrati, quello corrispondente alla sensazione che di volta in volta prova. Dopo ogni
applicazione, la lingua devessere accuratamente pulita con
un tampone o, meglio ancora, sciaquata con acqua.
Le sostanze usate per la stimolazione sono classicamente: zucchero (dolce), sale comune o NaCl (salato),
acido citrico (acido) e chinino solfato (amaro). La
stimolazione con acido citrico pu essere sostituita da una
stimolazione galvanica mediante comuni pile connesse
tramite potenziometro ed interruttore a due elettrodi applicati luno in un punto indifferente della mucosa orale
(negativo), laltro su differenti punti del dorso della lingua (positivo). Idonee apparecchiature predisposte per
erogare correnti costanti sono necessarie per effettuare
lelettrogustometria quantitativa.
211
In caso di deficit bilaterale, pu essere utile valutare
globalmente la sensibilit gustativa residua del paziente
invitandolo ad assaggiare direttamente in bocca le soluzioni di ogni sostanza.
Alterazioni del gusto
IPOGEUSIA ED AGEUSIA
Definiscono rispettivamente la riduzione e la
perdita completa della sensibilit gustativa. In
mancanza di una classificazione universalmente
accettata delle cause di ipo- ageusia, si propone tentativamente la seguente Tabella riassuntiva (Tab. 7.6).
1. Lipo-ageusia da cause non neurologiche
spesso associata a disgeusia ed diffusa allintera mucosa gustativa. Tralasciando lazione lesiva
di fumo di tabacco ed infezioni oro-faringee e delle
prime vie aeree, una causa abbastanza comune di
ipo- disgeusia luso cronico di farmaci a larga
diffusione. In questi casi, il disturbo pu non solo
compromettere la qualit della vita, ma anche
comportare una scarsa compliance terapeutica
da parte del paziente. I quadri farmaco-iatrogeni
si osservano generalmente in soggetti di et media attorno ai 50 anni di ambo i sessi (58% femmine), nei quali la sospensione del trattamento
usualmente si associa a regressione del disturbo
gustativo, che si completa, per, solo nel 60% circa
dei casi (Ratrema et al., 2001).
Una possibile spiegazione dellipogeusia da farmaci
pu essere ricercata nellazione chelante svolta da alcuni
di essi su metalli divalenti come il rame e lo zinco (vedi
ad esempio D-penicillamina). Lo zinco, in particolare,
un cofattore essenziale per oltre 300 funzioni enzimatiche,
per la sintesi del DNA e lespressione genomica, per la
difesa immunitaria, per il trofismo della cute, delle mucose e degli epiteli chemosensoriali, ed assieme al rame,
essenziale per il funzionamento della Cu2+/Zn2+-superossido-dismutasi18. Il fabbisogno alimentare di zinco, pari
18
Ridotta, incidentalmente, nella malattia di Parkinson, ove sono
stati descritti importanti disturbi olfattivi e anche gustativi.
212
Elementi di fisiopatologia e semeiologia
nelladulto a 15 mg al giorno, normalmente soddisfatto
dalla comune alimentazione basata su cereali, legumi, noci,
latticini, carne e pesce, ma pu aumentare in gravidanza,
o lapporto diventare insufficiente per cause alimentari,
malassorbimento o patologia sistemica grave. Lo zinco,
infine cruciale per la conduzione di una normale gravidanza e per un corretto sviluppo fetale, e successivamente, per un normale sviluppo infantile (Prasad, 1996).
avanzata oltre 30 anni fa (Henkin e Bradley,
1970) poco prima della descrizione di unallora
nuova sindrome di ipogeusia idiopatica con
disgeusia, iposmia e disosmia (Henkin et al.,
1971), si rafforzata via via fino ad oggi, anche
per merito di una progressiva serie di ricerche
effettuate dagli stessi e da altri Autori.
Lipotesi di un cruciale coinvolgimento dello
zinco nella funzione gustativa ed anche olfattiva,
In sintesi, stato dimostrato che il 3% delle proteine
secrete nella saliva dalla parotide rappresentato dalla
Tabella 7.6 Principali cause di alterazione del gusto *.
1. - Cause non neurologiche
2. - Cause neurologiche
1. Fumo di tabacco (specie sigaro, pipa)
1. Periferiche
Lesioni del V nervo linguale
Interventi odontostomatologici e maxillo-facciali
Intubazione tracheale
Poliradicoloneuropatia di Guillain Barr
Neuropatie sensitive
Lesioni gasseriane (terapia della nevralgia del trigemino)
Lesioni del VII intermediario corda del timpano
Paralisi di Bell
Traumi facio-cervicali
Aneurisma dissecante carotide interna extracranica
Neoplasie
Lesioni IX-(X) (foro lacero posteriore)
Tumori (neoplasie, iperplasie linfonodali)
Traumi
2. Patologia infettiva del cavo orale e prime vie aeree
Virale (Adeno, rino ed influenza-virus; Herpes simplex)
Batterica (sialoadeniti)
Fungina (candidiasi orale)
3. Patologia salivatoria
Sindrome di Sjgren (sicca syndrome)
Sclerodermia
Fibrosi cistica
Radioterapia
4. Farmaci (oltre 250), ma soprattutto:
ACE-inibitori, ipocolesterolemizzanti orali, antistaminici, D-penicillamina, inibitori dellanidrasi carbonica
(Diamox), imidazolici ed imidazolinici (metimazolo,
carbimazolo, metronidazolo, zopiclone), captopril, calcio-antagonisti, psicofarmaci, chinoloni, macrolidi
5. Patologia tossico-carenziale
Malnutrizione e celiachia
Insufficienza renale ed epatica
Ipovitaminosi A e B
Deficit di zinco e di ferro
Cachessia neoplastica
6. Patologia endocrinologica
Iper o ipocorticosurrenalismo
Panipopituitarismo
Ipotiroidismo
Pseudoipoparatiroidismo
Diabete mellito
7. Patologia psichiatrica
Depressione
Schizofrenia
* modificata da Sanchez-Juan e Combarros, 2001.
2. Centrali
Troncoencefaliche
Lesioni vascolari
Sclerosi multipla
Malattia di Parkinson
Talamiche
Neoplasie
Sclerosi multipla
Lesioni vascolari
Corticali
Sclerosi temporale mesiale (in associazione ad epilessia)
Lesioni vascolari
Neoplasie
3. A topografa indeterminata
Traumi cranici maggiori
Neuropatia sensitivo- autonomica ereditaria tipo III
(sindrome di Riley-Day)
Funzioni dei nervi cranici e dei nervi spinali
gustina, Zn2+-metalloproteina di 37 kD corrispondente allisoforma VI dellanidrasi carbonica (CAVI-gustina), capace di attivare una fosfodiesterasi Ca2+-calmodulino-dipendente (Thatcher et al., 1998) e probabilmente
anche fattore trofico per la mucosa neuro-epiteliale. Infatti, in malati con sindrome influenzale complicata con
ipogeusia, disgeusia, iposmia e disosmia, stata osservata una riduzione dei tassi di Zn2+ urinari, ematici e
salivari associata ad una riduzione dei tassi salivari di
CAVI-gustina e ad evidenti segni di danno morfostrutturale dei calici gustativi delle papille circumvallate
(Henkin et al., 1999a). Il fatto che linsieme dei disturbi
sensoriali e delle alterazioni biochimico-strutturali migliorasse in oltre il 70% dei malati dopo trattamento per
4-6 mesi con 100 mg/pro die (in dosi refratte ripetute)
di sali di zinco (solfato), ha indotto a concludere che lo
zinco attiva lespressione genica (e probabilmente lattivit specifica e la secrezione) di CAVI-gustina nella saliva, e che essa fondamentale per il processo di rinnovamento del neuroepitelio gustativo attivando i precursori staminali basali. Le mancate risposte terapeutiche
possono dipendere o da una zinco-resistenza, o da uninattivazione della CAVI-gustina da eccessiva sialilazione dellenzima (Henkin et al., 1999b).
Supporto allipotesi di un deficit di zinco/
CAVI-gustina quale principale causa (o via finale comune) di ipo-disgeusie ed ipo- disosmie
di varia natura deriva anche dallevidenza che
la profilassi o la terapia con zinco efficace nel
migliorare o prevenire lipo- disgeusia da psicofarmaci (Stoll e Oepen, 1994) o da irradiazione del capo e del collo (Ripamonti et al.,
1998), e che il trattamento con zinco riduce i
sintomi neurosensoriali deficitari e la durata del
comune raffreddore, come risultato da una
revisione critica di numerosi studi randomizzati
effettuati a questo riguardo (Marshall, 1998).
2. Lipo-ageusia da cause neurologiche si
manifesta con ipo-ageusia localizzata ad unemilingua, o a porzioni di lingua, salvo alcune eccezioni (contusioni cerebrali bilaterali, neuropatie
sensitive). Il seguente semplice schema illustra
gli elementi di base che servono per una diagnosi di sede lesionale (Tab. 7.7).
DISGEUSIE E PARAGEUSIE. Indicano rispettivamente distorsioni delle sensazioni gustative evo-
213
cate dai normali cibi, il cui sapore percepito
come sgradevole (fino alla cacogeusia), e percezioni abnormi di sapori strani ed inusuali, non
evocati da alcun stimolo e spesso a carattere accessuale. Il disturbo di solito percepito se sufficientemente intenso o bilaterale.
La disgeusia, come lipogeusia, pu dipendere innanzi tutto dal fumo (specie di tabacchi forti da sigaro o pipa) e da cause locali odontostomatologiche, ad esempio infiammazioni acute e
croniche del cavo orale e le otturazioni o protesi
di differenti metalli (con produzione di effetti
galvanici). Altre cause da ricercare sono leccessivo uso locale di disinfettanti ad azione ossidante
(acqua ossigenata, soluzioni iodate, clorexidina,
sbiancanti dello smalto), luso topico di sostanze ad azione antisettica tannante (antrachinonici,
sali di argento e, paradossalmente, anche di zinco) e lassunzione di certi farmaci (Tab. 7.6).
Quadri di dominante disgeusia, spesso associata
a disosmia, possono insorgere nellet avanzata,
apparentemente senza causa, oppure accompagnarsi a quadri depressivi o psicotici, ove diventa pressoch impossibile stabilire se il disturbo in
realt non dipenda dal trattamento psicofarmacologico, spesso gi da tempo in atto, o anche dallet e dalle abitudini alimentari.
A scanso di errori, in ognuna di queste situazioni lipotesi carenziale ipovitaminosica o da
deficit di zinco (pi sopra descritta) dovrebbe
essere seriamente considerata, ed eventualmente
provata una terapia integrativa con zinco solfato per un adeguato periodo di tempo.
Ipo- disgeusia causata da un aneurisma dissecante della carotide interna extracranica con effetto massa stata descritta isolatamente (3% dei
casi, per interessamento della corda del timpano)
o in associazione a deficit unilaterale di uno o pi
nervi cranici (17% dei casi) (Mokri et al., 1996):
tali sintomi, associati (83% dei casi) o meno che
siano ad emicrania omolaterale, hanno un importante valore patognomonico predittivo, sollecitando una dirimente esplorazione eco-doppler dei
vari tronchi sovra-aortici.
214
Elementi di fisiopatologia e semeiologia
Tabella 7.7 Diagnosi di sede nellageusia da lesioni neurologiche focali.
Ageusia localizzata a:
Territorio dinnervazione
Strutture lese
emilingua
nervi VII-(V)-IX
Tronco (bulbo-ponte dorsale): nucleo del tratto solitario*
Talamo: VPM mediale
Corteccia: area opercolo-insulare
due terzi anteriori
nervi VII(V)
Nervo intermedio-facciale (VII)
Ganglio genicolato
Corda del timpano
N. linguale (V)
terzo posteriore
nervo IX
Nervo glossofaringeo (IX)
Ganglio petroso
* La possibilit di una lesione isolata e selettiva del nucleo del tratto solitario da alcuni messa in discussione (Victor, 2001).
Le parageusie sono quasi sempre di natura
epilettica, quasi mai hanno un contenuto percettivo piacevole, ed esprimono lattivazione parossistica focale delle aree corticali gustative
primarie o secondarie.
ALLUCINAZIONI GUSTATIVE. Corrispondono a
percezioni gustative altamente realistiche prive
doggetto, e possono rappresentare sia un sintomo psichico positivo nelle forme di schizofrenia produttiva, sia un sintomo epilettico da interessamento di aree associative, qualora la loro
insorgenza sia repentina e la loro durata breve.
In questo caso, valgono le stesse considerazioni gi esposte a proposito delle allucinazioni
olfattive (v. pag. 201).
Neuroftalmologia
E. Favale
La neuroftalmologia studia le alterazioni
della funzione visiva e della motilit oculare
(intrinseca ed estrinseca) di interesse neurologico.
Vie ottiche
Dati anatomici
Il nervo ottico (cos come il nervo olfattivo)
deve essere considerato come una estroflessione
cerebrale, poich la retina in realt una evaginazione dellemisfero cerebrale, sviluppata
nella vita fetale dalla vescicola ottica.
La retina infatti formata da cellule nervose, divise in dieci strati (Fig. 7.10). Le cellule
sensoriali sono rappresentate dai coni e dai
bastoncelli: i primi si trovano isolati nella fovea
e predominano sui secondi nella restante parte
della macula lutea, mentre in tutta la superficie
retinica circostante sono pi numerosi i bastoncelli. La macula lutea la zona di maggior acuit visiva mentre la papilla ottica, priva di organi sensoriali, non ha capacit visive e si esprime nel campo visivo come una macchia cieca.
I dendriti delle cellule bipolari dello strato
nucleare interno (VI strato), diretti verso lesterno, entrano in connessione sinaptica con i
recettori visivi, i coni e i bastoncelli. Gli assoni
delle cellule bipolari, diretti centralmente, entrano in connessione sinaptica con le cellule gangliari dellVIII strato, i cui assoni a loro volta,
dopo avere attraversato lo strato fibrillare della
You might also like
- Epiteli SensorialiDocument5 pagesEpiteli Sensorialiapi-3704348100% (1)
- 11 MaggioDocument64 pages11 Maggioalison.pedrini98No ratings yet
- Dispensa NeuroanatomiaDocument142 pagesDispensa NeuroanatomiaPierpaolo LuzioNo ratings yet
- Centri e corpi sottili: Aura, plesso solare, centro Hara, chakra...From EverandCentri e corpi sottili: Aura, plesso solare, centro Hara, chakra...No ratings yet
- Sistema Nervoso Centrale e PerifericoDocument11 pagesSistema Nervoso Centrale e PerifericoELENA ISABELA TAUTUNo ratings yet
- Creierul Enteric 01Document14 pagesCreierul Enteric 01Sebi MocanuNo ratings yet
- SeitaiDocument44 pagesSeitaiwalterline100% (1)
- La Fabbrica dei Sentimenti sul Corpo dell'Uomo - Vol. 1From EverandLa Fabbrica dei Sentimenti sul Corpo dell'Uomo - Vol. 1Rating: 5 out of 5 stars5/5 (1)
- Appunti Lezione Fondamenti Neuro Psico FisiologiaDocument51 pagesAppunti Lezione Fondamenti Neuro Psico FisiologiaGiulia Di ModicaNo ratings yet
- Nervi Cranici FinaleDocument30 pagesNervi Cranici FinalefedericoNo ratings yet
- Lezione 1 Generalità CorsoDocument10 pagesLezione 1 Generalità CorsoAlessandro Scar PoliNo ratings yet
- Sbobinature Neurologia PDFDocument336 pagesSbobinature Neurologia PDFMichele Benvenuto100% (1)
- RiassuntiDocument179 pagesRiassuntiAu VeNo ratings yet
- Nervi CraniciDocument31 pagesNervi CraniciJessicaNo ratings yet
- FacciDocument34 pagesFacciMartinaNo ratings yet
- Il trattamento fasciale osteopatico per il sistema nervoso centrale e perifericoFrom EverandIl trattamento fasciale osteopatico per il sistema nervoso centrale e perifericoRating: 5 out of 5 stars5/5 (1)
- Ix 2013 X - Xi - Xii PDFDocument43 pagesIx 2013 X - Xi - Xii PDFKaiser Von PollonsNo ratings yet
- Cervelle T ToDocument3 pagesCervelle T ToShonaNo ratings yet
- Sistema NervosoDocument14 pagesSistema NervosoMiurrinaNo ratings yet
- La Fabbrica dei Sentimenti sul Corpo dell'Uomo: Volume IFrom EverandLa Fabbrica dei Sentimenti sul Corpo dell'Uomo: Volume INo ratings yet
- Fondamenti Neuroscienze ComportamentoDocument19 pagesFondamenti Neuroscienze ComportamentoRossanaNo ratings yet
- 5 SensiDocument43 pages5 SensiAntonio PaparellaNo ratings yet
- SCIENZE - Il Cervello ... Dove Nascono I SogniDocument15 pagesSCIENZE - Il Cervello ... Dove Nascono I SogniAndrea De AntoniisNo ratings yet
- Domande Pacini ZecchiDocument4 pagesDomande Pacini ZecchiPietro SpinelliNo ratings yet
- Riassunto Bear Neuroscienze Esplorando Il CervelloDocument9 pagesRiassunto Bear Neuroscienze Esplorando Il CervellocdeipoliNo ratings yet
- Funzioni SensitiveDocument13 pagesFunzioni SensitiveRoberta RacitiNo ratings yet
- Sistema Nervoso Periferico - Nervi CraniciDocument10 pagesSistema Nervoso Periferico - Nervi CraniciSabrina CillariNo ratings yet
- Neurologia - RiassuntoDocument38 pagesNeurologia - Riassuntoapi-3863584100% (3)
- Psicobiologia e Psicologia FisiologicaDocument42 pagesPsicobiologia e Psicologia FisiologicaErika SpadettoNo ratings yet
- PhylumDocument14 pagesPhylumWendy Marilyn Ysamar AlvaroNo ratings yet
- L'espressione dei sentimenti nell'uomo e negli animali (Edizione illustrata)From EverandL'espressione dei sentimenti nell'uomo e negli animali (Edizione illustrata)No ratings yet
- Dal Sistema Limbico Al Cervello EmotivoDocument46 pagesDal Sistema Limbico Al Cervello Emotivopaolo continiNo ratings yet
- Dispense Coclea 1Document23 pagesDispense Coclea 1Natalia MenottiNo ratings yet
- 18 - Anatomia II (Microscopica) - 13.03.2017 - RDocument8 pages18 - Anatomia II (Microscopica) - 13.03.2017 - RSandroNo ratings yet
- Manuale Di Neuropsicologia PDFDocument26 pagesManuale Di Neuropsicologia PDFSilvia GiraldiNo ratings yet
- Il Sistema Nervoso Centrale È Costituito DaDocument5 pagesIl Sistema Nervoso Centrale È Costituito DaFrancesca CancelliereNo ratings yet
- La scienza in cucina e l'arte di mangiar bene: Preface by Giancarlo RossiniFrom EverandLa scienza in cucina e l'arte di mangiar bene: Preface by Giancarlo RossiniNo ratings yet
- La Laringe, Unica Fonte Del SuonoDocument12 pagesLa Laringe, Unica Fonte Del SuonoAlessandro GranatoNo ratings yet
- A2 Anatomia Visione D InsiemeDocument17 pagesA2 Anatomia Visione D InsiemeBruce McNamaraNo ratings yet
- Fisiologia, Esplorazione e Disturbi Dell'olfatto: P. BonfilsDocument12 pagesFisiologia, Esplorazione e Disturbi Dell'olfatto: P. BonfilsFabio QuijanoNo ratings yet
- Gli Organi Di SensoDocument34 pagesGli Organi Di SensoDavide SantarcangeloNo ratings yet
- Riassunti Il Cervello FonologicoDocument9 pagesRiassunti Il Cervello FonologicoCaterinaNo ratings yet
- NEUROANATOMIADocument172 pagesNEUROANATOMIAFrancesco LanzaNo ratings yet
- Tesi Osteopatia FINITADocument34 pagesTesi Osteopatia FINITArobertofacincaniNo ratings yet
- Indice Dei RicordiDocument103 pagesIndice Dei RicordiMarco Psyco GiordanoNo ratings yet
- La ghiandola pineale: splendida connessione tra cervello ed animaFrom EverandLa ghiandola pineale: splendida connessione tra cervello ed animaRating: 3.5 out of 5 stars3.5/5 (3)
- Tesina AlzheimerDocument22 pagesTesina AlzheimerTudor Valentina100% (2)
- Agopuntura AuricolareDocument59 pagesAgopuntura AuricolareCaterina AlifrediNo ratings yet
- Neuro PsiDocument58 pagesNeuro Psiterror.billy02100% (1)
- Le Catene Lineari del Corpo e dello SpiritoFrom EverandLe Catene Lineari del Corpo e dello SpiritoRating: 4 out of 5 stars4/5 (1)
- 21-04-08 Vie Della Sensibilit+á GeneraleDocument7 pages21-04-08 Vie Della Sensibilit+á GeneraleGiovanni VescovoNo ratings yet
- Virilità: Come conservare e accrescere le forze virili - Cura dell'impotenza fisica e nervosaFrom EverandVirilità: Come conservare e accrescere le forze virili - Cura dell'impotenza fisica e nervosaNo ratings yet
- Mollusc ADocument9 pagesMollusc Agmc.messanaNo ratings yet
- 01 Introduzione Anatomia UmanaDocument33 pages01 Introduzione Anatomia UmanaAlucardNo ratings yet
- 13 Organi Di SensoDocument4 pages13 Organi Di SensoELENA ISABELA TAUTUNo ratings yet
- Circuit Training Donna ProgressivoDocument4 pagesCircuit Training Donna ProgressivoMichele Scilla FresielloNo ratings yet
- ECG Facile1Document14 pagesECG Facile1Michele Scilla FresielloNo ratings yet
- Organizzazione MotoriaDocument47 pagesOrganizzazione MotoriaMichele Scilla FresielloNo ratings yet
- Mauriello Scienze Dell Alimentazione e Della NutrizioneDocument78 pagesMauriello Scienze Dell Alimentazione e Della NutrizioneMichele Scilla FresielloNo ratings yet
- Alimentazione Da Zero A Tre AnniDocument93 pagesAlimentazione Da Zero A Tre AnniMichele Scilla FresielloNo ratings yet
- COCIS2009Document132 pagesCOCIS2009Michele Scilla FresielloNo ratings yet
- Farmaci Prima o Dopo I PastiDocument6 pagesFarmaci Prima o Dopo I Pastixdagoopass100% (1)
- Semeiotica Fisica DelladdomeDocument50 pagesSemeiotica Fisica DelladdomeMichele Scilla Fresiello100% (1)
- 02 GlucocorticoidiDocument20 pages02 GlucocorticoidiMichele Scilla Fresiello100% (2)
- Ugo Nocentini, Sarah Di Vincenzo-La Riabilitazione Dei Disturbi Cognitivi Nella Sclerosi Multipla (Metodologie Riabilitative in Logopedia) (2006)Document90 pagesUgo Nocentini, Sarah Di Vincenzo-La Riabilitazione Dei Disturbi Cognitivi Nella Sclerosi Multipla (Metodologie Riabilitative in Logopedia) (2006)borbu-jasNo ratings yet
- Lista Medici Italiani Circoscrizione DubaiDocument5 pagesLista Medici Italiani Circoscrizione DubaiSaranya JinuNo ratings yet
- Vie SensitiveDocument21 pagesVie SensitivestefpecNo ratings yet
- Prof - Mossa - Il Mio LibroDocument92 pagesProf - Mossa - Il Mio LibroTrandafir LacramioaraNo ratings yet
- NeurologiaDocument16 pagesNeurologiaenzocavajuoloNo ratings yet
- Neurologia-Giordano Perin PDFDocument169 pagesNeurologia-Giordano Perin PDFangiolikkia67% (3)
- Codici Secondo La Classificazione ICD 10 OMS Relativi Alle Diagnosi Riguardanti Gli Alunni Diversamente Abili in Base Alla Legge 104Document16 pagesCodici Secondo La Classificazione ICD 10 OMS Relativi Alle Diagnosi Riguardanti Gli Alunni Diversamente Abili in Base Alla Legge 104Amedeo FeraNo ratings yet
- Casi Clinici 2Document18 pagesCasi Clinici 2Giulia VizzaNo ratings yet
- Potenziali Evocati VisiviDocument24 pagesPotenziali Evocati Visivicaila8716No ratings yet
- Indice Manuale Concorso MedicinaDocument19 pagesIndice Manuale Concorso Medicinagiovanni urciuoliNo ratings yet
- Alzheimer Stimolazione Cognitiva ElencoDocument4 pagesAlzheimer Stimolazione Cognitiva ElencoJacopo BenattiNo ratings yet
- NEUROLOGIADocument23 pagesNEUROLOGIAracheleNo ratings yet
- Tab - Propedeu Medicina BariDocument2 pagesTab - Propedeu Medicina BariGiacomo BiancoNo ratings yet