Professional Documents
Culture Documents
Resumen - Inf 2
Uploaded by
ソーダ エドゥアルドOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Resumen - Inf 2
Uploaded by
ソーダ エドゥアルドCopyright:
Available Formats
OBJETIVO GENERALE
Determinar e identificar los compuestos orgnicos segn la solubilidad de estos
compuestos en presencia de diferentes solventes, como el agua, el hidrxido de sodio,
el cido clorhdrico, el bicarbonato de sodio y cido sulfrico, estos solventes nos
ayudaran a determinar propiedades fsicas.
OBJETIVOS ESPECIFICOS
analizar varias muestras conocidas de compuestos orgnicos, realizarles correctamente
la prueba de solubilidad en varios solventes, tales como; agua, ter etlico, hidrxido de
sodio, cido clorhdrico, cido sulfrico y bicarbonato de sodio.
Clasificar los compuestos orgnicos conocidos en uno de los grupos IA, IB, IIA, IIB, IIA 1,
IIA2, IIC1, IIC2, IIC2A o IIC2B .
Clasificar dos compuestos orgnicos desconocidos ( muestra problema) como
pertenecientes a dos de los grupos de solubilidad descrito en el objetivo anterior.
Percatarse y deducir los factores que afectan a la solubilidad de un compuesto orgnico
en varios solventes, como agua, cido clorhdrico y otros.
determinar que compuestos orgnicos son ms solubles en sustancias polares.
TEORIA RELACIONADA
Pruebas de Solubilidad (miscibilidad):
El nmero de compuestos orgnicos actualmente conocidos sobrepasa el milln, por lo tanto,
iniciar la identificacin de una muestra sin disponer de alguna informacin o clasificacin
preliminar es una tarea casi imposible.
Si a los datos sobre caractersticas fsicas y anlisis elemental cualitativo agregamos los que
se obtienen por un estudio de solubilidad de la muestra frente a disolventes con caractersticas
apropiadas, el problema de la identificacin se
simplifica y puede resolverse.
.
La solubilidad de los compuestos orgnicos en diferentes disolventes ha sido de gran utilidad
para una rpida y fcil caracterizacin de ellos.
Cuando un compuesto (soluto) se diluye en un disolvente. Las molculas de aquel se
separan y quedan rodeadas por las molculas del disolvente (solvatacin). En ste proceso
las fuerzas de atraccin intermoleculares entre las molculas del soluto, son sobrepasadas,
formndose nuevas interacciones moleculares ms intensas entre las molculas del soluto y
las del disolvente; el balance de estos dos tipos de fuerzas de atraccin determina si un
soluto dado se disolver en un determinado disolvente.
A menudo las caractersticas de solubilidad de un disolvente son fijadas por la polaridad de
sus molculas y las del soluto. En general, se dice que las molculas semejantes disuelven a
las semejantes por la similitud de sus estructuras y de sus fuerzas de interaccin. Por ejemplo:
la molcula no polar n-pentano, CH 3 - CH2 CH2 - CH2 - CH3 no se disolver en un grado
significativo en un disolvente polar como el agua (H 2O)
Muchas sustancias orgnicas se disolvern en agua, pero debe ser muy polares o formar
fcilmente enlaces de hidrgeno con ella.
La mayora de los compuestos inicos son solubles en agua, debido a la interaccin in dipolo. As, un cido carboxlico, R-COOH, insoluble en agua, se puede transformar en una
sal, R-COO-M, sdica o potsica, la cual es soluble en agua. Anlogamente, una amina, R
-NH2, insoluble en agua se puede transformar en su sal de amonio, R-NH 3 - X -, soluble en
agua. Por esta razn, !a
mayora de los cidos carboxlicos y de las aminas sern solubles en soluciones
de hidrxido de sodio NaOH, al 10%, y de cido Clorhdrico HCl 10%
respectivarnente.
.
Otros muchos compuestos orgnicos son insolubles en agua y en soluciones
diluidas de NaOH y de HCI, pero son solubles en cido sulfrico H 2S04,
concentrado. A este tipo de sustancias pertenecen los compuestos no saturados,
los que sulfonan rpidamente y los que poseen un grupo oxigenado
Algunas veces al ensayar la solubilidad de un compuesto orgnico en cido sulfrico
concentrado, el compuesto reacciona y se transforma en un producto insoluble. Por
ejemplo, una olefina RCH=CHR; puede producir un polmero insoluble, y un alcohol, ROH,
puede deshidratarse a una olefina, R- CH=CHR, que a su vez se transforma en un
polmero insoluble. Todo los compuestos que presentan este comportamiento se clasifican
como solubles en el reactivo.
Los compuestos orgnicos se han clasificado en grupos bastantes definidos, segn su
solubilidad en diferentes disolventes; estos grupos son:
a. GRUPO 1: est constituido por todas las sustancias orgnicas que son solubles, en agua.
b. GRUPO 11: constituido por compuestos orgnicos insolubles en agua.
c. GRUPO lA: est constituido por sustancias orgnicas que son solubles simultneamente en
agua, H2O, y en ter etlico CH3 CH2 - O - CH2 - CH3: Alcoholes alifticos R - OH; aldehdos,
R- COH; cetonas. R - CO - R; cidos carboxlicos, R - COOH; steres, R - COO - R 1; aminas
RNH2; amidas, R OC --NH2; nitrilos, R - C = N; de peso molecular bajo (en general, los
trminos inferiores de la mayora de las series homlogas); algunos fenoles.
y algunos anhdridos de cidos carboxlicos R - COO - CO - R 1.
d. GRUPO lB: constituido por compuestos orgnicos solubles en agua e insolubles en ter
etlico, CH3 - CH2 - O - CH2 - CH3; tales como: Glicoles R-- CH - CH - R; sales de aminas, RNH+3 X-; sales de cidos carboxlicos
OH
OH
OH
O
R - C - O - Na+; cidos dicarboxlicos HOOC - CH2 R-COOH;
Hidroxicidos, HO - CH - R CO - OH: Carbohidratos.
O=C - CH - CH -- CH2 - OH; algunos aminocidos R - CH -COOH;
H
OH
OH
NH 2
O
Algunas aminas, R - NH2 Y amidas, R-C NH2
e. GRUPO IIA: comprende los compuestos orgnicos insolubles .en agua y solubles en
solucin acuosa de Hidrxido de Sodio, NaOH al1 0%:
cidos Carboxlicos y Fenoles (R - COOH y Ar - OH).
f. GRUPO IIA1: compuestos orgnicos solubles en solucin diluida de bicarbonato de
Sodio, NaHC03 al 5%, tales como: cidos Carboxlicos y Nitrofenoles.
g. GRUPO IIA2: comprende los compuestos orgnicos insolubles en solucin acuosa de
bicarbonato de sodio al 5%, tales como: Fenoles simples AR -OH; algunas amidas.
Algunos nitrocompuestos, R NO2; algunos fenoles, R - C = C R
OH OH
Algunas oximas, R - CH = N - OH
h. GRUPO IIB: est constituido par todos los compuestos orgnicos insolubles en hidrxido
de sodio al 10% Y solubles en cido clorhdrico al 10%: Aminas e Hidrazinas, NH2 - NH - R.
i. GRUPO IIC : comprende las sustancias orgnicas insolubles en cido
clorhdrico al 10%.
I
j. GRUPO IIC1: compuestos orgnicos con nitrgeno insolubles en HCl al 10% y en NaOH
al 10% tales como : amidas R- CO NN2; nitrilos
R - C = N; nitrocompuestos, R-NO2, azocompuestos, R - N = N - R; e hidrazocompuestos.
k. GRUPO IIC2: est constituido por los compuestos orgnicos sin nitrgeno, insolubles
en HCL al 10% Y en NaOH al 10%.
l. GRUPO IIC2a: comprende compuesto orgnicos sin nitrgeno, insolubles en HCI al 10%
y en NaOH al 10%. pero solubles en cido sulfrico concentrado y fro: alcoholes,
aldehdos, cetonas y esteres de peso molecular relativamente
elevados; quinonas, teres, R - O- R1, acetales.
m. GRUPO IIC2b: est constituido por compuestos orgnicos sin nitrgeno, insolubles
en HCI al 10%, NaOH al 10% y en H2S04 concentrado y fro; tales como: Halogenuros
alifticos, R - X; Y aromticos, Ar - X; hidrocarburos saturados, R - CH3, y aromticos
Ar-CH3.
MATERIALES Y REACTIVOS
HCl al 10 %
NaOH al 10%
NaHCO3 al 5%
H2SO4
ter
Agua
Muestra problema
Sacarosa
cido saliclico
Alcohol amlico
Acetato de etilo
Esptula metlica
Pipeta de 5mL
tubos de ensayo y gradilla
PROCEDIMIENTO
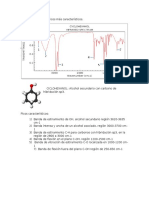
RESULTADOS EXPERIMENTALES
La siguiente tabla muestra la solubilidad de cada compuesto orgnico en diferentes
disolventes :
H 2O
NaOH
NaHCO3
Insoluble, forma dos fases
Insoluble, se notan dos
transparentes pero que fases
Alcohol amlicoSe pueden distinguir
(CH3(CH2)3CH2OH)
Insoluble, se torna inmiscible Insoluble
HCl
H2SO4
insoluble
Soluble
Soluble, parcialmente se
torna amarillo plido
Anilina
Soluble, los cristales de
sacarosa se mezclan
Sacarosa
Acetato etlicoInsoluble, se observan dos
ter etlico
Insoluble, los
cristales de sacarosa
se precipitan
Insoluble
Soluble
(CH3COOC2H5) fases
cido saliclico
insoluble
Soluble
soluble
(C2H6O3)
ANALISIS DE RESULTADOS
Deduciendo de los datos obtenidos anteriormente que se muestra en la tabla, tenemos en
cuenta estos resultados para cada sustancia de manera que se puede incidir en la agrupacin
de cada compuesto en el cuadro de clasificacin de la solubilidad, de esta manera para la
sacarosa la prueba de solubilidad resulto positiva en H 2O pero fue negativa en ter
deduciendo de la tabla la sacarosa pertenece al grupo IB, para la anilina la prueba fue
negativa cuando se quiso determinar la solubilidad en H 2O y NaOH, por el contrario cuando se
quiso determinar la solubilidad en HCl la respuesta fue positiva por tanto podemos deducir que
la anilina pertenece al grupo IIB; si observamos ahora el alcohol amlico notamos que fue
soluble nicamente en H2SO4 y fue insoluble en H2O, NaOH, HCl de manera que lo podemos
ubicar en el grupo IIC2d, para el acetato de etilo observamos que fue insoluble en H 2O y NaOH
pero fue soluble en HCl por tanto podemos deducir que el acetato de etilo pertenece al grupo
IIB, AHORA para el cido saliclico que fue el ultimo que analizamos en el laboratorio notamos
que era soluble en NaOH y NaHCO3 pero insoluble en H2O de manera que podemos ubicarlo
en el grupo IIA1.
CUESTIONARIO
1. Explique la manera en que afecta a la solubilidad de un compuesto cada uno de los
siguientes factores.
a) Polaridad
b) Enlace de hidrogeno
2. que efecto tienen las ramificaciones de la cadena (sustituyentes alquilicos) de un compuesto
sobre la solubilidad.
3. clasifique cada uno de los compuestos segn el comportamiento esperado:
a) p, cloro anilina
b) propanona
c) pentano
d)
e)
4. Que son solventes :
a) Proticos
b) Aproticos
Indique ejemplos de cada uno de ellos.
5. escriba las ecuaciones correspondientes a las pruebas que indique resultados positivos.
SOLUCIONARIO
1. La forma en que afecta la solubilidad la polaridad es trascendental al momento de incidir si
un compuesto es soluble en otro, ya que lo semejante disuelve lo semejante, esto quiere decir
que las molculas polares se disolvern en compuestos polares, ya que habr o se crearan
fuerzas moleculares mas intensas lo cual har que las molculas del soluto y solvente se
disuelvan, esto tambin se debe a la similitud de sus estructuras y fuerzas, as como los
apolares disolvern compuestos apolares.
Los enlaces de hidrgenos son atracciones intermoleculares particularmente fuerte entre un
par de electrones no enlazantes y un hidrogeno electrofilo procedente de un grupo O H o N
H, estos enlaces de hidrgenos tienen una energa aproximada de 5Kcal/mol. Esto nos quiere
decir que los enlaces de hidrogeno aumenta la solubilidad de una molcula en otra, siempre y
cuando esta molcula o compuesto sea semejante a ella, entones estos enlaces de
hidrgenos se forman con tomos electronegativos y con electrones libres los cuales hacen
que viajen del soluto al solvente y se puedan disolver.
2. el efecto de las ramificaciones de la cadena, con sustituyentes alquilicos tiene un efecto
muy importante en la solubilidad de los compuestos, ya que al estar ramificados con estos
sustituyentes aumentaran el nmero de carbonos presentes en el compuesto, esto conlleva a
que sea insoluble en agua, puesto a alto grado de peso molecular menor ser la solubilidad.
3. la clasificacin de los compuestos que se observaran a continuacin se har teniendo en
cuenta los grupos funcionales, el numero de carbonos presentes en la molcula.
a)
P- cloro anilina por ser insoluble en agua por poseer 6 tomos de carbono y cloro,
por ser bsica ya que contiene un grupo arilo unido al grupo amino y por lo tanto es soluble en
cido clorhdrico por lo tanto se clasifica el grupo 2B.
b)
La propanona es una cetona metlica con 3 tomos de carbono esta en el umbral
si es soluble en agua, pero si lo es estara en el grupo 1, o tambin estara en el grupo 2C2a
puesto que el cido sulfrico disuelve algunas cetonas.
c)
El pentano por poseer 5 carbonos es insoluble en agua, en el hidrxido de sodio es
insoluble ya que este un compuesto polar y los hidrocarburos son apolares, y tambin es INEN
el cido clorhdrico y sulfrico, lo cual lo colocara en el grupo 2C2b.
d)
CH3CH2OOH este cido por poseer solo 3 tomos de carbono y tomos de
oxigeno los cual indica que se pueden formar enlaces de hidrogeno con el agua lo cual
conlleva a que sea soluble en ella, entonces se clasificara en el grupo 1.
e)
CH3CH = CHCH2CH3 este compuesto insaturado puede clasificarse en el grupo
2C2a puesto que ser insoluble en agua (tiene mas 5 tomos de carbono), en cido clorhdrico
e hidrxido de sodio, pero es soluble en cido sulfrico.
4.
a). los solventes proticos son aquellos que contienen protones disociables, que poseen alta
polaridad y por consiguiente pueden solvatar en cierta medida sustancias polares como las
sales, ejemplo de ellos tenemos el, metanol, y el NH3 liquido.
b) son solventes aproticos aquellos que no contienen ningn fcilmente disociable, por ello no
participan en aquellas reacciones caractersticas del metanol, etanal, y otros solventes.
Ejemplos de estos tenemos; acetonitrilo, piridina, la acetona, el dimetilforamida y el nitro
metano.
CONCLUSION
la solubilidad es de gran importancia al momento de clasificar o analizar un compuesto, puesto
que esta nos puede indicar cuantos carbonos posee, si la molcula es polar o si puede formar
puentes de hidrogeno.
Hay muchos factores que afectan la solubilidad de un compuestos entre ellos estn la
polaridad la cual es una fuerza intermolecular que son sobrepasadas
entre molculas
similares o sea polares, formndose entonces interacciones moleculares mas fuertes
intensas entre las molculas del soluto y las del solvente por esta razn se dice que lo
semejante disuelve lo semejante, otro factor importante son los enlaces de hidrogeno los
cuales ayudaran al solubilidad de las molculas puesto que si hay mayor grado de enlaces o
sea interaccin entre el soluto y el solvente mayor ser la solubilidad, tambin esta el aspecto
de las cadenas ramificas aqu tuvimos en cuenta el numero de carbono que posee un
compuesto para determinar si es o no soluble en el agua , en el hidrxido de sodio y cido
clorhdrico que son compuestos polares, que a alto numero de carbono o peso molecular mas
difcil ser su solubilidad.
Hay muchos solventes que nos pueden ayudar en la clasificacin de los compuestos por
solubilidad entre ellos estn los solventes proticos los cuales poseen tomos disociables, que
tienen alta polaridad, en cambio los aproticos no poseen protones disociables los cuales
dificultan la solubilidad ya que al no disociarse no podr unirse a los tomos o molculas del
solvente.
Muchos son los factores que afectan la solubilidad pero hay que tener presentes que estos
son los que nos indican la presencia o identificacin de los compuestos.
BIBLIOGRAFA
HOLUM, John R, Qumica Orgnica, Curso breve, Editorial Limusa. 1986 primera
edicin.
GOMEZ, Miguel A. Qumica orgnica, investiguemos, Editorial voluntad. sexta
edicin. ISBN 958-02-0176-5
http://www.uam.es/departamentos/ciencias/qorg/docencia red/qo/l14
durante esta prctica se clasificaron diferentes compuestos orgnicos de acuerdo a su solubilidad,
identificando los factores y parmetros que influyen en esta. Lo mencionado anteriormente se llev
a cabo mediante ensayos de solubilidad en diferentes solventes siguiendo un orden especfico de los
solutos para de esta manera poder determinar que solubilidad tena cada sustancia estudiada
obtenindose como resultado la tabla (xxxxx) .
You might also like
- Informe Practica #7Document5 pagesInforme Practica #7ソーダ エドゥアルドNo ratings yet
- Lab Mec 7 Balanza de Fuerzas ParalelasDocument6 pagesLab Mec 7 Balanza de Fuerzas Paralelasソーダ エドゥアルドNo ratings yet
- Informe de CineticaDocument7 pagesInforme de Cineticaソーダ エドゥアルドNo ratings yet
- Informe 1 MasasDocument12 pagesInforme 1 Masasソーダ エドゥアルドNo ratings yet
- Informe de CineticaDocument9 pagesInforme de Cineticaソーダ エドゥアルドNo ratings yet
- Disminución punto fusión NaClDocument8 pagesDisminución punto fusión NaClソーダ エドゥアルドNo ratings yet
- Informe 1 MasasDocument12 pagesInforme 1 Masasソーダ エドゥアルドNo ratings yet
- Segundo Informe de CineticaDocument6 pagesSegundo Informe de Cineticaソーダ エドゥアルドNo ratings yet
- Codigo de Matab PropioDocument2 pagesCodigo de Matab Propioソーダ エドゥアルドNo ratings yet
- Resumen Parcial IDocument4 pagesResumen Parcial Iソーダ エドゥアルドNo ratings yet
- Control ChinosDocument13 pagesControl Chinosソーダ エドゥアルドNo ratings yet
- Clase Espectroscopia IrDocument50 pagesClase Espectroscopia Irソーダ エドゥアルドNo ratings yet
- Informe 3 CineticaDocument8 pagesInforme 3 Cineticaソーダ エドゥアルドNo ratings yet
- Codigo de Matab PropioDocument2 pagesCodigo de Matab Propioソーダ エドゥアルドNo ratings yet
- Produccion de SalDocument1 pageProduccion de Salソーダ エドゥアルドNo ratings yet
- Taller InfrarrojoDocument7 pagesTaller Infrarrojoソーダ エドゥアルドNo ratings yet
- Introducción Inf Masa3Document3 pagesIntroducción Inf Masa3ソーダ エドゥアルドNo ratings yet
- Informe 2Document10 pagesInforme 2ソーダ エドゥアルドNo ratings yet
- Ejercicios Ley CeroDocument3 pagesEjercicios Ley Ceroソーダ エドゥアルドNo ratings yet
- Informe 3 CineticaDocument8 pagesInforme 3 Cineticaソーダ エドゥアルドNo ratings yet
- RicardoDocument2 pagesRicardoソーダ エドゥアルドNo ratings yet
- Catalizadores PDFDocument86 pagesCatalizadores PDFソーダ エドゥアルドNo ratings yet
- Taller de Control de Procesos 3er CorteDocument8 pagesTaller de Control de Procesos 3er Corteソーダ エドゥアルドNo ratings yet
- Operaciones de Transferencia de Masa I FGA23Document11 pagesOperaciones de Transferencia de Masa I FGA23ソーダ エドゥアルドNo ratings yet
- Lixiviación líquido-sólido: balances y diseño de procesos en múltiples etapasDocument17 pagesLixiviación líquido-sólido: balances y diseño de procesos en múltiples etapasソーダ エドゥアルドNo ratings yet
- Parcial 3Document9 pagesParcial 3ソーダ エドゥアルドNo ratings yet
- Infra R RojoDocument7 pagesInfra R Rojoソーダ エドゥアルドNo ratings yet
- Guía Buenas Prácticas TextilesDocument55 pagesGuía Buenas Prácticas TextilesNata Rodriguez LopezNo ratings yet
- Estrategia Paara La Implementación de Proyectos Exitosos en Aguas ResidualesDocument72 pagesEstrategia Paara La Implementación de Proyectos Exitosos en Aguas Residualesソーダ エドゥアルドNo ratings yet
- Espectroscopia UV-VIS: Principios y AplicacionesDocument63 pagesEspectroscopia UV-VIS: Principios y Aplicacionesソーダ エドゥアルドNo ratings yet
- Formacion de Iones Complejos Cationicos y AnionicosDocument9 pagesFormacion de Iones Complejos Cationicos y AnionicosSherlin Almanza ObregonNo ratings yet
- BiohidrometalurgiaDocument32 pagesBiohidrometalurgiaMarco Antonio SalcedoNo ratings yet
- Práctica Materia OrgánicaDocument13 pagesPráctica Materia OrgánicaNathaly QuevedoNo ratings yet
- Bioquímica Unidad 1Document47 pagesBioquímica Unidad 1Io ZamudioNo ratings yet
- DesinfeccionDocument24 pagesDesinfeccionGiroshi Roberth Reyes VillarNo ratings yet
- Nuevo Tratado de Farmacia Teorico y Prac PDFDocument405 pagesNuevo Tratado de Farmacia Teorico y Prac PDFgulitxNo ratings yet
- Potasio General 2018Document20 pagesPotasio General 2018Jose Heli Vallejos CoronadoNo ratings yet
- Torres EWKDocument4 pagesTorres EWKjavifiestas100% (1)
- 4.-Lípidos 2018Document75 pages4.-Lípidos 2018Alicia SánchezNo ratings yet
- Intoxicación por cianuro: Mecanismo de acción, cuadro clínico y tratamientoDocument35 pagesIntoxicación por cianuro: Mecanismo de acción, cuadro clínico y tratamientoJoseph Junior Jahuira TaparaNo ratings yet
- METALURGIA PARA LA MEDIANA MINERÍA (Jorge Menacho, de Re Metallica)Document31 pagesMETALURGIA PARA LA MEDIANA MINERÍA (Jorge Menacho, de Re Metallica)MINEXPON100% (1)
- Informe Del Sulfato de Tetraaminocobre (II)Document3 pagesInforme Del Sulfato de Tetraaminocobre (II)ferney romerocaperaNo ratings yet
- Tecnicas de Obtencion de Hidroxiapatita y Otros Fosfatos de CalcioDocument8 pagesTecnicas de Obtencion de Hidroxiapatita y Otros Fosfatos de Calcioangie danielaNo ratings yet
- Propiedades de Los HidrocarburosDocument9 pagesPropiedades de Los HidrocarburosJesús David Rodríguez LiñanNo ratings yet
- Química Orgánica IDocument12 pagesQuímica Orgánica IOmar Velasquez Atahua100% (1)
- Metodos VolumetricosDocument43 pagesMetodos VolumetricosLesly GelacioNo ratings yet
- Tabla de Grupos FuncionalesDocument2 pagesTabla de Grupos FuncionalesHarley's QuinnNo ratings yet
- 02 Estructura Atómica y Nomenclatura (Modo de Compatibilidad)Document35 pages02 Estructura Atómica y Nomenclatura (Modo de Compatibilidad)Yandary Leyton QuiñelNo ratings yet
- Informe Laboratorio MacromoleculasDocument7 pagesInforme Laboratorio MacromoleculasLaura CardenasNo ratings yet
- La Industria Del PerfumeDocument11 pagesLa Industria Del PerfumeJavier Feria RamosNo ratings yet
- Examen de Química General - 2023 I U. CientíficaDocument2 pagesExamen de Química General - 2023 I U. CientíficaIngenieríaNo ratings yet
- Guia para Descubrir PH y IonizacionDocument5 pagesGuia para Descubrir PH y IonizacionBELÉN JACQUELINE PEREIRA BORLANDONo ratings yet
- Cálculos QuímicosDocument14 pagesCálculos QuímicosRuben Dario RamirezNo ratings yet
- Taller de Lipidos ResueltoDocument5 pagesTaller de Lipidos ResueltoAngelica SuarezNo ratings yet
- Nomenclatura de Compuestos Organicos PDFDocument34 pagesNomenclatura de Compuestos Organicos PDFpepegrillo20No ratings yet
- Tarea de Equilibrio Ácido-BaseDocument3 pagesTarea de Equilibrio Ácido-BaseDaniel CVNo ratings yet
- Sintesis de M-NitrobenzaldehidoDocument12 pagesSintesis de M-NitrobenzaldehidobyronNo ratings yet
- Alex PRÁCTICA XIIDocument3 pagesAlex PRÁCTICA XIIAlex SosaNo ratings yet
- Proceso de HalogenacionDocument4 pagesProceso de HalogenacioneddyNo ratings yet
- Práctica 7 Organica IIDocument4 pagesPráctica 7 Organica IILUIS JAVIER RAMIRO SANCHEZNo ratings yet