Professional Documents
Culture Documents
Inf Pourbaix
Uploaded by
ChristianHernandezCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Inf Pourbaix
Uploaded by
ChristianHernandezCopyright:
Available Formats
ESCUELA DE INGENIERA METALRGICA Y CIENCIA DE MATERIALES
LABORATORIO DE HIDRO Y ELECTROMETALRGIA
LABRATORIO DE HIDRO Y ELECTROMETALURGIA
INFORME PRACTICA 2.2. CONOCIMIENTO DEL SOFTWARE HSC PARA
CONSTRUIR DIAGRAMAS DE POURBAIX DE SISTEMAS ACUOSOS EN
EQUILIBRIO.
PRESENTADO POR:
CARLOS DURAN CODIGO: 2122455
CHRISTIAN HERNANDEZ COD: 2112387
ALEJANDRA GMEZ CODIGO: 2122451
GRUPO A
PRESENTADO A:
PROFESOR: JHON FREDDY PALACIOS
UNIVERSIDAD INDUSTRIAL DE SANTANDER
FACULTAD DE INGENIERAS FISICOQUMICAS
ESCUELA DE INGENIERA METALRGICA Y CIENCIA DE MATERIALES
BUCARAMANGA
2016
ESCUELA DE INGENIERA METALRGICA Y CIENCIA DE MATERIALES
LABORATORIO DE HIDRO Y ELECTROMETALRGIA
OBJETIVO
Trabajar el software HSC con el fin de aplicarlo en la construccin de Diagramas
de Pourbaix de sistemas hidrometalrgicos a diferentes condiciones.
ESCUELA DE INGENIERA METALRGICA Y CIENCIA DE MATERIALES
LABORATORIO DE HIDRO Y ELECTROMETALRGIA
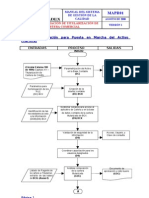
PROCEDIMIENTO
INICIO
Abrir el programa HSC.
Seleccionar la opcin Eh-pH Diagram.
Seleccionar el elemento principal en estudio.
Seleccionar los otros elementos en estudio.
La seleccin
es correcta?
No
Si
Seleccionar las posibles fases presentes en el sistema y la temperatura.
Dar clic en OK.
Seleccionar las especies presentes en la solucin acuosa o dar clic en All.
Dar clic en EpH.
Dar clic en guardar.
Modificar la concentracin si es necesario y dar clic en Diagram.
Analizar y organizar resultados.
FIN
ESCUELA DE INGENIERA METALRGICA Y CIENCIA DE MATERIALES
LABORATORIO DE HIDRO Y ELECTROMETALRGIA
PROCEDIMIENTO 2.2
1 Abrir el programa HSC 5.11, esta es la ventana de inicio que aparece.
2 Seleccionar la opcion Eh-pH Diagrams.
ESCUELA DE INGENIERA METALRGICA Y CIENCIA DE MATERIALES
LABORATORIO DE HIDRO Y ELECTROMETALRGIA
3 En la primer columna, seleccionar el elemento principal de nuestro
diagrama.
4 De la segunda columna se seleccionan los otros elementos que van a ir
incluidos en el diagrama.
5 Seleccionar las fases y las temperaturas en las que estan presentes las
especies del sistema en estudio.
ESCUELA DE INGENIERA METALRGICA Y CIENCIA DE MATERIALES
LABORATORIO DE HIDRO Y ELECTROMETALRGIA
6 Dar clic en OK.
7 Seleccionar las especies que se desean analizar en el diagrama.
8 Dar clic en el boton EpH.
ESCUELA DE INGENIERA METALRGICA Y CIENCIA DE MATERIALES
LABORATORIO DE HIDRO Y ELECTROMETALRGIA
Seleccionar la
temperatura y
concentraciones que se desean estudiar.
10 Dar clic en el boton Diagram.
ESCUELA DE INGENIERA METALRGICA Y CIENCIA DE MATERIALES
LABORATORIO DE HIDRO Y ELECTROMETALRGIA
11 El diagrama del sistema en estudio.
En este ultimo paso, se puedencambiar las distintas opciones de la presentacion
de la grafica con el objetivo de obtener un mejor analisis.
ANALISIS Y RESULTADOS.
SISTEMA Ag-H2O
a) Especies Ag0(s), Ag+1(aq), Ag2O(s); concentracin de los iones metlicos de 1M,
1x10-3M, 1x10-6 M; a 250C.
Eh (Volts)
2.0
Ag - H2O - System at 25.00 C
1.5
Ag2O
Ag(+a)
1.0
0.5
0.0
-0.5
Ag
-1.0
-1.5
H2O Limits
-2.0
C:\HSC5\EpH\Ag25.iep
10
12
14
pH
ESCUELA DE INGENIERA METALRGICA Y CIENCIA DE MATERIALES
LABORATORIO DE HIDRO Y ELECTROMETALRGIA
Ilustracin 1 Concentracin de iones metlicos de Ag 1 [M]
Eh (Volts)
2.0
Ag - H2O - System at 25.00 C
1.5
Ag2O
Ag(+a)
1.0
0.5
0.0
-0.5
Ag
-1.0
-1.5
H2O Limits
-2.0
Eh (Volts)
2.0 2
Ag - H2O - System at 25.00 C
10
12
14
C:\HSC5\EpH\Ag25.iep
pH
1.5
Ag2O
Ag(+a)
Ilustracin 2: Grafica 2. Concentracin
de iones metlicos
0.001M
1.0
0.5
0.0
-0.5
Ag
-1.0
-1.5
H2O Limits
-2.0
C:\HSC5\EpH\Ag25.iep
10
12
14
pH
ESCUELA DE INGENIERA METALRGICA Y CIENCIA DE MATERIALES
LABORATORIO DE HIDRO Y ELECTROMETALRGIA
Grafica 3. Concentracin de iones metlicos de Ag de 1*10-6. M
De los Grficos del 1 al 3 se puede observar como la disminucin de la
concentracin de Ag genera un desplazamiento hacia la derecha de la linea de
estabilidad del Ag+ provocando un incremento del campo de estabilidad de este y
una reduccon del campo de estabilidad del Ag 2O.
Ademas de ello para un proceso hidrometalrgico a bajas concetraciones de Cu
se torna dficil la pasivacin de este.
b) Las mismas condiciones del punto a) pero a temperaturas de 50, 100, 2500C.
Eh (Volts)
2.0
Ag - H2O - System at 50.00 C
1.5
Ag2O
Ag(+a)
1.0
0.5
0.0
Eh (Volts)
2.0
Ag - H2O - System at 100.00 C
-0.5
1.5
Ag
Ag2O
Ag(+a)
-1.0
1.0
-1.5
0.5-2.0
H2O Limits
10
12
14
C:\HSC5\EpH\Ag50.iep
0.0
pH
Grafica 4.Concentracin
de los Iones metlicos de cobre y Temperatura 50C
-0.5
Ag
-1.0
-1.5
H2O Limits
-2.0
C:\HSC5\EpH\Ag100.iep
10
Grafica 5. Temperatura 100C.
12
14
pH
ESCUELA DE INGENIERA METALRGICA Y CIENCIA DE MATERIALES
LABORATORIO DE HIDRO Y ELECTROMETALRGIA
Eh (Volts)
2.0
Ag - H2O - System at 250.00 C
1.5
Ag(+a)
Ag2O
1.0
0.5
0.0
-0.5
-1.0
Ag
-1.5
H2O Limits
-2.0
10
C:\HSC5\EpH\Ag250.iep
Grafica 6: Temperatura 250C
12
14
pH
ESCUELA DE INGENIERA METALRGICA Y CIENCIA DE MATERIALES
LABORATORIO DE HIDRO Y ELECTROMETALRGIA
Eh (Volts)
2.0
Ag - H2O - System at 50.00 C
1.5
Ag2O
Ag(+a)
1.0
0.5
0.0
-0.5
Ag
-1.0
-1.5
H 2 O L imits
-2.0
10
12
C:\HSC5\EpH\Ag50.iep
14
pH
ELEMENTS
Ag
Molality
1.000E-06
Pressure
1.000E+00
Grafica 7. Temperatura 50
Eh (Volts)
2.0
Ag - H2O - System at 100.00 C
1.5
Ag2O
Ag(+a)
1.0
0.5
0.0
-0.5
Ag
-1.0
-1.5
H 2 O L imits
-2.0
10
12
C:\HSC5\EpH\Ag100.iep
ELEMENTS
Ag
pH
Molality
1.000E-06
Pressure
1.000E+00
Grafica 8. Temperatura 100
SISTEMA Zn-H2O
14
ESCUELA DE INGENIERA METALRGICA Y CIENCIA DE MATERIALES
LABORATORIO DE HIDRO Y ELECTROMETALRGIA
a) Especies Zn0(s), Zn+2(aq), ZnO2-2(aq), ZnO(s), Zn(OH)2(s),
ZnS(s);
concentracin de los iones metlicos de 1, 1x10-3, 1x10-6 M; a 250C
Eh (Volts)
2.0
Zn - H2O - System at 25.00 C
1.5
ZnO
Zn(+2a)
1.0
0.5
0.0
-0.5
-1.0
ZnS
-1.5
H 2 O L imits
-2.0
10
12
14
C:\HSC5\EpH\2a.iep
pH
ELEMENTS
Zn
Eh (Volts)
2.0
Molality
1.000E+00
Zn - H2O - System at 25.00 C
Pressure
1.000E+00
Grafica 8. Concentracin de iones metlicos 1M.
1.5
ZnO
1.0
Zn(+2a)
ZnO2(-2a)
0.5
0.0
-0.5
Eh (Volts)
10
-1.0
Zn - H2O - System at 25.00 C
ZnS
8
-1.5
6
ZnO2(-2a)
ZnO
-2.0
4 0
Zn(+2a)
2
H 2 O L imits
10
12
C:\HSC5\EpH\2a.iep
ELEMENTS
Zn
14
pH
Molality
1.000E-03
Pressure
1.000E+00
-2
Grafica 9. Concentracin de iones metlicos 0.001M.
-4
ZnS
-6
-8
H 2 O L imits
-10
10
15
20
25
C:\HSC5\EpH\2a.iep
ELEMENTS
Zn
30
pH
Molality
1.000E-06
Pressure
1.000E+00
Grafica 10. Concentracin de los iones metlicos 1x10-6M.
ESCUELA DE INGENIERA METALRGICA Y CIENCIA DE MATERIALES
LABORATORIO DE HIDRO Y ELECTROMETALRGIA
Eh (Volts)
2.0
Zn - H2O - System at 25.00 C
1.5
1.0
Zn(+2a)
+00
-03
-06
ZnO
-06
-03
+00
ZnO2(-2a)
-06
0.5
+00
-03
0.0
+00
-06
-03
-06
-0.5
-06 -03 +00
-06
-1.0
ZnS
-1.5
H 2 O lim its
-2.0
0
10
12
14
16
C:\HSC5\EpH\2a.iep
ELEMENTS
Zn
18
20
pH
Molality
Variable
Pressure
1.000E+00
Grafica 11. Combinacin de las grficas de las diferentes
concentraciones.
ESCUELA DE INGENIERA METALRGICA Y CIENCIA DE MATERIALES
LABORATORIO DE HIDRO Y ELECTROMETALRGIA
b) Sistema 2. Zn-H2O con las especies anteriores pero cambios en la
temperatura 50, 100, 250 C.
Eh (Volts)
2.0
Zn - H2O - System at 50.00 C
1.5
ZnO
Zn(+2a)
1.0
ZnO2(-2a)
0.5
0.0
-0.5
-1.0
ZnS
-1.5
H 2 O L imits
-2.0
10
12
14
16
18
20
C:\HSC5\EpH\2b.iep
pH
ELEMENTS
Zn
Molality
1.000E+00
Pressure
1.000E+00
Grafica 12. Temperatura a 50C y concentracin 1M.
Eh (Volts)
2.0
Zn - H2O - System at 50.00 C
1.5
ZnO
1.0
ZnO2(-2a)
Zn(+2a)
0.5
0.0
-0.5
-1.0
ZnS
-1.5
H 2 O L imits
-2.0
10
12
14
16
C:\HSC5\EpH\ZnS50.iep
ELEMENTS
Zn
18
20
pH
Molality
1.000E-03
Pressure
1.000E+00
Grafica 13. Temperatura a 50C y concentracin de 0.001M
ESCUELA DE INGENIERA METALRGICA Y CIENCIA DE MATERIALES
LABORATORIO DE HIDRO Y ELECTROMETALRGIA
Eh (Volts)
2.0
Zn - H2O - System at 50.00 C
1.5
1.0
ZnO
Zn(+2a)
ZnO2(-2a)
0.5
0.0
-0.5
-1.0
ZnS
-1.5
H 2 O L imits
-2.0
10
12
14
16
C:\HSC5\EpH\ZnS50.iep
18
20
pH
ELEMENTS
Zn
Molality
1.000E-06
Pressure
1.000E+00
Grafica 14. Temperatura a 50C y concentracin de 1x10-6M.
Eh (Volts)
2.0
Zn - H2O - System at 50.00 C
1.5
+00
1.0
-03
-06
-06
0.5
-03
+00
+00
+00
0.0
-03
+00
-06
-03
-06
-0.5
+00
-1.0
-06 -03 +00
-1.5
H 2 O lim its
-2.0
0
10
15
20
C:\HSC5\EpH\ZnS50.iep
ELEMENTS
Zn
25
pH
Molality
Variable
Pressure
1.000E+00
Grafica 15. Temperatura a 50C y combinacin de las concentraciones.
ESCUELA DE INGENIERA METALRGICA Y CIENCIA DE MATERIALES
LABORATORIO DE HIDRO Y ELECTROMETALRGIA
c) Especies Zn0(s), Zn+2(aq), ZnO2-2(aq), [Zn(CN)4]-2(a), ZnO(s); concentracin
de los iones metlicos de 1x10-3M;
a 250C.
Eh (Volts)
4
Zn - H2O - System at 25.00 C
3
2
ZnO
Zn(+2a)
ZnO2(-2a)
0
-1
Zn
-2
Zn(CN)4(-2a)
-3
H 2 O L imits
-4
10
C:\HSC5\EpH\ZnCN25.iep
ELEMENTS
Zn
12
14
pH
Molality
1.000E-03
Pressure
1.000E+00
Figura. Sistema Zn-H2O a 25C, con concentracin de Zn de [1x10-3 M]
3. Obtener el diagrama de Pourbaix para el sistema Cu-H2O-S-NH3 teniendo en
cuenta las siguientes especies: Cu0(s), Cu+1(aq), Cu+2(aq), CuO(s), Cu2O(s), CuO2=(aq),
Cu(OH)2(s), Cu2S(s), CuS(s), [Cu(NH3)]+2(a), [Cu(NH3)2]+2(a), [Cu(NH3)3] +2 (a), [Cu(NH3)4]
+2
-3
(a); concentracin de los iones metlicos de 1x10 M; temperaturas de 25, 50 y
0
100 C.
ESCUELA DE INGENIERA METALRGICA Y CIENCIA DE MATERIALES
LABORATORIO DE HIDRO Y ELECTROMETALRGIA
Eh (Volts)
2.0
Cu - H2O - System at 25.00 C
1.5
Cu(OH)2
Cu(+2a)
1.0
0.5
CuS
0.0
-0.5
-1.0
Cu(NH3)4(+2a)
-1.5
H 2 O L im its
-2.0
10
12
C:\HSC6\EpH\CuNS25.iep
ELEMENTS
Cu
14
pH
Molality
1.000E-03
Pressure
1.000E+00
Grafica 17. Sistema Cu-H2O a 25C, y concentracin o.oo1 M
Eh (Volts)
2.0
Cu - H2O - System at 50.00 C
1.5
Cu(OH)2
Cu(+2a)
1.0
0.5
CuS
0.0
-0.5
-1.0
Cu(NH3)4(+2a)
-1.5
H 2 O L im its
-2.0
10
C:\HSC6\EpH\CuNS25.iep
ELEMENTS
Cu
12
14
pH
Molality
1.000E-03
Pressure
1.000E+00
Grafica 18. Sistema Cu-H2O a 50C, y concentracin o.oo1 M
ESCUELA DE INGENIERA METALRGICA Y CIENCIA DE MATERIALES
LABORATORIO DE HIDRO Y ELECTROMETALRGIA
Eh (Volts)
2.0
Cu - H2O - System at 100.00 C
1.5
Cu(+2a)
Cu(OH)2
1.0
CuO2(-2a)
0.5
0.0
CuS
-0.5
-1.0
-1.5
Cu(NH3)4(+2a)
H 2 O L imits
-2.0
10
12
14
C:\HSC6\EpH\CuNS25.iep
ELEMENTS
Cu
pH
Molality
1.000E-03
Pressure
1.000E+00
Grafica 19. Sistema Cu-H2O a 25C, y concentracin o.oo1 M
Eh (Volts)
2.0
Cu - H2O - System at 25.00, 100.00 and 50.00 C
1.5
Cu(+2a)
25 50
Cu(OH)2
100
1.0
CuO2(-2a)100
25
50
100
2550 100
0.5
2550
100
0.0
CuS
100
25
50
50
100
100
-0.5
-1.0
Cu(NH3)4(+2a)
-1.5
H 2 O lim its
-2.0
0
C:\HSC6\EpH\CuNS25.iep
10
12
14
pH
Grafica 20. Sistema Cu-H2O combinado [25, 50, 100], y concentracin o.oo1
M
ESCUELA DE INGENIERA METALRGICA Y CIENCIA DE MATERIALES
LABORATORIO DE HIDRO Y ELECTROMETALRGIA
SISTEMA Au-H2O
a) Diagrama Pourbaix para el sistema Au-H2O con una
concentracin del ion metlico 0.001 M
Eh (Volts)
10
Au - H2O - System at 25.00 C
8
Au(OH)3
Au(+3a)
4
2
0
Au
-2
-4
-6
Au(CN)2(-a)
-8
H 2 O L imits
-10
-10
-5
10
15
20
C:\HSC6\EpH\AuCN25.iep
pH
ELEMENTS
Au
Molality
1.000E-03
Pressure
1.000E+00
Grfica 21: Sistema Au-H2O-CN a 25C, y concentracin o.oo1 M de Au
Eh (Volts)
10
Au - H2O - System at 25.00 C
8
6
Au(OH)3
4
2
0
Au
-2
-4
-6
Au(CN)2(-a)
-8
H 2 O L im its
-10
10
C:\HSC6\EpH\AuCN25.iep
ELEMENTS
Au
12
14
pH
Molality
1.000E-03
Pressure
1.000E+00
Grfico 22: Sistema Au-H2O-CN a 25C, y concentracin o.oo1 M de Au
ESCUELA DE INGENIERA METALRGICA Y CIENCIA DE MATERIALES
LABORATORIO DE HIDRO Y ELECTROMETALRGIA
ANALISIS DE RESULTADOS
Para el diagrama de Pourbaix de la Ag, en las grficas 1-3 se presenta un
aumento de la zona de estabilidad del ion metlico Ag + y aumento de la solubilidad
de este ion en presencia de H2O, con una simultanea disminucin de la zona de
estabilidad del xido Ag2O.
De lo contrario, un aumento de la temperatura produce un aumento en la zona de
estabilidad del xido de Ag2O y con ello la disminucin simultnea de la zona de
estabilidad del ion Ag+ en las grficas 4-6. Este efecto de la temperatura continua,
cuando las concentraciones son muy pequeas, de esta forma, pero un aumento
de la temperatura provocara un aumento ms pequeo del xido Ag 2O, cuya
evidencia son las grficas 7 y 8.
En cualquiera de los dos casos no hay mayor variacin en la estabilidad del Ag
slido.
Ahora, para el sistema del Zn, trabajar con concentraciones pequeas implica la
disminucin considerable de la zona de estabilidad del xido de Cinc, debido al
aumento del rea del ion Zn+2 y ZnO22- (graficas 8-10). Si adems de las pequeas
concentraciones de trabajo, se le agrega que se eleva la temperatura del sistema,
seguir disminuyendo la zona del ZnO, pero aumenta en mayor proporcin el rea
del ZnO22- (graficas 12-14).
Para el sistema del Cu, un aumento de la temperatura aumenta tanto la zona de
estabilidad del Cu2+ como su solubilidad en el agua, cabe resaltar la presencia casi
incambiable del CuO22- en condiciones muy bsicas (graficas 17-20).
En las grficas 21 y 22, para el sistema del Au, es posible la presencia del ion Au 3+
en condiciones de pH por debajo de 0, en la prctica real es imposible llegar a
estos valores, y el Au solido es ms soluble en agua que el ion mencionado.
Ahora, todos estas variaciones en las reas de estabilidad tanto de iones como de
molculas, se pueden analizar dentro del mbito de disolucin para procesos de
lixiviacin, donde aquellas sustancias cuya zona sea congruente con la zona de
presencia del agua, son sustancias lixiviables en soluciones acuosas, un proceso
importante en la recuperacin de un metal a partir de un mineral donde el licor rico
en el metal deseado es llevado a precipitacin, con el objetivo de recuperar
siempre la mayor cantidad de metal disponible.
No solo es importante este factor, tambin es posible visualizar la posible reaccin
que se tendr en el proceso de disolucin, o de que mineral es posible extraer ese
metal que quiero aprovechar, de esta manera, de esta manera en la grfica 7 es
posible obtener disolucin de la Ag slida en un ion Ag + en un medio acuoso con
ESCUELA DE INGENIERA METALRGICA Y CIENCIA DE MATERIALES
LABORATORIO DE HIDRO Y ELECTROMETALRGIA
condiciones de bajo voltaje y un rango amplio de pH cuando el mineral
es de baja concentracin y la reaccin se da a una temperatura de
50C.
En la grfica 11, tanto el ZnO como el ZnS pueden disolverse en un medio acuoso
y dar paso a Zn2+ o ZnO22-. El factor que determinara la formacin del catin o del
anin radica en el pH de la solucin, una solucin acida favorecer la disolucin
de las dos molculas en Zn2+, y una solucin bsica permitir la aparicin de
ZnO22-.
Un anlisis similar es posible realizar en la grfica 15, donde no vara en gran
manera la distribucin de las zonas salvo una pequea disminucin en el voltaje, y
tanto en esta grafica como en la 11 el anin se presenta en concentraciones
menores a 0.001M.
Para minerales de CuS, la facilidad de disolverse en soluciones acuosas es ms
evidente cuando la soluciones acidas y la temperatura es mayor a 25C, segn lo
visto en la grfica 20. Para la disolucin del Cu(NH 3)42+ en Cu2+ es necesario
ciertas condiciones, como un Eh mayor a 0.5 y un pH menor a 4.
CONCLUSIONES
El programa HSC es un software muy preciso y demasiado til para la
construccin de diagramas de Pourbaix, necesarios para el anlisis y
estudio de procesos de lixiviacin y a su vez en la obtencin del metal
valioso de una mena.
Es posible analizar estos diagramas bajo modificaciones tanto en
concentracin del metal como variaciones de las temperaturas para hallar
esas condiciones adecuadas de Eh y pH en las que se puede diluir y de
esta manera extraer el metal del mineral slido.
Es necesario tener en cuenta las especies presentes en la mena para que
el anlisis del diagrama sea ptimo y adecuado al proceso que se desea
realizar.
Al ser un diagrama basado en la termodinmica de las reacciones, este
tiene las mismas limitaciones (no se podr conocer la velocidad de la
reaccin, el proceso se considera en estado de equilibrio lo cual no es
cierto), sin embargo esto no impide estudiar la viabilidad de los procesos
hidrometalurgicos que se estn llevando a cabo, por supuesto
posteriormente se deber realizar un estudio cintico.
ESCUELA DE INGENIERA METALRGICA Y CIENCIA DE MATERIALES
LABORATORIO DE HIDRO Y ELECTROMETALRGIA
BIBLIOGRAFA
Manual del programa HSC.
Apuntes de Clase
You might also like
- Semana 13 Solución EjerciciosDocument8 pagesSemana 13 Solución EjerciciosEdwin Rosas100% (2)
- Trangram PDFDocument8 pagesTrangram PDFMalusitaNo ratings yet
- Cuadro Comparativo Empresas PanificadosDocument2 pagesCuadro Comparativo Empresas PanificadosOlga Beatriz LehmannNo ratings yet
- Pets-Ssoma-Conexionado de Cables de Fuerza y Control en Equipos y Tableros Electricos Existentes 1Document5 pagesPets-Ssoma-Conexionado de Cables de Fuerza y Control en Equipos y Tableros Electricos Existentes 1Mercy CarriónNo ratings yet
- 01 El Oficio Del Productor MusicalDocument34 pages01 El Oficio Del Productor MusicalFernando OrtegaNo ratings yet
- OptotiposDocument8 pagesOptotiposgenesis holguinNo ratings yet
- Naval de Nasa PDFDocument133 pagesNaval de Nasa PDFdaniilNo ratings yet
- Formulas Del Trabajo Mecánico para Primer Grado de Secundaria PDFDocument4 pagesFormulas Del Trabajo Mecánico para Primer Grado de Secundaria PDFAlonso Anwar Vargas SaavedraNo ratings yet
- Solución Guia N°5. ESTEQUIOMETRIA DE LA REACCION IDocument5 pagesSolución Guia N°5. ESTEQUIOMETRIA DE LA REACCION IPablo Santillán LopezNo ratings yet
- Falla CochabambaDocument6 pagesFalla CochabambahugogalindoNo ratings yet
- Negociación y Contratación InternacionalDocument3 pagesNegociación y Contratación Internacionalyara espinozaNo ratings yet
- ESTUDIO ORGANIZACIÓN Y ASPECTOS LEGALESDocument83 pagesESTUDIO ORGANIZACIÓN Y ASPECTOS LEGALESMelvinDonaldoLopez100% (1)
- 1 Derecho Notarial y RegistralDocument38 pages1 Derecho Notarial y Registralreyna burboa100% (2)
- Latarjet Ruiz Liard. Anatomía Humana 5 Edicion T2. Corazón y PericardioDocument47 pagesLatarjet Ruiz Liard. Anatomía Humana 5 Edicion T2. Corazón y PericardioYunier Valderrama FaleroNo ratings yet
- Optica fisica - Optica geométricaDocument12 pagesOptica fisica - Optica geométricaMathe QuinteroNo ratings yet
- Ficha Tecnica de DuchaDocument3 pagesFicha Tecnica de DuchaAngaman Ventas SACNo ratings yet
- Flujograma de ProcesosDocument9 pagesFlujograma de ProcesosAlcides ChanaNo ratings yet
- Vigas grandes luces, comparación diseñoDocument5 pagesVigas grandes luces, comparación diseñoSergio Steven Guarin CaldasNo ratings yet
- Dokumen - Tips - Partitura Completa Abba PadreDocument26 pagesDokumen - Tips - Partitura Completa Abba PadreAlberto de jesus Macias vidalNo ratings yet
- Autoevaluación Probabilidad y EstadisticaDocument4 pagesAutoevaluación Probabilidad y EstadisticaMNo ratings yet
- Guía EPS informes 30 reglasDocument5 pagesGuía EPS informes 30 reglasNoe AguilarNo ratings yet
- Procesamiento e interpretación de SEVs utilizando softwareDocument7 pagesProcesamiento e interpretación de SEVs utilizando softwarePaul SoriaNo ratings yet
- Ejemplo 6 Modelo Estudios Previos Mínima CuantíaDocument7 pagesEjemplo 6 Modelo Estudios Previos Mínima CuantíaDaniela FrancoNo ratings yet
- Visita A CemexDocument10 pagesVisita A CemexOscar Kase MartinezNo ratings yet
- Cursos para Especializacion en Geotecnia y Estabilidad de TaludesDocument7 pagesCursos para Especializacion en Geotecnia y Estabilidad de Taludesandres jaenoNo ratings yet
- Multietapas Columbia PDFDocument2 pagesMultietapas Columbia PDFjoseNo ratings yet
- Tema 07 - Románico y GóticoDocument165 pagesTema 07 - Románico y GóticoMABBY LITZI ROJAS ENRIQUEZNo ratings yet
- Recuperacion TermicaDocument21 pagesRecuperacion TermicaAdriana SanchezNo ratings yet
- Expansion EuropeaDocument4 pagesExpansion EuropeaPaz Vivas ArriagadaNo ratings yet
- Descontinuacion de ModelosDocument2 pagesDescontinuacion de ModelosBeto FmJrNo ratings yet