Professional Documents
Culture Documents
Practica 2 de Reactores
Uploaded by
Jeniffer GonzálezCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Practica 2 de Reactores
Uploaded by
Jeniffer GonzálezCopyright:
Available Formats
Obtencin de la ecuacin de velocidad para la reaccin de
saponificacin del acetato de etilo, mediante el mtodo integral y
diferencial.
Estado del arte:
Hidrlisis alcalina
En la hidrlisis alcalina de los esteres, tambin conocida como
saponificacin, estos reaccionan con el hidrxido de sodio formando un
carboxilato de sodio y un alcohol.
La reaccin de saponificacin del acetato de etilo con NaOH
La reaccin del acetato de etilo con el hidrxido sdico tiene lugar segn la
siguiente
estequiometra:
CH3COOC2H5 + NaOH CH3COONa + C2H5OH
y si llamamos:
CH3COOC2H5 A1 , NaOH A2 , CH3COONa A3 y C2H5OH A4
se puede escribir de la forma:
- A1 - A2 + A3 + A4 = 0
Como sucede en todas las reacciones entre steres y lcalis, el equilibrio est
muy desplazado hacia la derecha, y la velocidad a la que tiene lugar la reaccin es
adecuada para poderla seguir en el laboratorio sin necesidad de emplear tcnicas
sofisticadas. Por esta razn suele ser una de las ms utilizadas en el estudio del
comportamiento de los reactores qumicos.
El mecanismo de la hidrlisis se explica por una accin nuclefila del grupo
oxhidrilo sobre el ster, segn el esquema:
es decir, una cintica compleja con formacin de productos intermedios que
transcurre mediante cinco etapas elementales. La expresin cintica que resultara
de este mecanismo de reacciones de equilibrio consecutivas sera bastante
compleja.
No obstante, a concentraciones pequeas de reactantes, puede suponerse que la
Concentracin del complejo de adicin es muy baja, y las velocidades de las
reacciones inversas son despreciables frente a las de las reacciones directas. Por
esta razn, puede admitirse, en primera aproximacin, que la reaccin es
irreversible y de segundo orden global, es decir, que la velocidad de
reaccin depende nica y linealmente de las concentraciones de ster y lcali
presentes:
en donde k, constante cintica de la reaccin, slo depende de la temperatura.
Anlisis de la cintica de la reaccin de saponificacin del acetato de etilo
por conductimetra
Conforme transcurre la reaccin se produce una variacin de la conductividad de
la disolucin debido al cambio de los iones presentes en la mezcla reactante.
La conductividad de una disolucin de acetato de etilo es casi mil veces inferior a
la de una disolucin de sosa de la misma concentracin y a la misma temperatura.
Es decir, podemos asociar la variacin de la conductividad de la mezcla reactante
a la desaparicin del hidrxido de sodio: al disminuir la concentracin de dicho
reactante disminuye la conductividad de la disolucin (K).
De esta forma, podemos determinar la concentracin de sosa en cada momento a
partir de la medida de la conductividad y de la ecuacin de calibrado del
conductmetro a la temperatura de operacin.
Por otra parte, la conductividad es una propiedad fsica muy dependiente de la
temperatura.
Por ello se debe evitar gradientes de temperatura y procurar que la temperatura de
reaccin permanezca constante.
http://www.uv.es/idiqlab/labquimicos/documentos/RDTA.pdf
Parte experimental:
Experimento
Reactivos:
Solucion de NaOH
HCl concetrado
Solucin de acetato de etilo
Material:
3 matraces Erlenmeyer
Bureta
Vaso de precipitados
Pipeta volumtrica
2 jeringas
Probeta
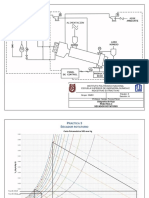
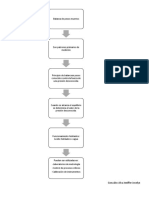
Diagrama de flujo
Reaccin de
Saponificaci
n del
Acetato de
Etilo.
Preparar
las
soluciones:
*100 ml de solucin
acetato de etilo
*100 ml de solucin
NaOH
*100 ml de solucin
HCL
*Agregar al reactor 50 ml de NaOH
0.03M e inmediatamente tomar una
alcuota de 10 ml.
*Arrancar el cronometro al momento que
una gota de NaOH toque a la solucin del
reactor.
*pasar la alcuota a un matraz
Erlenmeyer y titular con HCL. Repetir
este paso cada 3 min. , hasta 10
siguientes
0.03M de
0.03M de
Valoracin
de
la
solucin
de HCL
0.02M de
Molaridad promedio:
*Aforar una bureta con HCL
valorado.
*Medir 50 ml de acetato de etilo
a 0.03M para colocarlos en un
vaso de precipitados de 250 ml.
*Agregar 2 a 3 gotas de
fenolftalena.
You might also like
- Hipótesis, Variables y Escalas de MediciónDocument58 pagesHipótesis, Variables y Escalas de MediciónErik CastañedaNo ratings yet
- Proceso de Mejora ContinuaDocument15 pagesProceso de Mejora ContinuaJhunior Lizana Ochoa100% (1)
- Practica Condensador HorizontalDocument13 pagesPractica Condensador HorizontalJeniffer GonzálezNo ratings yet
- EstapsicoDocument16 pagesEstapsicoJeniffer GonzálezNo ratings yet
- Instituto Politécnico NacionalDocument6 pagesInstituto Politécnico NacionalJeniffer GonzálezNo ratings yet
- Evaporación Triple EfectoDocument10 pagesEvaporación Triple EfectoJeniffer GonzálezNo ratings yet
- Instituto Politécnico NacionalDocument1 pageInstituto Politécnico NacionalJeniffer GonzálezNo ratings yet
- Proceso de Elaboración de LevadurasDocument7 pagesProceso de Elaboración de LevadurasJeniffer GonzálezNo ratings yet
- Practica 3 Secador RotatorioDocument9 pagesPractica 3 Secador RotatorioJeniffer GonzálezNo ratings yet
- Practica 3 Diagrama y GraficaDocument2 pagesPractica 3 Diagrama y GraficaJeniffer GonzálezNo ratings yet
- Proceso de Elaboración de LevadurasDocument7 pagesProceso de Elaboración de LevadurasJeniffer GonzálezNo ratings yet
- NORMADocument20 pagesNORMAJeniffer GonzálezNo ratings yet
- Evaporación Múltiple EfectoDocument6 pagesEvaporación Múltiple EfectoJeniffer GonzálezNo ratings yet
- Practica 3 Secador RotatorioDocument9 pagesPractica 3 Secador RotatorioJeniffer GonzálezNo ratings yet
- NORMADocument20 pagesNORMAJeniffer GonzálezNo ratings yet
- Evaporador simple efecto: presión vapor, temperaturas, masas y eficienciasDocument4 pagesEvaporador simple efecto: presión vapor, temperaturas, masas y eficienciasJeniffer GonzálezNo ratings yet
- Diagrama de Las Practicas 678Document1 pageDiagrama de Las Practicas 678Jeniffer GonzálezNo ratings yet
- Termopares y receptor eléctrico IPNDocument3 pagesTermopares y receptor eléctrico IPNJeniffer GonzálezNo ratings yet
- Practica 4 Placa de OrificioDocument3 pagesPractica 4 Placa de OrificioJeniffer GonzálezNo ratings yet
- Diagrama Pesos MuertosDocument2 pagesDiagrama Pesos MuertosJeniffer GonzálezNo ratings yet
- Practica 7 CRONTOLADOR PROPORCIONALDocument4 pagesPractica 7 CRONTOLADOR PROPORCIONALJeniffer GonzálezNo ratings yet
- Bases de DiseñoDocument9 pagesBases de DiseñoJeniffer GonzálezNo ratings yet
- Secador de CharolasDocument2 pagesSecador de CharolasJeniffer GonzálezNo ratings yet
- Introduccion Papa y ManzanaDocument3 pagesIntroduccion Papa y ManzanaJeniffer GonzálezNo ratings yet
- INTEGRACIÓN NUMÉRICA Metodo Del TrapecioDocument2 pagesINTEGRACIÓN NUMÉRICA Metodo Del TrapecioJeniffer GonzálezNo ratings yet
- Practica SerpentinDocument1 pagePractica SerpentinJeniffer GonzálezNo ratings yet
- Ionización Electrónica-FragmentaciónDocument1 pageIonización Electrónica-FragmentaciónJeniffer GonzálezNo ratings yet
- Historia y Evolución Del CoachingDocument28 pagesHistoria y Evolución Del CoachingJeniffer GonzálezNo ratings yet
- Diagrama DescriptivoDocument1 pageDiagrama DescriptivoJeniffer GonzálezNo ratings yet
- Tecnologia de Alimentos 2Document31 pagesTecnologia de Alimentos 2Jeniffer GonzálezNo ratings yet
- Transferencia de Calor. Práctica 1Document6 pagesTransferencia de Calor. Práctica 1Jeniffer GonzálezNo ratings yet
- Datos Practica 4Document1 pageDatos Practica 4Jeniffer GonzálezNo ratings yet
- Clasificación y Tipologia de La Toma de DecisionesDocument5 pagesClasificación y Tipologia de La Toma de DecisionesyanitzaNo ratings yet
- Acondicionadores de TejidoDocument18 pagesAcondicionadores de Tejidogdvrchpx52No ratings yet
- Caracterización FloraDocument30 pagesCaracterización FloraRosana OtalvarezNo ratings yet
- Capítulo 01 - Estadística Relevante Del SEINDocument34 pagesCapítulo 01 - Estadística Relevante Del SEINmishelNo ratings yet
- Comentario Del Libro Ingenieros y Las Torres de MarfilDocument2 pagesComentario Del Libro Ingenieros y Las Torres de Marfilmijaelc15No ratings yet
- PEC4Sol 20191Document4 pagesPEC4Sol 20191Ohanna OhanaNo ratings yet
- Examen de confección de vestidos y la industria textilDocument5 pagesExamen de confección de vestidos y la industria textilRocio RMNo ratings yet
- Mera - Mateo Construcciones 3 P1Document7 pagesMera - Mateo Construcciones 3 P1lily loor c.No ratings yet
- Alpina Act.18Document10 pagesAlpina Act.18MARIANo ratings yet
- Calculo Indice Actos SegurosDocument16 pagesCalculo Indice Actos SegurosMANGUERAS DE MINATITLANNo ratings yet
- Organización celular y tejidosDocument5 pagesOrganización celular y tejidosisabel niebles arenasNo ratings yet
- Norma de Competencia Laboral: Fue Reemplazada Por La(s) Norma(s) 280401035 Que Ya Se Encuentra (N) Publicada(s)Document4 pagesNorma de Competencia Laboral: Fue Reemplazada Por La(s) Norma(s) 280401035 Que Ya Se Encuentra (N) Publicada(s)Inap PrincipalNo ratings yet
- 1° Básico Artes Visuales Guía 12. Profesoras Primero BásicoDocument3 pages1° Básico Artes Visuales Guía 12. Profesoras Primero BásicoMarioNo ratings yet
- Estadística para la calidad - IVDocument9 pagesEstadística para la calidad - IVjoseNo ratings yet
- Cuestionario Sobre El Origen de Las EspeciesDocument3 pagesCuestionario Sobre El Origen de Las EspeciesFernándo nieto100% (1)
- Clase de Gauss - Jordan Terceros IIDocument8 pagesClase de Gauss - Jordan Terceros IIGrafic MediaNo ratings yet
- Tema 3 PoliticasDocument32 pagesTema 3 PoliticasSoniaNo ratings yet
- Buenas Prácticas Archivísticas Cuestionario 9Document8 pagesBuenas Prácticas Archivísticas Cuestionario 9JIMENA FLORES SANCHEZNo ratings yet
- Creación de tablas en Access - Ejercicios prácticosDocument2 pagesCreación de tablas en Access - Ejercicios prácticosAnita Mejía Chi Ham100% (1)
- Restauración Ecológica TallerDocument9 pagesRestauración Ecológica Tallerbayron99No ratings yet
- HaudenosauneeDocument12 pagesHaudenosauneeDraighean ErlandNo ratings yet
- Taller ElectivaDocument2 pagesTaller ElectivaSilviTaPinOsNo ratings yet
- Power Point FacuDocument42 pagesPower Point FacupilardemierreNo ratings yet
- TAREA en EQUIPO 5 Crecimiento y Desarrollo Durante La AdolescenciaDocument13 pagesTAREA en EQUIPO 5 Crecimiento y Desarrollo Durante La AdolescenciaIvon VerasteguiNo ratings yet
- Tema 6 Teoría Unid. EstratigraficasDocument22 pagesTema 6 Teoría Unid. EstratigraficasCarlos Gonzalez VergaraNo ratings yet
- Caso Practico Conciliación Bancaria 2Document3 pagesCaso Practico Conciliación Bancaria 2magaliNo ratings yet
- Fua Sis Adolescente RC 017Document2 pagesFua Sis Adolescente RC 017LORENA ROSALINDA QUINTO RODRIGUEZNo ratings yet
- Aprendiendo Naturalmente Grupo 3 Jose de LeónDocument2 pagesAprendiendo Naturalmente Grupo 3 Jose de LeónJuanNo ratings yet