Professional Documents
Culture Documents
Mapa Mental
Uploaded by
Isa UrbinaCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Mapa Mental
Uploaded by
Isa UrbinaCopyright:
Available Formats
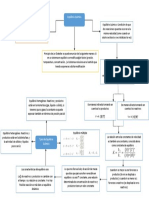
Teorema de
Duhem:
Determinacin
intensiva y
extensiva de un
puras.
Regla de las fases de
Gibbs: Determina el estado
intensivo de un sistema en
equilibrio. F=2-+N
; 1=
Potencial qumico: Indica
cmo cambia la energa
libre de Gibbs cuando se
combinan n. de moles de
un componente en la
solucin. =
Relaciones de
adicionalidad: M=
Termodinmic
a de
soluciones.
xi y nM=
Propiedades parciales:
Propiedad parcial del
componente i en solucin.
(nM )
Modelo
de gas ideal:
tiene
fundamentos
moleculares, es
analticamente
Vi
simple.
g
ig
(T,P)=Mii
- - C2
Propiedades parciales en
soln binarias M=
M 2
Mi
x2.
Ecuacin de Gibbs
Duhem: 0=(
M
P
Punto de roco: condiciones en
las cuales en un sistema inicia la
condensacin.
Presin de roco (yi y T
conocidos) P=
1
Yi /Pisat
Temperatura de roco( yi y P
Ecuacin fundamental en sistemas
multifsico: d(nG)=(nV) dP-(nS)
dT+i dni d(nG)=(nV) dP(nS) dT+i dni
La
Relacin fundamental de
Gibbs: d(nG)=(nV)dP(nS)dT+idni
Fugacidad y coeficiente de
fugacidad- Es una medida
relacionada con el potencial
qumico y est relacionada
con la tendencia de una
sustancia de preferir una fase.
de actividad
x1+
i
(nG)
Ley de Raoutl modificada:
Ecuacin para EVL, no supone
soln ideal, en la fase vapor se
supone gas ideal. YiP=XiPisat
= Coeficiente de actividad (se
utiliza cuando los compuestos no
son qumicamente semejantes).
Punto de burbuja: condiciones en
las cuales en un sistema inicia la
ebullicin.
Presin de
burbuja (xi y T conocidos)
P=XiPisat. Temperatura de
burbuja( xi y P conocidos) T=
Propiedades de
exceso. Coeficiente
=Vii g = RT/P
Mi
lnPsat=A-
Ley de Henry: Vlida para
soluciones donde Xi se acerca a 0
(soluciones diluidas de A) siempre
y cuando A no se disocie, ionice o
reaccione en la fase lquida. Se
aplica en fases no condensables.
Termodinmica II
Ley de Raoult: establece que
la relacin entre la presin de
vapor de cada componente en
una solucin ideal es
dependiente de la presin de
vapor de cada componente
individual y de la fraccin
molar de cada componente en
Equilibrio lquido
vapor y propiedades
termodinmicas con
ecuaciones de estado.
Valor k: Medida de volatilidad
relativa. ki=yi/xi=Pisat/P 1=xiki
1=yi/ki ecuacin modificada: Ki=
iPisat/P
Destilacin
flash: Destilacin instantnea.
L+V=1; XiL+YiV=Zi Yi=
ziki
1+ v (ki1)
Ecuacin de Antoine:
Describe la relacin entre
la temperatura y la
presin de saturacin del
vapor de sustancias
i=
fi^ /xifi ; Gi
Energa libre de Gibbs en
exceso. Coeficientes de
actividad. Modelos
termodinmicos: Ecuacin
de Wilson
Ecuacin de Margules
NRTL
UNIQUAC
UNIFAC
Van Laar
energa libre de Gibbs en todo el
sistema ser: d(nG)=(nV)dP-
En especies puras: GR=Gi-
Gii g; i=fi/P;
G =RTln(fi/P); en gas
ideal : GR=0,fiig=P,GiR=0
R
Calculo de fugacidad en
gases puros: a) A partir de
datos PVT. b)Mediante ec. de
estado (virial zi=1+BiiP/RT),
c)De diagramas de f vs pr a
tr cte, d)Por correlaciones
generalizadas para
(lee/kesler = 0 (1)w) y e)A
EVL para especies
puras: fiv=fil=fisat ;
iv= il= iV
Fugacidad para lquido
comprimido: fi=
isatPisatexp(Vil(PPisat)/RT)
Regla de Lewis Randall:
^
fi
iid
=xifi;
^
i
iid
= i
modelo adecuado para
You might also like
- Descripcion Breve de La Emrpesa - GDMDocument19 pagesDescripcion Breve de La Emrpesa - GDMMiguel Flores CornejoNo ratings yet
- Camara de SedimentacionDocument4 pagesCamara de SedimentacionArmando EscalaNo ratings yet
- Ensayo SoldaduraDocument12 pagesEnsayo SoldaduraluisNo ratings yet
- CV 2016 MibancoDocument5 pagesCV 2016 MibancoYuri YanceNo ratings yet
- Semana 14 Soldadura de MantenimientoDocument7 pagesSemana 14 Soldadura de MantenimientoJOSUE CORDOVANo ratings yet
- 041 - Curso de Derecho Laboral y Tributario - 2022 - 02Document318 pages041 - Curso de Derecho Laboral y Tributario - 2022 - 02José BerrocalNo ratings yet
- Prestamos y Tcea G1Document5 pagesPrestamos y Tcea G1Jhon Jiménez RomeroNo ratings yet
- Fenomenos de TransferenciaDocument11 pagesFenomenos de TransferenciaJuan AlvaradoNo ratings yet
- Gestion Social InpeDocument38 pagesGestion Social InpePaulina Juanita Hidalgo AramburuNo ratings yet
- Transferencia de Calor Convección Natural y ForzadaDocument29 pagesTransferencia de Calor Convección Natural y ForzadaYelsen Yonathan Canchari VargasNo ratings yet
- 02 - Etapas de Salida de SensoresDocument16 pages02 - Etapas de Salida de SensoresCarlos HerreraNo ratings yet
- EXPOSICION de Sedimentacion de Gases Camaras de SedimentacionDocument10 pagesEXPOSICION de Sedimentacion de Gases Camaras de Sedimentacionrebaj PeñaNo ratings yet
- Trabajo en FrioDocument10 pagesTrabajo en FrioJosue Alejandro HernándezNo ratings yet
- Universidad Nacional de San Agustin de Arequipa - 2Document3 pagesUniversidad Nacional de San Agustin de Arequipa - 2Yolanda Ccori PaucaraNo ratings yet
- Un Libro Un CafeDocument664 pagesUn Libro Un CafeAna Sofia OsunaNo ratings yet
- Tablas de ConversionesDocument2 pagesTablas de ConversionesasdNo ratings yet
- Banco de Preguntas - SoldaduraDocument10 pagesBanco de Preguntas - SoldaduraAlberto estrella guarandaNo ratings yet
- Forjado FinalDocument29 pagesForjado FinalJuan GranaraNo ratings yet
- Fundamentos de Transferencia de Momento Calor y Masa 5ta Edicion James WeltyDocument803 pagesFundamentos de Transferencia de Momento Calor y Masa 5ta Edicion James WeltyKevin Rivera GarciaNo ratings yet
- Teoria SedimentacionDocument2 pagesTeoria SedimentacionRubén Santos SanabriaNo ratings yet
- Fenomenos de TransferenciaDocument14 pagesFenomenos de TransferenciaJuan AlvaradoNo ratings yet
- Examen Parcial Hidrometalurgia Mayo 2016-2Document1 pageExamen Parcial Hidrometalurgia Mayo 2016-2Leo RodgersNo ratings yet
- Tarea 2 - Fenómenos de TransferenciaDocument5 pagesTarea 2 - Fenómenos de TransferenciaStefany CaballeroNo ratings yet
- INFORME 02 Control de ProcesosDocument11 pagesINFORME 02 Control de ProcesosAlex L CjNo ratings yet
- Articulo CientificoDocument4 pagesArticulo CientificoMISAEL SIFUENTES GONZALEZ100% (1)
- Cinética de La LixiviaciónDocument25 pagesCinética de La LixiviaciónRoberto E. Alfaro Cortes100% (1)
- PC Prototipo 6 LIZARRAGADocument1 pagePC Prototipo 6 LIZARRAGAJoaquin LizarragaNo ratings yet
- Cinetica de Flotación de Sulfuros Nana-1Document24 pagesCinetica de Flotación de Sulfuros Nana-1Eleana Marisol Surco QuispeNo ratings yet
- Soldabilidad de Aceros Al Carbono - Grupo 6Document17 pagesSoldabilidad de Aceros Al Carbono - Grupo 6david pullutasigNo ratings yet
- Trabajo Final de OptimizacionDocument15 pagesTrabajo Final de OptimizacionWinder Jose Reyes GarciasNo ratings yet
- Ensayo de Flotacion de CuDocument11 pagesEnsayo de Flotacion de CuCristopher HernándezNo ratings yet
- Síntesis de Procesos Quimicos r12Document42 pagesSíntesis de Procesos Quimicos r12Rosmaryan GuzmanNo ratings yet
- ZacDocument27 pagesZacFlorencio Martínez KenNo ratings yet
- Lab - 07 Solo Cuestionario PrevioDocument4 pagesLab - 07 Solo Cuestionario PrevioRichard Sosa SolisNo ratings yet
- Solicitud de Reingreso 2023Document1 pageSolicitud de Reingreso 2023Isabel CórdovaNo ratings yet
- Mina Fosfatos BayovarDocument93 pagesMina Fosfatos BayovarRichard Diaz100% (1)
- Modelamiento Matematico de LixiviacionDocument50 pagesModelamiento Matematico de LixiviacionEver Olguin Carpio Huamani100% (1)
- Transiciones de Fases Unidad II Cinètica de Las Transformaciones de FaseDocument85 pagesTransiciones de Fases Unidad II Cinètica de Las Transformaciones de Fasecoreano63No ratings yet
- Informe de Investigacion Meta 2Document19 pagesInforme de Investigacion Meta 2Isabela de 66 CondoriNo ratings yet
- Tema04 Reacciones Redox Ejercicios PDFDocument75 pagesTema04 Reacciones Redox Ejercicios PDFJuan Novo PhigaroNo ratings yet
- Extraccion Solvente de Cobre PDFDocument188 pagesExtraccion Solvente de Cobre PDFLuciano Cruz JancoNo ratings yet
- Procesos en Frio POWER POINTDocument27 pagesProcesos en Frio POWER POINTNati IbarraNo ratings yet
- IMhetehjDocument91 pagesIMhetehjJérôme KyabuNo ratings yet
- Laboratorio 2Document18 pagesLaboratorio 2Alejandro Enrique Godoy CastilloNo ratings yet
- Control EstabilizanteDocument7 pagesControl EstabilizanteEsther Condori SanchezNo ratings yet
- Camaras de SedimentacionDocument5 pagesCamaras de SedimentacionRuben LopezNo ratings yet
- Sensores de GasDocument11 pagesSensores de GasRafael MisteriosoNo ratings yet
- Reporte EdtaDocument12 pagesReporte EdtaYazmín Luévano'No ratings yet
- Sílabo Química-TecsupDocument3 pagesSílabo Química-TecsupAlonso GuillénNo ratings yet
- Capítulo 7 Tratamiento en Frío de Los MetalesDocument69 pagesCapítulo 7 Tratamiento en Frío de Los MetalesHumberto Daniel Lira LugoNo ratings yet
- Programa de Asignatura Ics-751 Administración GeneralDocument3 pagesPrograma de Asignatura Ics-751 Administración GeneralDiego L CruzNo ratings yet
- Silabo TermodinamicaDocument2 pagesSilabo TermodinamicajhonNo ratings yet
- SOCIEDAD Y DESARROLLO SOSTENIBLE - Tarea N°1Document3 pagesSOCIEDAD Y DESARROLLO SOSTENIBLE - Tarea N°1soy_40No ratings yet
- Copia de Práctica FinalDocument30 pagesCopia de Práctica FinalVICTOR ANDRES CCAHUANA CUTIPANo ratings yet
- Taller Gratuito: Ing. Robinson ParedesDocument20 pagesTaller Gratuito: Ing. Robinson ParedesEmmanuel GarciaNo ratings yet
- Cap4 Sistemas Homogeneos Mul PDFDocument105 pagesCap4 Sistemas Homogeneos Mul PDFMarcelo TorresNo ratings yet
- Capitulo 16Document5 pagesCapitulo 16Dasha Escalera TorricoNo ratings yet
- Termodinamica Soluciones Presentacion Powerpoint PDFDocument21 pagesTermodinamica Soluciones Presentacion Powerpoint PDFJuan Michael Antonio HuarcayaNo ratings yet
- Equilibrio Entre Dos Fases LíquidasDocument21 pagesEquilibrio Entre Dos Fases LíquidasRocio RojasNo ratings yet
- Psicometría. Principios básicos y protocolos experimentales diversosFrom EverandPsicometría. Principios básicos y protocolos experimentales diversosNo ratings yet
- SacarificaciónDocument6 pagesSacarificaciónIsa UrbinaNo ratings yet
- CentrífugaDocument3 pagesCentrífugaIsa Urbina100% (1)
- LevadurasDocument5 pagesLevadurasIsa UrbinaNo ratings yet
- VERMICULITADocument4 pagesVERMICULITAIsa UrbinaNo ratings yet
- GalvanómetroDocument3 pagesGalvanómetroIsa UrbinaNo ratings yet
- Problemas KERNDocument12 pagesProblemas KERNIsa Urbina100% (1)
- ELECTROQUÍMICADocument5 pagesELECTROQUÍMICAIsa UrbinaNo ratings yet
- Tarea Quimica AnaliticaDocument1 pageTarea Quimica AnaliticaIsa UrbinaNo ratings yet
- VoltamperometríaDocument5 pagesVoltamperometríaIsa UrbinaNo ratings yet
- Gravitacion UniversalDocument3 pagesGravitacion UniversalIsa UrbinaNo ratings yet
- Equilibrio Líquido Vapor en Un Sistema No IdealDocument6 pagesEquilibrio Líquido Vapor en Un Sistema No IdealIsa UrbinaNo ratings yet
- Volumen Molar ParcialDocument3 pagesVolumen Molar ParcialIsa UrbinaNo ratings yet
- Humanidades ValoresDocument2 pagesHumanidades ValoresIsa UrbinaNo ratings yet
- Control de Las Emisiones de Óxido NítricoDocument2 pagesControl de Las Emisiones de Óxido NítricoIsa UrbinaNo ratings yet
- Problemas TermodinámicaDocument16 pagesProblemas TermodinámicaIsa Urbina100% (2)
- Preguntas de Discusion Capítulo 2 PDFDocument4 pagesPreguntas de Discusion Capítulo 2 PDFIsa UrbinaNo ratings yet
- Stronger Kids PipDocument1 pageStronger Kids PipjavitapazvuNo ratings yet
- Normas Jurídicas, Sociales y ReligiosasDocument4 pagesNormas Jurídicas, Sociales y Religiosasvntn 100% (1)
- Premisas Psicológicas de La Orientación Vocacional.Document17 pagesPremisas Psicológicas de La Orientación Vocacional.Melanie RiveraNo ratings yet
- FT TINAJAS Terras DautanDocument6 pagesFT TINAJAS Terras DautanPablo Montes StewartNo ratings yet
- Arellano, Ignacio (Reseña), Andrés Sánchez Robayna, Poesía de Islas CanariasDocument3 pagesArellano, Ignacio (Reseña), Andrés Sánchez Robayna, Poesía de Islas CanariasJosé P. SerratoNo ratings yet
- Foro Medicion 1Document3 pagesForo Medicion 1scarleth MaradiagaNo ratings yet
- Evidencia 3 Informe "Identificación de Las Tecnologías de La Información"Document6 pagesEvidencia 3 Informe "Identificación de Las Tecnologías de La Información"Edgar Carpintero81% (16)
- Programa de Mejoramiento de Barrios - Plan de Manejo Ambiental y Social (ESMR)Document15 pagesPrograma de Mejoramiento de Barrios - Plan de Manejo Ambiental y Social (ESMR)mauroNo ratings yet
- RP I RazonesDocument1 pageRP I Razonesvera_esteban_oNo ratings yet
- Etapa 1 de 23Document15 pagesEtapa 1 de 23Jonaykher Johann Oro Bobadilla100% (1)
- Proactividad PDFDocument11 pagesProactividad PDFAntony OrellanaNo ratings yet
- Unidad 1 Fase 1 - Conocer Los Fundamentos de La EpistemologíaDocument7 pagesUnidad 1 Fase 1 - Conocer Los Fundamentos de La Epistemologíafernando buitragoNo ratings yet
- MD Teoria Logica ProposicionalDocument2 pagesMD Teoria Logica Proposicionaljuan cruz marquezNo ratings yet
- Variaciones Lingüísticas ListoDocument10 pagesVariaciones Lingüísticas ListoMaría PazNo ratings yet
- Qué Es Servicio Al ClienteDocument8 pagesQué Es Servicio Al ClienteBrigit Sanchez PrinsfresitaNo ratings yet
- Ondas - Función de Onda - Ondas en CuerdasDocument6 pagesOndas - Función de Onda - Ondas en CuerdasJuan Carlos NegreteNo ratings yet
- Sesión 1 C y T - El Crecimiento de Las PlantasDocument6 pagesSesión 1 C y T - El Crecimiento de Las PlantasSaniht RamirezNo ratings yet
- Visualización Del Proyecto ExposicionDocument11 pagesVisualización Del Proyecto ExposicionIris Martinez100% (1)
- Poster Marina Mercante EspañolaDocument1 pagePoster Marina Mercante EspañolaDaniel Sánchez SoldevillaNo ratings yet
- Cuadro Comparativo Teoria CelularDocument3 pagesCuadro Comparativo Teoria CelularMayra RamosNo ratings yet
- 2º C Refuerzo Cuaderno Actividades M Carmen Perez Parque Colegio Santa Ana Parte 1 de 2Document9 pages2º C Refuerzo Cuaderno Actividades M Carmen Perez Parque Colegio Santa Ana Parte 1 de 2Oscar Zubiaga HernanNo ratings yet
- BiorregionalismoDocument20 pagesBiorregionalismoZoila Martinez0% (1)
- Grado Tercero. Guia 11. Lenguaje PoeticoDocument5 pagesGrado Tercero. Guia 11. Lenguaje PoeticoasesoraNo ratings yet
- Servicio Social 1Document12 pagesServicio Social 1Naren MarinNo ratings yet
- 5 Rasgos Deseables Del ProfesorDocument3 pages5 Rasgos Deseables Del ProfesorEstefanía SaucedoNo ratings yet
- 2 - Calculo Mecanico BT CAAIDocument7 pages2 - Calculo Mecanico BT CAAIMendoza LilianaNo ratings yet
- Tesis - Destilacion - Control LogixDocument62 pagesTesis - Destilacion - Control LogixAlonso SanchezNo ratings yet
- REPASO INTEGRAL - 2014 - RM - 01 PDFDocument8 pagesREPASO INTEGRAL - 2014 - RM - 01 PDFMariaSteinNo ratings yet
- Modelos de Doble Permeabilidad en Yacimientos Naturalmente FracturadosDocument15 pagesModelos de Doble Permeabilidad en Yacimientos Naturalmente FracturadosMarcos RiberaNo ratings yet
- Cronograma FarmaciaDocument1 pageCronograma FarmaciaJesús MuñozNo ratings yet