Professional Documents
Culture Documents
SIFAT GAS ALAM
Uploaded by
Fomalhaut AdityaOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
SIFAT GAS ALAM
Uploaded by
Fomalhaut AdityaCopyright:
Available Formats
SIFAT GAS ALAM
Gas bumi merupakan sumber daya alam yang terdiri dari Senyawa Hidrokarbon (Cn H2n+2 )
dan komponen non-hidrokarbon lainnya seperti N2, C02 dan H2S. Gas Bumi yang
dihasilkan dipermukaan dapat dikelompokkan dalarm dua golongan, yaitu :
1. Sebagai produk ikutan dari minyak dikenal sebagai associated gas.
2. Gas sebagai produk utama dikenal sebagai non-associated gas.
Kelompok yang kedua ini, walaupun di dalam reservoir terbentuk dalam satu fasa
mungkin dipermukaan berubah menjadi gas dan cairan. Kadar cairan menjadi patokan
kasar pembagian lebih lanjut dari non-associated gas menjadi gas kering dan gas basah
(kondensat) Gas disebut kering bila GOR > 100.000 SCF/STB , sebaliknya disebut sebagai
gas basah. Akan tetapi klasifikasi yang tepat baru diperoleh dari diagram P.T, dari fluida
reservoar. Gambar skematis yang umum diberikan pada Gambar 1.
Gambar 1
Sifat Gas Alam 1
1.1. Sifat - sifat Gas Ideal.
Suatu gas ideal adalah fluida yang :
1. Memiliki volume dari molekul relatif dapat diabaikan dibandingkan dengan volume dari
fluida secara menyeluruh.
2. Tidak memiliki daya tarik atau gaya tolak antara sesama molekul atau antara molekul
dengan dinding dari tempat dimana gas itu berada.
3. Semua tubrukan dari molekul bersifat elastik murni, yang berarti tidak ada kehilangan
energi dalam akibat tubrukan tadi.
Dasar untuk menggambarkan suatu gas ideal datang dari percobaan - percobaan yang
kemudian dikenal sebagai hukurn - hukum gas.
1. Hukum Boyle.
Bahwa perubahan volume dari suatu gas ideal berbanding terbalik dengan tekanan pada
temperatur konstan
V 1/P atau PV = konstan
2. Hukum Charles.
Bahwa perubahan volume berbanding lurus dengan perubahan temperatur pada tekanan
yang konstan.
V T atau V/T = konstan.
3. Hukurn Avogadro.
Bahwa pada kondisi tekanan dan temperatur yang sama suatu gas ideal dengan volume
yang sama, akan mempunyai jumlah molekul yang sama.
Dari gabungan antara Hukurn Boyle, Charles dan Avogadro di peroleh suatu persamaan
kesetimbangan :
PV=nRT (1)
Sifat Gas Alam 2
P =Tekanan, psia
V = volume, cuft
T = temperatur, R
n = jumlah mol gas.
R = konstanta, untuk satuan diatas harganya 10.732 psia cuft/lb-mol R
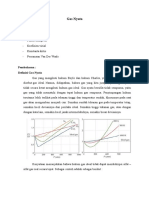
1.2. Sifat-sifat Gas Nyata.
Beberapa asumsi telah digunakan untuk memformulasikan persamaan
kesetimbangan untuk gas ideal. Namun asumsi tersebut tidak tepat untuk gas yang berada
pada kondisi jauh dari kondisi ideal atau standar. Untuk menanggulangi hal tersebut
digunakan suatu koreksi yang dinamakan sebagai faktor deviasi gas (Z). Faktor deviasi gas
didefinisikan sebagai perbandingan antara volume gas pada keadaan tekanan dan
temperatur sebenarnya dibagi dengan volume gas pada keadaan ideal/standar,
Z = V actual atau V actual = Z V ideal
V ideal
Sehingga persamaan kesetimbangan menjadi :
PV=ZnRT (2)
untuk gas ideal harga Z = 1.
Harga faktor deviasi gas tergantung, dari perubahan tekanan, temperatur atau
komposisi gas. Gambar 2 menunjukkan Z yang umum terhadap tekanan untuk suatu
temperatur dan komposisi gas tertentu.
Sifat Gas Alam 3
Gambar 2
1.3. Sifat Fisik Gas
1.3.1 Komposisi Gas
Komposisi dari suatu campuran gas diekspresikan sebagai fraksi mol fraksi volume atau
fraksi berat dari setiap komponen. Atau dapat juga diekspresikan sebagai persen mol,
persen volume atau persen berat.
Fraksi mol, yi, didefinisikan sebagai :
ni
yi = (3)
ni
Sifat Gas Alam 4
Keterangan :
yi = fraksi mol. dari komponen.
ni = jumlah mol dari komponen.
n i = total mol dari seluruh komponen campuran.
Sehingga berat molekul. total untuk suatu campuran adalah :
Ma = yi Mi (4)
Harga berat molekul untuk setiap komposisi dapat dilihat di Tabel 1.
Fraksi volume didefinisikan sebagai :
Vi
Fraksi Volume = (5)
Vi
keterangan :
Vi = Volume dari komponen i pada kondisi standar.
Vi = Volume total dari campuran pada kondisi standar.
Fraksi berat, i , didefinisikan sebagai :
Wi
i = (6)
Wi
keterangan :
i = fraksi berat dari komponen.
Wi = berat dari komponen i.
W = berat total dari campuran.
i
1.3.2. Perkiraan Sifat Fisik Gas
Sifat fisik fluida sangat diperlukan dalam perhitungan selanjutnya. Pada sub bab ini akan
dibahas korelasi -korelasi yang, sejauh pengamatan dapat dipercayai dan diuji
kebenarannya. Akan tetapi prioritas utama adalah data yang didapatkan dari Laboratorium.
dan korelasi ini digunakan. apabila data tersebut tidak tersedia.
Sifat Gas Alam 5
Sifat Gas Alam 6
Sifat-sifat fisik metana sampai dekana, dan juga senyawa-senyawa yang biasa terkandung
didalam fluida hidrokarbon di reservoar diberikan pada Tabel 1. Informasi ini dapat
dipakai untuk memperkirakan sifat-sifat campuran hidrokarbon.
Dua besaran, Temperatur Pseudokritis dan Tekanan Pseudokritis suatu campuran
banyak digunakan untuk korelasi - korelasi yang, diterangkan pada sub bab ini. Sifat sifat
tadi dapat diperkirakan dari persamaan
TPC= y i Tci (7)
Ppc= y i
Pci (8)
keterangan :
yi = Fraksi mol komponen i
Tci = Temperatur kritis Komponen ke I, 0R
Pci = Tekanan kritis komponen ke i, Psia
Atau dapat juga menggunakan korelasi dari Gambar 3, perlu diketahui terlebih dahulu
harga specific Gravity gas yaitu :
g = M / 28,97 (9)
keterangan :
M adalah berat molekul total campuran gas dan harga 28.97 adalah berat molekul
udara. Sehingga Pseudo Tekanan dan Temperatur adalah :
P
Ppr = (10)
Ppc
T
Tpr = (11)
Tpc
1.3.2.1. Faktor Deviasi Gas
Dengan diketahuinya harga Ppr dan Tpr maka harga faktor deviasi gas dapat
ditentukan. Katz dan Standing telah menghasilkan grafik korelasi Z = f(Ppr, Tpr) seperti
dapat dilihat pada Gambar 4. Grafik ini memberikan hasil yang memuaskan bila gas tidak
mengandung C02 dan H2S. Untuk gas yang mengandung kedua unsur
Sifat Gas Alam 7
Sifat Gas Alam 8
Gambar 3a
Sifat Gas Alam 9
Gambar 4
Sifat Gas Alam 10
tersebut perlu dilakukan koreksi harga Ppc dan Tpc lebih dahulu sebelum menchitung Pr
dan Tr Koreksi tersebut adalah sebagai berikut :
T ' pc = Tpc
Ppc T ' pc
P ' pc =
(
Tpc + B B2 )
Keterangan :
Tpc = Temperatur Pseudokritis sebelum koreksi.
Ppc = Tekanan Pseudokritis sebelum koreksi.
T'pc = Temperatur Pseudokritis sesudah koreksi.
Ppc = Tekanan Pseudokritis sesudah koreksi.
= 120 (A 0.9 A1.6 ) + 15( B 0.5 B 4 )
B = fraksi mol H2S.
A = fraksi mol (C02 + B)
Sehingga :
Tpr = T/T'pc dan Ppr = P/P'pc
dan selanjutnya harga faktor deviasi gas dapat ditentukan dari Gambar 4.
Grafik korelasi Z dari Standing-Katz telah dipakai secara meluas dilingkungan
industri. Dengan munculnya komputer maka komputasi persoalan Gas bumi membutuhkan
cara yang lebih sederhana dari pada memasukkan harga harga Z dari grafik Standing - Katz
kedalam program komputer. Cara yang sederhana adalah dalam bentuk persamaan Z yang
diperoleh berdasarkan penyelarasan dengan grafik Z dari Standing Katz atau berdasarkan "
equation of state". Pendekatan yang pertama ini digunakan oleh Dranchuck, dkk. dengan
menggunakan equation of state dari Benedict-Webb-Rubin (BWR). Pendekatan yang
kedua dilakukan oleh Hall - Yarborough dengan menggunakan persamaan " equation of
state " dari Starling - Karnahan.
Sifat Gas Alam 11
Parsamaan dan dari Dranchuck - Purvis -Robinson dinyatakan dalam bentuk
Z = 1 +(A1 + A2 / Tr+ A3 / Tr 3 ) + (A4 + A5 / Tr) r + A5 A6 r / Tr
2 5
+ A7 r / Tr3 (1 + A8 r ) exp ( A8 r )
2 2 2
(14)
Keterangan :
r = 0.27 Pr / ( Z Tr) (15)
dan
Al = 0.31506237 A5 = -0.612.32032
A2 = -1.04670990 A6 = -0.10488813
A3 = -0.57832729 A7 = 0.68157001
A4 = 0.53530771 A8 = 0.68446549
Mengingat Pr adalah fungsi dari Z, maka penyelesaian persamaan 14 dilakukan dengan
cara trial & error
Hall - Yarborough menghasilkan persamaan 16 untuk menghitung Z.
2
0.06125 Pr t 1.2(1 t )
Z= e (16)
y
Keterangan :
.t = 1 /Tr
y = akar dari persamaan F(y) = 0
2 y + y2 + y3 y 4
F = 0.06125 Pr t 1.2(1 t ) + -
e 3
(1 y )
2.18 + 2.82t
(14.7t - 9.76t 2
) (
+ 4.58t 3 y 2 + 90.7 242.2t 2 + 42.4t 3 y )
=0 (17)
Penyelesaian dari persamaan 16 menggunakan teknik iterasi dari Newton-Raphson ,
yaitu dengan menganggap harga y dan namakan yo. Gunakan harga yo pada persamaan 17
sehingga diperoleh role harga Fo yang tidak sama dengan nol, mengingat harga yo hanya
perkiraan saja. Dengan rangkaian Taylor
Sifat Gas Alam 12
0 = F Fo +
dFo
( y yo ) (18)
dy
dapat disusun persamaan untuk memperkirakan harga y :
Fo
. y = yo - (19)
dF0
dy
dFo
dy
(
= 29.52 t 19.52 t 2 + 9.16 t 3 y + (2.18 + 2.82 t ))
(20)
1.18 + 2.82t
(90.7t 242.2t )
2
+ 42.4t 3 y
Jadi dengan menggunakan persamaan 19 itu dihitung harga y yang baru sehingga. akhirnya
diperoleh harga F = 0. Harga y ini kemudian dimasukkan ke dalam persamaan 16 untuk
mencari harga Z.
1.3.2.2. Faktor Volume Formasi Gas (Bg)
Faktor Volume Formasi Gas (Bg) didefinisikan sebagai perbandingan volume gas dalam
kondisi reservoar dengan volume gas dalam kondisi permukaan :
V Z n R T/P
Bg = =
P, T
vol/vol std
VSC Zsc nR Tsc/Psc
dengan mengambil volume standart Tsc = 520 0R, Psc = 14.7 Psia serta Z sc = 1, maka :
TZ ft 3
B g = 0.0283 (21)
P scf
atau
TZ bbl
Bg = 0.00504 (22)
P scf
1.3.2.3. Kompresibilhs Gas.
Sifat Gas Alam 13
Kompresibilitas isothermal dari gas diukur dari perubahan volume per unit volume
dengan perubahan tekanan pada temperatur konstan atau dalam persamaan ditulis menjadi
:
1 dV
C= (23)
V dP T
Untuk gas ideal :
nRT dV nRT
V= maka = 2
P dP P
sehingga
P nRT 1
C= = (24)
nRT P 2 P
Sedangkan untuk gas nyata,
ZnRT
V=
P
dimana Z f(P) maka akan didapat :
1 1 dZ
C= - (25)
P Z dP
dZ
Harga dapat ditentukan secara analitis, yaitu :
dP
dZ Z1 Z 2
=
dP P1 P2
Persamaan 25 dapat diubah menjadi :
Cr=C Ppc (26)
Keterangan :
1 1 dZ
Cr = (27)
P Z dP
pr pr Tpr
Sifat Gas Alam 14
Mattar telah membuat korelasi untuk menentukan Cr Tpr yang merupakan fungsi dari Ppr
dan Tpr seperti terlihat pada Gambar 5 dan 6. Berdasarkan korelasi ini, maka harga
kompresibilitas gas Cg dapat ditentukan.
1.3.2.4 Viskositas gas
Viskositas dari suatu gas campuran tergantung pada tekanan, temperatur dan
komposisi. Carr-Kobayashi-Burrows telah menyusun grafik korelasi untuk, menentukan
viskositas dari gas seperti ditunjukkan oleh Gambar 7 dan 8. Kedua gambar tadi
didasarkan pada hubungan :
1 = f (M, T ) = f (, T )
= f (Ppr, Tpr )
1
Keterangan :
1 = viskositas pada tekanan 1 atm.
= viskositas pada tekanan > 1 atm.
Dengan mengetahui harga berat molekul M dari gas atau spesifik graviti gas, serta
g
menggunakan Gambar 7 maka diperoleh harga 1 . Harga / 1 diperoleh dari Gambar 8
bila diketahui harga Ppr dan Tpr.
Viskositas gas juga dapat diperkirakan berdasarkan Gambar 9.
Persamaan semi empiris untuk keperluan program komputer dijabarkan oleh Lee Gonzales
- Eakin yang akan memberikan hasil yang, memuaskan untuk "sweet gas".
= Kexp(X y ) (28)
Keterangan :
K=
(9.4 + 0.02M )T1.5
209 + 19M + T
986
X = 3.5 + + 0.01M
T
Y = 2.4 0.2X
Sifat Gas Alam 15
Sifat Gas Alam 16
Sifat Gas Alam 17
Gambar 7
Sifat Gas Alam 18
Gambar 8
Sifat Gas Alam 19
Gambar 9
= viskositas gas, mikro poise.
= massa jenis, gr/cc.
T = temperatur, 0R.
M = beat molekul gas (28.97 * ).
g
1 mikro poise = 10 -6 poise.
Sifat Gas Alam 20
Persamaan lain yang dapat digunakan dalam komputasi komputer adalah seperti yang
diusulkan oleh Hollo - Holmes Pais :
1 = [1.709 x10 5 2.062 x10 6 ( g )] T + 8.188x10 -3 5.615 x10 3 log g 29
Keterangan :
T dalam 0F.
( )
ln Tr = a o + a 1 Pr + a 2 Pr 2 + a 3 Pr 3 + Tr a 4 + a 5 Pr + a 6 Pr 2 + a 7 Pr 3
1 30
( ) ( )
+ Tr 2 a 8 + a 9 Pr + a 10 Pr 2 + a 11 Pr 3 + Tr 3 a 12 + a 13 Pr + a 14 Pr 2 + a 15 Pr 3
a0 = -2.4611820 a8 = -7.93385684x10-1
a1 = 2.97054714 a9 = 1.396443306
a2 = -2.86264054 a10 = -1.49144925x10-1
a3 = 8.05420522x10-1 a11 =4.41015512x10-3
a4 = 2.80860949 a12 = 8.39387178x10-2
a5 = -3.49803305x10-1 a13 = -1.86408848x10-1
a6 = 3.60373020x10-1 a14 = 2.03367881x10-2
a7 = -1.04432413x10-2 a15 = -6.09579263x10-4
1.3.2.5. Kelarutan Gas di Air
Harga kelarutan gas di air tergantung, dari tekanan temperatur dan salinitas air.
Hubungan tersebut ditunjukkan pada Gambar 10, faktor koreksi untuk salinitas dihitung
dari persamaan :
Rsw
= 1 XYx10 4 31
Rswp
Sifat Gas Alam 21
Y = salinitas air, ppm.
X = 3.471 / T0.837.
T = Temperatur, 0F.
Rsw = Kelarutan gas terkoreksi, cuft/bbl.
Rswp = Kelarutan gas di air tawar, cuft/bbl.
Sifat Gas Alam 22
Gambar 10
1.3.2.6. Kelarutan Air dalam Gas
Kelarutan air alam gas tergantung dari tekanan, temperatur dan salinitas air.
Hubungan tersebut ditunjukkan pada Gambar 11, faktor koreksi untuk salinitas dihitung,
dengan :
Ws
Wsp
(
= 1 - 2.87x10 -8 y )
1.266
32
Keterangan :
Ws = kelarutan air dalam gas, lbm/MMscf.
Wsp = kelarutan air tawar dalam gas (dari Gambar 11)
Y = salinitas air, ppm
1.4. Sistem Gas - Kondensat
Diagram fasa untuk sistem reservoar kondensat dapat dilihat di Gambar 12. Dari
gambar tersebut terlihat bahwa pada saat awal, fluida yang keluar dari reservoar tersebut
adalah gas. Ketika tekanan reservoar mengalami penurunan, garis dew point akan
terlewati, fasa cair terbentuk. Dari fakta inilah bahwa fluida hidrokarbon sering terdiri dari
dua fasa sehingga diperlukan suatu metoda untuk menghitung volume atau massa setiap
fasa dan juga komposisi setiap fasa.
Distribusi komponen dari suatu sistem gas dan cairan diekpresikan dengan Konstanta
Kesetimbangan , K yaitu perbandingan antara fraksi mol komponen pada fasa gas dengan
fraksi mol komponen pada fasa cair.
yi
Ki = 33
xi
Keterangan :
Ki =konstanta Kesetimbangan dari komponen i.
.yi = fraksi mol dari komponen i dalam fasa gas.
xi = fraksi mol dari komponen i dalam fasa, cair.
Sifat Gas Alam 23
Gambar 11
Sifat Gas Alam 24
Gambar 12.
Penggunaan Konstanta Kesetimbangan tersebut adalah untuk menentukan tekanan
gelembung, tekanan embun dan perbandingan antara fasa gas dan cair pada kondisi
tekanan dan temperatur kedua fasa tersebut. Didalam perhitungan, sistem diasumsikan
berada dalam kesetimbangan termodinamik Notasi-notasi yang digunakan dalam
persamaan adalah :
n = total mol dari fluida campuran
L = total mol dari fasa cair
Sifat Gas Alam 25
V = total mol dari fasa gas.
Zi = fraksi mol dari komponen i dalam campuran.
Zi n = mol komponen i dari fluida campuran.
xi L = mol komponen i dari fluida cair pada saat ketimbangan
yi V = mol komponen i dari fasa gas pada saat kesetimbangan.
Dari suatu sistem seperti yang terlihat pada Gambar 13, persamaan kesetimbangan untuk
sistem tersebut adalah :
n=L+V 34
Gambar 13.
Persamaan kesetimbangan untuk komponen ke i adalah :
Zi n = xi L + yi V (35)
atau
Sifat Gas Alam 26
nZ i
xi = (36)
L + VK i
Pada saat setimbang, jumlah fraksi mol untuk setiap fasa adalah sama
xi = 1
y i =1
Sehingga :
Zi
x = L + VK
i (39)
i
Zi
y = i
L
(40)
V+
Ki
Prosedur perbitungan untuk kedua per amaan diatas adalah secara coba, - coba (trial and
error ). Prosedur tersebut adalah sebagai berikut :
1. Perkirakan harga K untuk setiap komponen pada kondisi tekanan dan temperatur
penentuan ( untuk setiap komposisi dapat dilihat pada Gambar 14 hingga 25 ).
2. Asumsikan harga V dan kemudian harga L, dari hubungan L + V = 1.
3. Menghitung jumlah fraksi mol untuk setiap komponen dari asumsi harga V pada
langkah 2 dengan menggunakan persamaan 39.
4. Jika jumlah fraksi mol yang dihasilkan dari langkah 3 tidak sama dengan 1 maka
asumsi harga V tidak benar. Ulangi lagi dengan mengasumsikan harga V dan
kembali ke langkah 3 hingga jumlah fraksi mol yang dihasilkan sama dengan 1.
5. Dengan diketabuinya harga xi dari lanok, th 4 maka fraksi mol gas dapat dihitung
dari
yi = Ki xi
Untuk menentukan tekanan gelembung dari ystem ini maka dibuat jumlah fraksi mol gas
sama dengan nol :
V
0 dan L
n
sehingga :
Sifat Gas Alam 27
Gambar 14
Sifat Gas Alam 28
Gambar 15
Sifat Gas Alam 29
Gambar 16
Sifat Gas Alam 30
Gambar 17
Sifat Gas Alam 31
Gambar 18
Sifat Gas Alam 32
Gambar 19
Sifat Gas Alam 33
Gambar 20
Sifat Gas Alam 34
Gambar 21
Sifat Gas Alam 35
Gambar 22
Sifat Gas Alam 36
Gambar 23
Sifat Gas Alam 37
Gambar 24
Sifat Gas Alam 38
Gambar 25
Sifat Gas Alam 39
Gambar 26
Sifat Gas Alam 40
Gambar 27
Sifat Gas Alam 41
n Zi
y i = lim
V + L/K i
=1
V 0
atau
K Z i i =1 (41)
Sedangkan untuk menentukan titik embun maka dibuat jumlah fraksi mol dari fasa
cair sama dengan nol,
V
n dan L
0
sehingga :
n Zi
x i = lim L + V Ki
=1
L 0
atau
Z /K i i =1 (42)
Dalam banyak kasus , sifat dari campuran fluida reservoar tidak diketahui, tetapi sifat -
sifat gas dan kondensat setelah dipisahkan diketahui, untuk itu dibuat perhitungan yang
merupakan gabungan dari kedua fasa tersebut.
Spesifik gravity dari campuran adalah :
g + 4584 o /R
=
gm 1 + Vo/R
Keterangan :
gm =spesifik gravity dari campuran.
g = spesifik gravity dari gas.
o = spesifik gravity dari kondensat.
Vo = volume kondensate yang teruapkan.
R = perbandingan produksi gaskondensat.
Sifat Gas Alam 42
Harga Vo didapat dari Gambar 26 untuk kasus dimana o diukur pada separator
bertekanan tinggi jika o diukur pada kondisi standar, harga Vo tergantung pada tekanan
separator dan dapat ditentukan dari Gambar 27.
1.5. Termodinamika.
Pada suatu proses dinamis dalam suatu sistem termodinamika berlangsung
perpindahan energi dari dan ke dalam sistem serta perubahan energi di dalam sistem.
Sebagai contoh Pengaliran gas dalam pipa, dimana energi dibawa oleh gas yang mengalir
dan yang mungkin dipindahkan keluar sistem. Perpindahan energi dari sistem keluar
lingkungannya hanya dapat berbentuk panas dan kerja.
Energi yang terbawa bersama fluida meliputi
1. Energi dalam (internal energy) U; energi yang, dimiliki oleh fluida tanpa
ketergantungan pada lokasi dan gerakan.
m v2
2. Energi kinetis energi yang berkaitan dengan gerakan yang dinyatakan
2g c
terhadap suatu titik tertentu.
mgz
3. Energi potensial yang diakibatkan oleh kedudukan dari sistem.
gc
4. Energi penekanan PV, yang terbawa kedalam atau keluar dari sistem sebagai
akibat dari penekanan.
Energi yang dipindahkan dari dan kedalam sistem terdiri dari
1. Panas q yang diserap oleh sistem sebagai akibat perbedaan temperatur antara
sistem dengan lingkungannya. Panas yang diperoleh sistem diberi tanda positif.
2. Kerja W dilaksanakan dari sistem ke sekelilingnya. Kerja yang diberikan oleh
sistem kesekelilingnya diberi tanda positif.
Kesetimbangan energi dimana pompa digunakan dalam sistem untuk mengalirkan gas
diberikan oleh persamaan berikut ini
Sifat Gas Alam 43
mV2 2 mgZ 2 mV12 mgZ1
U2 + + + p 2 V2 = U1 + + + p1V1 + q W (44)
2g c gc 2g c gc
atau
mV 2 mgZ
U + + + pV = q W (45)
2g c gc
1.5.1. Entalpi.
Entalpi merupakan konsep termodinamik yang didefinisikan sebagai :
H=U+P V, BTU/Ib.mole (46)
Penentuan entalpi dari suatu komponen dibagi atas dua bagian. Yang pertama
menyangkut penentuan entalpi yang, dipengaruhi oleh temperatur berdasarkan konsep gas
yang ideal. Yang kedua memperhatikan pengaruh tekanan atas entalpi dari gas nyata (real
gas). Hubungan bagian tersebut diberikan oleh persamaan 47.
( ) (
H TP H o0 = H oT H o0 H oT H TP ) (47)
Superscript T = temperatur.
P = tekanan pada p.
Po = tekanan pada p = 0.
H0o = entalpi pada datum, BTU/lb mole. = 0.
Persamaan diatas dapat disederhanakan menjadi :
(
H TP = H oT H oT H TP ) (48)
H = H o (H o H) (49)
Keterangan :
Sifat Gas Alam 44
Gambar 28
Sifat Gas Alam 45
Gambar 29
Sifat Gas Alam 46
Gambar 30
Sifat Gas Alam 47
Gambar 31
Sifat Gas Alam 48
H = entalpi pada P, T.
Ho = entalpi dari gas ideal pada T.
Harga H0 atau (HT0 H00 ) dalam BTU/lb dari komponen murni dapat dicari dari
grafik korelasi H0 vs. T(OF), seperti pada Gambar 28 dan Gambar 29. Untuk
komponenyang tidak tercantum pada kedua grafik tersebut, grafik korelasi Gambar 30
dapat digunakan untuk memperkirakan harga HO atau menagunakan persamaan 50.
( )
ln H 0 = 2.61456
ln T
T
0.5
2.49639 + 1.56283 +
25.159
M
(50)
M = berat molekul.
g = specific gravity
O
T = R
(
) {( ) } {(
(')
Harga H 0 H = RTc H 0 H /RTc (0 )+ H 0 H /RTc
) } (51)
Keterangan :
= acentric factor (diberikan pada Tabel 2).
R = 1.986 BTU/Ib.mole OR.
O
Tc = R.
[(H o
- H)/RTc ]( ) = ditentukan berdasarkan Gambar 31 dengan
o
mengetahui Pr dan
Tr
[(H o
- H)/RTc ]( ) =
'
ditentukan berdasarkan Gambar 32 dengan mengetabui harga
Pr dan Tr
Bagian atas dari masing-masing gambar dimaksudkan untuk cairan.
Entalpi dari campuran beberapa sumur, seperti gas bumi, ditentukan berdasarkan
data masing-masing unsur dengan, menggunakan hukurm percampuran (Kay). Entalpi dari
gas campuran berdasarkan kaidah gas ideal diterapkan berdasarkan persamaan 52.
Sifat Gas Alam 49
H 0m = X i H i0 (52)
Keterangan :
Xi = fraksi mole dari komponen i.
Demikian pula dengan harga "acentric factor" dari gas campuran m , harganya
ditentukan berdasarkan harga acentric factor dari masing-masing unsur ( i ) .
m = X i i (53)
sedangkan
Tc = X i Tci (54)
Pcm = X i Pci (55)
digunakan untuk mencari harga
[(H 0
) ]( )
H /RTc
0
[(H 0
H )/RT ] ( )
c
'
Dari Gambar 31 dan Gambar 32.
Selanjutnya harga (H0 - H)m diperoleh dari persamaan :
(H 0
H )m
[(
= RTcm H 0 H /RTc
)
(0 )
] [( )
m H 0 H /RTc ]
(')
(56)
sehingga entalpi dari gas campuran pada tekanan dan temperatur tertentu dapat dihitung,
yaitu dengan menggunakan persamaan 57.
H m = H 0m H 0 H ( )m (57)
1.5.2. Panas Jenis.
Dalam perhitungan termodinamika, seperti penekanan gas (adiaoatic compression),
sering digunakan harga panas jenis. Dibedakan dua macam. panas jenis, yaitu :
Sifat Gas Alam 50
panas jenis pada volume yang konstan Cv dan panas jenis pada tekanan konstan Cp Untuk
gas yang ideal keduanya dinyatakan dalam hubungan
Cp = Cv + 1.986 BTU / (lb.mole OR). (58)
Definisi dari panas jenis masing-masing di dikaitkan dengan dua fungsi, yaitu entalpi (H)
dan energi dalam (U).
H = f (T, P)
H H
dH = dT + dP
T P P T
H
dH = C p dT + dP (59)
dP T
dH
Keterangan : Cp =
dT P
U = f(T, V) , V specific volume.
U U
dU = dT + dV (60)
T V V T
U
dU = Cv dT + dV
V T
Harga Cp dari masing-masing komponen dari gas campuran pada tekanan 1 atm dapat
diperoleh dari Tabel 1. Harga panas jenis campuran Cpm diperoleh dengan menggunakan
hukum pencampuran
C pm = X i C pi (61)
atau dicari langsung dengan menggunakan grafik pada Gambar 33.
Penentuan panas jenis untuk tekanan yang konstan dimana P > 14.7 psia didasarkan
pada harga untuk P = 14.7, Cp (14.7, T) dengan menambahkan harga koreksi, Cp (Pr,
Tr)
Cp(P, T ) = Cp(14.7, T) + Cp(Pr, Tr) (62)
H
Cp(Pr, Tr) = * Pr (63)
Pr Tr
Sifat Gas Alam 51
Gambar.32
Sifat Gas Alam 52
Gambar 33
Sifat Gas Alam 53
H Tc Tr 2 Z
= 1.986 (64)
Pr Tr Pr Tr
Pr
Selain rumus di atas maka harga Cp dapat ditentukan langsung dengan bantuan Gambar
34.
1.5.3. Entropi
Entropi tidak dapat digambarkan secara fisik ia merupakan suatu konsep
matematis yang, sering timbul dalam analisa termodinamika. Istilah entropi diberikan
dq
untuk menyatakan jumlah T . Tidak ada harga absolut untuk entropi yang ada adalah
perbedaan entropi untuk dua keadaan dalam suatu sistem termodinamis. Perbedaan
entropi untuk "reversible process" dinyatakan oleh persamaan
2
dq
S 2 S1 = (65)
1
T
atau
dq=Tds (66)
Harga entropi masing-masing unsur pembentuk gasbumi sebagai gas yang ideal
dengan tekanan P = 0 dapat ditentukan dari grafik Gambar 35. Harga Sio (BTU/Ib 0R)
dinyatakan sebagai fungsi dari temperatur. Sedangkan harga entropi dari gas campuran
diperoleh dari persamaan berikut ini :
Som = X i M i Sio R X i ln X i (67)
Keterangan :
Xi = fraksi mole
R = konstanta gas = 1.986 BTU/ lb.mole OR)
Sio = entropi dari komponen i, BTU/Ib.OR.
Sifat Gas Alam 54
Gambar 34
Sifat Gas Alam 55
Som = BTU/lb.R
Harga entropi pada tekanan P dan temperatur T dari gas campuran -memerlukan koreksi
dari harga Som . Harga koreksi ini dinyatakan oleh S o S ( )
m
.
o (o ) (')
(S o
)
S m = R
S S
R
So S
+ m
R
+ lnP
(68)
Keterangan :
R = 1.986 BTU/ (lb.mole OR)
P = tekanan dalam atm.
m = X i i
Hasil dari persamaan 68 merupakan koreksi untuk menghitung S m (P, T )
(
S m (P, T) = Som So S m ) (69)
Cara lain untuk mencari entropi dari gas bumi adalah menggunakan persamaan
analisis.
T Z P P
S(P, T ) = Cp ln
T
1.986 Z + ln (70)
Ts Tc Tr pr Ps Ps
Keterangan :
Ts = temperatur referensi, OR.
Ps = tekanan referensi, Psia
T = temparatur, OR
Tc = temperatur kritis, OR.
T
Cp dT
Cp = Ts
(71)
T - Ts
Sifat Gas Alam 56
Gambar 35
Sifat Gas Alam 57
Pr
P
Z dP Z dPr
s
Z= Ps
= Pr (72)
P - Ps Pr - Pr s
Z
Z Tr dPr
= (73)
Tr Pr Pr - Pr s
1.5.4. Diagram Mollier
Hubungan entalpi - entalpi diperoleh berdasar masing-masing, definisi.
dH = dU + d(PV)
= dU + P dV + V dP (74)
d U + P dV
dS=dq/T = (75)
T
Pengolahan lebih lanjut dari persamaan 74 dan 75 akan memberikan hubungan
dH = TdS + VdP (76)
Hubungan H(P,T) terhadap S(P,T) untuk bermacarn-macam. harga specific gravity ( g )
diberikan pada grafik dari Gambar 38.
1.6. Contoh Penyelesaian
1. Penentuan Sifat Fisik Gas alam.
Suatu gas alarn yang bersifat asam (sour gas) memiliki komposisi (fraksi mol) berikut ini:
N2 = 0.0236
C02 = 0.0164
H2S = 0. 1841
CH4 = 0.7700
C2H6 = 0.0042
C3H8 = 0.0005
Sifat Gas Alam 58
iC4H10 = 0.0003
nC4H10 = 0.0003
iC5H12 = 0.0001
nC5H12 = 0.0001
C6H14 = 0.000 1
C7H 16 = 0.0003
Tekanan dan temperatur gas masing - masing 2000 psia dan 200 0F.
Tentukan:
a. Pc, Tc dan g
b. Z
C. Cg
d. g
Jawaban:
a. Jawaban a ditabelkan
b. Jawaban b ditabelkan
c. Harca Cr Tr diperoleh dari Gambar 6 untuk harga Pr = 2.73, yaitu
Cr Tr = 0.66
Cr = 0.66 = 0.38
1.73
Cg = Cr/Pc
= 0.83 = 0.000520 psi -1
731.34
Sifat Gas Alam 59
d. Gambar 7 digunakan untuk mencari harga viskositas pada tekanan 14.7 psia (1 )
dan dilengkapi dengan faktor koreksi.
Komponen Fraksi M Tc Pc Xi Mi Xi Tci Xi Pci
O
mol. Xi Berat R Psia
mol. Mi
N2 0,0236 28,013 227,30 493,0 0,6611 5,36 11,63
C02 0,0164 44,010 547,87 1071,0 0,7218 8,99. 17,56
H2S 0,1841 34,076 672,60 1306,0 6,2734 123,83 240,43
CH4 0,7700 16,043 343,32 667,8' 12,3531 264,36 514,21
C2H6 0,0042 30,070 550,10 707,8 0,1263 2,3 2,97
C3H8 0,0005 44,097 666,01 616,3 0,0220 0,33 0,31
iC4H10 0,0003 58,124 734,96 529,1 0,0174 0,22 0,16
nC4H10 0,0001 58,124 765,62 550,7 0,0174 0,23 0,17
iC5H12 0,0001 72,151 829,03 490,4 0,0072 0,08 0,05
nC5H12 0,0001 72,151 845,60 488,6 0,0072 0,08 0,05
C6H14 0,0001 86,178 913,60 436,9 0,0086 0,09 0,04
C7H16 0,0003 114,232 1024,10 360,6 0,0343 0,31 0,11
1,0000 20,2498 406,19 787,69
Dengan harga
M = 20.2498 == 20.25
T = 200 OF.
Sifat Gas Alam 60
diperoleh 1 = 0.0123 Cp
Koreksi untuk 2,36 % mole N2 = 0.00023 Cp
Koreksi untuk 1.64 % C02 = 0,00010 Cp
Koreksi untuk 18.41 % H2S = 0.00040 Cp (ektrapolasi)
Jadi harga, 1 yang sudah dikoreksi
1 = 0.01230 + 0.00023 + 0.00010 + 0.00040 = 0. 0 1303 C p
Tr = (200 + 460) / 406.19 = 1.62
Pr = 2000 / 787.69 = 2.54
Harga Pr dan Tr, yang digunakan disini adalah harga-harga yang belum dikoreksi
Berdasarkan Gambar 8 diperoleh harga :
/1 = 1.28
Jadi = (1.28) (0.01303)
= 0.01668 Cp.
Sifat Gas Alam 61
Tabel 2
Sifat Gas Alam 62
Tabel 2 (lanjutan)
Sifat Gas Alam 63
Tabel 2 (lanjutan)
Sifat Gas Alam 64
2. Penentuan Entalpi
Tabulasi berikut ini mengambarkan urutan perhitungan untuk memperoleh harga
H(P,T) dengan menggunkan data yang sama seperti soal (1).
Prosedur penentuan harga dalam tabulasi adalah sebagai berikut:
1. Kolom (2) ditetentukan berdasarkan Tabel 3.
2. Penentuan H0 pada kolom (4) dengan satuan BTU/lb ditentukan berdasarkan
Gambar 28 dan 29. Khusus untuk nC6 dan C7+, H0 ditentukan berdasarkan
Gambar 30 dengan menggunakan spec. gravity C6 dan C7+ masing-masing 0,6640
dan 0,7070. Data ini diperoleh dari Tabel 3. Perhitungan H0 didasarkan pada T =
200 0F.
3. Kolom (5) diperoleh dengan mengalikan kolom (3) dengan kolom (4).
4. Kolom (6) diperoleh dari Tabel 3.
5. Kolom (7) diperoleh dari kolom (3) x (6)
6. Kolom (8) diperoleh dari kolom (3) x (5)
Jadi m = X i .i H m0 = X i H i0
= 0.0327 = 5379 BTU/lb mole
Kemudian tentukan
[(H0 - H)/RTc](0) = 1.1 dari Gambar 31.
dan
[(H0 - H)/RTc](') = - 0,04 dari Gambar 32.
Sifat Gas Alam 65
Penentuan Entalpi
1 2 3 4 5 6 7
Kompo- Berat Fraksi Ho,T 200 0F
.nen mol. mol. BTU/lb BTU/Ib.mole i X i i XiHo
Mi Xi
N2 28,013 0,0236 164,0 4594,1 0,0372 0,00088 108,4
C02 44,010 0,0164 118,0 5193,2 0,2667 0,00437 85,2
H2 S 34,076 0,1841 154,0 5247,7 0,0920 0,01694 966,1
CH4 1 6,043 0,7700 337,5 5414,5 0,0126 0,00970 4169,2
C2 H6 30,070 0,0042 227,5 6840,9 0,0978 0,00041 28,7
C3 H8 44,097 0,0005 197,5 8709,2 0,1541 0,00008 4,4
iC4Hl0 58,124 0,0003 187,5 10898,3 0,1840 0,0006 3,3
nC4H10 58,124 0,0003 197,5 11479,5 0,2015 0,0006 3,4
iC5H12 72,151 0,0001 187,5 13528,3 0,2286 0,0002 1,4
nC5H12 72,151 0,0001 195,0 14009,4 0,2524 0,0003 1,4
C6H14 86,178 0,0001 178(l) 15339,7 0,290 0, 0003 1,5
C7H16 + 114,232 0,1003 175(2) 19990,6 0,3981 0,0012 6,0
1,0000 0,03270 5379,0
berdasarkan Pr = 2,54 dan Tr = 1,62
(HO - H)m = 1,986 Tcm[ ((HO H) / RTc)(0) + m ((HO - H) / RTc)(') ]
= 1,986(406,19)[1,1 + 0,0327(-0,04)]
Sifat Gas Alam 66
Sifat Gas Alam 67
= 886,3 BTU/lb mole
Jadi H(P,T) = Hom - (Ho - H)m
= 53 79 - 886,3
= 4492,7 BTU/Ib mole
3. Penentuan Entropi (So)
Dengan menagunakan data gas seperti soal (1), maka sasaran pertama dalam perhitungan
adalah menentukan hargra entropi untuk gas yang ideal pada T 200 0F, berdasarkan
persamaan :
S0m = Xi Si0 1.986 X i ln X i
Harga penjumlahan Xi Si0 diperoleh dalam tabulasi berikut ini. Prosedur pengisian
kolom-kolom dari tabulasi penentuan entropi adalah sebagai berikut :
1. Kolom (4) diisi berdasarkan Gambar 35.
2. Harga Si0 untuk C6 dan C7+ ditentukan berdasarkan ekstrapolasi hubungan So vs.
M seperti terlihat pada Gambar 35. Hasil diperoleh dari gambar itu
So (C6) = 1, 18 BTU/Ib. OR
So (C7 +) = 1,06 BTU/Ib. OR
3. Kolom (5) = kolom (2) x kolom (4)
4. Kolom (6) = kolom (3) x kolom (5)
Sm0 = 51,5177 - 1,986 (-0,754) = 52,92 BTU/Ib mole OR
Langkah selanjutnya adalah menentukan
Sifat Gas Alam 68
Penentuan So
I
I~
1 2 3 4 5 6 7
O
Kom- Berat Fraksi Ho,T = 200 F xi Si0
ponen mol. mol. BTU/lbOR BTU/Ib. BTU/mol. R
0 Xi ln Xi
Mi Xi Mol.OR.
N2 28,013 0, 0236 1,68 47,06 1,1106 -0,0884
C02 44,010 0,0164 1,20 52,81 0,8661 -0,0674
H2 S 34,076 0,184 1,49 50,77 9,3468 -0,3115
C1 16, 043 0,7700 3,22 51,66 29,7782 -0,2013
C2 30,070 0,0042 2,09 62,85 0,2640 -0,0230
C3 44,097 0,0005 1,68 74,08 0,0370 -0,0038
iC4 58,124 0,0,003 1,46 84,86 0,0255 -0,0024
nC4 58,124 0,0003 1,39 80,79 0,0242 -0,0009
iC5 72,151 0,0001 1,32 95,24 0,0095 -0,0009
nC5 72,151 0,0001 1,30 93,8O 0,0093 -0,0010
C6 86,178 0,0001 1,18 101,69 0,0102 -0,0010
C7 + 114,232 0,0003 1,06 121,09 0,0363 -0,0024
1,000. -0,7054
[(So - S)/R](0) berdasarkan Gambar 36
dan
[(So - S)/R](1)
berdasarkan Gambar 37.
Sifat Gas Alam 69
Gambar 36
I
Sifat Gas Alam 70
Gambar 37
Sifat Gas Alam 71
Gambar 38
Sifat Gas Alam 72
Gambar 39
Sifat Gas Alam 73
Gambar 40
Sifat Gas Alam 74
Gambar 41
Sifat Gas Alam 75
Gambar 42
Sifat Gas Alam 76
untuk harga Pr = 2,54
Tr = 1,62
Hasilnya adalah sebagai berikut :
[(So - S)/R](0) = 0,52
[(So - S)/R](') = 0,075
dan
(S 0
) ((
) ) (0 )
(( ) )
(')
S m = 1.986 S0 S / R + S0 S / R + ln P
= 1,986( 0,52 + 0,0327 (0,075))
= 10,79 BTU/lb mole OR.
Jadi S(P,T) S = Sm0 -(So - S)m
= 52,92 - 10,79
= 42,13 BTU/Ib. mole OR
4. Penentuan Cp (P , T)
Contoh berikut ini masih menggunakan data komposisi gasbumi seperti soal (1)
Cp (P,T) = Cp ( 14,7, T) + Cp (Pr, Tr)
Ada dua cara menentukan harga Cp(14,7, T), yaitu
A. Menggunakan Gambar 33 bila diketahui g dan T.
Dari contoh yang digunakan berikut ini g = 0,699 dan T = 200 OF dan dengan
bantuan Gambar 33 diperoleh Cp(14,7, T) = 11,15 BTU/Ib. mole 0F.
B. Bila komposisi dari gas diketahui maka dengan bantuan Tabel 1 dapat dihitung
Cp(14,7, T) = Xi Cpi
Sifat Gas Alam 77
-
Komposi Fraksi mol. Cp, T = 200 OF Xi Cp
Xi BTU/Ib.mole oR
N2 0,0236 6,97 0,164
C02 0,0164 9,56 0,157
H2 S 0,1841 8,36 1,539
C1 0,7700 9,28 7,146
C2 0,0042 14,63 0,061
C3 0,0005 20,89 0,010
Komposisi Fraksi mol Cp, T = 200 OF Xi Cp
Xi BTU/lb.mole oR
iC4 0,0003 27,55 0,008
nC4 0,0003 27,59 0,008
iC5 0,0001 33,87 0,003
nC5 0,0001 33,99 0,003
nC6 0,0001 40,45 0,004
C7 + 0,0003 46,94* 0,014
Total seluruh = 9,12
(*) Digunakan harga Cp untuk C7.
Langkah berikutnya menentukan faktor koreksi Cp (Pr, Tr) dari Gambar 34. Dengan
diketahuinya Pr = 2,54 dan Tr = 1,62, maka diperoleh :
Cp = 2,90 BTU/Ib-mole OF.
Jadi :
Cp(P, T) =11,15 + 2.9 =14,05 BTU/lb mole 0F.
Sifat Gas Alam 78
Cp(P,T) = 11.15 + 2.9
= 14.05 BTU /b moleoF
Sifat Gas Alam 79
You might also like
- Sifat Gas AlamDocument79 pagesSifat Gas AlamAthaurrohman Alfaina ShidiqNo ratings yet
- SIFAT GAS ALAMDocument79 pagesSIFAT GAS ALAMAndre SuwandiNo ratings yet
- Teknik Eksploitasi Gas Bumi (Materi Kuliah)Document262 pagesTeknik Eksploitasi Gas Bumi (Materi Kuliah)Kyosuke HilmiNo ratings yet
- 3.teknik Eksploitasi Gas Bumi (Materi Kuliah)Document261 pages3.teknik Eksploitasi Gas Bumi (Materi Kuliah)Tunjung Wicaksana Ranukusuma50% (2)
- Matrikulasi Teknik Reservoir Lanjutan - Raka Fajar NugrohoDocument10 pagesMatrikulasi Teknik Reservoir Lanjutan - Raka Fajar NugrohoRaka NugrohoNo ratings yet
- Sifat Fisik GasDocument5 pagesSifat Fisik GasAndy SuhermanNo ratings yet
- 2Document22 pages2amangsakkaNo ratings yet
- Gas IdealDocument49 pagesGas IdealNurjannahNo ratings yet
- Penentuan Sifat Fisik GasDocument15 pagesPenentuan Sifat Fisik GasRomi Rarasta Romuzon100% (2)
- Yudha AfrDocument3 pagesYudha AfrDanny ChandraNo ratings yet
- KAMPURAN GASDocument47 pagesKAMPURAN GASerlanggaaa23No ratings yet
- Keadaan GasDocument7 pagesKeadaan GasAbdullah Ibnu Ma'sumNo ratings yet
- Bab Iv Persamaan KeadaanDocument16 pagesBab Iv Persamaan KeadaanFakhrur RaziNo ratings yet
- Pertemuan 4 Modul 4 Persamaan KeadaanDocument6 pagesPertemuan 4 Modul 4 Persamaan KeadaanAbdullah TeluNo ratings yet
- Resume Kimia Dasar IDocument60 pagesResume Kimia Dasar IMUHAMMAD RAMLINo ratings yet
- Gas NyataDocument10 pagesGas NyataFianti DamayantiNo ratings yet
- Chapter 3 - Group 5Document9 pagesChapter 3 - Group 5Rahdatul NajmiNo ratings yet
- Kelompok 4a Indralaya - PPT Tugas 3 Termodinamika DasarDocument56 pagesKelompok 4a Indralaya - PPT Tugas 3 Termodinamika DasarM.rangga PerdanaNo ratings yet
- 04-02 KOMPRESOR SENTRIFUGAL (Performnace2-Sifat-sifat Gas-12 HLM 4-15) NewDocument12 pages04-02 KOMPRESOR SENTRIFUGAL (Performnace2-Sifat-sifat Gas-12 HLM 4-15) NewSeptia DamayantiNo ratings yet
- Gas IdealDocument6 pagesGas IdealRamadhanuu DirjaaNo ratings yet
- Kesetimbangan KimiaDocument7 pagesKesetimbangan KimiaMade SuarNo ratings yet
- Persamaan Keadaan Gas Ideal dan NyataDocument13 pagesPersamaan Keadaan Gas Ideal dan Nyatamella karlinaNo ratings yet
- Sifat GasDocument151 pagesSifat GasRaihan PutriNo ratings yet
- Tugas Terstruktur 1-6Document31 pagesTugas Terstruktur 1-6RismawardiNo ratings yet
- Termodinamika LanjutDocument19 pagesTermodinamika Lanjutanggi harahapNo ratings yet
- CP-1 Fasa TunggalDocument22 pagesCP-1 Fasa TunggalJery TumanggorNo ratings yet
- CP-1 Fasa TunggalDocument22 pagesCP-1 Fasa TunggalHotmauli AruanNo ratings yet
- Teknik Eksploitasi Gas Bumi (Materi Kuliah)Document182 pagesTeknik Eksploitasi Gas Bumi (Materi Kuliah)Afnan Mukhtar Syauqi0% (2)
- Teknik Eksploitasi Gas Bumi Materi KuliahDocument182 pagesTeknik Eksploitasi Gas Bumi Materi KuliahPray YogiNo ratings yet
- SIFAT GAS BUMIDocument151 pagesSIFAT GAS BUMImerlinNo ratings yet
- Efek PanasDocument16 pagesEfek Panasclaudia50% (2)
- 1 Gas - PropertiesDocument31 pages1 Gas - PropertiesKyosuke HilmiNo ratings yet
- Sistem Fasa Tunggal - 1Document22 pagesSistem Fasa Tunggal - 121-096 Kharisma Theresia Adelina ButarButarNo ratings yet
- Week 2.gas NyataDocument4 pagesWeek 2.gas NyataAndro SihombingNo ratings yet
- Hand Out Kimia Fisika IDocument58 pagesHand Out Kimia Fisika IEvan Afrista Wiokartina PurbaNo ratings yet
- Termodinamika - Teknik - B2. Zat Murni PDFDocument8 pagesTermodinamika - Teknik - B2. Zat Murni PDFAhmad Husain HasbullahNo ratings yet
- Laporan Termod KLMPK 2Document10 pagesLaporan Termod KLMPK 2Wahid AsharyNo ratings yet
- Farmasi Fisika IDocument25 pagesFarmasi Fisika IuciNo ratings yet
- Tugas Termo1Document10 pagesTugas Termo1Yuhdian HazNo ratings yet
- Gas NyataDocument10 pagesGas NyataYusuf EfendiNo ratings yet
- TEORI GAS DAN KINETIK GASDocument24 pagesTEORI GAS DAN KINETIK GASBAHRUNNo ratings yet
- Makalah Kimfis Gas 1Document7 pagesMakalah Kimfis Gas 1Sicilya Ruth YudhikaNo ratings yet
- Gas Ideal dan Hukum-hukumnyaDocument13 pagesGas Ideal dan Hukum-hukumnyamisranasrof9No ratings yet
- Kuliah1 Kimia FisikDocument37 pagesKuliah1 Kimia FisikFariz IzzanNo ratings yet
- 3.diagram Fasa Gas AlamDocument17 pages3.diagram Fasa Gas AlamtizeskiNo ratings yet
- Bab 2 AjgDocument36 pagesBab 2 AjgMatsna Az ZahraNo ratings yet
- BAB I Gas Dan SifatnyaDocument30 pagesBAB I Gas Dan Sifatnyaanisatulfirdaus100% (1)
- 0212075901-22-MSN 212-2013-Kw3a-03-Pertemuan 3 Properti Zat Murni Dan Karakteristik Gas IdealDocument6 pages0212075901-22-MSN 212-2013-Kw3a-03-Pertemuan 3 Properti Zat Murni Dan Karakteristik Gas IdealpermonoNo ratings yet
- Kimia Fisik I: Gas Ideal dan Gas NyataDocument42 pagesKimia Fisik I: Gas Ideal dan Gas NyataGalang LNo ratings yet
- KURVA GAS IDEALDocument127 pagesKURVA GAS IDEALIndahLestariNo ratings yet
- KF 1Document128 pagesKF 1Winda Regita Pratiwi100% (1)
- Gas IdealDocument128 pagesGas IdealDona PermataAyuNo ratings yet
- Gas Dan Sifat-SifatnyaDocument38 pagesGas Dan Sifat-SifatnyaウィーヤNo ratings yet
- KIMIA DASARDocument10 pagesKIMIA DASARCastielloNo ratings yet
- TERMODINAMIKADocument18 pagesTERMODINAMIKAFitri handayaniNo ratings yet
- Untuk Apa Kau Habiskan HidupmuDocument1 pageUntuk Apa Kau Habiskan HidupmuFomalhaut AdityaNo ratings yet
- GH Flow AssuranceDocument8 pagesGH Flow AssuranceFomalhaut AdityaNo ratings yet
- 2014-2-00084-TI Bab2001Document10 pages2014-2-00084-TI Bab2001Fomalhaut AdityaNo ratings yet
- Sand Exclusion TypeDocument1 pageSand Exclusion TypeFomalhaut AdityaNo ratings yet
- Document 1Document1 pageDocument 1softyputriadsuraNo ratings yet
- Para Perampok ProfessionalDocument1 pagePara Perampok ProfessionalFomalhaut AdityaNo ratings yet
- DistribusiDocument9 pagesDistribusiYusva SofianNo ratings yet
- dokumen tentang rumus kimia, mol, dan stoikiometriDocument57 pagesdokumen tentang rumus kimia, mol, dan stoikiometriFomalhaut Aditya0% (1)
- Permen ESDM Nomor 08 Tahun 2017Document21 pagesPermen ESDM Nomor 08 Tahun 2017JujupNo ratings yet
- Eksplorasi Abiogenic OilDocument6 pagesEksplorasi Abiogenic OilFomalhaut AdityaNo ratings yet
- Permen ESDM Nomor 08 Tahun 2017Document21 pagesPermen ESDM Nomor 08 Tahun 2017JujupNo ratings yet
- 2.stoikiometri IIDocument44 pages2.stoikiometri IIFomalhaut AdityaNo ratings yet
- 02 - Syaiful Bachri PDFDocument10 pages02 - Syaiful Bachri PDFDelita PuteriNo ratings yet
- COVERDocument1 pageCOVERFomalhaut AdityaNo ratings yet
- BOP SYSTEMDocument16 pagesBOP SYSTEMFomalhaut AdityaNo ratings yet
- Mat BalDocument26 pagesMat BalFomalhaut AdityaNo ratings yet
- Semen PemboranDocument26 pagesSemen PemboranFomalhaut AdityaNo ratings yet
- Isi pdf-120115141849Document16 pagesIsi pdf-120115141849Yosep PermanaNo ratings yet
- Isi pdf-120115141849Document16 pagesIsi pdf-120115141849Yosep PermanaNo ratings yet
- Tek. Lepas Pantai PendahuluanDocument26 pagesTek. Lepas Pantai PendahuluanFomalhaut AdityaNo ratings yet
- Mat BalDocument26 pagesMat BalFomalhaut AdityaNo ratings yet
- Flow Diagram Alir ProduksiDocument2 pagesFlow Diagram Alir ProduksiFomalhaut AdityaNo ratings yet
- One Day Course - Geologi PDFDocument43 pagesOne Day Course - Geologi PDFFomalhaut AdityaNo ratings yet
- Bab Vii Sistem PenyemenanDocument21 pagesBab Vii Sistem Penyemenansetyawan_m_heeryNo ratings yet
- One Day Course - Geologi PDFDocument43 pagesOne Day Course - Geologi PDFFomalhaut AdityaNo ratings yet
- 04 Tek. Lepas Pantai Operasi PembangunanDocument33 pages04 Tek. Lepas Pantai Operasi PembangunanFomalhaut AdityaNo ratings yet
- Mat BalDocument26 pagesMat BalFomalhaut AdityaNo ratings yet
- Kumpulan Soal Ujian Komprehensif TM 2007Document55 pagesKumpulan Soal Ujian Komprehensif TM 2007onibaliz100% (4)