Professional Documents
Culture Documents
Previo Electrolisis
Uploaded by
Diana MoedanoOriginal Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Previo Electrolisis
Uploaded by
Diana MoedanoCopyright:
Available Formats
Previo No.
1: Electrolisis
Moedano Prez Diana Laura, Balderas Gutirrez Axel Alejandro.
1. Buscar el uso de los siguientes instrumentos que se utilizarn en la
actividad experimental: ampermetro, voltmetro, fuente de poder y el
valor de la constante de Faraday.
Ampermetro: Es utilizado para mediciones de corriente elctrica siendo el
instrumento ms adecuado y usado en la industria.
Voltmetro: Es utilizado para mediciones de diferencias de potencial entre dos
puntos.
Fuente de poder: Es utilizada para transformar la corriente alterna en corriente
continua, adems regula o cambia la diferencia de potencial (tensin) de salida.
Valor de la constante de Faraday
La constante de Faraday es la cantidad de carga elctrica que hay en un mol de
electrones. Surge de la multiplicacin de nmero de Avogadro por la carga
elctrica del electrn:
F=6,0221023 molculas-1 x 1.6021019 culombios= 96484.5561 C/mol
La constante de Faraday es utilizada para determinar cantidades de metales que
pueden descomponerse en una reaccin electroqumica, en donde se utiliza una
determinada cantidad de corriente en cierto tiempo.
Teniendo en cuenta el valor de la constante de Faraday, tambin se puede
calcular la cantidad de electricidad requerida para depositar una determinada
cantidad de metal.
2. En qu posicin debern colocarse el ampermetro y el voltmetro para
hacer las determinaciones adecuadas en el circuito?
Es necesario conectarlo en serie con el circuito
Se debe tener un aproximado de corriente a medir ya que si es mayor de
la escala del ampermetro, lo puede daar. Por lo tanto, la corriente debe
ser menor de la escala del ampermetro.
Cada instrumento tiene marcado la posicin en que se debe utilizar:
horizontal, vertical o inclinada. Si no se siguen estas reglas, las medidas
no seran del todo confiables y se puede daar el eje que soporta la
aguja.
Todo instrumento debe ser inicialmente ajustado en cero.
Las lecturas tienden a ser ms exactas cuando las medidas que se
toman estn intermedias a escala del instrumento.
Nunca se debe conectar un ampermetro con un circuito que este
energizado.
Uso del voltmetro:
Para efectuar la medida de la diferencia de potencial el voltmetro ha de
colocarse en paralelo; esto es, en derivacin sobre los puntos entre los que
tratamos de efectuar la medida. Esto nos lleva a que el voltmetro debe poseer
una resistencia interna lo ms alta posible, a fin de que no produzca un consumo
apreciable, lo que dara lugar a una medida errnea de la tensin.
3. Electroqumicamente, qu nombre recibe cada electrodo y qu
reaccin ocurre en cada uno de ellos.
4. Cmo se espera que sea la variacin de la intensidad de corriente al
aumentar el voltaje? Explicar si este comportamiento tiene relacin
con la ley de Ohm o con el fenmeno de migracin inica.
Se relaciona con la ley de Ohm, esta ley se enuncia de la siguiente forma:
La intensidad que circula por un circuito vara en forma directamente
proporcional a la variacin del voltaje, y en forma inversamente proporcional a la
variacin de la resistencia
De este enunciado se deduce, que cuando aumenta o disminuye el voltaje,
aumenta o disminuye igualmente la intensidad de corriente en la misma
proporcin. Por su parte, cuando lo que aumenta o disminuye es la resistencia,
entonces la intensidad de corriente tambin lo hace proporcionalmente, pero a
la inversa.
5. Explicar ampliamente en que consiste la electrlisis as como su
relacin con el nmero de Avogadro y la carga del electrn.
Electrolisis
La electrolisis puede definirse como un proceso en el que el paso de la
corriente elctrica a travs de una disolucin o a travs de un electrolito
fundido, da como resultado una reaccin de xido-reduccin, no espontnea.
En la disolucin el movimiento de los iones positivos y negativos forma la
conductividad inica, tambin llamada electroltica, esta se trata de la
conductividad propia de los electrolitos.
Esta se lleva a cabo en celdas electrolticas que contiene la disolucin y en
la cual se sumergen los electrodos, ambos conectados a una fuente de
corriente continua para que la celda reciba electrones.
Los electrodos son las placas donde tienen lugar las semirreacciones redox.
En los electrodos puede distinguirse un ctodo y un nodo.
nodo: electrodo en el cual se produce la oxidacin, ste va conectado al
polo positivo de la fuente de corriente.
Ctodo: electrodo donde se produce la reduccin, ste se conecta al polo
negativo de la fuente de corriente.
La relacin que guarda con el nmero de Avogadro y la carga del
electrn estn ligados directamente con las Leyes de Faraday y su
constante:
Donde nos explica que la descomposicin de una sustancia qumica es
directamente proporcional a la cantidad de energa elctrica que pasa por el
sistema, y que un Faraday descompone o deposita un equivalente de
sustancia.
La constante de Faraday es necesaria para determinar la masa de la
sustancia qumica y la corriente elctrica que pasa por el sistema, esta a su
vez relaciona los conceptos del nmero de Avogadro y la carga del electrn,
puesto que la constante de Faraday determina la cantidad de carga elctrica
que hay en un mol de electrones. Y se obtiene por el producto del nmero de
Avogadro y la carga elctrica del electrn:
F=6,0221023 molculas-1 x 1.6021019 culombios= 96484.5561 C/mol
6. Escriba las leyes de Faraday.
1. La descomposicin de una sustancia qumica es directamente
proporcional a la cantidad de energa elctrica que pasa por el sistema.
2. Un Faraday descompone o deposita un equivalente de sustancia.
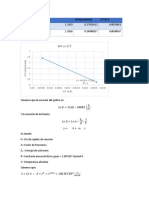
8. Diagrama de flujo del experimento.
You might also like
- Previo 1 RealDocument7 pagesPrevio 1 RealAreli CervantesNo ratings yet
- Previo5 SecciónB Lista7Document8 pagesPrevio5 SecciónB Lista7Kevin CalzadaNo ratings yet
- Reporte 3 Electroquímica y CorrosiónDocument12 pagesReporte 3 Electroquímica y CorrosiónJahir Monroy CamareroNo ratings yet
- Eq1 - Reporte 5 Celdas Electroquímicas - FQ4Document10 pagesEq1 - Reporte 5 Celdas Electroquímicas - FQ4Andrew WilliamsNo ratings yet
- Reporte3. Conductividad de ElectrolítosDocument10 pagesReporte3. Conductividad de Electrolítosluis100% (1)
- Informe 6 - CorrosionDocument9 pagesInforme 6 - CorrosionYeremi Teotl HuayNo ratings yet
- Previo 4Document7 pagesPrevio 4Marco GonzalezNo ratings yet
- Propiedades Coligativas - InformeDocument7 pagesPropiedades Coligativas - InformeDavid G. CalderónNo ratings yet
- Previo 3 Fico 4Document8 pagesPrevio 3 Fico 4Omar AlexNo ratings yet
- Reporte 5 - Entalpia de FusionDocument5 pagesReporte 5 - Entalpia de FusionUriel RamosNo ratings yet
- Previo Experimental No 10Document6 pagesPrevio Experimental No 10Nicib MendozaNo ratings yet
- Informe 1 Laboratorio de ElectroquímicaDocument7 pagesInforme 1 Laboratorio de ElectroquímicaVictor Manuel Mozo MartinezNo ratings yet
- Previo 2. Cin Tica de La Reacci N Reloj de Yodo Con Persulfato 1 PDFDocument12 pagesPrevio 2. Cin Tica de La Reacci N Reloj de Yodo Con Persulfato 1 PDFJazmín Pineda GarcíaNo ratings yet
- Previo 2 CQDocument5 pagesPrevio 2 CQjonathan H.No ratings yet
- Previo 2Document7 pagesPrevio 2Marco GonzalezNo ratings yet
- Entalpia de EbullicionDocument6 pagesEntalpia de EbullicionFrancisco Javier Arteaga ManriquezNo ratings yet
- Previo 7 EqcDocument7 pagesPrevio 7 EqcDanGodAlvNo ratings yet
- Reporte 2 ColoidesDocument9 pagesReporte 2 ColoidesLadii Reyes RodriguezNo ratings yet
- Reporte 6 Electro y CorrosiónDocument9 pagesReporte 6 Electro y CorrosiónMariana Alexandra Martínez MárquezNo ratings yet
- Previo 2. Factor FricciónDocument5 pagesPrevio 2. Factor FricciónAxl MachadoNo ratings yet
- Reporte EQC 5Document9 pagesReporte EQC 5Zaira RicoNo ratings yet
- Previo 3 Electro y CorrosiónDocument9 pagesPrevio 3 Electro y CorrosiónMariana Alexandra Martínez MárquezNo ratings yet
- Conductividad de ElectrolitosDocument9 pagesConductividad de ElectrolitosJosé Emilio GómezNo ratings yet
- Informe Efecto de La Temperatura en La Tensión SuperficialDocument17 pagesInforme Efecto de La Temperatura en La Tensión SuperficialBeto RiveraNo ratings yet
- Previo Coloides 1Document2 pagesPrevio Coloides 1victorNo ratings yet
- Reporte 2 Fisicoquimica y ColoidesDocument11 pagesReporte 2 Fisicoquimica y ColoidesVictor PerezNo ratings yet
- Determinación Del Exceso de Soluto SuperficialDocument3 pagesDeterminación Del Exceso de Soluto SuperficialDaniela GarcíaNo ratings yet
- Previo 5Document9 pagesPrevio 5Marco GonzalezNo ratings yet
- Propiedades Termodinamicas de Una CeldaDocument9 pagesPropiedades Termodinamicas de Una CeldaAldo Ilyan Perez Mendez100% (1)
- Yodacion Catalitica InformeeeDocument12 pagesYodacion Catalitica InformeeeDavid Ramirez TorresNo ratings yet
- Reporte 4Document7 pagesReporte 4juan islasNo ratings yet
- Previo 4 de Electroquimica y CorrosiónDocument10 pagesPrevio 4 de Electroquimica y CorrosiónMariana Alexandra Martínez MárquezNo ratings yet
- Reporte 1. Cinética Química y CatálisisDocument10 pagesReporte 1. Cinética Química y CatálisisDaniel PérezNo ratings yet
- Entalpia de EbulliciónDocument7 pagesEntalpia de EbulliciónAragón Ricardo0% (1)
- R3 LEMIV Relleno de ColumnasDocument13 pagesR3 LEMIV Relleno de ColumnasJessica Hernández100% (3)
- Informe de Corrosion Practica 3Document15 pagesInforme de Corrosion Practica 3Sergio Armando Resendiz0% (1)
- Previo 4 Celdas ElectroquímicasDocument5 pagesPrevio 4 Celdas ElectroquímicasKaren Elí Quiroz100% (1)
- Reporte 4 - Celdas ElectroquimicasDocument12 pagesReporte 4 - Celdas ElectroquimicasJimmy Daniel Balderas ContrerasNo ratings yet
- Previo 2Document7 pagesPrevio 2DanGodAlvNo ratings yet
- Previo Practica 3-OrganicaDocument5 pagesPrevio Practica 3-OrganicaAngélic Vallejo de HoranNo ratings yet
- Practica 1 ManitolreporteloctefinalDocument15 pagesPractica 1 ManitolreporteloctefinalAylin montañoNo ratings yet
- Previo 5 Banco de Intercambiadores de CalorDocument4 pagesPrevio 5 Banco de Intercambiadores de CalorAlejandro Rojo LuqueñoNo ratings yet
- Previo 1Document14 pagesPrevio 1Cinthya Yolotzin KinmyNo ratings yet
- Leyes de La ElectrolisisDocument10 pagesLeyes de La ElectrolisisBrenda KarenNo ratings yet
- Previo 2 Conductividad de ElectrolitosDocument7 pagesPrevio 2 Conductividad de ElectrolitosGael VizcainoNo ratings yet
- Electroquimica InformeDocument13 pagesElectroquimica InformeUlises Ramírez MatheyNo ratings yet
- Fqf6 Determinación de La Energía Libre Estandar de MicelizaciónDocument2 pagesFqf6 Determinación de La Energía Libre Estandar de MicelizaciónMarilin Vásquez67% (3)
- Extracción Selectiva (Previo)Document10 pagesExtracción Selectiva (Previo)Edgar ArmandoNo ratings yet
- Reporte 2 Electroquímica y CorrosiónDocument11 pagesReporte 2 Electroquímica y CorrosiónJahir Monroy CamareroNo ratings yet
- Previo de Celdas Electroquímicas 1Document4 pagesPrevio de Celdas Electroquímicas 1VaniaL8No ratings yet
- Reporte Practica 7.corrosionDocument8 pagesReporte Practica 7.corrosionEdgar Armando75% (4)
- Analitica III Previo Practica 2 ElectrodeposicionDocument5 pagesAnalitica III Previo Practica 2 ElectrodeposicionrereNo ratings yet
- Previo 10 Organica 1Document33 pagesPrevio 10 Organica 1Brenda KarenNo ratings yet
- Practica 5 Optica Geometrica (I)Document9 pagesPractica 5 Optica Geometrica (I)Marcos RodrigoNo ratings yet
- Serie 1 Problemas FQSyC - Cortés - CabañasDocument11 pagesSerie 1 Problemas FQSyC - Cortés - CabañasRaúl Jair Cortés CabañasNo ratings yet
- Previo 2 RecristalizaciónDocument7 pagesPrevio 2 RecristalizaciónNaty TitiNo ratings yet
- Previo 1 LEM IVDocument8 pagesPrevio 1 LEM IVDavid UribeNo ratings yet
- Previo 1 ElectroquimicaDocument16 pagesPrevio 1 ElectroquimicaMariana Alexandra Martínez MárquezNo ratings yet
- Fisicoquimica PREVIODocument2 pagesFisicoquimica PREVIOleonNo ratings yet
- Ley de Ohm y La ResistividadDocument15 pagesLey de Ohm y La ResistividadLUIS HENRRY CRUZ AGUILARNo ratings yet
- Curvas de SecadoDocument6 pagesCurvas de SecadoDiana MoedanoNo ratings yet
- Previo Secador Rotatorio-Diana Laura Moedano PérezDocument7 pagesPrevio Secador Rotatorio-Diana Laura Moedano PérezDiana MoedanoNo ratings yet
- Tercer Examen ReactquimhomDocument3 pagesTercer Examen ReactquimhomDiana MoedanoNo ratings yet
- Solucion Del Examen PDFDocument5 pagesSolucion Del Examen PDFDiana MoedanoNo ratings yet
- FerrostalDocument33 pagesFerrostalDiana MoedanoNo ratings yet
- ConclusionesDocument2 pagesConclusionesDiana MoedanoNo ratings yet
- LN KDocument2 pagesLN KDiana MoedanoNo ratings yet
- BenzofenonaDocument6 pagesBenzofenonaDiana MoedanoNo ratings yet
- Publicidad Subliminal en Nuestros TiemposDocument9 pagesPublicidad Subliminal en Nuestros TiemposDiana MoedanoNo ratings yet
- P6EQ7Document8 pagesP6EQ7Ybonhe Ahava Ezmer100% (1)
- 338260846Document10 pages338260846Diana MoedanoNo ratings yet
- Carlos Infome Labo 2Document15 pagesCarlos Infome Labo 2Diana Moedano0% (1)
- Recuperación Del Magnetrón en Hornos de MicroondasDocument25 pagesRecuperación Del Magnetrón en Hornos de MicroondasRICHIHOTS2No ratings yet
- Capitulo 05 Teoria MicroondasDocument84 pagesCapitulo 05 Teoria MicroondasPxndx 007No ratings yet
- Introducción A La RadiologíaDocument107 pagesIntroducción A La RadiologíaKaren FrancoNo ratings yet
- Medidor de Oxigeno MAxtec MaxO2 PlusDocument10 pagesMedidor de Oxigeno MAxtec MaxO2 PlusDuban GuerreroNo ratings yet
- Prácticas de Quimica Basica Qui-014Document37 pagesPrácticas de Quimica Basica Qui-014Stewart Henry Acevedo Henriquez0% (1)
- Celdas GalvanicasDocument24 pagesCeldas GalvanicasMario Farfan88% (8)
- Ejercicios de TSQuímica II - B2Document4 pagesEjercicios de TSQuímica II - B2Ulises GuerreroNo ratings yet
- Seguridad Den La Fabricacion de HornosDocument9 pagesSeguridad Den La Fabricacion de HornosAlvaro RojasNo ratings yet
- Electrodeposicion de CuDocument14 pagesElectrodeposicion de CuRichardSaavedra100% (22)
- Electronica Recreativa - E SedovDocument311 pagesElectronica Recreativa - E Sedovrataburguer100% (1)
- 0018981Document359 pages0018981Jose TrianoNo ratings yet
- Seguridad Eléctrica Tarea 2Document4 pagesSeguridad Eléctrica Tarea 2OznEnriqueMedinaDíazNo ratings yet
- Arduino Lession 1Document43 pagesArduino Lession 1Jailin Reales contrerasNo ratings yet
- Trabajo MetalurgiaDocument45 pagesTrabajo MetalurgiaAlmacén AndrewNo ratings yet
- Celda ElectroliticaDocument7 pagesCelda Electroliticaedgar yadhir perez hernandezNo ratings yet
- (RX) Martino AnaliaDocument57 pages(RX) Martino AnaliamariNo ratings yet
- Electrólisis para La Recuperación de Oro-1Document7 pagesElectrólisis para La Recuperación de Oro-1Jorge Jhonatan López CamposNo ratings yet
- Consolidado Final Fundamentos de QuimicaDocument16 pagesConsolidado Final Fundamentos de QuimicaDaniel Baena RodriguezNo ratings yet
- Previo 4Document5 pagesPrevio 4Karen DlCcNo ratings yet
- Tecnicas y Teorias Infraestructura ComunicacionesDocument104 pagesTecnicas y Teorias Infraestructura Comunicacionesroberto carlos anguloNo ratings yet
- Unidad 1Document71 pagesUnidad 1MailènNo ratings yet
- 4ta Rev 14-02-23 FinDocument85 pages4ta Rev 14-02-23 FinCarmela EspinosaNo ratings yet
- NCh2348 1998Document29 pagesNCh2348 1998Guillermo AriasNo ratings yet
- PDF Electroobtencion de Oro y PlataDocument75 pagesPDF Electroobtencion de Oro y Platakcontreras_79309No ratings yet
- (Extra) Tema 3. Redox 2000-2009 PDFDocument81 pages(Extra) Tema 3. Redox 2000-2009 PDFjoseluNo ratings yet
- Introducción A La RadiologíaDocument16 pagesIntroducción A La RadiologíaJoshua Sarmiento MendietaNo ratings yet
- Trabajo de Investigación Conociendo La Pilas y BateriasDocument5 pagesTrabajo de Investigación Conociendo La Pilas y BateriasDhana Sofia Cordova SerafinNo ratings yet
- Temas Selectos de Química 2 ResumenDocument23 pagesTemas Selectos de Química 2 ResumenMiguel Angel López Navarrete100% (1)
- Texto 9Document28 pagesTexto 9Pedro MartinezNo ratings yet
- Practica N°6 QuimicaDocument12 pagesPractica N°6 QuimicaAbel TapuyoNo ratings yet