Professional Documents
Culture Documents
Demanda de Cloro
Uploaded by
Ferrer CelestinoCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Demanda de Cloro
Uploaded by
Ferrer CelestinoCopyright:
Available Formats
Laboratorio de Ingenier´ıa
Ambiental
Qu´ım. Ma. Teresa Moran y
Moran
Ing. Leticia Espinosa Marvan
Pr´actica 10: Demanda de Cloro y Cloro
Residual
Traba jo
Prelaboratorio Francisco
Jos´e Guerra Millan Adelwart
Struck Garza
Santiago Andr´es Villalobos Steta
M´exico D.F., 27 de octubre de 2008.
Pr´actica 10: Demanda de Cloro y Cloro
Residual
Traba jo Prelaboratorio
1. Explicar qu´e se entiende por demanda de cloro en el agua.
Explicar qu´e compuestos podr´ıan generar una demanda de cloro
en el agua.
¿Qu´e compuestos forman el cloro libre y el cloro combinado? ¿Cu
´al es la importancia de su presencia?
La demanda de cloro se define como la diferencia entre la cantidad de cloro
aplicada al agua y la cantidad de cloro libre residual, combinado residual o total
resultante al final de un espec´ıfico per´ıodo de contacto.
Las diferentes sustancias presentes en el agua, como lo es la materia org
´anica y otros contaminantes, influyen en la demanda de cloro y complican el
uso de cloro para la desinfeccion. Por ello es necesario agregar suficiente cloro
no s´olo para destruir organismos, sino tambi´en para compensar el cloro
consumido por esas sustancias.
La demanda de cloro se debe a la gran variedad de reacciones entre el cloro
F. J. Guerra, A. Struck, S. A. Villalobos 1
activo y los compuestos presentes en el agua y tambi´en en algunas
circunstan- cias a su propia descomposici´on.
Estas reacciones se puede agrupar del siguiente modo:
1. Las provocadas por la radiaci´on solar
F. J. Guerra, A. Struck, S. A. Villalobos 2
Universidad Iberoamericana Laboratorio de Ingenier´ıa Ambiental, Oton˜o
2008
2. Las que se producen entre el cloro activo y los compuestos inorg´anicos
3. Las reacciones del cloro activo con el amoniaco y el nitrogeno org´anico
4. Las producidas entre el cloro activo y los compuestos org´anicos
El cloro presente en el agua se aglutina con las bacterias, dejando s´olo
una parte de la cantidad original (cloro libre) para continuar su acci´on
desinfectante. Si el nivel de cloro libre no es el que corresponde al pH, el agua
tendr´a un olor y sabor desagradables y el potencial desinfectante del cloro se
ver´a disminuido.
El cloro libre reacciona con los iones de amoniaco y compuestos org
´anicos hasta formar compuestos de cloro que dan como resultado una
disminucion de su capacidad desinfectante si la comparamos con el cloro libre.
Los compuestos de cloro junto con las cloraminas forman el cloro combinado.
El conjunto de cloro combinado y cloro libre da como resultado el cloro total.
Mientras que el cloro libre tiene un potencial desinfectante superior, el cloro
combinado tiene una mayor estabilidad y una menor volatilidad.
2. ¿Como es una curva de cloro residual? ¿Qu´e significa el punto de
ruptura en esta curva? ¿Por qu´e debe rebasarse este punto en la
do- sificacion del cloro?
La Figura 1 muestra de forma ilustrativa la tendencia de una curva de cloro
residual.
El punto de ruptura (“Breakpoint” en la Figura 1) es cuando se llega a un
punto en donde todo el amonio presente se oxida llegando a cloro residual. Es-
to aplica generalmente para la desinfecci´on del agua, pero tambi´en sirve
para controlar el olor y el sabor. Para llegar al punto de ruptura se aplica una
super cloracion, lo que implica concentraciones de cloro que excedan 1 mg/L.
La importancia de rebasar este punto radica en la obtenci´on de cloro
libre para tener una mejor desinfeccion, siempre y cuando haya amoniaco en el
agua. El cloro libre tiene una gran capacidad desinfectante pero se disipa
rapidamente. Es por ello que se usa un tratamiento final con amoniaco para
convertir el cloro libre a cloro combinado, el cual tiene un tiempo de vida
mucho m´as elevado.
3. ¿Qu´e son los trihalometanos? ¿Como se generan y porque es
inde- seable su presencia en el agua potable?
Los trihalometanos (THMs) son compuestos qu´ımicos vol´atiles que se
gene- ran durante el proceso de potabilizaci´on del agua por la reacci´on de la
materia organica, au´n no tratada, con el cloro utilizado para desinfectar. En
esta reac- cion se reemplazan tres de los cuatro atomos de hidrogeno del
F. J. Guerra, A. Struck, S. A. Villalobos 3
Universidad Iberoamericana Laboratorio de Ingenier´ıa Ambiental, Oton˜o
metano (CH4 ) 2008
F. J. Guerra, A. Struck, S. A. Villalobos 4
Universidad Iberoamericana Laboratorio de Ingenier´ıa Ambiental, Oton˜o
2008
Figura 1: Curva de cloro residual.
por atomos halogenos.
Muchos trihalometanos son considerados peligrosos para la salud y el me-
dio ambiente e incluso carcinogenos. La normativa de la Comunidad Europea
establece que no se deben superar los cien microgramos de trihalometanos por
litro de agua para el consumo. No obstante, algunos se utilizan en la industria
como disolventes o refrigerantes. La Figura 2 muestra algunos de los THMs m
´as comunes.
4. ¿Cu´ales otros m´etodos de desinfeccion existen? ¿Qu´e venta
jas y desventa jas presentan cada uno de estos m´etodos?
Entre los m´etodos para desinfecci´on del agua m´as habituales se
encuentran el cloro, las cloraminas, el ozono, la radiaci´on ultravioleta y el
carb´on activado.
Cloraminas: Las cloraminas son un tipo de aminas org´anicas que se
producen cuando el amoniaco y el cloro (en forma de acido hipocloroso)
reaccionan entre s´ı. Cada vez se emplea mas la cloramina en lugar del cloro
en las plantas de tratamiento de agua, debido a que la cloramina es mucho
m´as estable y no desaparece del agua asegurando la desinfecci´on hasta el
momento en que el agua llega al consumidor. En el tratamiento del agua con
cloramina, se forma monocloramina (NH2 Cl) al an˜adir cloro y amoniaco
bajo ciertas condiciones. En el tratamiento del agua con cloro, los
F. J. Guerra, A. Struck, S. A. Villalobos 5
Universidad Iberoamericana Laboratorio de Ingenier´ıa Ambiental, Oton˜o
subproductos de desinfecci´on que se2008
F. J. Guerra, A. Struck, S. A. Villalobos 6
Universidad Iberoamericana Laboratorio de Ingenier´ıa Ambiental, Oton˜o
2008
Figura 2: Tabla de trihalometanos comunes (ordenados por peso molecular).
forman son una combinacion de cloraminas inorg´anicas, a la que tambi´en
se llama residuos combinados de cloro. En el aire, las cloraminas son un
fuerte irritante respiratorio.
Ozono: El ozono es una mol´ecula de car´acter oxidante formada por tres
ato- mos de ox´ıgeno. Su uso se ha ido generalizando con el paso del tiempo
en la desinfeccion de aguas, area donde muestra gran eficacia. Sus principales
venta- jas son que no deja residuos qu´ımicos y no confiere aromas u olores
particulares al producto final, como ocurre con otros desinfectantes como el
hipoclorito. La capacidad desinfectante del ozono se basa en su potencial
oxidante, produciendo una intoxicacion intracelular que conduce a la muerte de
los microorganismos. Consecuentemente, cuanto mas sucia est´e el agua (cuanto
menos efectivos hayan sido los sistemas de depuracion), menos efectivo ser´a el
ozono, por lo que mayor debe ser la concentracin para lograr resultados
optimos.
Radiacion UV: La irradiaci´on de los g´ermenes presentes en el agua con
rayos UV provoca una serie de dan˜os en su mol´ecula de ADN, que impiden la
divisi´on celular y causan su muerte. La luz ultravioleta a 253.7 nm, altera el
material DNA en las c´elulas para que los microbios, virus, mojo, alga y otros
microor- ganismos no puedan reproducirse. Los microorganismos al estar
considerados muertos se elimina el riesgo de enfermedad.
F. J. Guerra, A. Struck, S. A. Villalobos 7
Universidad Iberoamericana Laboratorio de Ingenier´ıa Ambiental, Oton˜o
2008
Carbon Activado: La aplicaci´on del Carbon Activado (CA) en el tratamien-
to del agua est enfocada en la retenci´on de materia org´anica. La decloraci´on,
constituye una excepcion, porque el cloro no es un contaminante, sino un desin-
fectante que agrega el hombre.?
5. ¿A qu´e se denomina el Nu´mero m´as Probable de
Coliformes?
¿Qu´e nos est´a
indicando?
El nu´mero mas probable de coliformes (NMP) es un indicador de la
presencia de microorganismos del grupo coliforme. El m´etodo del Nu´mero Mas
Probable, descrito por McCrady en 1914, se basa en que existe la posibilidad
de detectar la presencia o ausencia de microorganismos del tipo coliformes en
el agua pero no es posible hacer un recuento directo de ´estos.
Las bacterias coliformes son bacilos cortos, gram negativos que fermentan
la lactosa y forman acido y gas dentro de un periodo de 48 hrs. En general,
se obtiene una combinacion de resultados positivos y negativos y existe una
concentracion c que maximiza la probabilidad de obtener dicha combinaci
´on. Esta concentracion c es la que se denomina NMP. Para el c´alculo del
NMP se utilizan tablas estad´ısticas.
6. ¿Como se puede destruir o eliminar el exceso de cloro presente en
el agua?
En el agua, el cloro queda disuelto en forma de acido hipocloroso (HClO),
un acido d´ebil que tiende a disociarse. Para eliminar el cloro libre se
utiliza carbon activado granular. La eliminaci´on sucede de acuerdo a las
siguientes reacciones:
HClO + CA → CA O + H+ + Cl− (1)
2HClO + CA → CA O2 + 2H+ + 2Cl− (2)
En donde CA representa el carb´on activado. Los oxidos superficiales poco a
poco van ocupando espacios en la superficie del carb´on Activado. Algunos
de estos oxidos se liberan hacia la soluci´on, disolvi´endose como acido carb
´onico (HCO3 ), dejando espacios libres que alargan la vida del carb´on
activado. Al mismo tiempo que el carbon activado granular actu´a como
declorador, adsorbe la materia organica presente en el agua.
7. Segu´n las normas oficiales de calidad del agua, ¿cu´al es la
concen- tracion de cloro permisible en el agua potable?, ¿cu´al es
la norma para la cantidad de coliformes presentes en agua potable y
en aguas de descarga a r´ıos y lagos? ¿Cu´al es la norma de
calidad del agua potable para trihalometanos?
F. J. Guerra, A. Struck, S. A. Villalobos 8
De acuerdo con las normas mexicanas NOM-003-SEMARNAT-1997 y NOM-
127-SSA1-1994, el l´ımite permsible de cloro en el agua para consumo
humano es de 0.2 a 1.50 mg/L mientras que el l´ımite de trihalometanos es de
0.2 mg/L.
En la Figura 3 se muestran los lmites permisibles de coliformes en agua
potable y en aguas de descarga.
Figura 3: Tabla extra´ıda de la norma mexicana NOM-003-SEMARNAT-1997.
8. Hacer un diagrama de flujo estableciendo los pasos de la experi-
mentacion a seguir, y asignando una actividad espec´ıfica a cada
uno de sus miembros.
Preparacion y valoraci´on de la solucion est´andar de
cloro
Diluir 2 mL de la solucion de cloro comercial en 100 mL de agua destilada, en
un matraz aforado.
(2 minutos. Francisco Guerra (FG))
⇓
De esta solucion determinar el cloro libre total utilizando el M´etodo de
titulacion con tiosulfato que se muestra a continuaci´on haci´endolo
por duplicado (a dos muestras).
⇓
a) Colocar 2 mL de esta soluci´on medidos con pipeta volum´etrica en
un
matraz Erlenmeyer de 25 mL.
⇓
b) An˜adirle 0.5 mL. de acido sulfu´rico 0.1M ´o 0.25 mL de acido ac
´etico
concentrado con una pipeta Beral.
⇓
c) An˜adirle unos cristales de yoduro de potasio (la punta de una esp
´atula), mezclar la muestra hasta disoluci´on del yoduro de potasio y la
liberaci´on de yodo (coloraci´on amarillo-caf´e).
⇓
d) Si la muestra presenta un color amarillo claro, an˜adir unas gotas
de
indicador de almidon. Si la muestra todav´ıa muestra un color caf´e oscuro,
titular con tiosulfato de potasio o sodio 0.01N hasta lograr el color amarillo, y
en ese momento an˜adir el indicador de almid´on. La soluci´on podr´a tomar
una coloraci´on verdosa o azul.
⇓
e) Continuar titulando con el tiosulfato de sodio hasta lograr que el color azul
desaparezca y la soluci´on permanezca incolora por un minuto.
⇓
f ) Anotar el volumen total en mL (Y) y la normalidad del titulante utilizado,
as´ı como el taman˜o de la muestra
valorada.
(10 minutos. Adelwart Struck (AS))
Preparacion de la curva de calibraci
´on
1. Para construir la curva de calibraci´on por el m´etodo espectrofotom
´etrico utilizando el m´etodo de DFD se har´a lo siguiente: tomar la soluci
´on est´andar de cloro al 2 % en volumen preparada en el paso anterior, y
preparar en matraces aforados de 50 mL las diluciones de la Tabla 1:
(5 minutos. Santiago Villalobos (SV))
⇓
Tabla 1: Diluciones.
Dilucion V de soluci´on base
50 mL
1 0.1
2 0.3
3 0.5
4 0.7
5 0.9
6 1.1
Una vez preparadas las diluciones en los matraces aforados, continuar con el
siguiente procedimiento con cada una de ellas, para determinar el cloro total
presente por el M´etodo de cloro total con DFD y lograr lecturas en el
espectrofotometro entre 10 % y 90 % de transmitancia.
M´etodo de Cloro Total con
DFP
En un matraz Erlenmeyer de 10 ´o 25 mL, colocar 0.5 mL de buffer de fosfatos
con una pipeta Beral y an˜adir una pequen˜a cantidad de indicador de
DFD
s´olido con una esp
´atula.
⇓
Verter en el matraz 5 mL de la correspondiente diluci´on, mezclar
e
inmediatamente an˜adir 0.1 g de cristales de yoduro de potasio (punta de
espatula mediana) y mezclar perfectamente hasta disoluci´on de los
cristales. Observar la formaci´on de la coloraci´on rosa o roja.
(10 minutos. FG)
⇓
Dejar reaccionar al menos 5 minutos. Al final de este tiempo llenar una celda
de espectrofotometro y medir en el espectrofot´ometro la absorbancia o
transmitancia a una longitud de onda de 515 nm calibrando previamente con
agua destilada al 100 % de transmitancia.
(10 minutos. AS)
⇓
Una vez determinados estos valores y con la valoraci´on por titulaci´on
realizada
a la solucion estandar por el m´etodo de titulaci´on con tiosulfato, calcular la
concentracion real de cada diluci´on y relacionarla con la absorbancia, para
construir una curva de calibraci´on que nos permita relacionar, la concentraci
´on de cloro presente con la absorbancia a 515 nm.
⇓
Esta curva servir para determinar la concentraci´on en todo el resto de las
determinaciones.
Determinacion del cloro residual total, libre y combinado en el agua
de la llave
Tomar una muestra de 5 mL del agua de la llave y determinarle el cloro
residual total presente siguiendo la t´ecnica del Anexo I.1.
(15 minutos. SV)
⇓
Tomar otra al´ıcuota de 5 mL del agua de la llave con una pipeta volum
´etrica,
colocarla en un matraz de 25 mL y seguir el mismo procedimiento de
valoracion espectrofotom´etrica con DFD que se presenta en el Anexo I.2, I.3
y I.4 para determinarle el cloro libre, las monocloraminas y las dicloraminas
presentes.
(17 minutos. AS)
⇓
Anotar en cada caso la lectura de absorbancia y referirse a la curva de
calibracion construida inicialmente, para determinar la concentraci´on del
cloro en su forma correspondiente, como se indica en el Anexo I.
Determinacion del cloro residual total, libre y combinado en el agua
de salida de la planta de tratamiento de agua antes de cloraci´on
a) Colocar una al´ıcuota de 5 mL del agua de salida de la planta de
tratamiento de aguas antes de la cloracion y determinar el Cloro total
utilizando el m´etodo
espectrofotom´etrico con DFD siguiendo la t´ecnica especificada en el Anexo
I.1 y midiendo en el espectrofot´ometro.
(15 minutos. FG)
⇓
b) Tomar otra al´ıcuota de 5 mL y hacer en esta la valoraci
´on
espectrofotom´etrica para determinar el cloro libre y el cloro combinado,
utilizando nuevamente el m´etodo espectrofom´etrico (Anexo I.2, I.3 y I.4).
Anotar las lecturas y determinar las concentraciones correspondientes de
acuerdo a la curva de calibracion y las indicaciones del anexo correspondiente.
(17 minutos. AS)
Determinacion del cloro residual total, libre y combinado en el agua
de salida de la planta de tratamiento de agua despu´es de cloraci
´on
Tomar dos al´ıcuotas de 5 mL con pipeta volum´etrica del agua de salida de
la planta de tratamiento de aguas despu´es de cloraci´on, colocar cada una
en un matraz de 25 mL y seguir el mismo procedimiento de valoraci´on que
se
utiliz en el inciso anterior. Anotar las lecturas y determinar las
concentraciones correspondientes de acuerdo a la curva de calibraci´on y
las indicaciones del anexo correspondiente.
(32 minutos. FG y SV)
Determinacion de la demanda de cloro del agua de salida de la
planta antes de clorar
a) Medir el pH del agua residual ´o agua de salida de la planta sin desinfectar
(antes de la cloracion). Colocar en 10 matraces con tapon o Parafilm, 50 mL
del agua de salida de la planta sin desinfectar medida con probeta, y an˜adirle
la cantidad de solucion estandar de cloro segu´n se indica en la siguiente
tabla.
⇓
b) En otro matraz igual colocar 50 mL de agua destilada que servir´a como
Testigo, an˜adi´endole la cantidad de cloro como se indica la
tabla.
⇓
c) An˜adir las dosis de la Tabla 2 a cada uno de los matraces, asegurando
que
se mezcle perfectamente en el momento de la dosificaci
´on.
(10 minutos. AS)
⇓
Mezclar intensamente, medir el pH de cada soluci´on y dejar reposar 30
minutos exactamente como tiempo de reacci´on, sin que le d´e la luz del sol
directamente. Se recomienda desfasar la dosificaci´on 5 minutos entre matraz
y matraz, para poder llevar un control m´as riguroso del tiempo de reacci´on.
Se pueden cubrir los matraces con Papel Parafilm o con tapon de hule.
(1 hora. Todos)
⇓
d) Al final del tiempo de reacci´on seguir los pasos de valoraci
´on
espectrofotom´etrica con DFD utilizando una muestra de 5 mL para
Tabla 2: Dosis.
Matraz No. Contenido Soluci´on est´andar de
hipoclorito
1 Agua residual sin clorar Volumen
0.1 [mL]
2 Agua residual sin clorar 0.2
3 Agua residual sin clorar 0.3
4 Agua residual sin clorar 0.4
5 Agua residual sin clorar 0.5
6 Agua residual sin clorar 0.6
7 Agua residual sin clorar 0.7
8 Agua residual sin clorar 0.8
9 Agua residual sin clorar 0.9
10 Agua residual sin clorar 1.0
Testigo Agua desionizada 1.0
determinar cloro residual total (Anexo I.1) y otra de 5 mL para determinar el
cloro residual libre y combinado (mono y dicloroamina) siguiendo la t´ecnica
en el mismo anexo (Anexo I.2, I.3 y I.4) para cada soluci´on.
(1 hora. Todos)
⇓
En los matraces con concentraciones elevadas como ser´ıan: el testigo y
los
matraces 8 a 10, se requiere hacer una diluci´on, por lo que se sugiere
preparar diluciones al 10 % de la muestras: testigo y 8 en adelante para poder
hacer las lecturas en el espectrofot´ometro.
⇓
Para esto se tomaran 5 mL y se llevar´an a 50 mL en los matraces aforados
de
50 mL previamente lavados. Las muestras diluidas en los matraces aforados se
mezclaran bien y de all´ı se tomar´an las muestras correspondientes para
poder hacer las determinaciones del cloro total, libre y combinado.
Pruebas de decloracion
En esta prueba se compararan los m´etodos de decloraci´on: 1) usando carb
´on activado y 2) el tratamiento qu´ımico con un reactivo reductor.
⇓
Despu´es del tratamiento con cloro, colocar 5 mL del agua utilizada como
testigo (agua desionizada + cloro) en un vaso de precipitados y an˜adirle
1 punta de espatula de carbon activado. Agitar y dejar reaccionar unos 5
minutos.
⇓
Colocar otros 5 mL del mismo matraz en otro vaso o tubo de ensaye y
an˜adirle
1 punta de espatula de bisulfito o sulfito de sodio. Agitar y dejar reaccionar
unos 5 minutos.
⇓
Tomar una al´ıcuota de 2 mL de cada uno de los matraces y pasarlas a
diferentes matraces de 25 mL y valorar el cloro total con el m´etodo (B) ya
anteriormente planteado. Cuidar que la muestra no lleve s´olidos. Anotar
los resultados observados para cada caso.
(15 minutos. FG, AS)
ANEXO I: M´etodo de determinacion de cloro total, libre
y combinado utilizando DFP
I.1 Determinacion del cloro total
En un matraz Erlenmeyer de 10 o 25 mL colocar 0.5 mL de buffer de fosfatos
y una pequen˜a cantidad de indicador de DFD s´olido.
⇓
An˜adir 5 mL de la muestra utilizando una pipeta volum´etrica
e
inmediatamente an˜adir unos 0.1 g de cristales de yoduro de potasio (punta de
espatula mediana) y mezclar perfectamente hasta disoluci´on de los cristales y
observar la formacion de la coloraci´on rosa o roja. Dejar reaccionar al menos
4 minutos.
⇓
Al final de este tiempo llenar una celda de espectrofot´ometro y medir la
absorbancia o transmitancia a una longitud de onda de 515 nm calibrando
previamente con agua destilada al 100 % de transmitancia. Con este lectura se
podra, a partir de la curva de calibraci´on, obtener el valor en mg/L de cloro
total o VALOR T.
(15 minutos. SV)
I.2 Determinacion del cloro libre
Colocar en un matraz de 25 mL, 0.5 mL de buffer de fosfatos con una pipeta
Beral y 25 mg de DFD solido (una punta de esp´atula fina); mezclar y an˜adir
5 mL de muestra con pipeta volum´etrica y mezclar perfectamente. Si hay
cloro
se generar´a una coloraci´on
roja.
⇓
Llenar una celda del espectrofot´ometro y medir inmediatamente en el
espectrofotometro previamente calibrado con agua destilada a 515 nm. De esta
lectura se podr´a determinar el valor de la concentraci´on de cloro libre o
VALOR A.
(10 minutos. AS)
I.3 Determinacion de monocloramina presente
Sobre la misma muestra en la celda de espectrofot´ometro, an˜adir un cristal
muy pequen˜o de yoduro de potasio (0.05 mg) y mezclar. Si existe
monocloramina se generar´a el color rojo mas intenso. Medir inmediatamente
a la misma longitud de onda, para obtener el VALOR B.
(2 minutos. AS)
I.4 Determinacion de dicloramina presente
Sobre la misma muestra en la celda del espectrofot´ometro an˜adir exceso
de cristales de yoduro de potasio (una punta de espatula mediana, 0.1 g
aproximadamente) y mezclar hasta disoluci´on.
⇓
Dejar reposar un m´ınimo de 3 a 5 minutos y al t´ermino de este tiempo
medir
la absorbancia en el espectrofot´ometro y determinar la nueva concentraci´on
o
VALOR C.
(5 minutos. AS)
⇓
Cuando el valor del cloro total (T) sea mayor a la suma del cloro libre + el
cloro combinado como mono y dicloroamina, la diferencia ser´ıa la contribuci
´on por tricloroamina (NCl3 ) presente, es decir, en ese caso, la diferencia de
concentraciones de cloro nos dar´a el valor de la concentraci´on de la forma de
tricloroamina en que se encuentra el cloro en el agua en mg/L de Cl2 .
Referencias
[1] Lenntech. Chlorine as disinfectant for water.
http://www.lenntech.com/water-disinfection/disinfectants-chlorine.htm,
October 2008.
[2] C. N. Sawyer. Qumica para Ingeniera Ambiental. McGraw-Hill, 2001.
[3] Secretar´ıa de Salud. NOM-127-SSA1-1994, November 1995.
[4] SEMARNAT. NOM-003-ECOL-1997, April 2003.
[5] Textos Cient´ıficos. Adsorbedores de carb´on activado granular.
http://www.textoscientificos.com/quimica/carb on-activo/carb on-activado-
granular, October 2008.
[6] Wikipedia. A´ cido hipocloroso.
http://es.wikip edia.org/wiki/A´ cido hipocloroso, October 2008.
[7] Wikipedia. Trihalometano.
http://es.wikip edia.org/wiki/Trihalometano, October 2008.
[8] Yahoo! Answers. ¿Cuales son las impurezas del carbon activado?
http://espanol.answers.yahoo.com/question/index?qid=
20080106154651AA2UhpI, October 2008.
You might also like
- Ejercicios Resueltos de PLCS y SensoresDocument16 pagesEjercicios Resueltos de PLCS y SensoresGonzalo GrimaldiNo ratings yet
- Reglamento Tutoria v2 PDFDocument5 pagesReglamento Tutoria v2 PDFFerrer CelestinoNo ratings yet
- Reglamento Sistema Evaluacion Docente 4vDocument36 pagesReglamento Sistema Evaluacion Docente 4vFerrer CelestinoNo ratings yet
- 03 Especificaciones Técnicas Ubs ComunidadDocument28 pages03 Especificaciones Técnicas Ubs ComunidadFerrer CelestinoNo ratings yet
- Matriz Ppto YautanDocument11 pagesMatriz Ppto YautanFerrer CelestinoNo ratings yet
- Formato C Marco LogicoDocument1 pageFormato C Marco LogicoFerrer CelestinoNo ratings yet
- 5.10 Obras PreliminaresDocument1 page5.10 Obras PreliminaresFerrer CelestinoNo ratings yet
- Formato C Marco LogicoDocument1 pageFormato C Marco LogicoFerrer CelestinoNo ratings yet
- Reglamento Promocion Difusion Invest v005 ActualizadoDocument32 pagesReglamento Promocion Difusion Invest v005 ActualizadoNardia Margot Zapata ZavalaNo ratings yet
- Reglamento Ingreso Profesores-nuevo-Ordinarios v3Document9 pagesReglamento Ingreso Profesores-nuevo-Ordinarios v3Ferrer CelestinoNo ratings yet
- Lectura1 PDFDocument11 pagesLectura1 PDFFerrer CelestinoNo ratings yet
- Desagregado Gastos GeneralesDocument6 pagesDesagregado Gastos GeneralesFerrer CelestinoNo ratings yet
- 03 Especificaciones Técnicas Ubs ComunidadDocument28 pages03 Especificaciones Técnicas Ubs ComunidadFerrer CelestinoNo ratings yet
- 5.00 Resumen de Presupuesto PDFDocument1 page5.00 Resumen de Presupuesto PDFFerrer CelestinoNo ratings yet
- 5.50 Monitoreo ArqueologicoDocument1 page5.50 Monitoreo ArqueologicoFerrer CelestinoNo ratings yet
- Micro Biolog I ADocument22 pagesMicro Biolog I AFerrer CelestinoNo ratings yet
- 12 Parametros de Dibujo PDFDocument2 pages12 Parametros de Dibujo PDFFerrer CelestinoNo ratings yet
- Memoria Calculo AbastecimientoDocument25 pagesMemoria Calculo AbastecimientoReyna Natalia Huancara PumaNo ratings yet
- MaterialDocument3 pagesMaterialFerrer CelestinoNo ratings yet
- Plan Contingencia Contra IncendiosDocument21 pagesPlan Contingencia Contra IncendiosVillavicencio Contreras PedroNo ratings yet
- BIODIGESTORDocument13 pagesBIODIGESTORFerrer CelestinoNo ratings yet
- 0.04 Resumen EjecutivoDocument3 pages0.04 Resumen EjecutivoFerrer CelestinoNo ratings yet
- Hoja Tecnica Fierro Corrugado A615 PDFDocument2 pagesHoja Tecnica Fierro Corrugado A615 PDFFerrer CelestinoNo ratings yet
- Cronograma ValorizadoDocument42 pagesCronograma ValorizadoFerrer CelestinoNo ratings yet
- 0.04 Resumen EjecutivoDocument3 pages0.04 Resumen EjecutivoFerrer CelestinoNo ratings yet
- Analisis de G.GDocument18 pagesAnalisis de G.GFerrer CelestinoNo ratings yet
- Gestion de Proyectos Con OpenERPDocument30 pagesGestion de Proyectos Con OpenERPAgustin E Cruz IceloNo ratings yet
- 0.02 IndiceDocument2 pages0.02 IndiceFerrer CelestinoNo ratings yet
- Insumos PSBDocument6 pagesInsumos PSBFerrer CelestinoNo ratings yet
- Presupuesto Saneamiento BasicoDocument15 pagesPresupuesto Saneamiento BasicoFerrer CelestinoNo ratings yet
- Presupuesto Saneamiento BasicoDocument15 pagesPresupuesto Saneamiento BasicoFerrer CelestinoNo ratings yet
- Ast T-Set 017 Instalacion de Interruptor de Potencia Con Camión GrúaDocument3 pagesAst T-Set 017 Instalacion de Interruptor de Potencia Con Camión GrúaCarlos RodasNo ratings yet
- RoboticaDocument39 pagesRoboticaAvril Luciana Ysla GascoNo ratings yet
- Conservas de Esparragos Trabajo MejoradoDocument13 pagesConservas de Esparragos Trabajo Mejoradomaximo palomino rodasNo ratings yet
- 3 Ejemplos Con SolverDocument7 pages3 Ejemplos Con SolverMarco NovoaNo ratings yet
- REPASÍN Trabajo Final. Reloj Pastillero InteligenteDocument52 pagesREPASÍN Trabajo Final. Reloj Pastillero Inteligentepelayo-enriquez-de-salamanca-3454100% (1)
- Diagrama de Análisis Del Proceso Actual OkDocument2 pagesDiagrama de Análisis Del Proceso Actual OkJose TapiaNo ratings yet
- Amplificador Salon tx-sr701 - Manual - S PDFDocument82 pagesAmplificador Salon tx-sr701 - Manual - S PDFFrank MasonNo ratings yet
- Análisis de Refinerías en México - OperaciónDocument33 pagesAnálisis de Refinerías en México - OperaciónMarco Mares RedacciónNo ratings yet
- Trabajos en Altura PetarDocument1 pageTrabajos en Altura PetarCarlos Rodriguez CastilloNo ratings yet
- Granja de Cría y Engorde REQUERIMIENTO TECNICODocument7 pagesGranja de Cría y Engorde REQUERIMIENTO TECNICOBertha Villanueva GomezNo ratings yet
- SGI-P-MIN-06 Transporte y Manipulación y Entrega de Explosivos y Accesorios en TerrenoDocument17 pagesSGI-P-MIN-06 Transporte y Manipulación y Entrega de Explosivos y Accesorios en Terrenofredy molinaNo ratings yet
- Makrolon® Multi UV Un Programa Con Muchas SolucionesDocument2 pagesMakrolon® Multi UV Un Programa Con Muchas SolucionesJUAN1995ANo ratings yet
- Traducir OpenBravo ERP Version 2.4Document4 pagesTraducir OpenBravo ERP Version 2.4Fabian Alejandro Moná MartinezNo ratings yet
- Estructura Filtro LentoDocument3 pagesEstructura Filtro LentoLouis AlbertNo ratings yet
- Memoria Descriptiva de InterferenciaDocument6 pagesMemoria Descriptiva de Interferenciajulio sabinoNo ratings yet
- Catalogo Herrajes Gayner 2014 PDFDocument107 pagesCatalogo Herrajes Gayner 2014 PDFnylesNo ratings yet
- Cap - 4 - Variadores de Velocidad y ArrancadoresDocument31 pagesCap - 4 - Variadores de Velocidad y ArrancadoresNelson GonzalezNo ratings yet
- Informe IIIDocument55 pagesInforme IIIIvette MorelNo ratings yet
- Tarifa ValvulasDocument20 pagesTarifa Valvulasmnicolas_prointecNo ratings yet
- Tipos de Reacciones QuimicasDocument4 pagesTipos de Reacciones QuimicasSanti AvareceNo ratings yet
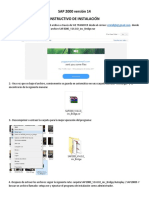
- Instalación SAP 2000 v14 guía completaDocument17 pagesInstalación SAP 2000 v14 guía completaJc Medina DonnelliNo ratings yet
- Analisis Del Grupo IV - Analisis QuimicoDocument19 pagesAnalisis Del Grupo IV - Analisis Quimicowillyball100% (1)
- Impacto Ambiental Del Sector de La Construcción - Fábio Maia GuzenskiDocument232 pagesImpacto Ambiental Del Sector de La Construcción - Fábio Maia GuzenskiRicardo MantariNo ratings yet
- Sistema Job Shop-Flow ShopDocument2 pagesSistema Job Shop-Flow ShopGisela GonzalezNo ratings yet
- 7 Espigones de GavionesDocument15 pages7 Espigones de GavionesJULIO MONTENEGRO OBANDONo ratings yet
- Gq-Fo-29 Al 36 Formatos InspeccionesDocument14 pagesGq-Fo-29 Al 36 Formatos InspeccionesGloria HernandezNo ratings yet
- Reciclaje Tetra Pak planchas construcciónDocument4 pagesReciclaje Tetra Pak planchas construcciónRocio Maribel Araujo QuispeNo ratings yet
- Concentrado estimado de obra de introducción de red de drenaje sanitarioDocument1 pageConcentrado estimado de obra de introducción de red de drenaje sanitarioRuben CM100% (1)
- Cursos Del Training Center Ademinsa GroupDocument7 pagesCursos Del Training Center Ademinsa GroupGrupo AdeminsaNo ratings yet