Professional Documents
Culture Documents
Atividades Globais SD2
Uploaded by
milenerato2240Original Title
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Atividades Globais SD2
Uploaded by
milenerato2240Copyright:
Available Formats
1 A constante de equilíbrio para uma determinada reação é:
De entre as equações seguintes, selecione a que representa a reação em causa.
(A)
(B)
(C)
(D)
2 De entre as afirmações seguintes sobre o equilíbrio químico, assinale a incorreta.
(A) A velocidade da reação inversa é sempre igual à velocidade da reação direta
(B) O equilíbrio químico é um equilíbrio dinâmico.
(C) As concentrações de todas as espécies presentes no sistema são iguais ao atingir o equilíbrio.
(D) Atingido o equilíbrio, as características macroscópicas do sistema (fechado) permanecem constantes
com o tempo.
3 De entre os diagramas seguintes, selecione o que representa a variação das concentrações de A e B
com o tempo na reação A → B, quando o equilíbrio é atingido ao fim de um tempo t.
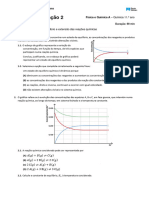
4 O gráfico seguinte representa a variação, para uma determinada temperatura, das concentrações dos
reagentes e dos produtos, no decorrer da reação:
4.1 Indique as concentrações iniciais e de equilíbrio do N2O4 e do NO2.
4.2 Calcule a constante de equilíbrio da reação à temperatura considerada.
5 Considere a reação de formação do pentacloreto de fósforo traduzida pela seguinte equação química:
Um recipiente de 2,0 dm3 contém em equilíbrio, à temperatura de 200 °C, 0,144 mol de PCℓ5, 0,360 mol
de PCℓ3 e 0,016 mol de Cℓ2. O valor da constante de equilíbrio para esta reação, à temperatura
considerada, é:
(A) 25 (B) 0,040 (C) 50 (D) 0,020
6 Para a reação de formação do amoníaco:
Calcule a quantidade química de hidrogénio presente a essa temperatura, sabendo que num recipiente de
20,0 dm3 existem, no estado de equilíbrio, 6,23 mol de nitrogénio e 4,48 mol de amoníaco.
7 Os diagramas seguintes representam, para as reações I e II, a variação da concentração de reagentes
e de produtos, em função do tempo, à temperatura de 500 K.
Classifique cada uma das afirmações como verdadeira (V) ou falsa (F).
(A) À temperatura de 500 K, a constante de equilíbrio, Kc, da reação II é superior à da reação I.
(B) A reação II é mais extensa.
(C) No instante t, na reação I, terminam as transformações no sentido direto e inverso.
(D) No instante t', a reação II atinge um estado de equilíbrio.
Exame Nacional de Química do 12.º ano, 2000 — 1.ª fase, 1.ª chamada
8 Num recipiente de 4,00 dm3 colocaram-se 18,0 mol de N2O, a uma determinada temperatura. Este
composto decompõe-se de acordo com a seguinte equação:
Quando se atinge o equilíbrio, no recipiente existem 4,20 mol de N2O. Determine o valor da constante
de equilíbrio desta reação.
9 Considere a seguinte equação química e a constante de equilíbrio a uma determinada temperatura.
De entre as afirmações seguintes, escolha a opção correta.
(A) A constante de equilíbrio da reação inversa é 4,0 x 10–4.
(B) A reação direta é menos extensa do que a reação inversa.
(C) Quando é atingido o equilíbrio, as concentrações dos reagentes são aproximadamente iguais às dos
produtos de reação.
(D) Ao atingir o estado de equilíbrio, as concentrações dos produtos de reação predominam face às dos
reagentes.
10 Considere a reação a seguir representada, a uma determinada temperatura T:
Num recipiente de capacidade V, encontram-se em equilíbrio 1,810 mol de NO2 e 0,095 mol de N2O4.
Calcule o volume do recipiente.
11 Considere a reação em meio gasoso:
Num reator, com 10,0 dm3 de capacidade, são colocados à temperatura de 1200 K, 28,01 g de CO e 6,06
g de H2. Sabendo que a quantidade de H2O no equilíbrio é 0,387 mol, calcule:
a) as concentrações de todas as espécies no equilíbrio;
b) a constante de equilíbrio à temperatura considerada.
12 Pretende-se estudar a reação do dióxido de enxofre, SO2, com o oxigénio a uma temperatura elevada.
Num reator de 20 dm3, inicialmente estavam contidas 1,52 mol de SO2 e 0,720 mol de O2. Quando se
estabeleceu o equilíbrio, verificou-se que 57,8% de SO2 tinham reagido.
Calcule o valor de Kc para esta reação.
13 A determinada temperatura, T, misturaram-se num reator 0,040 mol dm–3 de PCℓ3, 0,0120 mol dm–
3
de Cℓ2 e 0,0080 mol dm–3 de PCℓ5. Ao fim de algum tempo atingiu-se o equilíbrio:
13.1 Calcule o quociente da reação.
13.2 Refira, justificando, em que sentido evolui o sistema até atingir o equilíbrio.
14 Considere o seguinte equilíbrio:
Selecione, de entre as opções seguintes, a única que causará um aumento na constante Kc para esta
reação.
(A) Diminuição da pressão do sistema.
(B) Diminuição da concentração de SO2.
(C) Aumento da temperatura do sistema.
(D) Diminuição da temperatura do sistema.
15 O gráfico seguinte refere-se ao sistema:
De acordo com o Princípio de Le Châtelier e após análise do gráfico, selecione a opção correta.
(A) A adição de Cℓ2 em t1 aumentou a concentração de HCℓ.
(B) O sistema encontra-se em equilíbrio entre t1 e t2.
(C) A adição de HCℓ em t1 alterou o equilíbrio do sistema.
(D) A adição de H2 em t1 aumentou a concentração de HCℓ.
16 Considere a síntese do amoníaco:
Sendo as concentrações de H2, N2 e NH3 em determinado momento, respetivamente, 0,76 mol dm–
3
, 0,60 mol dm–3 e 0,48 mol dm–3, selecione, de entre as afirmações seguintes, a correta.
(A) O sistema está em equilíbrio.
(B) O sistema evolui no sentido do consumo de NH3.
(C) O quociente da reação é 0,78.
(D) O quociente da reação vai aumentar até o sistema atingir o equilíbrio.
17 Considere o seguinte sistema químico em equilíbrio:
17.1 Refira, justificando, qual a modificação que se observa na cor do sistema quando o volume do
recipiente diminui.
17.2 Considerando que a 127 °C o valor de Kc para a reação é igual a 1,44 e a 25 °C é igual a 4,00 10–
2
, conclua se a dissociação do N2O4 é um processo exotérmico ou endotérmico.
You might also like
- 4a Atividade - Constante de EquilíbrioDocument11 pages4a Atividade - Constante de EquilíbrioERIK CESARNo ratings yet
- Ficha NR 3 PerguntasDocument5 pagesFicha NR 3 PerguntasernildoernestomalajissaNo ratings yet
- Exercícios de Aplicação - Equilíbrio Químico 3Document4 pagesExercícios de Aplicação - Equilíbrio Químico 3sevinchrajabova027No ratings yet
- Apostila Química Orgânica: Carbono, Dienos E AromáticosFrom EverandApostila Química Orgânica: Carbono, Dienos E AromáticosNo ratings yet
- Ficha - Avaliacao - Equilibrio Químico2Document6 pagesFicha - Avaliacao - Equilibrio Químico2Carla CruzNo ratings yet
- Lista de Equilíbrio Químico PDFDocument3 pagesLista de Equilíbrio Químico PDFMarcelo SatorresNo ratings yet
- Ficha de Trabalho Global - EquilíbrioDocument2 pagesFicha de Trabalho Global - EquilíbrioDiogo NunesNo ratings yet
- Equilibrio QuimicoDocument4 pagesEquilibrio QuimicoEfraim Nobre SoaresNo ratings yet
- Ficha 2 - Equilíbrio QuímicoDocument5 pagesFicha 2 - Equilíbrio QuímicoBeatriz AmorimNo ratings yet
- Ficha 2 - QuímicaDocument6 pagesFicha 2 - QuímicaBeatriz VenâncioNo ratings yet
- Teste - 2 - PORTO EDITORA 2023 - Enunciado - sd2 - Estado - Equilibrio - Extensao - Reacoes - QuimicasDocument6 pagesTeste - 2 - PORTO EDITORA 2023 - Enunciado - sd2 - Estado - Equilibrio - Extensao - Reacoes - QuimicasLuis VarelaNo ratings yet
- FichaprinchatDocument4 pagesFichaprinchatAndrei GalanNo ratings yet
- 11FQA Ficha Trab Ini Q1.2 - N.º 2Document4 pages11FQA Ficha Trab Ini Q1.2 - N.º 2carlosNo ratings yet
- Atividade Avaliativa Equilíbrio QuímicoDocument6 pagesAtividade Avaliativa Equilíbrio QuímicoJetterson CondeNo ratings yet
- Ae q11 Fich Form 1Document5 pagesAe q11 Fich Form 1Mariana Coelho100% (4)
- 11FQA Ficha Trab Ini Q1.2 - N.º 2Document4 pages11FQA Ficha Trab Ini Q1.2 - N.º 2Andrei GalanNo ratings yet
- Ficha de Trabalho 7 - Aspetos Quantitativos Das RQ e Equilíbrio Químico e Extensão Das RQDocument4 pagesFicha de Trabalho 7 - Aspetos Quantitativos Das RQ e Equilíbrio Químico e Extensão Das RQFranciscaNo ratings yet
- Ae q11 Fich Form 1Document5 pagesAe q11 Fich Form 1Ana Raquel PintoNo ratings yet
- 18 - Equilíbrio QuímicoDocument3 pages18 - Equilíbrio QuímicoツBorutoNo ratings yet
- FICHA 2 - Equilibrio QuimicoDocument4 pagesFICHA 2 - Equilibrio QuimicoINES DE LEMOS SARGENTO E ALMEIDANo ratings yet
- Equilibrio Químico Com Resolução - Química 11Document7 pagesEquilibrio Químico Com Resolução - Química 11João CarvalhoNo ratings yet
- Ficha Formativa - UFCD 6708Document5 pagesFicha Formativa - UFCD 6708cristinajlopesNo ratings yet
- Ae q11 Fich Form 1Document5 pagesAe q11 Fich Form 1carla50% (2)
- 11FQA Ficha Formativa Q1.2Document3 pages11FQA Ficha Formativa Q1.2Andrei GalanNo ratings yet
- Química - EquilíbrioDocument5 pagesQuímica - EquilíbrioEzequiel CalixtoNo ratings yet
- ExercíciosDocument6 pagesExercíciosCaroline Paglia NadalNo ratings yet
- Ae q11 Fich Form 1Document6 pagesAe q11 Fich Form 1sandraimartins0% (1)
- 5 Ficha de Trabalho - Cálculos Estequiométricos e Equilíbrio Químico - 12-13 PDFDocument3 pages5 Ficha de Trabalho - Cálculos Estequiométricos e Equilíbrio Químico - 12-13 PDFMaria Do Carmo BrazNo ratings yet
- 02 Teste de Avaliacao q11 d1 sd2 PDFDocument6 pages02 Teste de Avaliacao q11 d1 sd2 PDFSantana RamosNo ratings yet
- Ficha Formativa - Equilíbrio QuímicoDocument3 pagesFicha Formativa - Equilíbrio Químiconelson_honorioNo ratings yet
- Equilíbrio Químico (Lista)Document2 pagesEquilíbrio Químico (Lista)Tobias Scherrer IINo ratings yet
- Química 12a Classe - Ficha de ExerciciosDocument3 pagesQuímica 12a Classe - Ficha de ExerciciosJoaquim Saldeira ManuelNo ratings yet
- Ficha6 QuímicaDocument4 pagesFicha6 QuímicaRodrigo lopesNo ratings yet
- Q2-Ficha Trabalho Nº2Document3 pagesQ2-Ficha Trabalho Nº2Ana SilvaNo ratings yet
- (4.2.1) 11Q - CAP - (Fichas 1.2)Document25 pages(4.2.1) 11Q - CAP - (Fichas 1.2)Catarina FerreiraNo ratings yet
- 3-Equilíbrio Químico (Apostila)Document14 pages3-Equilíbrio Químico (Apostila)Vaniely SiqueiraNo ratings yet
- Prof. Rafa - Química - Equilíbrio Químico - Prova P2 - 1 BimDocument2 pagesProf. Rafa - Química - Equilíbrio Químico - Prova P2 - 1 BimRafael VaristeloNo ratings yet
- FichatrabeqquímicoDocument3 pagesFichatrabeqquímicoAndrei GalanNo ratings yet
- Prof. Rafa - Química - Equilíbrio QuímicoDocument9 pagesProf. Rafa - Química - Equilíbrio QuímicoRafael VaristeloNo ratings yet
- Lista de Exercícios - Equilíbrio QuímicoDocument7 pagesLista de Exercícios - Equilíbrio QuímicoIzabelleNo ratings yet
- FT - FQA11 - Equilíbrio QuímicoDocument5 pagesFT - FQA11 - Equilíbrio QuímicoRui RodriguesNo ratings yet
- Ficha - 14 - Estado de Equilíbrio e Extensão Das Reações Químicas - AlunoDocument3 pagesFicha - 14 - Estado de Equilíbrio e Extensão Das Reações Químicas - AlunoJoão MoreiraNo ratings yet
- Lista Exercicios - Equilibrio Quimico - Parte 1Document2 pagesLista Exercicios - Equilibrio Quimico - Parte 1aaNo ratings yet
- Trabalho de Química 3º ANODocument9 pagesTrabalho de Química 3º ANOdubequimaoNo ratings yet
- Física e Química A - 11º Ano Física e Química A - 11º AnoDocument2 pagesFísica e Química A - 11º Ano Física e Química A - 11º AnoMaria CanudoNo ratings yet
- Equilíbrio QuímicoDocument17 pagesEquilíbrio QuímicojulioNo ratings yet
- qr11 02 Teste Aval 3 sd2 EnunciadoDocument10 pagesqr11 02 Teste Aval 3 sd2 Enunciadorucacostinha2No ratings yet
- Equilíbrio Químico-Lq2Document49 pagesEquilíbrio Químico-Lq2Pedro H. FassarellaNo ratings yet
- Exercícios CAp-COLUNIDocument3 pagesExercícios CAp-COLUNImaiaNo ratings yet
- Exe EquilibrioDocument48 pagesExe Equilibrioruannamsb4596100% (2)
- Pcasd - Uploads - Rogerio - Arquivos - Lista 12 - Equilbrio Qumico - Constante de Equlibrio KCDocument9 pagesPcasd - Uploads - Rogerio - Arquivos - Lista 12 - Equilbrio Qumico - Constante de Equlibrio KCRaisson HolandaNo ratings yet
- Questões Objetivas CinéticaDocument10 pagesQuestões Objetivas CinéticaMônica Cecato100% (1)
- 7c2ba Teste Fqa11Document6 pages7c2ba Teste Fqa11Sofia CarvalhoNo ratings yet
- Hqen11 Desd Prop Res d2Document2 pagesHqen11 Desd Prop Res d2milenerato2240No ratings yet
- Aecn6 FF FotossinteseDocument2 pagesAecn6 FF Fotossintesemilenerato2240No ratings yet
- Orações Coordenadas e SubordinadasDocument5 pagesOrações Coordenadas e SubordinadasAna Tapadinhas Explicações67% (3)
- 11oqui Mica FT Apoio No2Document4 pages11oqui Mica FT Apoio No2milenerato224050% (2)
- 11oqui Mica FT Apoio No2Document4 pages11oqui Mica FT Apoio No2milenerato224050% (2)
- Questão Aula 5Document2 pagesQuestão Aula 5milenerato2240No ratings yet
- Ae q11 Teste Ava 1Document5 pagesAe q11 Teste Ava 1milenerato2240100% (2)
- Solucoes Fichas TrabalhoDocument9 pagesSolucoes Fichas Trabalhomilenerato2240No ratings yet
- Cfq7 Ficha 19Document1 pageCfq7 Ficha 19milenerato2240No ratings yet
- Solucoes Fichas TrabalhoDocument9 pagesSolucoes Fichas Trabalhomilenerato2240No ratings yet
- Atividades Globais SD3Document5 pagesAtividades Globais SD3milenerato2240No ratings yet
- Atividades Globais SD2Document4 pagesAtividades Globais SD2milenerato2240No ratings yet
- Atividades Globais SD3Document5 pagesAtividades Globais SD3milenerato2240No ratings yet
- Subdomínio 1 Aspetos Quantitativos Das Reações QuímicasDocument7 pagesSubdomínio 1 Aspetos Quantitativos Das Reações Químicasmilenerato2240No ratings yet
- Cfq7 Ficha 19Document1 pageCfq7 Ficha 19milenerato2240No ratings yet
- Rec Archivo Esarc00001961 10082016105148Document1 pageRec Archivo Esarc00001961 10082016105148milenerato2240No ratings yet
- Ficha 10 FQ 7ºDocument4 pagesFicha 10 FQ 7ºmilenerato2240No ratings yet
- 2.1 Substâncias e Misturas Tipos de Misturas: 1. Considera A Seguinte Lista de MateriaisDocument4 pages2.1 Substâncias e Misturas Tipos de Misturas: 1. Considera A Seguinte Lista de Materiaismilenerato2240100% (1)
- 6 SoluçõesDocument2 pages6 SoluçõesCristina MariaNo ratings yet
- SeparaçãoDocument9 pagesSeparaçãomilenerato2240No ratings yet
- SeparaçãoDocument9 pagesSeparaçãomilenerato2240No ratings yet
- Cfq7 Ficha 19Document1 pageCfq7 Ficha 19milenerato2240No ratings yet
- FT Transporte Nas PlantasDocument6 pagesFT Transporte Nas Plantasmilenerato2240100% (1)
- SoluçõesDocument2 pagesSoluçõesmilenerato2240No ratings yet
- Ficha Trabalho Transporte No Floema Com CorreçãoDocument3 pagesFicha Trabalho Transporte No Floema Com Correçãomilenerato224040% (5)
- 2008 11 13 15 0 55 109 - Teste - Avaliacao - 01 PDFDocument2 pages2008 11 13 15 0 55 109 - Teste - Avaliacao - 01 PDFBeatriz SilvaNo ratings yet
- FT Tansformação Da MatériaDocument3 pagesFT Tansformação Da Matériamilenerato2240No ratings yet
- FT XilemaDocument4 pagesFT Xilemamilenerato2240No ratings yet
- Aulas de Resmat 05-06Document23 pagesAulas de Resmat 05-06Engenharia FEINo ratings yet
- Alex - Termodinaì MicaDocument9 pagesAlex - Termodinaì MicaThays BordalloNo ratings yet
- Texto de Apoio 12a ClasseDocument4 pagesTexto de Apoio 12a ClasseAnildaNo ratings yet
- GODIVASDocument4 pagesGODIVASLauren BianchiNo ratings yet
- AUT0278 Aula 03 - Som, Ouvido e Percepção SonoraDocument36 pagesAUT0278 Aula 03 - Som, Ouvido e Percepção SonoraBaixar ApostilaNo ratings yet
- Lista 1 - Variáveis de Processo PDFDocument2 pagesLista 1 - Variáveis de Processo PDFPetroleo PlanaltoNo ratings yet
- Transferncia de Calor Conveccao PDFDocument5 pagesTransferncia de Calor Conveccao PDFezioNo ratings yet
- LISTASistemasTrmicos2 20170407182050Document5 pagesLISTASistemasTrmicos2 20170407182050Jorge MarquesNo ratings yet
- Apostila de Trocadores de CalorDocument35 pagesApostila de Trocadores de CalorThiago Dias BarbosaNo ratings yet
- Lista de SobressalentesDocument4 pagesLista de SobressalentesSebastião da CruzNo ratings yet
- Danfoss FreonDocument11 pagesDanfoss FreonJuan Pablo100% (1)
- RELATORIO Dilatação TérmicaDocument3 pagesRELATORIO Dilatação TérmicaJonas Gomes Pereira50% (4)
- Relatório Experimento 2Document6 pagesRelatório Experimento 2Mariane Borges100% (2)
- Estrutura de Aço I - Aula 3Document33 pagesEstrutura de Aço I - Aula 3Pedro HenriqueNo ratings yet
- 3451 GMV VDocument12 pages3451 GMV VBlasphem NekNo ratings yet
- Apostila de Química - SuperiorDocument57 pagesApostila de Química - SuperiorGabriel DaniloNo ratings yet
- Diagramas de FasesDocument7 pagesDiagramas de FasesJoyce SouzaNo ratings yet
- 1 Lista de Exercícios - Hidráulica 1º Semestre - R01 - AlunosDocument70 pages1 Lista de Exercícios - Hidráulica 1º Semestre - R01 - AlunosPaulo ArrieiroNo ratings yet
- AL2.2-Determinação Da Velocidade Do SomDocument3 pagesAL2.2-Determinação Da Velocidade Do Somfqa11esqf6682No ratings yet
- Taxa de EvaporaçãoDocument5 pagesTaxa de EvaporaçãoCassiano ScarpariNo ratings yet
- Atividade II - CalorímetroDocument9 pagesAtividade II - CalorímetroLEILANE SILVA CARVALHONo ratings yet
- 01 PAA Hidraulica Geral, Lote 1 - Intr. Teorica - Impulsao HidrostaticaDocument4 pages01 PAA Hidraulica Geral, Lote 1 - Intr. Teorica - Impulsao HidrostaticaBelchior Reinaldo NhantumboNo ratings yet
- Trocador de CalorDocument25 pagesTrocador de Calorneto544No ratings yet
- Curso de Análise de Falhas - Aula 3Document42 pagesCurso de Análise de Falhas - Aula 3Lucio NascimentoNo ratings yet
- Lista Operações Unitarias 4Document3 pagesLista Operações Unitarias 4Julia GuimaraesNo ratings yet
- Pirometalurgia - Exercícios TermodinamicaDocument4 pagesPirometalurgia - Exercícios TermodinamicaLoren KellyNo ratings yet
- Padrões de Circulação Atmosférica e OceânicaDocument7 pagesPadrões de Circulação Atmosférica e OceânicaSolange FerreiraNo ratings yet
- Exercicios Sobre CALOR SENSÍVEL e Transferencia de CalorDocument18 pagesExercicios Sobre CALOR SENSÍVEL e Transferencia de CalorPedro Henrique BorgesNo ratings yet
- Lab, Hid 2,2Document10 pagesLab, Hid 2,2Belizário Artur NhapuloNo ratings yet
- Estudo MASPDocument35 pagesEstudo MASPedsonflorentino1740100% (1)