Professional Documents
Culture Documents
Atividades de Equilibrio
Uploaded by
bininha89Original Description:
Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Atividades de Equilibrio
Uploaded by
bininha89Copyright:
Available Formats
Questões Enem
Equilíbrio Químico e Iônico
1) (UFV-MG–2009) O metanol, usado como combustível, A) a produção de monóxido de dinitrogênio aumenta com o
pode ser obtido industrialmente pela hidrogenação do aumento de temperatura.
monóxido de carbono, de acordo com a equação B) a adição de um catalisador aumenta a formação do gás
representada a seguir: hilariante.
C) o equilíbrio químico é atingido quando as concentrações
dos produtos se igualam.
D) um aumento na concentração de água desloca o
equilíbrio químico no sentido da reação de formação do
Assinale a afirmativa INCORRETA. monóxido de dinitrogênio.
A) A diminuição da temperatura favorece a produção do E) uma diminuição na concentração de monóxido de
metanol. dinitrogênio desloca o equilíbrio químico no sentido da
B) O aumento da pressão total sobre o sistema favorece a reação de decomposição do nitrato de amônio.
produção do monóxido de carbono.
C) O aumento da concentração de H2 aumenta a 4) (Cesgranrio) Entre os antiácidos caseiros, destacam-se o
concentração de metanol no equilíbrio. leite de magnésia e o bicarbonato de sódio. Quantas vezes o
D) Trata-se de uma reação exotérmica leite de magnésia (pH = 11) é mais básico do que uma
solução de bicarbonato de sódio (pH = 8)?
2) UFMG–2009) O “galinho do tempo”, representado a A) 3 B) 19 C) 88 D) 100 E) 1 000
seguir, é um objeto que indica as condições meteorológicas,
pois sua coloração muda de acordo com a temperatura e a 5) (PUC-Campinas-SP) Uma área agrícola foi adubada com
umidade do ar. amônia, nitrato e fosfato de amônio. Na amostra das águas
residuais da irrigação dessa área, verifica-se que a
concentração de íons OH–(aq) é igual a 8x10–5 mol.L–1, a
25 ºC. Pode-se afirmar que a amostra tem pH igual a
Dados: log 8 = 0,90; Kw = [H+] . [OH–] = 1x10–14 a 25 ºC
A) 9,9. B) 8,5. C) 7,0. D) 6,9. E) 3,9.
6) FESP-PR) O vibrião colérico não sobrevive em meio de
pH = 3, ou mais ácido. O número de gotas de uma solução
1,0 M de ácido clorídrico que se deve introduzir em 10 litros
de água, a fim de eliminar o vibrião colérico é
Dado: Admita que não há alteração de volume e que o
Nesse caso, a substância responsável por essa mudança de volume de uma gota é 0,05 mL
coloração é o cloreto de cobalto, CoCℓ2, que, de acordo com A) 10 gotas. B) 100 gotas C) 30 gotas D) 200 gotas. E) 50 gotas.
a situação, apresenta duas cores distintas – azul ou rosa –,
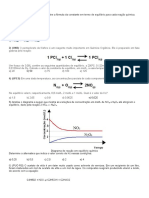
como representado nesta equação: 7) (UFOP-MG–2008) A figura a seguir apresenta uma
escala relativa de pH de diversas misturas e soluções
aquosas bastante comuns.
Considerando-se essas informações, é CORRETO afirmar
que as duas condições que favorecem a ocorrência, no
“galinho do tempo”, da cor azul são
A) alta temperatura e alta umidade.
B) alta temperatura e baixa umidade.
C) baixa temperatura e alta umidade.
D) baixa temperatura e baixa umidade Tomando por base essa escala relativa e considerando a
[H3O+] como critério de acidez, é CORRETO afirmar que
3) (PUC RS) O monóxido de dinitrogênio, quando inalado A) o suco gástrico é cerca de três vezes mais ácido que o
em pequenas doses, produz uma espécie de euforia, daí ser suco de tomate.
chamado de gás hilariante. Ele pode ser obtido por meio da B) o suco de limão é cerca de 100 vezes mais ácido que o
decomposição do nitrato de amônio, conforme equação suco de tomate.
representada a seguir: C) o sangue é cerca de quatro vezes mais básico que o leite
de magnésia.
D) o alvejante é cerca de 100 vezes mais básico que o
amoníaco de limpeza.
Com relação a essa reação em equilíbrio, está CORRETO
afirmar que
8) (UFMG) Quando um mol de amônia é aquecido em um
sistema fechado, a uma determinada temperatura, 50% do A) ocorre o aumento da constante de equilíbrio da reação de
composto se dissocia, estabelecendo-se o equilíbrio. síntese da oxiemoglobina.
B) a constante de equilíbrio da reação de síntese da
oxiemoglobina não se altera.
C) ocorre a diminuição da constante de equilíbrio da reação
de síntese da oxiemoglobina.
A soma das quantidades de matéria, em mols, das D) ocorre um aumento da pressão parcial do O2(g) e da
substâncias presentes na mistura em equilíbrio é concentração de oxiemoglobina.
A) 3,0. E) ocorre uma diminuição da pressão parcial do O2(g) e da
B) 2,5. concentração de oxiemoglobina.
C) 2,0.
D) 1,5. 11) O equilíbrio químico se caracteriza por ser uma
E) 1,0. dinâmica em nível microscópico. Para se ter uma
informação quantitativa da extensão do equilíbrio químico,
9) (Enem–2009) Sabões são sais de ácidos carboxílicos de usa-se a grandeza constante de equilíbrio. Considere a
cadeia longa utilizados com a finalidade de facilitar, durante tirinha a seguir: Aplicada ao equilíbrio químico, a ideia que
processos de lavagem, a remoção de substâncias de baixa o personagem tem sobre equilíbrio:
solubilidade em água, por exemplo, óleos e gorduras. A
figura a seguir representa a estrutura de uma molécula de
sabão.
Em solução, os ânions do sabão podem hidrolisar a água e,
desse modo, formar o ácido carboxílico correspondente. Por
exemplo, para o estearato de sódio, é estabelecido o seguinte a) É correta, pois, no equilíbrio químico, metade das
equilíbrio: quantidades sempre é de produtos, e a outra metade é de
reagentes.
b) Não é correta, pois, no equilíbrio químico, as
concentrações de produtos e as de reagentes podem ser
diferentes, mas são constantes.
Uma vez que o ácido carboxílico formado é pouco solúvel c) É correta, pois, no equilíbrio químico, as concentrações
em água e menos eficiente na remoção de gorduras, o pH do de reagentes e as de produtos sempre são iguais, desde que o
meio deve ser controlado de maneira a evitar que o equilíbrio não seja perturbado por um efeito externo.
equilíbrio anterior seja deslocado para a direita. d) Não é correta, pois, no equilíbrio químico, as
Com base nas informações do texto, é CORRETO concluir concentrações dos produtos sempre são maiores que as dos
que os sabões atuam de maneira reagentes, desde que o equilíbrio não seja afetado por um
A) mais eficiente em pH básico. fator externo.
B) mais eficiente em pH ácido. e) É correta, pois, no equilíbrio químico, as concentrações
C) mais eficiente em pH neutro. de reagentes e as de produtos sempre não são iguais
D) eficiente em qualquer faixa de pH.
E) mais eficiente em pH ácido ou neutro. 12) Os refrigerantes têm-se tornado cada vez mais o alvo de
políticas públicas de saúde. Os de cola apresentam ácido
10) Jogadores de futebol e alpinistas necessitam de um fosfórico, substância prejudicial à fixação de cálcio, o
período de aclimatação, a fim de se minimizarem os efeitos material que é o principal componente da matriz dos dentes.
das grandes altitudes. Nesse tipo de situação, o ar é rarefeito A cárie é um processo dinâmico de desequilíbrio do
e a baixa quantidade de oxigênio acarreta alguns processo de desmineralização dentária, perda de minerais
desconfortos físicos, tais como dores de cabeça, fadiga, em razão da acidez. Sabe-se que o principal componente do
náuseas e, em casos mais graves, o indivíduo pode entrar no esmalte do dente é um sal denominado hidroxiapatita. O
estado de coma, o que pode levá-lo ao óbito. refrigerante, pela presença de sacarose, faz decrescer o pH
do biofilme (placa bacteriana), provocando a
desmineralização do esmalte dentário. Os mecanismos de
A hemoglobina é a responsável pelo transporte de oxigênio defesa salivar levam de 20 a 30 minutos para normalizar o
inalado para as células de nosso organismo na forma de nível do pH, remineralizando o dente. A equação química
oxiemoglobina. Esse processo é representado pela equação seguinte representa esse processo:
não balanceada:
Hemoglobina(aq) + O2(g) Oxiemoglobina(aq)
Durante o período de aclimatação, o organismo aumenta a
taxa de produção de hemoglobina, restabelecendo os níveis
de oxigenação nas células e
e) Não foi realizada, pois o caráter neutro da cal virgem
Considerando que uma pessoa consuma refrigerantes promove o deslocamento do equilíbrio descrito para a
diariamente, poderá ocorrer um processo de esquerda, em decorrência da manutenção do pH do meio.
desmineralização dentária, devido ao aumento da
concentração de:
a) OH-, que reage com os íons Ca2+, deslocando o
equilíbrio para a direita.
b) H+, que reage com as hidroxilas OH-, deslocando o
equilíbrio para a direita.
c) OH-, que reage com os íons Ca2+, deslocando o
equilíbrio para a esquerda.
d) H+, que reage com as hidroxilas OH-, deslocando o
equilíbrio para a esquerda.
e) Ca2+, que reage com as hidroxilas OH-, deslocando o
equilíbrio para a esquerda.
13) Às vezes, ao abrir um refrigerante, percebe-se que uma
parte do produto vaza rapidamente pela extremidade do
recipiente. A explicação para esse fato está relacionada à
perturbação do equilíbrio químico existente entre alguns dos
ingredientes do produto de acordo com a equação:
A alteração do equilíbrio anterior, relacionada ao vazamento
do refrigerante nas condições descritas, tem como
consequência a:
a) Liberação de CO2 para o ambiente.
b) Elevação da temperatura do recipiente.
c) Elevação da pressão interna do recipiente.
d) Elevação da concentração de CO2 no líquido.
e) Formação de uma quantidade significativa de H2O.
14) O pH do solo pode variar em uma faixa significativa
devido a várias causas. Por exemplo, o solo de áreas com
chuvas escassas, mas com concentrações elevadas do sal
solúvel carbonato de sódio (Na2CO3), torna-se básico
devido à reação de hidrólise do íon carbonato, segundo o
equilíbrio:
Esses tipos de solo são alcalinos demais para fins agrícolas e
devem ser remediados pela utilização de aditivos químicos.
BAIRD, C. Química ambiental. São Paulo: Artmed, 1995
(adaptado).
Suponha que, para remediar uma amostra desse tipo de solo,
um técnico tenha utilizado como aditivo a cal virgem (CaO).
Nesse caso a remediação:
a) Foi realizada, pois o caráter básico da cal virgem
promove o deslocamento do equilíbrio descrito para a
direita, em decorrência da elevação do pH do meio.
b) Foi realizada, pois o caráter ácido da cal virgem promove
o deslocamento do equilíbrio descrito para a esquerda, em
decorrência da redução do pH do meio.
c) Não foi realizada, pois o caráter ácido da cal virgem
promove o deslocamento do equilíbrio descrito para a
direita, em decorrência da redução do pH do meio.
d) Não foi realizada, pois o caráter básico da cal virgem
promove o deslocamento do equilíbrio descrito para a
esquerda, em decorrência da elevação do pH do meio.
You might also like
- Apostila Química Orgânica: Carbono, Dienos E AromáticosFrom EverandApostila Química Orgânica: Carbono, Dienos E AromáticosNo ratings yet
- Teste N.º7Document6 pagesTeste N.º7Tania FernandesNo ratings yet
- Lista Revisão PO 2oano - 2osemestreDocument10 pagesLista Revisão PO 2oano - 2osemestremauoscuroNo ratings yet
- Biofísica para ciências biomédicas – 4ª ediçãoFrom EverandBiofísica para ciências biomédicas – 4ª ediçãoNo ratings yet
- 4teste - 11º Ano V1-1101 VFFDocument6 pages4teste - 11º Ano V1-1101 VFFSofia DiasNo ratings yet
- Docs6b25u0grnk4ti3ev - Pdfresponse Content Disposition Attachment3b20fDocument6 pagesDocs6b25u0grnk4ti3ev - Pdfresponse Content Disposition Attachment3b20fVera Alexa 18310No ratings yet
- Apostila Química Orgânica: Terpenos E Rotas De SínteseFrom EverandApostila Química Orgânica: Terpenos E Rotas De SínteseNo ratings yet
- PH e Poh Lista 2ºbim. 3ºano .Document2 pagesPH e Poh Lista 2ºbim. 3ºano .paralemalu80No ratings yet
- Alfa - Módulo 45Document20 pagesAlfa - Módulo 45Juliano Abreu PrattiNo ratings yet
- Espcex - Lista 14 Equilíbrio QuímicoDocument2 pagesEspcex - Lista 14 Equilíbrio Químico27.marcos9521100% (1)
- Saerj 2012 1bim 3anoDocument3 pagesSaerj 2012 1bim 3anoCamilla VieiraNo ratings yet
- Lista 7 ITA 2009Document5 pagesLista 7 ITA 2009edfloydNo ratings yet
- Deslocamento de Equilibrio Quimica Exercicios GabaritoDocument29 pagesDeslocamento de Equilibrio Quimica Exercicios GabaritoAdolfo GomesNo ratings yet
- Simulado FTC QuimicaDocument9 pagesSimulado FTC QuimicaUelder Jeferson SantosNo ratings yet
- Lista de Exercícios Química 2º Ano Prof. Brainer 1. (Uema) Na EquaçãoDocument7 pagesLista de Exercícios Química 2º Ano Prof. Brainer 1. (Uema) Na EquaçãoMaria Eduarda SchullerNo ratings yet
- Lista Complementar de Exercícios: Ensino Médio 3º AnoDocument10 pagesLista Complementar de Exercícios: Ensino Médio 3º AnogabezmirandaNo ratings yet
- Quimica 1Document4 pagesQuimica 1eusebiawatalaNo ratings yet
- Espcex - Lista 14 Equilíbrio QuímicoDocument3 pagesEspcex - Lista 14 Equilíbrio Químico27.marcos9521No ratings yet
- Soluções IDocument16 pagesSoluções IEduardo AlbinoNo ratings yet
- Lista Sobre Equilíbrio Químico Química Geral PresençaDocument4 pagesLista Sobre Equilíbrio Químico Química Geral PresençaAriélly RolimNo ratings yet
- Equi Lib RioDocument3 pagesEqui Lib RioJhennifer FonsecaNo ratings yet
- Equilc3adbrio Ic3b4nicoDocument3 pagesEquilc3adbrio Ic3b4nicoromansara966No ratings yet
- Química - Prof. Rafael - Equilíbrio Químico e Deslocamento de EquilíbrioDocument12 pagesQuímica - Prof. Rafael - Equilíbrio Químico e Deslocamento de EquilíbrioRafael VaristeloNo ratings yet
- Fisico Quimica Equilibrio Quimico PDFDocument20 pagesFisico Quimica Equilibrio Quimico PDFLeonardo PyrrhoNo ratings yet
- Fisico Quimica Equilibrio Quimico PDFDocument20 pagesFisico Quimica Equilibrio Quimico PDFEricson Andre MonteiroNo ratings yet
- 7 Lista - Equilíbrio IônicoDocument2 pages7 Lista - Equilíbrio IônicoClertan Souza Martins de PaulaNo ratings yet
- Questões - Equilíbrio Químico e IônicoDocument20 pagesQuestões - Equilíbrio Químico e IônicoMariana BarçanteNo ratings yet
- Exercicios de Forças e NoxDocument8 pagesExercicios de Forças e NoxpedromsjNo ratings yet
- Prof. Rafa - Química - Equilíbrio QuímicoDocument9 pagesProf. Rafa - Química - Equilíbrio QuímicoRafael VaristeloNo ratings yet
- Lista de Exercícios - Equilíbrio QuímicoDocument7 pagesLista de Exercícios - Equilíbrio QuímicoIzabelleNo ratings yet
- 53-Equilíbrio Iônico Na ÁguaDocument7 pages53-Equilíbrio Iônico Na Águanv77vnmNo ratings yet
- EXERCÍCIOSDocument17 pagesEXERCÍCIOSAlexssan drive100% (1)
- Effq22. Equilíbio Iônico Ki, Ka e KB PDFDocument6 pagesEffq22. Equilíbio Iônico Ki, Ka e KB PDFjoao victorNo ratings yet
- Lista de Exercícios PH e pOHDocument4 pagesLista de Exercícios PH e pOHCamila VitoriaNo ratings yet
- Ficha Revisões Química TitulaçãoDocument6 pagesFicha Revisões Química TitulaçãoIsaac OliveiraNo ratings yet
- Novo 11Q NL (Teste2) Maio2021Document7 pagesNovo 11Q NL (Teste2) Maio2021Sofia CarvalhoNo ratings yet
- Exerc PHDocument56 pagesExerc PHHercilio ArmandoNo ratings yet
- Teste de Avaliação: Domínio 2 Reações em Sistemas Aquosos Subdomínio 1 Reações Ácido-BaseDocument4 pagesTeste de Avaliação: Domínio 2 Reações em Sistemas Aquosos Subdomínio 1 Reações Ácido-BaseCristina CoragemNo ratings yet
- Lista de Exercícios Sobre Estequiometria e SoluçõesDocument3 pagesLista de Exercícios Sobre Estequiometria e SoluçõesAna IsabellaNo ratings yet
- ListaequilibrioDocument17 pagesListaequilibriolinynhaline100% (1)
- Ficha Acido BaseDocument4 pagesFicha Acido Basejoao sequeiraNo ratings yet
- 2º ANO - Equilibrio IonicoDocument8 pages2º ANO - Equilibrio Ionicomatheus xexeuNo ratings yet
- Provbim2ºano3 Etcmm 22Document5 pagesProvbim2ºano3 Etcmm 22Daniel SousaNo ratings yet
- Deslocamento de EquilíbrioDocument29 pagesDeslocamento de EquilíbrioFernandes YoshimotoNo ratings yet
- Prova 2 ANO Unidade 2 (QUÌMICA)Document5 pagesProva 2 ANO Unidade 2 (QUÌMICA)Anna CarllaNo ratings yet
- Ficha - Avaliacao - Equilibrio QuímicoDocument6 pagesFicha - Avaliacao - Equilibrio QuímicoCarla CruzNo ratings yet
- Ae q11 Fich Form 1Document5 pagesAe q11 Fich Form 1Ana Raquel PintoNo ratings yet
- 2012 - TEmescam - Química - Borges - Deslocamento de EquilíbrioDocument7 pages2012 - TEmescam - Química - Borges - Deslocamento de EquilíbrioKlebson Santos da SilvaNo ratings yet
- Ae rq11 Ficha 1Document9 pagesAe rq11 Ficha 1Juliana SáNo ratings yet
- Gab - gb22 Lrp3b.qui 2emaeb 3bimDocument3 pagesGab - gb22 Lrp3b.qui 2emaeb 3bimabidabugaNo ratings yet
- Bloco 2 Aula 11 e 12 Propriedades ColigativasDocument5 pagesBloco 2 Aula 11 e 12 Propriedades ColigativasMax NunesNo ratings yet
- Atividades de EquilibrioDocument5 pagesAtividades de Equilibriobininha89No ratings yet
- Ae q11 Fich Form 1Document5 pagesAe q11 Fich Form 1Mariana Coelho100% (4)
- Exercícios Cinética e EquilíbrioDocument8 pagesExercícios Cinética e EquilíbrioBruna FerreiraNo ratings yet
- Teste 3 - CeppeaDocument4 pagesTeste 3 - CeppeaMartins AiupaNo ratings yet
- EquilibrioIonico - AvançadosDocument4 pagesEquilibrioIonico - AvançadosSaymon SiqueiraNo ratings yet
- Exercicios Equilibrio IonicoDocument2 pagesExercicios Equilibrio IonicokamilaringenbergNo ratings yet
- 5º Teste 3º P 11º A 18-19 v9Document5 pages5º Teste 3º P 11º A 18-19 v9sofiaNo ratings yet
- Relatorio Dimensionamento Do CicloneDocument16 pagesRelatorio Dimensionamento Do Ciclonebininha89No ratings yet
- Operações Unitárias II - RefrigeraçãoDocument37 pagesOperações Unitárias II - Refrigeraçãobininha89No ratings yet
- Operações Unitárias II - RefrigeraçãoDocument37 pagesOperações Unitárias II - Refrigeraçãobininha89No ratings yet
- Operações Unitárias II - RefrigeraçãoDocument37 pagesOperações Unitárias II - Refrigeraçãobininha89No ratings yet
- Quimica Separacao de Fases ExerciciosDocument10 pagesQuimica Separacao de Fases ExerciciosDaniel FilhoNo ratings yet
- Química 1Document1 pageQuímica 1bininha89No ratings yet
- EvaporadoresDocument38 pagesEvaporadoresedu15987No ratings yet
- Enade-2008 2Document31 pagesEnade-2008 2Genilson E Neliane SilvaNo ratings yet
- Exercicios Geometria Molecular Gabarito ResolucaoDocument8 pagesExercicios Geometria Molecular Gabarito ResolucaoNatália BrazNo ratings yet
- EvaporadoresDocument38 pagesEvaporadoresedu15987No ratings yet
- Enade-2008 2Document31 pagesEnade-2008 2Genilson E Neliane SilvaNo ratings yet
- Enade Química 2005 PDFDocument36 pagesEnade Química 2005 PDFAnna OliveiraNo ratings yet
- Enade Química 2005 PDFDocument36 pagesEnade Química 2005 PDFAnna OliveiraNo ratings yet
- Enade-2008 2Document31 pagesEnade-2008 2Genilson E Neliane SilvaNo ratings yet
- Físico Quimica II EletroquimicaDocument48 pagesFísico Quimica II Eletroquimicabininha89No ratings yet
- Enade Química 2005 PDFDocument36 pagesEnade Química 2005 PDFAnna OliveiraNo ratings yet
- Plano de Ensino Op 2Document5 pagesPlano de Ensino Op 2bininha89No ratings yet
- EvaporadoresDocument38 pagesEvaporadoresedu15987No ratings yet
- Plano de Ensino Op 2Document5 pagesPlano de Ensino Op 2bininha89No ratings yet
- Bombeamento de PolpaDocument78 pagesBombeamento de PolpaGeovaneSouzaNo ratings yet
- Atividade de Físico Química II - 2 ProvaDocument1 pageAtividade de Físico Química II - 2 Provabininha89No ratings yet
- Cinética QuímicaDocument51 pagesCinética Químicabininha89No ratings yet
- Diagrama de FasesDocument34 pagesDiagrama de Fasesbininha89No ratings yet
- Diagrama de Fases - CópiaDocument34 pagesDiagrama de Fases - Cópiabininha89No ratings yet
- Fisico Química II - Aula 1Document48 pagesFisico Química II - Aula 1bininha89No ratings yet
- AbsorçãoDocument14 pagesAbsorçãobininha89No ratings yet
- OpII - Aula 1Document27 pagesOpII - Aula 1bininha89No ratings yet
- Operações Unitárias II - RefrigeraçãoDocument37 pagesOperações Unitárias II - Refrigeraçãobininha89No ratings yet
- Op Iii - Extração Liquido LiquidoDocument35 pagesOp Iii - Extração Liquido Liquidobininha89No ratings yet
- Aditivo para Radiador Tecbril Teccool Original Montadora Flex 1LDocument8 pagesAditivo para Radiador Tecbril Teccool Original Montadora Flex 1LMatheus VieiraNo ratings yet
- 00 - Tabela Periódica Colorida PDFDocument1 page00 - Tabela Periódica Colorida PDFEvilasio CostaNo ratings yet
- Fispq 48 Agua Sanitaria Zulu Codigo 660 661 662 Rev00Document17 pagesFispq 48 Agua Sanitaria Zulu Codigo 660 661 662 Rev00Erica EstanislauNo ratings yet
- 12Document2 pages12Gyy RochaNo ratings yet
- C1006Document8 pagesC1006Leonardo RibeiroNo ratings yet
- Resumão Reações Orgânicas - 4º PeríodoDocument2 pagesResumão Reações Orgânicas - 4º PeríodoGleidiane FerreiraNo ratings yet
- Ficha Trabalho CFQ 7 Ano Materiais e Concentracao 3Document3 pagesFicha Trabalho CFQ 7 Ano Materiais e Concentracao 3neb79No ratings yet
- ,NGHJKLDocument2 pages,NGHJKLAna Catarina Dias0% (1)
- Qo-cap.07-Alcenos e Alcinos I - Propriedades e Sinteses - Resumo-2012Document37 pagesQo-cap.07-Alcenos e Alcinos I - Propriedades e Sinteses - Resumo-2012Margarida MirandaNo ratings yet
- Aula Phmetria Retomada 2020.1Document25 pagesAula Phmetria Retomada 2020.1JOSE ROBERTO DA CRUZNo ratings yet
- Projecto Agra Fertilizer Protocolo de Análise de Nutrientes: 1. Determinação de PH Do SoloDocument35 pagesProjecto Agra Fertilizer Protocolo de Análise de Nutrientes: 1. Determinação de PH Do SoloHélio FaustinoNo ratings yet
- Dureza Total - Ondeo NalcoDocument4 pagesDureza Total - Ondeo NalcoAndréNo ratings yet
- SaisDocument3 pagesSaisFa BiNo ratings yet
- Aula de ComplexosDocument35 pagesAula de ComplexosKALINE MARIA CARVALHONo ratings yet
- Sedimentação MarinhaDocument56 pagesSedimentação MarinhaBruno Saraiva100% (1)
- 30-Geometria, Polaridade e InteraçõesDocument4 pages30-Geometria, Polaridade e Interaçõesnv77vnmNo ratings yet
- Lista de Exercícios - Materiais IDocument4 pagesLista de Exercícios - Materiais IRafael StangeNo ratings yet
- MÉTODO 7000 - Traduzido - ESPECTROFOTOMETRIA DE ABSORÇÃO ATÔMICA DA CHAMADocument25 pagesMÉTODO 7000 - Traduzido - ESPECTROFOTOMETRIA DE ABSORÇÃO ATÔMICA DA CHAMARafael SoaresNo ratings yet
- Resumo de Química para AC2 e AC3Document30 pagesResumo de Química para AC2 e AC3lucas 60fpsNo ratings yet
- Acidos, Bases, Sais e ÓxidosDocument23 pagesAcidos, Bases, Sais e ÓxidosANA CAROLINE CADORIN100% (1)
- CarbânionsDocument4 pagesCarbânionsJBNo ratings yet
- Aula - IsomeriaDocument59 pagesAula - IsomeriaLaryssa Kethelly100% (1)
- Minidicionário de QuímicaDocument116 pagesMinidicionário de QuímicaOmar de Camargo100% (4)
- Pratica 1 Pos e GranuladosDocument8 pagesPratica 1 Pos e GranuladosMárciaRebeloNo ratings yet
- E-Book Completo - Química Analítica Qualitativa - CENGAGE - V2 (Versão Digital)Document97 pagesE-Book Completo - Química Analítica Qualitativa - CENGAGE - V2 (Versão Digital)claudioNo ratings yet
- Soluções AquosasDocument11 pagesSoluções AquosasCarla Alexandra Estevam CanhotoNo ratings yet
- NPT - 027 - Unidades de Armazenamento Eou Beneficiamento de Produtos Agricolas e Insumos - Parte01Document12 pagesNPT - 027 - Unidades de Armazenamento Eou Beneficiamento de Produtos Agricolas e Insumos - Parte01Gustavo UchoaNo ratings yet
- Quadro Comparativo de Reações de Substituição e EliminaçãoDocument6 pagesQuadro Comparativo de Reações de Substituição e EliminaçãoPaulo AugustoNo ratings yet
- Experiência 7 - EletroquímicaDocument5 pagesExperiência 7 - EletroquímicaRodolfo TavaresNo ratings yet
- Focar: Supere a procrastinação e aumente a força de vontade e a atençãoFrom EverandFocar: Supere a procrastinação e aumente a força de vontade e a atençãoRating: 4.5 out of 5 stars4.5/5 (53)
- Treinamento cerebral: Compreendendo inteligência emocional, atenção e muito maisFrom EverandTreinamento cerebral: Compreendendo inteligência emocional, atenção e muito maisRating: 4.5 out of 5 stars4.5/5 (169)
- Os Códigos do Mindset da Prosperidade: destrave os bloqueios em sua mente e cresça em todos os aspectos de sua vidaFrom EverandOs Códigos do Mindset da Prosperidade: destrave os bloqueios em sua mente e cresça em todos os aspectos de sua vidaNo ratings yet
- Técnicas Proibidas de Manipulação Mental e PersuasãoFrom EverandTécnicas Proibidas de Manipulação Mental e PersuasãoRating: 5 out of 5 stars5/5 (3)
- Bololô: contém ferramentas de treinamento para pais e filhosFrom EverandBololô: contém ferramentas de treinamento para pais e filhosNo ratings yet
- Psicologia sombria: Poderosas técnicas de controle mental e persuasãoFrom EverandPsicologia sombria: Poderosas técnicas de controle mental e persuasãoRating: 4 out of 5 stars4/5 (92)
- Técnicas De Terapia Cognitivo-comportamental (tcc)From EverandTécnicas De Terapia Cognitivo-comportamental (tcc)No ratings yet
- Diálogo entre Terapia do Esquema e Terapia Focada na Compaixão: Contribuição à integração em Psicoterapias Cognitivo-ComportamentaisFrom EverandDiálogo entre Terapia do Esquema e Terapia Focada na Compaixão: Contribuição à integração em Psicoterapias Cognitivo-ComportamentaisRating: 5 out of 5 stars5/5 (1)
- Treinamento cerebral: Como funcionam a inteligência e o pensamento cognitivo (2 em 1)From EverandTreinamento cerebral: Como funcionam a inteligência e o pensamento cognitivo (2 em 1)Rating: 4.5 out of 5 stars4.5/5 (29)
- 35 Técnicas e Curiosidades Mentais: Porque a mente também deve evoluirFrom Everand35 Técnicas e Curiosidades Mentais: Porque a mente também deve evoluirRating: 5 out of 5 stars5/5 (3)
- Treino de Habilidades Sociais: processo, avaliação e resultadosFrom EverandTreino de Habilidades Sociais: processo, avaliação e resultadosRating: 5 out of 5 stars5/5 (2)
- Biomecânica Básica dos Exercícios: Membros InferioresFrom EverandBiomecânica Básica dos Exercícios: Membros InferioresRating: 3.5 out of 5 stars3.5/5 (8)
- Elaboração de programas de ensino: material autoinstrutivoFrom EverandElaboração de programas de ensino: material autoinstrutivoNo ratings yet
- Psicanálise de boteco: O inconsciente na vida cotidianaFrom EverandPsicanálise de boteco: O inconsciente na vida cotidianaRating: 5 out of 5 stars5/5 (1)
- Cartas de um terapeuta para seus momentos de criseFrom EverandCartas de um terapeuta para seus momentos de criseRating: 4 out of 5 stars4/5 (11)
- Simplificando o Autismo: Para pais, familiares e profissionaisFrom EverandSimplificando o Autismo: Para pais, familiares e profissionaisNo ratings yet