Professional Documents
Culture Documents
SERIE1 Quimica Orgánica 1451 PDF
Uploaded by
Diana Moedano0 ratings0% found this document useful (0 votes)
14 views10 pagesOriginal Title
SERIE1 Quimica Orgánica 1451.pdf
Copyright
© © All Rights Reserved
Available Formats
PDF or read online from Scribd
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
© All Rights Reserved
Available Formats
Download as PDF or read online from Scribd
0 ratings0% found this document useful (0 votes)
14 views10 pagesSERIE1 Quimica Orgánica 1451 PDF
Uploaded by
Diana MoedanoCopyright:
© All Rights Reserved
Available Formats
Download as PDF or read online from Scribd
You are on page 1of 10
Capitulo 1: Atomo, enlace y conceptos
1.1 Defina los términos siguientes.
a) orbital i) electrones no enlazantes
b) orbitales degenerados }) enlace polar
c) orbitales s k) carga formal
¢) orbital p 1) acido y base de Arrhenius
e) electrones de valencia m) acido y base de Bronsted-Lowry
f) enlace iénico n) acido y base de Lewis
g) enlace covalente 0) electrafilo
h) estructura de Lewis p) nucledfilo
4.2 Nombre el elemento que corresponda a cada configuracién electronica
a) 18°28?2p? b) 1872s72p* c) 1872872p%3s73p3 d) 1572s?2p%3s?3p5
4.3 Para todos los enlaces de cada compuesto, diga si el enlace es covalente, iénico o
covalente polarizado.
a)NaCl b)NaOH c)CHCl d)CHsLi e)NaOCH; f)HCO;Na 4) CF,
4.4 Escriba una estructura de Lewis para cada una de las especies siguientes.
a) NaH, b) NzH —c) (CH)KNCI_d) CH3CHO—€) CHsNCO__f) CHsOSO,0CH,
g)CO h) CO. i) NCCH;COCH;CHO j) CHsCHCHCH,CHCHCOOH
4.5 Identifique en los compuestos siguientes el 0 los grupos funcionales e indique cual
8 el tipo de hibridacién que tiene el dtomo del grupo funcional
ry
a) b) Lo. ° 5
© Cr H,N~ coo
a ‘ ‘OH
H
0 | ®) h) ® oH
Loe
o7 “cl
1.6 Para cada una de las estructuras de Lewis siguientes
a) Calcule la carga formal de todos los atomos, excepto la de hidrégeno. Todos
son eléctricamente neutros excepto aquellos en los que se indica su carga.
a) ») NN 20
°
yp é
° 4 7 a ¢
/e@ 9 AN
1.7 Teniendo en cuenta la electronegatividad, establezca la direccién de los momentos
dipolares de los enlaces siguientes.
aC-C b)CH c)CLi dCN e)C-O
NCB g)CMg h)NH OH j)C-Br
1.8 Determine si los pares de estructuras siguientes, son compuestos diferentes o
Tepresentan formas de resonancia del mismo compuesto.
°
a) 9 9. b) 9 °
o®
y y 2,
¢)
OC O a iC
I i
C. C.
H7@™H HH
®) ® @
HeCx CH, HAC~. CH,
SQ CHe bC~ 2=CH.
c ¥ G
q uu AG % oH
1.9 Represente las estructuras de resonancia para observar la deslocalizacion de
cargas en los iones siguientes
a) = b)
wD
d)
°) 2
oO
e
° a ei eae
wlhKAs, Sy
1.10 El compuesto siguiente puede protonarse en cualquiera de los atomos de
nitrégeno, no obstante, uno de esos nitrégenos es mucho mas basico que los otros.
Represente las formas de resonancia y determine que atomo de nitrégeno es el mas
basico.
NH
NH—cZ
Ke NH,
1.11 Para cada par de jones, determine cual es més estable. Use formas de
resonancia para explicar la respuesta.
FOS en Bre PS
°
HC—CHy 0 HG
1.12 Ordene los compuestos siguientes por orden creciente de acidez, explicando las
tazones de este ordenamiento,
a) NHs b) H2SO, c) CHyOH d) CHsCOOH
4.43 Ordene los compuestos siguientes por orden creciente de basicidad, explicande
las razones de esta clasificaci6n
a)CH;O —b)CHjCOOH =e) CH;COO’ sd) N@OH se) NE
4.44 La K, del Scido fenilacético es 5.2x10~° y el pX, del écido propiénico es 4.87,
°
OH
3
OH Son
dcido fonilacético Ka=5.2x 108 ado Propionico Pka = 4.67
a) Calcule el pK, del acido fenilacético y la K, del acido propionico.
) 4Cual de los acidos es el mas fuerte?
©) Prediga si el siguiente equilibrio favoreceré a los reactivos 0 a los productos,
explique:
CH,COO" + CHsCH,COOH +—* €\-cn,c00* CH3CHZCOO"
4.18 Prediga los productos de las reacciones Acido-base siguientes.
a) CHsCOOH + (CHs)gN? ———»
i
b) o
ou
@
©) (CH,)3NH_ + K*OH ———>
da)
You might also like
- Tercer Examen ReactquimhomDocument3 pagesTercer Examen ReactquimhomDiana MoedanoNo ratings yet
- FerrostalDocument33 pagesFerrostalDiana MoedanoNo ratings yet
- Curvas de secado clasificaciónDocument6 pagesCurvas de secado clasificaciónDiana MoedanoNo ratings yet
- Previo Secador Rotatorio-Diana Laura Moedano PérezDocument7 pagesPrevio Secador Rotatorio-Diana Laura Moedano PérezDiana MoedanoNo ratings yet
- Para Obtener Él Titulo De: Ingeniero Químico Industrial PresentanDocument45 pagesPara Obtener Él Titulo De: Ingeniero Químico Industrial PresentanDiana MoedanoNo ratings yet
- Catálisis 2Document18 pagesCatálisis 2Diana MoedanoNo ratings yet
- Poster ICWS RRDocument2 pagesPoster ICWS RRDiana MoedanoNo ratings yet
- LN KDocument2 pagesLN KDiana MoedanoNo ratings yet
- Solucion Del Examen PDFDocument5 pagesSolucion Del Examen PDFDiana MoedanoNo ratings yet
- Traducción CatalisisDocument13 pagesTraducción CatalisisDiana MoedanoNo ratings yet
- Poster ICWS RRDocument2 pagesPoster ICWS RRDiana MoedanoNo ratings yet
- T Are A LeonardoDocument4 pagesT Are A LeonardoDiana MoedanoNo ratings yet
- P6EQ7Document8 pagesP6EQ7Ybonhe Ahava Ezmer100% (1)
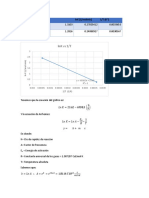
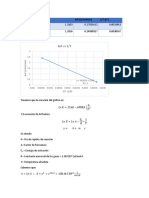
- LNK Vs 1/T: LNK (L/Molmin) 1/T (K) K (L/Molmin) A 297.15 K K (L/Molmin) A 327.15 KDocument2 pagesLNK Vs 1/T: LNK (L/Molmin) 1/T (K) K (L/Molmin) A 297.15 K K (L/Molmin) A 327.15 KDiana MoedanoNo ratings yet
- Cinética Inf 4.Document6 pagesCinética Inf 4.Diana MoedanoNo ratings yet
- ConclusionesDocument2 pagesConclusionesDiana MoedanoNo ratings yet
- Tarea 1Document3 pagesTarea 1Diana MoedanoNo ratings yet
- Conclusion EsDocument2 pagesConclusion EsDiana MoedanoNo ratings yet
- ProblemaDocument2 pagesProblemaDiana MoedanoNo ratings yet
- P Ka'sDocument6 pagesP Ka'sSalvador ZúñigaNo ratings yet
- Publicidad Subliminal en Nuestros TiemposDocument9 pagesPublicidad Subliminal en Nuestros TiemposDiana MoedanoNo ratings yet
- TernarioDocument7 pagesTernarioDiana MoedanoNo ratings yet
- Dispersion LuzDocument50 pagesDispersion LuzDiana MoedanoNo ratings yet
- GraficoDocument2 pagesGraficoDiana MoedanoNo ratings yet
- TernarioDocument7 pagesTernarioDiana MoedanoNo ratings yet
- Dispersion LuzDocument50 pagesDispersion LuzDiana MoedanoNo ratings yet
- Sistemas dispersos, propiedades fisicoquímicas y mecanismos de preparaciónDocument10 pagesSistemas dispersos, propiedades fisicoquímicas y mecanismos de preparaciónDiana MoedanoNo ratings yet
- Tabla Del ReporteDocument2 pagesTabla Del ReporteDiana MoedanoNo ratings yet
- Result A DosDocument1 pageResult A DosDiana MoedanoNo ratings yet
- BancoDocument1 pageBancoDiana MoedanoNo ratings yet