Professional Documents
Culture Documents
Des Ti Lac Ion
Uploaded by
Régulo Carrillo MillánCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Des Ti Lac Ion
Uploaded by
Régulo Carrillo MillánCopyright:
Available Formats
UNIVERSIDAD CATÓLICA ANDRÉS BELLO
DEPARTAMENTO DE QUÍMICA
LABORATORIO DE QUÍMICA
PRACTICA Nº 8
DESTILACIÓN. DETERMINACIÓN DE PUNTOS DE EBULLICIÓN
1.-OBJETIVOS
• Determinar el Punto de ebullición del agua en el laboratorio (UCAB)
• Identificar una sustancia pura a partir de su punto de ebullición utilizando
la técnica de destilación.
2.- ESTUDIO PREVIO
Antes de realizar esta práctica se debe repasar :
• Fuerzas intermoleculares
• Diagrama de fases
• Curvas de calentamiento
• Presión de Vapor
• Equilibrio líquido - vapor
• Procesos de destilación sencillo y fraccionada
• Punto de ebullición de sustancias puro
• Ecuación de Clapeyron.
3.- INTRODUCCIÓN TEÓRICA
En la naturaleza se encuentran muy pocos compuestos o elementos en
estado puro, por lo general estos están mezclados con otras sustancias.
Con el propósito de separar un compuesto de otros, se han desarrollado
diferentes técnicas, tales como cromatografía, separación en solventes,
destilación, entre otras.
La destilación ha sido utilizada frecuentemente para separar los
componentes volátiles de una mezcla líquida, y está basada en el hecho de
que si una solución ideal está en equilibrio con su vapor, el componente más
volátil de la mezcla será relativamente más rico en el vapor.
Existen básicamente dos tipos de destilación:
a) Sencilla: Se utiliza para separar dos sustancias volátiles cuyos puntos de
ebullición posean una diferencia de temperatura apreciable (más de 10ºC).
b) Fraccionada: Se utiliza para separar dos o más sustancias volátiles que
tengan puntos de ebullición cercanos.
4.- PARTE EXPERIMENTAL
4.1 DETERMINACIÓN DE LA TEMPERATURA DE EBULLICIÓN DEL
AGUA.
• Montar el equipo de destilación con los lineamientos del profesor.
• Agregar el agua y las perlas de ebullición en el balón de
destilación
• Caliente suavemente, y al comenzar la ebullición anote la
temperatura.
• Tomar valores de temperatura cada cierto tiempo (el indicado por
el profesor).
4.2 DETERMINACIÓN DE LA TEMPERATURA DE EBULLICIÓN DE
UNA SUSTANCIA DESCONOCIDA.
• Coloque la muestra a identificar asignada por su profesor y las perlas de
vidrio, en el balón de destilación y siga el mismo procedimiento de la
sección 4.1
4.3 CÁLCULOS Y RESULTADOS
• Mida la presión barométrica del laboratorio (Presión en la UCAB).
• Realizar la gráfica temperatura en función del tiempo. Señalar donde la
temperatura de ebullición permanece constante. Tome este valor.
• Utilizando la ecuación de Clapeyron, determine el punto de ebullición del
agua en la UCAB.
• Compare el valor experimental con el calculado con la ecuación. Analice
ambos resultados.
• Determine el % de error entre las temperaturas de ebullición del agua.
• De igual manera calcule el punto de ebullición de la sustancia
desconocida para así identificarla a partir de datos teóricos de las
propiedades de las sustancias.
ECUACION DE CLAPEYRON
P ∆H eb 1 1
ln 2 = −
P1 R T1 T2
6. PREGUNTAS DE LA PRÁCTICA.
1.- Defina:
a) Temperatura de ebullición b) Calor de ebullición c) Temperatura de fusión
d) Calor de fusión.
2.- ¿Qué es presión de vapor? ¿Cuál es la relación entre presión de vapor y
temperatura de ebullición?
3.- ¿Qué es volatilidad? ¿Por qué cada liquido tiene una volatilidad diferente?
4.- Explique cuales son las condiciones para que se establezca:
a) el equilibrio Líquido - sólido b) el equilibrio Líquido – vapor
5.- Explique por qué la temperatura de fusión no depende de la presión
ambiental y la de ebullición si.
6.- ¿Por qué cada sustancia tiene una temperatura de ebullición normal
diferente (alta o baja).
7.- ¿Qué utilidad tiene, en esta práctica, la ecuación de Clapeyron?
8.- Ud. en el laboratorio va a determinar la temperatura de ebullición de una
sustancia dada. ¿Cómo se calcula el % de error con respecto al valor reportado
en la literatura?
4. TEXTOS DE CONSULTA:
Libros de Texto de Química General.
Material del Laboratorio Virtual UCAB.
You might also like
- Brochure PropitalDocument17 pagesBrochure PropitalRégulo Carrillo MillánNo ratings yet
- Donacion Alicia GobernacionDocument2 pagesDonacion Alicia GobernacionRégulo Carrillo MillánNo ratings yet
- Trabajo de GeologiaDocument8 pagesTrabajo de GeologiaRégulo Carrillo MillánNo ratings yet
- Covenin 338-2002Document9 pagesCovenin 338-2002Bianca MedinaNo ratings yet
- Ejemplo Proctor ModificadoDocument2 pagesEjemplo Proctor ModificadoRégulo Carrillo MillánNo ratings yet
- CM6Document4 pagesCM6Régulo Carrillo MillánNo ratings yet
- Autovalores y Autovectores 1Document1 pageAutovalores y Autovectores 1Régulo Carrillo MillánNo ratings yet
- 4to Grado - Tareas de Matemática. Año Escolar 2016-2017.Document82 pages4to Grado - Tareas de Matemática. Año Escolar 2016-2017.Alberto Idrogo100% (2)
- Dr. Jorge Alberto Goñi ArevaloDocument4 pagesDr. Jorge Alberto Goñi ArevaloJaquelineNo ratings yet
- Exhibición Maquinaria Pesada AzucareraDocument20 pagesExhibición Maquinaria Pesada AzucareraDariela Jarely Gutierrez SeguraNo ratings yet
- Historia Brevísima Del Psicodrama en Acción VirtualDocument24 pagesHistoria Brevísima Del Psicodrama en Acción VirtualArticulación ProvincialNo ratings yet
- Inventario Almacen Palma 091023 131023Document12 pagesInventario Almacen Palma 091023 131023uliho10No ratings yet
- Desarrollo humano etapasDocument16 pagesDesarrollo humano etapasPsicólogo Jorge A. Benítez ContrerasNo ratings yet
- Universidad Bolivariana de Venezuela Asignados 2016Document242 pagesUniversidad Bolivariana de Venezuela Asignados 2016Ronald BarriosNo ratings yet
- 3 - 11 FuncionesDocument2 pages3 - 11 FuncionesChechu Garcia AlvarezNo ratings yet
- Triptico Moringa y SabilaDocument2 pagesTriptico Moringa y SabilaJandir Brian Del Carpio CorralesNo ratings yet
- MPS enfermedades lisosomalesDocument13 pagesMPS enfermedades lisosomalesMike Wasausky Linares FloresNo ratings yet
- Medicion y Resolucion de Problemas1 PDFDocument53 pagesMedicion y Resolucion de Problemas1 PDFsupershaman100100% (1)
- Amnesia Guide of A MermaidDocument754 pagesAmnesia Guide of A MermaidLaura Diaz SantosNo ratings yet
- Practica 1 CNCDocument5 pagesPractica 1 CNCAlexander Mancilla HuaytaNo ratings yet
- Estructuras en MaderaDocument76 pagesEstructuras en MaderaNayth Andres Galaz100% (7)
- Grupo3 Informe6 S3-P2Document43 pagesGrupo3 Informe6 S3-P2Antony PalaciosNo ratings yet
- Análisis de la fricción seca en ingeniería mecánicaDocument12 pagesAnálisis de la fricción seca en ingeniería mecánicaIrene Montoya BuitragoNo ratings yet
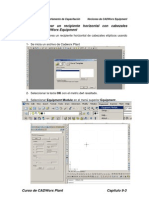
- Ejercicio1 - Crear Un Recipiente Horizontal Con Cabezales Elipicos en CADWorx EquipmentDocument8 pagesEjercicio1 - Crear Un Recipiente Horizontal Con Cabezales Elipicos en CADWorx EquipmentsellacneNo ratings yet
- 12 03Document26 pages12 03ELA_CAFNo ratings yet
- PERX San MartinDocument81 pagesPERX San MartinAlejandro RoyasNo ratings yet
- Cementos CPADocument52 pagesCementos CPAFяaиqo ChumpitazNo ratings yet
- Myeq-Myc-04-16. Pre - Operacional Vibrocompactador (Benitin)Document4 pagesMyeq-Myc-04-16. Pre - Operacional Vibrocompactador (Benitin)Yeisson MoraNo ratings yet
- Grupos VulnerablesDocument5 pagesGrupos VulnerablesNikol GuerraNo ratings yet
- URBANO FERRER SANTOS, Filosofía y CosmovisiónDocument10 pagesURBANO FERRER SANTOS, Filosofía y CosmovisiónLalo HernándezNo ratings yet
- Capitulo 22Document54 pagesCapitulo 22Josué SicalNo ratings yet
- Microsoft Word - URL - 02 - BAS02Document1 pageMicrosoft Word - URL - 02 - BAS02Perla SanchezNo ratings yet
- T 007Document829 pagesT 007ig2021No ratings yet
- Planeacion de Quimica SecundariaDocument8 pagesPlaneacion de Quimica SecundariaMario Alberto GC100% (1)
- Farmacologia 1950 2000Document13 pagesFarmacologia 1950 2000RaulXCastilloNo ratings yet
- Fleek - Catalogo Motos 2019-1Document15 pagesFleek - Catalogo Motos 2019-1Jesús RamírezNo ratings yet
- Ciudadanos y Opinión (Texto Argumentativo)Document9 pagesCiudadanos y Opinión (Texto Argumentativo)Carlos Estay VegaNo ratings yet