Professional Documents
Culture Documents
QFL
Uploaded by
Welton Rodrigo Ávila AlmeidaCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
QFL
Uploaded by
Welton Rodrigo Ávila AlmeidaCopyright:
Available Formats
QFL-605 - EXPERINCIA 3 DETERMINAO DO TEOR DE CARBONATO DE CLCIO EM UM MATERIAL OBJETIVOS: O problema a ser resolvido nesta experincia o da determinao do teor
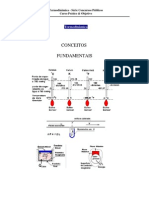
r de carbonato de clcio (CaCO3) em uma amostra de mrmore. Para isto, ser medido o volume de gs carbnico gerado pela reao do carbonato presente na amostra, com uma soluo de cido forte. A partir deste dado experimental, utilizando-se a lei de Dalton para as presses parciais de gases em uma mistura, a equao de estado dos gases ideais e a equao qumica balanceada que descreve o processo envolvido determina a porcentagem de carbonato de -se clcio presente no material analisado. CONCEITOS ENVOLVIDOS: Os conceitos relacionados a seguir devem ser compreendidos antes da execuo do experimento: a. reao de carbonatos com cidos; b. concentrao molar (molaridade) de uma soluo; c. clculos estequiomtricos, a partir de uma equao qumica balanceada; d. lei de Dalton das presses parciais; e. leis dos gases ideais; f. equao de estado de um gs ideal; g.presso de vapor de lqidos. INTRODUO: Na natureza, o carbonato de clcio (CaCO3) ocorre na forma de vastos depsitos sedimentares resultantes da fossilizao dos restos de vida marinha pr -histrica. Nestes depsitos, o carbonato de clcio ocorre principalmente como calcita, a forma mais comum, e como aragonita, mais freqente em mares temperados. Estas duas formas de carbonato de clcio diferem entre si quanto aos seus arranjos cristalinos. Vastos leitos de aragonita formam as Bahamas e o leito do Mar Vermelho. A calcita ocorre, mais freqentemente, como calcrio, dolomita (um carbonato misto de clcio e magnsio [CaMg(CO3)2]) e mrmore. Toda rocha constituda de carbonato de clcio e suscetvel de ser polida denominada de mrmore; diferentes impurezas conferem ao mrmore diferentes coloraes, tornando-o mais, ou menos, valioso. Tanto o mrmore, como o calcrio, caracterizam-se por apresentar baixa dureza e por reagirem, efervescendo, com cidos. Por exemplo, fragmentos de calcita em contato com cido clordrico diludo (HCl), a frio, reagem causando efervescncia; isto se deve ao desprendimento de gs carbnico (CO2). O carbonato de clcio ocorre, ainda, como depsitos em cavernas: so as estalactites, estalagmites, electites e incrustaes. o caso das grutas da Lapinha, Rei do Mato e de Maquin, em Minas Gerais. O carbonato de clcio uma importante matria prima na produo de cimento. A partir dele so, tambm, feitas a cal virgem e a cal hidratada. A fabricao de papel de alta qualidade envolve uso extensivo desta matria-prima de granulao especial: o papel opaco usado para livros-texto contm carbonato de clcio. O giz contm carbonato de clcio pulverulento, de granulao fina. PROCEDIMENTO EXPERIMENTAL: 1) Pese a poro da amostra de mrmore a ser analisada em uma balana analtica, anotando a sua massa exata. Esta poro deve ter uma massa ao redor de 190 mg. Transfira a amostra para um kitassato de 250 mL. Escolha uma rolha de borracha que se adapte perfeitamente ao kitassato e verifique, com ateno, se a rolha veda totalmente a boca do kitassato: muito importante que no ocorra vazamento do gs carbnico a ser
coletado. 2) Encha um bquer de 600 mL com gua destilada at aproximadamente 2/3 de seu volume. Pegue uma proveta de 100 mL e encha-a completamente com a mesma gua. Coloque um pedao de papel tapando a boca da proveta, inverta e -a mergulhe-a na gua do bquer. Retire o papel e verifique se no restaram bolhas de ar no fundo da proveta. Caso haja bolhas, repita esse procedimento at que no sobre qualquer bolha. A seguir, fixe a proveta a um suporte universal com uma garra e uma mufa. 3) Introduza um tubo de vidro, previamente entortado (ou uma mangueira de borracha), no interior da proveta invertida. A outra extremidade do tubo (ou mangueira) deve ser conecta-da sada lateral do kitassato. Finalmente, o sistema est montado para que se possa coletar o gs liberado pela reao. 4) Adicione 20 mL de uma soluo aquosa de HCl 6 mol.L-1 ao kitassato, tapando-o com a rolha de borracha o mais rapidamente possvel, para minimizar as possveis perdas de gs carbnico. Agite o kitassato, cuidadosamente, de vez em quando, para facilitar a expulso do gs. 5) Aps o final da reao (a amostra dever ser totalmente consumida pelo cido), aguarde algum tempo (pelo menos 5 minutos) para que o gs recolhido entre em equilbrio trmico com o ambiente. 6) Colete os dados experimentais, que so requisitados na tabela do relatrio (ver prxima pgina), com as respectivas unidades, incertezas e nmero de algarismos significativos. REFERNCIAS BIBLIOGRFICAS: 1. R.R. da Silva, N. Bocchi & R.C. Rocha Filho, Introduo Qumica Experimental", McGraw Hill, 1990. 2. J.B. Russel, "Qumica Geral", Trad. Geraldo Vicentini et alii , So Paulo, McGraw Hill, 1982. 3. N.N. Greenwood & A. Earhshaw, "A Chemistry of the Elements", Oxford, Pergamon Press, 1984. 4. V. Semishin, "Laboratory Exercises in General Chemistry", Peace Publishers, Moscow, p.26 a 29. QFL 0605 - RELATRIO 3 DETERMINAO DO TEOR DE CARBONATO DE CLCIO EM UM MATERIAL Nome ______________________________________________ ATENO: ESTA FOLHA DEVE SER ENTREGUE JUNTAMENTE COM AS RESPOSTAS S QUESTES 1. Preencha a tabela abaixo, colocando os valores com as respectivas unidades, incertezas, e nmero correto de algarismos significativos. Massa exata de mrmore utilizada Volume ocupado pelo gs na proveta Temperatura ambiente Presso atmosfrica Altura da coluna de gua na proveta Temperatura da gua Presso de vapor da gua (veja tabela) 2. Quantos mols de ons H+ (aq) esto contidos em 20,0 mL de soluo 6,0 mol.L-1 de cido clordrico? 3. Algum dos reagentes encontra-se em excesso? Qual o reagente limitante, neste experimento? 4. Escreva a equao balanceada que representa a reao entre CaCO3 e HCl(aq).
5. Usando essa equao balanceada e os dados apresentados na tabela acima calcule o teor, em % de massa, de carbonato de clcio na amostra de mrmore. 6. O que presso de vapor de um lquido? Por que necessrio conhecer a -se presso de vapor da gua na temperatura do experimento?
You might also like
- Reunião Welton PDFDocument1 pageReunião Welton PDFWelton Rodrigo Ávila AlmeidaNo ratings yet
- Universidade de São PauloDocument6 pagesUniversidade de São PauloWelton Rodrigo Ávila AlmeidaNo ratings yet
- Lista 2-2 QFL0605 2 Sem 2011Document2 pagesLista 2-2 QFL0605 2 Sem 2011Welton Rodrigo Ávila AlmeidaNo ratings yet
- EletroqumicaDocument6 pagesEletroqumicaWelton Rodrigo Ávila AlmeidaNo ratings yet
- Lista1 2010Document4 pagesLista1 2010Welton Rodrigo Ávila AlmeidaNo ratings yet
- Relatorio SolubilidadeDocument5 pagesRelatorio SolubilidadeWelton Rodrigo Ávila AlmeidaNo ratings yet
- Antecedentes - Mago A AscensaoDocument19 pagesAntecedentes - Mago A AscensaoLeonardo PerdigãoNo ratings yet
- Relatorio Quimica NDocument3 pagesRelatorio Quimica NWelton Rodrigo Ávila AlmeidaNo ratings yet
- Alebre e A TartarugaDocument2 pagesAlebre e A TartarugaWelton Rodrigo Ávila AlmeidaNo ratings yet
- Thermodynamics - Felix Sharipov PDFDocument120 pagesThermodynamics - Felix Sharipov PDFJohn DoeNo ratings yet
- Aula 4 - Engenharia Do Ga - S Natural 2022Document40 pagesAula 4 - Engenharia Do Ga - S Natural 2022João Paulo Dieno TeixeiraNo ratings yet
- 12 - Gases e MisturasDocument7 pages12 - Gases e MisturasWagner SchiavoniNo ratings yet
- Mecanica Dos Fluidos CompressíveisDocument149 pagesMecanica Dos Fluidos CompressíveisAlef Queiroz PereiraNo ratings yet
- Biofisica - Cap-2Document26 pagesBiofisica - Cap-2biofisica100% (3)
- Parâmetros de Estad1Document4 pagesParâmetros de Estad1IECM Bairro ClubeNo ratings yet
- Termodinâmica - Aula 4 e 5 - Propriedades de SubstâniciasDocument63 pagesTermodinâmica - Aula 4 e 5 - Propriedades de Substâniciassmarts777No ratings yet
- Lista 2 PDFDocument2 pagesLista 2 PDFFernando BortottiNo ratings yet
- Resumo Castelan Cap2Document22 pagesResumo Castelan Cap2fabianammbarbosa100% (1)
- Cap.18 - Lista de Exercícios 3 - TermodinâmicDocument9 pagesCap.18 - Lista de Exercícios 3 - TermodinâmicvaldirNo ratings yet
- Aula 3a - Tabela de Vapor - TermoDocument43 pagesAula 3a - Tabela de Vapor - TermoERICK GABRIEL DA CONCEICAONo ratings yet
- Apendices PDFDocument189 pagesApendices PDFJoão Pedro MireskiNo ratings yet
- Apontamentos TermMacroscopica PDFDocument227 pagesApontamentos TermMacroscopica PDFPedro AzevedoNo ratings yet
- Relatorio Lei de BoyleDocument13 pagesRelatorio Lei de BoyleLETICIA NUNES DOS SANTOSNo ratings yet
- Cursodebmrev3 160524025559Document136 pagesCursodebmrev3 160524025559Alex VianaNo ratings yet
- Lista de Exercícios 1 - P1 PDFDocument11 pagesLista de Exercícios 1 - P1 PDFValentina Di DonatoNo ratings yet
- Prova 21 Engenheiro A de Processamento JuniorDocument21 pagesProva 21 Engenheiro A de Processamento JuniorTamires OishiNo ratings yet
- Sebenta - Fisica - CompressedDocument76 pagesSebenta - Fisica - CompressedEugenio Manuel75% (4)
- Equações de EstadoDocument34 pagesEquações de EstadoGiPetlaNo ratings yet
- Equação CúbicaDocument16 pagesEquação CúbicaIsabelHutterNo ratings yet
- TermodinâmicaDocument146 pagesTermodinâmicavlimaverdeNo ratings yet
- Exercícios de TermodinâmicaDocument30 pagesExercícios de TermodinâmicaJoão Pedro Tesini Rocha100% (1)
- Capitulo 1Document56 pagesCapitulo 1FELIPENo ratings yet
- Lista de Exercícios 1 - Com RespostasDocument4 pagesLista de Exercícios 1 - Com RespostasGustavo PimentelNo ratings yet
- 06 Refrigeração Nível AvançadoDocument244 pages06 Refrigeração Nível AvançadoMarcelo CarabajalNo ratings yet
- Aula 1 - PE TERMODocument18 pagesAula 1 - PE TERMOAna NanabNo ratings yet
- Equacao Fundamental Da Termodinamica e ClapeyronDocument1 pageEquacao Fundamental Da Termodinamica e ClapeyronLow Santa RosaNo ratings yet
- Roteiros para As Aulas de Química Geral Experimental IIDocument78 pagesRoteiros para As Aulas de Química Geral Experimental IINathan Gabrescht Lima SantosNo ratings yet
- Aula 02 Capitulo 1 G S Ideal RealDocument44 pagesAula 02 Capitulo 1 G S Ideal RealJüvinal Pasiensia Simu DeitNo ratings yet
- Introduction To The Thermodynamics of Materials - Gaskell 4taed-Convertido Cortado1.en - PTDocument409 pagesIntroduction To The Thermodynamics of Materials - Gaskell 4taed-Convertido Cortado1.en - PTGladstone PinheiroNo ratings yet