Professional Documents
Culture Documents
Chemicals
Uploaded by
LinkSkyword94Copyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Chemicals
Uploaded by
LinkSkyword94Copyright:
Available Formats
Aldeide alifatica
Chetone alifatico
C
O
H
R C
O
R
R
Ar Ar
Ar
Aldeide aromatica
Chetone aromatico
(H)
Alcol 1
Alcol 2
-H
2
+H
2
C
O
H
C
O
Relazione ossidoriduttiva fra alcoli e composti carbonilici
Chetone RCOR
Aldeide RCHO
-RCHO
(NON
RCOH)
-RCOR
ALDEIDI e CHETONI: IL GRUPPO CARBONILICO
+3
Ossidazione degli alcoli a composti carbonilici ( C=O)
Deidrogenazione
-1 +1
0
+2
alcol primario aldeide
acido carbossilico
alcol secondario chetone
nessuna ossidazione di questo tipo;
nessun H sul C che porta l OH .
nessuna ossidazione di questo
tipo
OH O
H
ossidazione
ossidazione
O
OH
OH O
ossidazione
H
+ H
2
+ H
2
[O]
[O]
[O]
-Un prerequisito per ossidazione alcoli la presenza di H sul
C che porta il gruppo funzionale -OH.
C
O
H
H
metanale
aldeide formica
C
O
H
H
3
C
etanale
aldeide acetica
C
O
H
C H
3
C
H
H
propanale
aldeide propionica
Nome IUPAC delle aldeidi: suffisso -o (dellidrocarburo saturo
con PARI numero di atomi di carbonio) diventa -ale.
C
O
H
C C
H
H
H
H
H
3
C
butanale
aldeide butirrica
C
O
H
C C
C H
3
H
H
H
H
metilpropanale
aldeide metilpropionica
4 3 2 1
o |
La vecchia nomenclatura (ancora in uso) riportata in corsivo.
Il gruppo aldeidico sempre allinizio della catena, per definizione in posizione 1.
Latomo adiacente alla funzione viene indicato con alfa (o), il successivo con
beta (|), ecc., ultimo omega (e)
1
ClCH
2
CH
2
CH
2
CHO
4 3 2 1
4-cloro-butanale
-cloro butirraldeide
o
|
C
O
CH
3
H
3
C C
O
CH
2
CH
3
H
3
C
C
O
CH
2
CH
2
CH
3
H
3
C
propanone
butanone 2-pentanone
Chetoni : suffisso -o (dellidrocarburo saturo con PARI numero di atomi
di carbonio) diventa -one. Numero + basso possibile.
(dimetilchetone o
acetone)
(etilmetilchetone) (metilpropilchetone)
4-cloro-6-metil-3-eptanone
2,2-dimetil
ciclopentanone
CHO formile
C=O oxo
H H
2
SO
4
SO
3
H H
2
O +
Benzenesulfonic acid
Sulfonation:
+
H RX
AlCl
3
R HX + +
An alkylbenzene
Alkylation:
H R-C-X
O
AlCl
3
CR
O
HX
+
+
Acylation:
An acylbenzene
An acyl
halide
Acido 4-formil
benzensolfonico
OHC
Come sostituenti
1 3
Acido 3-oxo
pentanoico
CH
2
=CHCH
2
CHO
4 3 2 1
3-butenale
priorit
Glicerolo
(1,2,3-propantriolo)
C=O
Gliceraldeide
(2,3-diidrossipropanale)
priorit
C=O
Diidrossiacetone
(1,3-diidrossipropanone)
priorit
H
R o
t
xy
C O
Risonanza fra due forme limite
Struttura elettronica C=O : confronto con alcheni C=C (somiglianze e
differenze!)
C e O: ibridizzati sp
2
planarit
sp
2
-sp
2
:legame o
p-p : legame t
O : non lega atomi, ma porta
2 coppie di non legame
O : pi elettronegativo del C
(R
1
)
Polarit del gruppo carbonilico e propriet (chimiche e fisiche)
E
+
Nu
C O
C
(2)
Attacco da parte di elettrofili
(3)
H in alfa al carbonile pi acido di un H legato a un C
H
o
+
o
-
(1)
Attacco da parte di nucleofili
(Nu:
-
o Nu-H)
o
(1 e 2). Reazioni di addizione nucleofila
Reattivit del gruppo carbonilico: 3 regioni reattive
*Tautomeria cheto-enolica;
*Condensazione aldolica
H
+
(catalizzatore acido o Nu-H)
+
Composto tetraedrico
di addizione
sp
2
sp
3
1. Reazioni di addizione nucleofila
:Nu
:Nu-H
|
MECCANISMO: 2 percorsi.
1. Senza catalisi acida : nucleofili forti
2. Con catalisi acida nucleofili deboli
HOH ROH NH
o
-
o+
o
-
o+
I nucleofili possono essere carichi negativamente o neutri :
ione alcossido
sp
2
sp
3
sp
3
C
O
R
R
o+
o-
Nu
_
C
O
R
Nu
R
_
H
3
O
+
C
OH
R
Nu
R
H
2
O
+ OH
-
reagente
1 stadio: addizione nucleofila al C
2 stadio: protonazione ossigeno ( a spese del solvente)
Nucleofili forti anioni Nu:
-
ione idruro e ione ossidrile
Meccanismo generale con Nu:
-
1 stadio: il nucleofilo attacca il sito elettrofilo C
o+,
dona una coppia di elettroni e
forma un nuovo legame C-Nu, rompe il legame t, formando un intermedio
tetraedrico ione alcossido (base forte). Il carbonio passa da ibridazione sp
2
a
sp
3
. 2 stadio: segue la protonazione dellossigeno a spese del solvente.
neutri Nu:H ammoniaca e ammine
1 percorso : senza catalisi acida
C
O
R
R
o+
o-
Nu
_
C
O
R
Nu
R
_
H
3
O
+
C
OH
R
Nu
R
C
O
R
R
o+
o-
Nu
_
C
O
R
Nu
R
_
H
3
O
+
C
OH
R
Nu
R
H
C
O
R
R
o+
o-
Nu
_
C
O
R
Nu
R
_
H
3
O
+
C
OH
R
Nu
R
H
+
C
O
R
R
o+
o-
Nu
_
C
O
R
Nu
R
_
H
3
O
+
C
OH
R
Nu
R
Meccanismo generale con :NuH
1 stadio: il nucleofilo attacca il sito elettrofilo C
o+,
dona una coppia di elettroni e
forma un nuovo legame C-Nu, rompe il legame t, formando un intermedio
tetraedrico ione alcossido (base forte). Il carbonio passa da ibridazione sp
2
a
sp
3
. Il nucleofilo si carica positivamente !!
2 stadio: segue la protonazione dellossigeno, in questo caso per trasferimento
del protone da Nu a O
-
.
1 stadio: addizione nucleofila al C
2 stadio: protonazione ossigeno
(a spese dellidrogeno legato al nucleofilo)
H
1 percorso : senza catalisi acida
..
Chetone
sp
2
Ione alcossido
sp
3
Alcol 2
sp
3
Riduzione ad alcoli: ioni H:
-
H
2
O
da NaBH
4
Formazione di aldeidi e chetoni idrati (gem-diolo 1,1): ioni OH
-
R C
H
O
O H
-
R C
H
O
O H
H
2
O
O H
-
R C
H
OH
OH
Aldeide idrata
sp
3
Aldeide
sp
2
Ione alcossido
sp
3
Formazione IMMINE : gruppo funzionale C=N
H
3
C C
H
O
N H H
C H
3
H
3
C C
H
O
N
H
H
C H
3
H
|+
Aldeide sp
2
Ione alcossido sp
3
H
3
C
C
H
N C H
3
Aldimmina o Base di Schiff
H
3
C C
H
O
N C H
3
H
H
|
+ H
2
O
2) trasferimento di un protone: amminoalcol intermedio (prodotto di
addizione);
Nucleofilo neutro:Nu-H NH
3
e ammine primarie R-NH
2
stesso meccanismo, intermedio carico positivamente su Nu e rapido trasferimento
del protone da Nu-H a ossigeno.
1) Addizione nucleofila
3) Eliminazione acqua : formazione dellimmina
A, H
+
:
Aldeide + ammina 1 aldimmina + acqua
..
..
R C
H
O
R ' N H
2
R C
H
N R '
H
2
O
R C
H
O
R ' N H
2
R C
H
N R '
H
2
O
R
R
Chetone + ammina 1 chetimmina + acqua
Immina o Base di Schiff: composto contenente un doppio legame C=N
Immine sono intermedi metabolici comuni
(esempio: metabolismo amminoacidi. Transaminasi.)
Piridossalfosfato amminoacido (alanina) immina o base di Schiff
Da Mc Murry, Zanichelli
R C
H
O
R C
H
O H
H
+
2 percorso : con catalisi acida
Nucleofili deboli richiedono lattivazione del C=O prima
dellattacco del nucleofilo.
HOH, ROH, (RNH
2
)
R
H
C
OH
|
+
..
..
*Gruppo carbonile protonato,
stabilizzato per risonanza,
reso pi elettrofilo!
(carbocatione)
1 stadio: protonazione del carbonile su O e formazione del carbonile
protonato*
2 stadio: addizione di :Nu-H
:NuH
R C
H
O H
Nu H
H
+
R C
H
OH
3 stadio: perdita di un protone
(si rigenera catalizzatore!)
+
+
+
Nu
Addizione nucleofila di acqua in ambiente acido : aldeide o
chetone idrato : gem-diolo (1,1-diolo).
Addizione nucleofila di alcoli in ambiente acido : emiacetali e
acetali.
Stechiometria della reazione!
1 1
emiacetale
/emichetale
Eccesso alcol
Acetale / chetale
Emiacetale una molecola che contiene
un OH e un OR sullo stesso carbonio
Acetale una molecola che contiene
due gruppi OR sullo stesso
carbonio
H
+
Provare seguendo
meccanismo generale
R C
H
O
R C
H
O H
R C
H
O H
O R
H
H
+
O
H
R
H
+
R C
H
O H
O R
semiacetale
(idrossietere)
R
OH
+
|
+
H
C
semiacetale
protonato
Passaggio 1.
Reazione acido/base.
Il catalizzatore acido protona
lossigeno basico del carbonile
e forma il carbonile protonato
pi propenso ad accogliere il
nucleofilo.
Passaggio 2.
Lossigeno nucleofilo dellalcool
attacca il C elettrofilo del C=O
rompendo il legame t e
donando gli elettroni allO
+
.
Semiacetale protonato.
Passaggio 3.
La perdita di un protone
restituisce il catalizzatore
acido formando lemiacetale.
Formazione emiacetale
Formazione acetale
Reazione del semiacetale con una seconda molecola di alcol forma un
acetale ( da unaldeide) o un chetale (da un chetone).
H
+
R C
H
OH
(R)
OR
+
ROH
R C OR
OR
H (R)
SOSTITUZIONE NUCLEOFILA.
-OH gruppo uscente (esce come acqua)
-OR gruppo entrante (entra come alcol indissociato)
+
H
2
O
Eccesso alcol
emiacetale
acetale
C
H
O H
O R
H
+
R C
H
O H
O R
H
H
2
O
R C
H
O R
R O H
R C
H
O R
O
R H
H
+
R C
H
O R
O R
Passaggio 4:
Reazione acido/base.
La protonazione di OH lo
trasforma in un
miglior gruppo uscente.
Passaggio 6:
L O nucleofilo dellalcool
attacca il C elettrofilo e
si forma acetale protonato.
Passaggio 5:
Uscita dell acqua e
formazione
carbocatione
Passaggio 7.
La perdita di un
protone
restituisce il
catalizzatore
acido formando
lacetale.
R
+
HOCH
2
CH
2
CH
2
CH
2
CHO
5-idrossipentanale
Gruppo emiacetalico ciclico:
il gruppo etereo OR fa parte di
un anello a 6 termini
Intermedio
alcossido
o+
..
..
2
3
4
OH
H
..
..
4-idrossialdeidi e 5-idrossialdeidi:
formazione emiacetali ciclici. Reazione intramolecolare.
La formazione degli emiacetali e degli acetali parte centrale della chimica dei
carboidrati. Il glucosio, per esempio, si trova in soluzione in equilibrio tra una forma
aperta (idrossialdeide) e una forma chiusa semiacetalica ciclica.
Molte molecole di glucosio si uniscono poi a formare lamido e la cellulosa con legami
acetalici.
OR
C O
C
(2)
Attacco da parte di elettrofili
(3)
H in alfa al carbonile pi acido di un H legato a un C
H
o
+
o
-
(1)
Attacco da parte di nucleofili
(Nu:
-
o Nu-H)
o
Reattivit del gruppo carbonilico: 3 regioni reattive
H
+
(catalizzatore acido o Nu-H)
Presenza del gruppo carbonilico
aumenta lacidit del chetone
rispetto allalcano di un fattore
pari a 10
40
K
a
= 10
-19
K
a
= 10
-60
o+
C
H
H
H
O
H
C
OH
-
H
2
O
C
H
H
O
H
C
C
H
H
H
C
O
C
H
H
H
O
H
C C
H
H
O
H
C H C
H
H
C
H
O
C
H
H
C
H
O
H C
H
H
C
H
O
C
H
H
C
H
O
H C
H
H
C
H
OH
C
H
H
C
H
O
H
2
O
OH
-
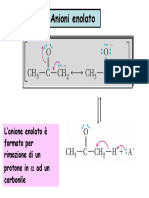
carbanione anione enolato
Nucleofilo al carbonio
pKa
*STABILIZZAZIONE PER RISONANZA DELLANIONE ENOLATO : CARICA
NEGATIVA DELOCALIZZATA SU OSSIGENO
CH
3
CH
2
CH
3
50
CH
3
COCH
3
19
CH
3
CHO 17
CH
3
COCH
2
COCH
3
8,8
ACIDITA DEGLI ATOMI DI IDROGENO IN ALFA:
LO IONE ENOLATO
Nel dichetone acidit aumenta
notevolmente!
o
Da Mc Murry - Fondamenti di Chimica
organica Zanichelli
Tautomeria cheto-enolica : ISOMERIA costituzionale
I composti carbonilici con idrogeni in o si equilibrano rapidamente con i
corrispondenti enoli (ene + alcol).
Interconversione nota come tautomeria cheto-enolica.
I singoli isomeri differiscono per posizione di un atomo di H (tautomeri)
Tautomero chetonico 99,999% Tautomero enolico 0,000001%
veloce
H
H
H
C C
O
C
H
H
H
H
C C
C
H
H
O
H
H
H
Movimento concertato di elettroni e protoni intramolecolare
Propen-2-olo Acetone
H
H
H
C
O
C H
C
C
H
O H
H
H
etanale o acetaldeide
alcol vinilico
Solo gli H in alfa sono acidi !!!
Gli atomi di H in |-, -, o- NON sono acidi poich lo ione che si
forma NON stabilizzato dalla risonanza (non coniugato)
REAZIONI DI CONDENSAZIONE ALDOLICA
Reazioni tra 2 composti carbonilici che formano un solo
prodotto (ALDOLO = aldeide + alcol).
Si forma legame C-C
Formazione di
|-idrossialdeide o 3-idrossialdeide
|-idrossichetone o 3-idrossichetone
Il Co (C2) di un composto carbonilico (nucleofilo) si lega al
C carbonilico (elettrofilo) dellaltro composto che diventa
(C3) o beta-idrossi
Condensazione aldolica
C
H
H
H
O
H
C
OH
-
H
2
O
C
H
H
O
H
C
C
H
H
H
C
O
C
H
H
H
O
H
C C
H
H
O
H
C H C
H
H
C
H
O
C
H
H
C
H
O
H C
H
H
C
H
O
C
H
H
C
H
O
H C
H
H
C
H
OH
C
H
H
C
H
O
H
2
O
OH
-
Passaggio 1: formazione del nucleofilo carbanione-anione enolato
a)
b)
c)
C
H
H
H
O
H
C
OH
-
H
2
O
C
H
H
O
H
C
C
H
H
H
C
O
C
H
H
H
O
H
C C
H
H
O
H
C H C
H
H
C
H
O
C
H
H
C
H
O
H C
H
H
C
H
O
C
H
H
C
H
O
H C
H
H
C
H
OH
C
H
H
C
H
O
H
2
O
OH
-
Passaggio 2 : attacco nucleofilo su una seconda molecola di aldeide
(ione alcossido)
C
H
H
H
O
H
C
OH
-
H
2
O
C
H
H
O
H
C
C
H
H
H
C
O
C
H
H
H
O
H
C C
H
H
O
H
C H C
H
H
C
H
O
C
H
H
C
H
O
H C
H
H
C
H
O
C
H
H
C
H
O
H C
H
H
C
H
OH
C
H
H
C
H
O
H
2
O
OH
-
Passaggio 3: protonazione a spese del solvente e formazione di una
|-idrossialdeide
Nu:
H
3
C C
C H
3
O
H
3
C C
C H
3
O H
C
H
H
C
C H
3
O
H
3
C C
C H
3
O
H
3
C C
C H
3
O
?
+
acetone
Questo il legame che si formato
4-idrossi-4-metil-2-pentanone
(aldolo)
OH
-
o
o |
REAZIONE RETRO-ALDOLICA
o |
C
H
H
H
O
H
C
O H
-
H
2
O
C
H
H
O
H
C
C
H
H
H
C
O
H
H C
H
H
C
H
O
C
H
H
C
H
O
Rottura del legame o- |
C
H
H
H
O
H
C
OH
-
H
2
O
C
H
H
O
H
C
C
H
H
H
C
O
C
H
H
H
O
H
C C
H
H
O
H
C H C
H
H
C
H
O
C
H
H
C
H
O
H C
H
H
C
H
O
C
H
H
C
H
O
H C
H
H
C
H
OH
C
H
H
C
H
O
H
2
O
OH
-
+ C
H
H
H
O
H
C
OH
-
H
2
O
C
H
H
O
H
C
C
H
H
H
C
O
C
H
H
H
O
H
C C
H
H
O
H
C H C
H
H
C
H
O
C
H
H
C
H
O
H C
H
H
C
H
O
C
H
H
C
H
O
H C
H
H
C
H
OH
C
H
H
C
H
O
H
2
O
OH
-
Catabolismo dello zucchero fruttosio 1,6-difosfato
o
|
C
C
C
Gliceraldeide 3-fosfato
Diidrossiacetonfosfato
Esercizio da fare
Propriet fisiche
o-
o+
o+
o-
Dipolo-dipolo
Composto peb (C)
Etilene -104
Formaldeide -21
2-metilpropene -140
Acetone 56
Solubilit
Addizione nucleofila di acqua in ambiente acido : aldeide o chetone
idrato : gem-diolo (1,1-diolo).
R
H
C
OH
+
|
+
..
..
R C
H
O
R C
H
O H
R C
H
O H
O H
H
H
+
O
H
H
H
+
R C
H
O H
O H
Passaggio 1.
Reazione acido/base.
Il catalizzatore acido protona
lossigeno basico del carbonile
e forma il carbonile protonato
pi propenso ad accogliere il
nucleofilo.
Passaggio 2.
Lossigeno nucleofilo dellacqua
neutra attacca il C elettrofilo del
C=O rompendo il legame t e
donando gli elettroni allO+.
Gem-diolo protonato.
Passaggio 3.
La perdita di un protone
restituisce il catalizzatore
acido formando il gem-diolo.
You might also like
- Nomenclatura chimica inorganica. Reazioni redox. Principi di stechiometriaFrom EverandNomenclatura chimica inorganica. Reazioni redox. Principi di stechiometriaNo ratings yet
- 11 - Aldeidi e ChetoniDocument40 pages11 - Aldeidi e ChetoniJasmineLuciaNo ratings yet
- Cap.14 Aldeidi e ChetoniDocument38 pagesCap.14 Aldeidi e ChetoniGabriele GuerraNo ratings yet
- Gruppi Funz FaddaDocument53 pagesGruppi Funz FaddaMarynaNo ratings yet
- Aldeidi e ChetoniDocument21 pagesAldeidi e Chetonijuve6No ratings yet
- Reazioni AldeidiDocument20 pagesReazioni AldeidistvlnpllNo ratings yet
- Chimica - Reazioni Di Organica by SilvioDocument12 pagesChimica - Reazioni Di Organica by SilvioIvanoBarnabaNo ratings yet
- Chimica OrganicaDocument31 pagesChimica Organicakuritaro100% (1)
- Aldeidi e ChetoniDocument21 pagesAldeidi e ChetonimikadoboomNo ratings yet
- Aldeidi ChetoniDocument70 pagesAldeidi ChetoniAldo BlesiNo ratings yet
- Reazioni OrganicaDocument21 pagesReazioni OrganicaRoberta PirasNo ratings yet
- Dispensa Acidi CarbossiliciDocument20 pagesDispensa Acidi CarbossiliciFrancesco BerniniNo ratings yet
- 13 Chimica OrganicaDocument29 pages13 Chimica OrganicaFabrizio FantasiaNo ratings yet
- Appunti Di Chimica Organica IIDocument5 pagesAppunti Di Chimica Organica IIFederica Moro100% (1)
- Ioni EnolatoDocument15 pagesIoni EnolatoWolframio74No ratings yet
- Alcoli Eteri e TioliDocument25 pagesAlcoli Eteri e TioliRenato GavaNo ratings yet
- Chimica OrganicaDocument50 pagesChimica Organicamarco50% (2)
- Esercizi Chimica OrganicaDocument108 pagesEsercizi Chimica OrganicaminchiazzurraNo ratings yet
- E6 ChetoniDocument3 pagesE6 ChetoniDiletta MontanelliNo ratings yet
- Gruppi Funzionali, Polimeri e CarboidratiDocument10 pagesGruppi Funzionali, Polimeri e CarboidratiLuca CanegratiNo ratings yet
- Acizi Carboxilici Si Derivati Functionali Partea IDocument8 pagesAcizi Carboxilici Si Derivati Functionali Partea IRaul Cris Ciobanca100% (1)
- Corso Chimica - 13 Reattività Da Alcani A ChetoniDocument59 pagesCorso Chimica - 13 Reattività Da Alcani A ChetoniGuenhNo ratings yet
- Chimica OrganicaDocument94 pagesChimica OrganicaAndrei (aesthetic demon)No ratings yet
- Reazioni Alcheni MeccDocument13 pagesReazioni Alcheni MeccGuido PiroliNo ratings yet
- Chimica Del CarbonioDocument18 pagesChimica Del Carbonioalcione12No ratings yet
- Alcani, Alcheni, AlchiniDocument19 pagesAlcani, Alcheni, AlchiniMassimiliano CameroniNo ratings yet
- Alchini PDFDocument5 pagesAlchini PDFdavidetrtNo ratings yet
- Aldehidos y CetonasDocument63 pagesAldehidos y CetonasLEYTON HCNo ratings yet
- Reazioni AlcheniDocument12 pagesReazioni AlcheniAndreazza IlariaNo ratings yet
- Breve Descrizione Reazioni Chimica OrganicaDocument16 pagesBreve Descrizione Reazioni Chimica OrganicaAlessio MenegonNo ratings yet
- Atkins GlossarioDocument33 pagesAtkins GlossarioAndrea Bucci0% (1)
- 3 Gruppi Funzionali PDFDocument28 pages3 Gruppi Funzionali PDFciccioNo ratings yet
- C. Organica COMPLETODocument18 pagesC. Organica COMPLETOAndra IoanaNo ratings yet
- Gli AlcoliDocument33 pagesGli AlcoliJacopo BallariniNo ratings yet
- Metode Generale de Obtinere A Compusilor OrganicDocument10 pagesMetode Generale de Obtinere A Compusilor Organicalyen333No ratings yet
- Chimica Generale RipassoDocument36 pagesChimica Generale RipassoEster CellucciNo ratings yet
- 08 - Alcoli e EteriDocument25 pages08 - Alcoli e Eterijuve6No ratings yet
- 2T Chimica OrganicaDocument20 pages2T Chimica OrganicaAndrea MagrisNo ratings yet
- Cap. 13 Benzene e DerivatiDocument77 pagesCap. 13 Benzene e DerivatiGabriele GuerraNo ratings yet
- Sintesi Di Williamson EpossidiDocument22 pagesSintesi Di Williamson EpossidiRoberta Lo IzzoNo ratings yet
- Aldeidi e ChetoniDocument51 pagesAldeidi e ChetoniMajorana.WEBNo ratings yet
- 05 Alcoli PDFDocument42 pages05 Alcoli PDFCeceNo ratings yet
- 8 - Competizione Tra E e SNDocument40 pages8 - Competizione Tra E e SNDouglas MaloneNo ratings yet
- Reazioni Alcoli MeccDocument10 pagesReazioni Alcoli MeccorganicaloverNo ratings yet
- Tabella Proprietà Composti OrganiciDocument8 pagesTabella Proprietà Composti OrganiciLovelyJadeNo ratings yet
- Nozioni Di Carboidrati Versione Aggiornata (B J Kakos)Document27 pagesNozioni Di Carboidrati Versione Aggiornata (B J Kakos)Vassily KakosNo ratings yet
- DomandeDocument4 pagesDomandewatsy-92No ratings yet
- 18 CarboidratiDocument43 pages18 Carboidratirodrigue yanNo ratings yet
- Chimica PDDocument37 pagesChimica PDerrorinsideNo ratings yet
- Nomenclatura ChimicaDocument11 pagesNomenclatura ChimicaGabriele MichelisNo ratings yet
- Chimica Organica - Principali ReazioniDocument7 pagesChimica Organica - Principali ReazioniStefanoNo ratings yet
- Transizioni Ordine-Disordine Nei BiopolimeriDocument61 pagesTransizioni Ordine-Disordine Nei BiopolimeriOriona DhamoNo ratings yet
- Fondamenti Di Chimica OrganicaDocument36 pagesFondamenti Di Chimica OrganicaDamianoScrasciaNo ratings yet
- Appunti Chimica OrganicaDocument53 pagesAppunti Chimica OrganicamantovanNo ratings yet
- PerossidiDocument3 pagesPerossidiPaoloMMNo ratings yet
- Guida Tesi OnlineDocument8 pagesGuida Tesi OnlineLinkSkyword94No ratings yet
- L'Etica Del LavoroDocument16 pagesL'Etica Del LavoroLinkSkyword94No ratings yet
- Diapo Colori Degli AlimentiDocument24 pagesDiapo Colori Degli AlimentiLinkSkyword94No ratings yet
- L'Etica Del LavoroDocument16 pagesL'Etica Del LavoroLinkSkyword94No ratings yet
- Informazioni Per La Compilazione Del Company Agreement FormDocument4 pagesInformazioni Per La Compilazione Del Company Agreement FormLinkSkyword94No ratings yet
- Testico LoDocument38 pagesTestico LoLinkSkyword94No ratings yet
- Guida Alla Compilazione Online Learning Agreement - OutDocument31 pagesGuida Alla Compilazione Online Learning Agreement - OutLinkSkyword94No ratings yet
- Testico LoDocument38 pagesTestico LoLinkSkyword94No ratings yet
- IMG1Document24 pagesIMG1LinkSkyword94No ratings yet
- Vetrini Per Istologia Ed Anatomia MicroscopicaDocument291 pagesVetrini Per Istologia Ed Anatomia MicroscopicaMatteo Paolucci100% (8)
- 2 Flussi Inf GenDocument36 pages2 Flussi Inf GenLinkSkyword94No ratings yet
- Sbobine Cardio PDFDocument235 pagesSbobine Cardio PDFLinkSkyword94No ratings yet
- Zinelli Disturbi Acido Base 2014Document135 pagesZinelli Disturbi Acido Base 2014LinkSkyword94No ratings yet
- Spedireweb Istruzioni Pacco PDFDocument3 pagesSpedireweb Istruzioni Pacco PDFLinkSkyword94No ratings yet
- Appunti Di Chimica GeneraleDocument46 pagesAppunti Di Chimica GeneraleLinkSkyword94No ratings yet
- Scansione0001 PDFDocument4 pagesScansione0001 PDFLinkSkyword94No ratings yet
- Spedireweb Istruzioni Pacco PDFDocument3 pagesSpedireweb Istruzioni Pacco PDFLinkSkyword94No ratings yet
- Ninja 250RDocument4 pagesNinja 250RStefano MilaniNo ratings yet
- Les Miserables FRADocument30 pagesLes Miserables FRALinkSkyword94No ratings yet
- Catalogo COETE 2009Document19 pagesCatalogo COETE 2009Orlando MartínNo ratings yet
- Esercizi Diagrammi Fase PDFDocument7 pagesEsercizi Diagrammi Fase PDFscienziatoNo ratings yet
- Organica, Modulo A, Relazione 1Document4 pagesOrganica, Modulo A, Relazione 1MartinaPozziNo ratings yet
- Materie Plastiche Caratteristiche FisicheDocument2 pagesMaterie Plastiche Caratteristiche Fisichelmax53No ratings yet