Professional Documents
Culture Documents
Energia Libre de Gibbs Expo
Uploaded by
Daniel Munoz BarbaCopyright
Available Formats
Share this document
Did you find this document useful?
Is this content inappropriate?
Report this DocumentCopyright:
Available Formats
Energia Libre de Gibbs Expo
Uploaded by
Daniel Munoz BarbaCopyright:
Available Formats
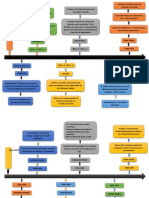
ENERGIA LIBRE DE GIBBS Y HELMOTZ
QUIEN ES?
J. WILLARD GIBBS (1939-1903)
Fue la primera persona la que se le otorgo un
doctorado en Ciencias.
Desde 1871 hasta su muerte tuvo a su cargo la
catedral de fisicomatemticas de Yale.
Gibbs formulo gran parte de los fundamentos
tericos que dieron origen al desarrollo de la
termodinmica.
J. Gibbs propuso una nueva funcin de estado
que ahora conocemos como energa libre de
Gibbs o energa libre, la cual se simboliza con
la letra G
QUE ES?
es un potencial termodinmico es decir, una
funcin de estado extensiva con unidades de
energa, que da la condicin de equilibrio y
de espontaneidad para una reaccin qumica
(a presin y temperatura constantes).
VARIABLE DE ESTADO
Es una magnitud fsica macroscpica que
caracteriza el estado de un sistema en
equilibrio.
Dado un sistema termodinmico en equilibrio
puede escogerse un numero finito de
variables de estado, tal que sus valores,
determinan unvocamente el estado del
sistema
La energa libre (G) de un estado se define como
G=H-TS
Don de T es la temperatura absoluta (Es un
proceso que se lleva a cabo a temperaturas
constantes el cambio de energa libre del sistema,
G, esta dada por la expresin)
G= H - TS
Para ver como la funcin G se relaciona con la
espontaneidad de reaccin, recurdese que para una
relacin que ocurre a temperatura y presin constante.
Se comparan las anteriores ecuaciones se ve el
cambio de energa libre de un proceso que se
lleva a cabo a temperaturas y presin contante
G y la espontaneidad de una reaccin.
si G es negativo, la reaccin es espontanea en
el sentido directo
Si G es cero, la reaccin esta en equilibrio
Si G es positivo, la reaccin en el sentido
directo no es espontanea; es necesario aportar
trabajo desde el entorno para que se lleve a
cabo, en cambio, la reaccin inversas ser
espontanea..
La analoga entre el cambio
de energa potencial de una
roca que rueda cuesta abajo
(a) y en el cambio de
energa libre de una
reaccin espontanea (b).
En (a) la posicin de
equilibrio esta dada por la
energa potencial mnima de
que dispone en sistema. En
(b) la posicin de equilibrio
esta dada por la energa
libre mnima de que dispone
el sistema.
CAMBIO DE ENERGA LIBRE
El cambio de energa se puede visualizar cuando
una roca ruada cuesta bajo por una pendiente.
La energa potencial del campo gravitatorio
impulsa la roca hasta que esta alcanza un
estado de energa potencial mnima en el valle.
De modo anlogo, la energa libre de un sistema
qumico disminuye hasta alcanzar un valor
mnimo. Cuando esta alcanza este mnimo,
existe un estado de equilibrio. En todo proceso
espontaneo a temperatura y presin constantes,
la energa siempre disminuye.
POTENCIAL TERMICO
Un potencial trmico es una variable de estado
asociado a un sistema termodinmico que se
tiene dimensiones de energa.
El potencial se debe aqu en cierto sentido
describe la cantidad de energa potencial
disponible en el sistema termodinmico sujeta a
ciertas restricciones
Nos sirve para predecir bajo las restricciones
impuestas que cambios termodinmicos sern
espontneos y cuales necesitaran aporte
energtico.
ENERGIA LIBRE
ENERGA LIBRE (Segunda ley de la termodinmica)
La Segunda Ley de la Termodinmica permite predecir la espontaneidad de un
proceso conociendo el cambio en la entropa del sistema y del ambiente donde la
entropa de un sistema aislado es mxima cuando el sistema alcanza el equilibrio.
A partir de esta Ley, es posible definir dos nuevas funciones de estado que dependen
exclusivamente de las propiedades del sistema, y establecer nuevos criterios de
espontaneidad para un proceso.
Energa libre de Gibbs
Energa libre de Helmholtz
Las cuales se relacionan con la cantidad de trabajo que puede realizar un sistema.
Si bien este criterio soluciona el problema de determinar la espontaneidad de los
procesos, en la prctica es difcil de aplicar, pues requiere del conocimiento de la
variacin de entropa del ambiente y del sistema.
DEFINICION DE ENERGIA LIBRE
Energa libre de Gibbs
Se ocupa en procesos llevado a cabo a temperatura y la presin contantes
Para introducir un nuevo criterio de espontaneidad
Supongamos que se transfiere reversiblemente una cierta cantidad de calor a
presin constante, Qp, desde el bao al sistema.
FORMULAS LEY DE GIBBS
Energa libre de Gibbs
Entropa Total
donde
Sustituyendo
Reordenando
G= Energa de Gibbs T= Temperatura
H= entalpia S= entropa
ENERGA LIBRE DE HELMONT
ENERGA LIBRE DE HELMHOLTZ
PROBLEMA
Calcular la energa libre de gibbs para un sistema
con una temperatura de 25 c , una entalpia de
-81000 joules y una entropa de -180 k/J .
datos formula
T= 25c = 298 K AG = AH- T*AS
AH= -81000 J
AS= -180 K/J
Operaciones
AG= -81000J-( 298 K * -180 J/K) -81000J +
53540J = -27360 J
PROBLEMA
Calcular la energia libre de helmholz en un
sistema con una energa interna de 500 J , una
entropa de 200 j/k
Datos formula
AS= 200 J/K A=U T*AS
U= 500J
T=10 K
Operaciones
A = 500 J ( 10 K *200 J/JK) 500 J
2000 J = -1500 J
You might also like
- Energía de GibbsDocument6 pagesEnergía de GibbsAnonymous sn5PGOsD53No ratings yet
- Energía Libre de GibbsDocument8 pagesEnergía Libre de GibbsAlexiia ReyezNo ratings yet
- Energía Libre de GibbsDocument12 pagesEnergía Libre de GibbsCristina Romero100% (1)
- Informe Laboratorio Nro 01Document19 pagesInforme Laboratorio Nro 01ALEXANDRA IRENE DEL AGUILA MENDOZANo ratings yet
- Practica N°3 Catalisis Corregida-1Document4 pagesPractica N°3 Catalisis Corregida-1gmailNo ratings yet
- Voltamperometría cíclica de electrodo de aceroDocument9 pagesVoltamperometría cíclica de electrodo de aceroAlejandro BuNo ratings yet
- Fistula Preauricular CDocument8 pagesFistula Preauricular CWillean Quispe QueaNo ratings yet
- Asinclitismo Anterior y PosteriorDocument2 pagesAsinclitismo Anterior y PosteriorAndresMaciasPNo ratings yet
- Determinacion ArsenicoDocument63 pagesDeterminacion ArsenicoFernanda SilvaNo ratings yet
- Ensayo 1 Medicion de Temperatura y Calibracion de TermometrosDocument24 pagesEnsayo 1 Medicion de Temperatura y Calibracion de TermometrosAnDres Esquivel0% (1)
- Sensor de Temperatura TermoparDocument17 pagesSensor de Temperatura TermoparSteven VillamarNo ratings yet
- Factores Que Modifican La Velocidad de Una ReaccionDocument4 pagesFactores Que Modifican La Velocidad de Una ReaccionMicchi AstudilloNo ratings yet
- Mecanismos de ReaccionDocument27 pagesMecanismos de ReaccionMeliza Rosi Bravo CastilloNo ratings yet
- Termogeneradores ElectricosDocument169 pagesTermogeneradores ElectricosRafael MancillaNo ratings yet
- Análisis de nutrientes y métodos de determinación de humedad en productos agroindustrialesDocument53 pagesAnálisis de nutrientes y métodos de determinación de humedad en productos agroindustrialesMiguel Angel O. FNo ratings yet
- CALOR Y TRABAJO Resumen FisicaDocument3 pagesCALOR Y TRABAJO Resumen FisicajoanjachaNo ratings yet
- Energía Libre de GibbsDocument13 pagesEnergía Libre de GibbsJesús Gamiño50% (2)
- Mecanica de Los FluidosDocument9 pagesMecanica de Los FluidosArturo GarciaNo ratings yet
- Sensores 1Document30 pagesSensores 1brandonNo ratings yet
- Informe N 1 TermoquimicaDocument12 pagesInforme N 1 Termoquimicaoscar alonsoNo ratings yet
- Tema 4.5.contenido de Fibra Cruda en AlimentosDocument42 pagesTema 4.5.contenido de Fibra Cruda en AlimentosEnrique John Lemmon BombermanNo ratings yet
- Ecuación de KirchhoffDocument11 pagesEcuación de KirchhoffRody Williams Curasma Villalva0% (2)
- CalorimetroDocument16 pagesCalorimetroGustavo Ricaño HernándezNo ratings yet
- Instrumentos para Medir La TemperaturaDocument2 pagesInstrumentos para Medir La TemperaturaGetsy de CamposNo ratings yet
- Gravimetria y Volumetria - Quimica AnaliticaDocument4 pagesGravimetria y Volumetria - Quimica AnaliticaWILLIAM CAMACHO DIAZNo ratings yet
- Analitica Capitulo 19Document19 pagesAnalitica Capitulo 19Alondra AlmeidaNo ratings yet
- Efectos de Los Tensoactivos Aniónicos Sobre El Medio AmbientDocument7 pagesEfectos de Los Tensoactivos Aniónicos Sobre El Medio AmbientJulio MirandaNo ratings yet
- Factores de corrosión del plomoDocument16 pagesFactores de corrosión del plomoLeydith Danitza Bernardo CotrinaNo ratings yet
- Dioxido de CarbonoDocument37 pagesDioxido de CarbonoNilreyam FerNo ratings yet
- Análisis de Varianza (ANOVADocument16 pagesAnálisis de Varianza (ANOVADaniel RodriguezNo ratings yet
- Primera Ley TermodinamicaDocument27 pagesPrimera Ley TermodinamicaRobinson CuevasNo ratings yet
- Preparando Ejercicios Acido-BaseDocument15 pagesPreparando Ejercicios Acido-BaseJhonatan HuarcaNo ratings yet
- Conductividad ElectricaDocument10 pagesConductividad ElectricaElkyn GoyenecheNo ratings yet
- Metodos EspectrometricosDocument27 pagesMetodos EspectrometricosLaura Edith Rojas100% (1)
- Determinación del coeficiente de distribución en una mezcla de ácido acético y acetato de etiloDocument11 pagesDeterminación del coeficiente de distribución en una mezcla de ácido acético y acetato de etiloMenphbruno27No ratings yet
- 06 Equilibrio Químico. Entropia y Energia Libre de GibbsDocument22 pages06 Equilibrio Químico. Entropia y Energia Libre de GibbsVane VegaNo ratings yet
- Dilatación térmica: coeficientes de aluminio, cobre y vidrioDocument11 pagesDilatación térmica: coeficientes de aluminio, cobre y vidriorubenfortunaNo ratings yet
- Ensayo - 2da Ley de La Termodinamica - Procesos BiologicosDocument5 pagesEnsayo - 2da Ley de La Termodinamica - Procesos BiologicosALMA PACHECO HUICOZANo ratings yet
- Tema 1 Introducción A La TermodinámicaDocument52 pagesTema 1 Introducción A La Termodinámicasteven villa cantiiloNo ratings yet
- Volumenes Molares ParcialesDocument8 pagesVolumenes Molares Parcialesana sol ojedaNo ratings yet
- Importancia de los metales pesados y su detecciónDocument7 pagesImportancia de los metales pesados y su detecciónRicardo De La CruzNo ratings yet
- Video Nora Beltrán ValoresDocument3 pagesVideo Nora Beltrán ValoresAlejandra J.0% (1)
- Cinética QuímicaDocument4 pagesCinética QuímicaAndrea PinkoNo ratings yet
- Ejemplos curvas calibración ciclos biogeoquímicosDocument7 pagesEjemplos curvas calibración ciclos biogeoquímicosArturo OBNo ratings yet
- Movimiento ParabolicoDocument5 pagesMovimiento ParabolicoAldair NavarroNo ratings yet
- Cambio ClimaticoDocument4 pagesCambio ClimaticoEdyson SibriNo ratings yet
- Equilibrio Quimico. DiaposDocument24 pagesEquilibrio Quimico. DiaposJuan Carlos MedinaNo ratings yet
- Equilibrio químico reversibleDocument25 pagesEquilibrio químico reversibleFranck Cristhian Arana Almonacid100% (1)
- BIOTECNOLOGIADocument25 pagesBIOTECNOLOGIAJhoel R CastilloNo ratings yet
- Seguridad en el LaboratorioDocument48 pagesSeguridad en el LaboratorioChristopher VelázquezNo ratings yet
- Tarea de BiocombustiblesDocument14 pagesTarea de BiocombustiblesJose Miguel Puc Totosao0% (1)
- Informe 7. Energia Quimica en Reacciones y Calor EspecificoDocument4 pagesInforme 7. Energia Quimica en Reacciones y Calor EspecificoNataly Hxijani Olaya CameloNo ratings yet
- Previo UlcerososoosDocument7 pagesPrevio UlcerososoosValeria LNo ratings yet
- Tercera Ley de La TermodinámicaDocument3 pagesTercera Ley de La TermodinámicaKelly XiomiNo ratings yet
- Espectrometria de Resonancia Magnetica NuclearDocument15 pagesEspectrometria de Resonancia Magnetica NuclearErikaPeñaNo ratings yet
- Energia LibreDocument11 pagesEnergia Libreleidycillapilla100% (3)
- Investigación 1 PDFDocument2 pagesInvestigación 1 PDFisabelNo ratings yet
- Equilibrio fasesDocument7 pagesEquilibrio fasesSergioCastilloNo ratings yet
- Ejercicios S8 FisicaDocument9 pagesEjercicios S8 FisicaBrauly Herrera50% (6)
- Apuntes Columna Ing MagneDocument7 pagesApuntes Columna Ing MagneLEYDI MARTHA GUZMAN HUACOTANo ratings yet
- Pauta de Clasificacion Rocas Igneas Intrusivas y Extrusivas GeoRustonDocument8 pagesPauta de Clasificacion Rocas Igneas Intrusivas y Extrusivas GeoRustonCroSe VALORANTNo ratings yet
- Pe102254z-Hseq-fs-26 Inspeccion de Pistola Neumatica v.1Document1 pagePe102254z-Hseq-fs-26 Inspeccion de Pistola Neumatica v.1fredc201180100% (3)
- Análisis de la película Replicas y sus implicaciones éticasDocument3 pagesAnálisis de la película Replicas y sus implicaciones éticasXiolin Rafael Ramirez GuzmanNo ratings yet
- Cuaderno 220 IRAMDocument182 pagesCuaderno 220 IRAMDanielMuñoz100% (5)
- Beneficios Del Ganoderma Lucidum en El SiiDocument18 pagesBeneficios Del Ganoderma Lucidum en El SiiRosa Maria Fernandez PaezNo ratings yet
- F3 13Document38 pagesF3 13LeandroLopezNo ratings yet
- Amoxycol Is 366Document2 pagesAmoxycol Is 366Yhimi YhanNo ratings yet
- Clasificación de Los Medios de CultivoDocument9 pagesClasificación de Los Medios de CultivoSamya Polet Meléndez CruzNo ratings yet
- Números Reales y Fundamentos de Álgebra PDFDocument157 pagesNúmeros Reales y Fundamentos de Álgebra PDFlmrc1010% (1)
- Kraepelin psiquiatraDocument2 pagesKraepelin psiquiatraFabricio García FragosoNo ratings yet
- Semiologia de PielDocument7 pagesSemiologia de PielMemphisNo ratings yet
- Manual de Entrega de Informacin Bsica Bim Mei EspaolDocument6 pagesManual de Entrega de Informacin Bsica Bim Mei EspaolMatias BerriosNo ratings yet
- Guia N°4, Lenguaje, LJVL, 1°medioDocument5 pagesGuia N°4, Lenguaje, LJVL, 1°mediokimadyNo ratings yet
- Ejemplo SMEDDocument39 pagesEjemplo SMEDAndrea CifuentesNo ratings yet
- Liofilización de alimentos: congelación, secado y almacenamientoDocument2 pagesLiofilización de alimentos: congelación, secado y almacenamientoANGHELO STEFFANO PAREDES GUTIERREZNo ratings yet
- PochoniaDocument10 pagesPochoniaFernando Ramirez100% (1)
- E.T. Serv. Alquiler de Camion Baranda 3 A 5tnDocument6 pagesE.T. Serv. Alquiler de Camion Baranda 3 A 5tnRey GutiNo ratings yet
- La Papa PeruanaDocument128 pagesLa Papa Peruanarosa asto chontaNo ratings yet
- Practica 1 Observación de Formas VegetalesDocument21 pagesPractica 1 Observación de Formas VegetalesLUIS DANIEL CABRERA VEGANo ratings yet
- Moana y El Viaje Del HéroeDocument23 pagesMoana y El Viaje Del HéroeAlejandro Tébar Ochoa100% (1)
- ES PP2EG NIC Fall2021-FinalDocument25 pagesES PP2EG NIC Fall2021-FinalAxel Mauricio Gámez EscobarNo ratings yet
- Emociones y Columna VertebralDocument70 pagesEmociones y Columna VertebralErwiin Diaz100% (1)
- Propuesta de Informe PericialDocument12 pagesPropuesta de Informe PericialAngie RojasNo ratings yet
- AlfareríaDocument7 pagesAlfareríaBrigitte RamirezNo ratings yet
- 2p Seminario Topo y CarreterasDocument168 pages2p Seminario Topo y CarreterasRODRIGO GÓMEZ DURININo ratings yet
- Investigación 1 Máquinas y Equipos Térmicos IIDocument26 pagesInvestigación 1 Máquinas y Equipos Térmicos IICarlos Martinez VazquezNo ratings yet
- AnatomíaDocument10 pagesAnatomíaCecilia Enedina Barreto Rosario100% (1)
- Actividad MicrobianaDocument9 pagesActividad Microbianaexhuma2100% (1)